文章信息
- 刘剑华, 刘连瑞, 李灵娟, 徐立新, 严若峰, 李祥瑞, 宋小凯
- LIU Jianhua, LIU Lianrui, LI Lingjuan, XU Lixin, YAN Ruofeng, LI Xiangrui, SONG Xiaokai
- 鸡球虫共同抗原UCE免疫原性分析及其对多种球虫感染的免疫保护效果评估
- Immunogenicity analysis and protective efficacy assessment of Eimeria common antigen UCE against infections of multiple Eimeria species in chickens
- 南京农业大学学报, 2018, 41(3): 496-503
- Journal of Nanjing Agricultural University, 2018, 41(3): 496-503.
- http://dx.doi.org/10.7685/jnau.201801008
-
文章历史
- 收稿日期: 2018-01-08
2. 河南牧翔动物药业有限公司, 河南 郑州 451162
2. Henan Muxiang Animal Pharmaceutical Co. Ltd., Zhengzhou 451162, China
鸡球虫病是养禽生产中一种分布广泛、危害严重的原虫病。鸡球虫常能严重损害宿主肠道, 导致其采食率减少, 死亡率增加[1]。全球每年因该病引起的经济损失达30亿美元以上[2]。目前, 鸡球虫病的防控主要依赖于化学药物和活卵囊疫苗。但是, 随着耐药虫株的不断出现, 新药研制费用高昂, 以及药物残留引起的食品安全问题, 抗球虫药物的使用越来越受到限制。活卵囊疫苗存在着成本高、产量低、毒力返强、有散毒风险等缺点。因此, 安全有效的新型制剂方法亟待研发。新型疫苗, 如亚单位疫苗或者DNA疫苗, 具有安全性高、无药物残留、生产成本低、稳定性好、方便贮存和运输等特点, 越来越受到人们的关注[3-4]。
国际上公认的鸡球虫有7种, 分别为柔嫩艾美耳球虫(Eimeria tenella)、堆型艾美耳球虫(E.acervulina)、毒害艾美耳球虫(E. necatrix)、巨型艾美耳球虫(E.maxima)、和缓艾美耳球虫(E. mitis)、早熟艾美耳球虫(E. praecox)和布氏艾美耳球虫(E. brunetti)。在临床上, 鸡球虫病往往是由多种球虫混合感染造成的[5], 因而单价疫苗常不能满足临床需要, 能抵抗多种球虫混合感染的疫苗变得尤为需要。在设计疫苗时, 那些保守的、多种球虫所共有的、具有良好免疫原性的抗原备受研究人员的青睐[6], 对于鸡球虫病的防控也具有极其重要的价值。
目前一些共同抗原已被报道, Alireza[7]在艾美耳球虫5个种间发现了一个相对分子质量约为45×103的具有免疫原性的共同抗原; Sasai等[8]在所有鸡艾美球虫子孢子的顶端复合体上发现了一个共同的抗原。Constantinoiu等[9]也证实了在艾美耳球虫各个种属中存在一个高度保守的顶端抗原。本实验室前期通过免疫蛋白组学方法对柔嫩艾美耳球虫、堆型艾美耳球虫和巨型艾美耳球虫孢子化卵囊蛋白进行分析, 得到了5个共同抗原, 其中GAPDH(3-磷酸甘油醛脱氢酶)已被证明具有免疫原性且保护性效果良好[10-11]; 泛素缀合酶结构域蛋白(ubiquitin-conjugating enzyme domain-containing protein, 简称UCE)是被发现的另一个共同抗原。本试验进一步分析其免疫原性, 评估其对多种球虫感染的保护性效果, 该抗原作为研制多价抗球虫疫苗提供试验依据。
1 材料与方法 1.1 试验动物与虫株1日龄海兰白雏鸡购自南京汤泉某养殖场, 饲养在经灭菌、消毒及无球虫的环境中, 自由采食、饮水且喂食不含任何抗球虫药的饲料。
纯种柔嫩艾美耳球虫、堆型艾美耳球虫和巨型艾美耳球虫孢子化卵囊是由本实验室保存, 贮存在40 mg·mL-1的重铬酸钾溶液中, 置于4 ℃, 每隔3月复苏1次。
1.2 细菌与载体宿主菌大肠杆菌DH5α、pVAX1真核载体购自Invitrogen公司, pMD18-T克隆载体购自TaKaRa公司。
1.3 试剂RNA提取试剂盒、胶回收试剂盒及质粒小量提取试剂盒购自Omega公司; 逆转录试剂盒购自南京诺唯赞公司; Taq酶、DNA标准品、限制性内切酶BamHⅠ、EcoRⅠ、T4连接酶、DNaseⅠ均购于TaKaRa公司; 蛋白质标准品、RIPA(Radio Immunoprecipitation Assay)裂解液购自Thermo公司; Trizol试剂购自Promega公司; DEPC水购自Amresco公司; 氨苄青霉素、卡那霉素、尿素及咪唑购于南京生兴公司; 堆型艾美耳球虫多克隆抗体由本实验室制备, 山羊抗鸡二抗购自北京博奥龙生物公司。其他试剂均为国产分析纯。
1.4 引物设计与合成参照GenBank中堆型艾美耳球虫UCE基因(GenBank登录号:XM_013391686)序列设计引物。上游引物:5′-CGCGGATCCATGGCGCTTAAAAGAATCAAT-3′, 下划线为引入的酶切位点BamHⅠ; 下游引物:5′-CCGGAATTCCTATTGGGCATACTTCTGAG-3′, 下划线为引入的酶切位点EcoRⅠ, 预计扩增片段大小为444 bp左右。
1.5 EaUCE基因扩增与鉴定收集纯化堆型艾美耳球虫孢子化卵囊, 提取总RNA, 反转录成cDNA, 以合成的cDNA为模板进行PCR反应。反应结束后, 取5 μL经10 g·L-1琼脂糖凝胶电泳检测片段, 剩余产物按照Omega胶回收试剂盒说明书进行胶回收, 纯化目的片段。
将回收的EaUCE产物与pMD18-T载体连接并将其转化DH5α感受态细胞, 37 ℃培养12 h, 提取质粒并用BamHⅠ和EcoRⅠ酶切鉴定和PCR扩增鉴定。将鉴定正确的克隆送至南京擎科公司测序。将测序结果用DNAstar软件进行分析并与GenBank的EaUCE基因序列分析比对。
1.6 EaUCE重组真核质粒构建用BamHⅠ/EcoRⅠ双酶切重组质粒pMD18-T-EaUCE和真核表达载体pVAX1, 回收目的基因片段和pVAX1大片段, 进行连接、转化以及酶切鉴定。
1.7 真核表达质粒pVAX-EaUCE在鸡体内转录和表达情况检测提取pVAX-EaUCE重组质粒, 经腿部肌肉注射14日龄雏鸡, 每羽100 μg, 另外设置pVAX1空质粒注射对照组。1周后分别取注射部位和非注射部位肌肉(约0.5 g), 从肌肉中提取总RNA, DNase Ⅰ消化去除残留质粒, 反转录成cDNA, 再以此为模板, 利用UCE基因特异引物进行反转录PCR, 10 g·L-1琼脂糖凝胶电泳检测EaUCE基因在注射部位的转录情况。用RIPA溶液对注射部位的肌肉处理3 h, 13 000 r·min-1, 收集上清液, 用人工感染的堆型艾美耳球虫血清为一抗进行Western blot检测, 分析EaUCE基因在注射部位的表达情况。
1.8 EaUCE免疫原性分析 1.8.1 试验设计选取体况良好、体质量接近的14日龄雏鸡, 随机分为3组, 每组40只鸡。免疫组每羽经腿部肌肉注射100 μg pVAX-EaUCE重组质粒, 对照组分别注射pVAX1和PBS, 7日后同样剂量加强免疫1次。分别于首免和二免后第7天, 每组取5只鸡进行剖杀, 取脾脏并分离脾脏淋巴细胞。取部分淋巴细胞, 通过流式细胞术来检测T淋巴细胞亚群的比例。另取一部分淋巴细胞提取总RNA并反转录成cDNA, 通过实时定量PCR技术(qPCR)检测细胞因子的mRNA水平。每组剩余的30只鸡, 于21日龄加强免疫1周后心脏采血, 连续采集6次, 每次间隔7 d, 收集血清, 用于检测特异性IgY水平。
1.8.2 流式细胞术检测T淋巴细胞亚群将分离好的1×106mL-1淋巴细胞悬液用鼠抗鸡CD3-PE、CD8α-FITC和鼠抗鸡CD3-PE、CD4-FITC双重染色, 室温避光孵育30 min后, 用PBS吹悬, 洗涤2次, 每次5 min, 2 000 r·min-1。用500 μL PBS吹悬淋巴细胞, 转入流式管中, 用BDFACS Calibur流式细胞仪(Bectom Dickinson)检测。
1.8.3 qPCR检测细胞因子mRNA水平qPCR检测IFN-γ、IL-2、IL-4、TNFSF15、IL-17D和TGF-β4等细胞因子的mRNA水平, 内参基因为GAPDH。通过2-ΔΔCT法, 比较各细胞因子与GAPDH mRNA水平变化情况[11]。引物设计及其扩增效率见表 1。
目的基因 Target gene | 引物对序列5′→3′ Primer pair sequences | 序列号 Accession No. | 扩增效率/% Amplification efficiency | 相关系数(R2) Correlation coefficients |
| IFN-γ | AGCTGACGGTGGACCTATTATT/GGCTTTGCGCTGGATTC | Y07922 | 99.16 | 0.997 6 |
| IL-2 | TCTGGGACCACTGTATGCTCT/ACACCAGTGGGAAACAGTATCA | AF000631 | 98.53 | 0.993 2 |
| TNFSF15 | CCTGAGTTATTCCAGCAACGCA/ATCCACCAGCTTGATGTCACTAAC | NM_001024578 | 98.51 | 0.999 2 |
| IL-17D | GCTGCCTCATGGGGATCTTTGGTG/CGATGACGGCTTGTTCTGGTTGAC | EF570583 | 98.18 | 0.995 4 |
| TGF-β4 | CGGGACGGATGAGAAGAAC/CGGCCCACGTAGTAAATGAT | M31160 | 97.39 | 0.998 1 |
| IL-4 | ACCCAGGGCATCCAGAAG/CAGTGCCGGCAAGAAGTT | AJ621735 | 99.41 | 0.999 6 |
| GAPDH | GGTGGTGCTAAGCGTGTTAT/GGTGGTGCTAAGCGTGTTAT | K01458 | 95.48 | 0.999 4 |
按实验室前期建立的方法[12], 通过间接ELISA法检测免疫鸡IgY抗体水平。
1.8.5 免疫保护效果评估选取14日龄体质量接近的健康雏鸡, 随机分为4个免疫组和9个对照组, 每组30只鸡。免疫组每只鸡腿部肌肉注射100 μg pVAX-EaUCE, 21日龄加强免疫。对照组分别注射PBS和pVAX1。28日龄, 除非免疫非攻虫组外, 其余分别用柔嫩艾美耳球虫(每羽5×104)、堆型艾美耳球虫(每羽1×105)、巨型艾美耳球虫(每羽1×105)和这3种球虫的混合卵囊感染(虫种浓度同上)[13]。每组随机选取20只鸡剖杀, 进行病变计分[14], 收集所有肠段的肠道内容物, 计算每克肠内容物的卵囊数(oocysts per gram content, OPG)[15]。
1.9 数据分析使用SPSS 13.0统计分析软件, 对组间数据进行方差分析, 采用Duncan ’ s多重比较法进行差异显著性检验。
2 结果与分析 2.1 EaUCE基因的RT-PCR扩增与测序如图 1所示:在约450 bp处可见一单一条带, 大小与预期一致。测序结果表明, 扩增片段的核苷酸序列与GenBank中登录的序列(登录号:XM_013391686)相似性为100%。BLAST分析显示, 堆型艾美耳、柔嫩艾美耳、巨型艾美耳和毒害艾美耳球虫UCE氨基酸序列相似性大于95%。

|
图 1 RT-PCR扩增产物电泳图 Figure 1 Agarose gel electrophoresis of EaUCE amplification products M. DNA标准品DL2000;1.EaUCE PCR扩增产物。 M. DNA marker DL2000;1. Amplification products of EaUCE gene. |
重组质粒pVAX-EaUCE经BamHⅠ/EcoRⅠ双酶切后进行电泳后, 出现2条带, 其中小片段大小约为450 bp(图 2), 与预期大小一致。测序结果显示, 其与GenBank中登录的EaUCE核苷酸序列相似性为100%, 无碱基突变。

|
图 2 重组质粒pVAX-EaUCE的双酶切鉴定 Figure 2 Identification of recombinant plasmid pVAX-EaUCE digested by BamHⅠ and EcoRⅠ M. DNA标准品DL2000;1. pVAX-EaUCE未酶切对照; 2. pVAX-EaUCE BamHⅠ/EcoRⅠ双酶切产物。 M. DNA marker DL2000;1. pVAX-EaUCE without digestion control; 2. pVAX-EaUCE digested with BamHⅠand EcoRⅠ. |
采用RT-PCR检测EaUCE基因在鸡体内的转录情况。结果如图 3所示, 从注射部位肌肉样品中检测到1条约444 bp的条带, 与目的条带大小一致, 测序表明该条带的核苷酸序列和EaUCE基因一致。在注射pVAX1和未注射的对照样品中未检测到该特异性条带。表明EaUCE基因在鸡注射部位的肌肉中成功转录。

|
图 3 pVAX-EaUCE肌肉注射后转录情况检测 Figure 3 Transcription detection of pVAX-EaUCE in injected muscles by RT-PCR M. DNA标准品DL2000;1.注射pVAX-EaUCE肌肉; 2.非注射肌肉; 3.注射pVAX1肌肉。 M. DNA marker DL2000;1. RT-PCR product of chicken muscle injected with pVAX-EaUCE; 2. RT-PCR product of non-injected chicken muscle; 3. RT-PCR product of muscle injected with pVAX1 plasmid. |
以堆型艾美耳球虫自然感染血清为一抗, 通过Western blot方法检测EaUCE基因在鸡体内的表达情况。结果所示:检测到1条相对分子质量约为17×103的特异性条带, 而在注射pVAX1和未注射组的对照样品中均未检测到该条带(图 4)。

|
图 4 pVAX-EaUCE肌肉注射后表达情况的Western blot检测 Figure 4 Expression detection of pVAX-EaUCE in injected muscles by Western blot M.蛋白质分子量标准物; 1.注射pVAX-EaUCE肌肉; 2.未注射肌肉; 3.注射pVAX1肌肉。 M. Protein molecular weight marker; 1. The chicken muscle injected with pVAX-EaUCE; 2. Non-injected muscle; 3. Muscle injected with pVAX1 plasmid. |
通过流式细胞术测定免疫鸡脾T淋巴细胞中CD4+/CD3+和CD8+/CD3+细胞比例。如图 5所示:接种pVAX-EaUCE 1周后, 免疫组脾脏T淋巴细胞CD4+/CD3+和CD8+/CD3+的比例显著高于PBS和pVAX1组(P < 0.05);而pVAX1与PBS组间无显著差异(P>0.05)。对免疫鸡IFN-γ、IL- 2、IL-4、TNFSF15、IL-17D和TGF-β4 mRNA水平测定结果显示, 加强免疫(二免)7 d后, pVAX-EaUCE免疫组的IFN-γ 、IL- 2、IL-4、TNFSF15、IL-17D和TGF-β4 mRNA水平显著增加; 而pVAX1组与PBS组间无显著差异(图 6)。
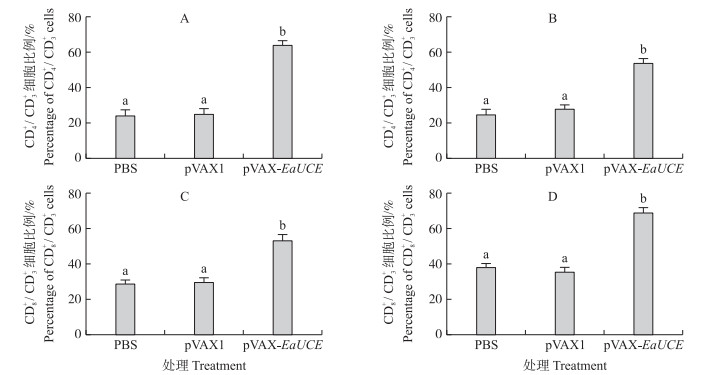
|
图 5 pVAX-EaUCE质粒一免(A、C)和二免(B、D)后7 d后鸡脾脏CD4+/CD3+和CD8+/CD3+细胞比例变化(n=5) Figure 5 Changes of the percentages of CD4+/CD3+ and CD8+/CD3+ cells in spleen following the recombinant plasmid pVAX-EaUCE of the 1st(A, C)and the 2nd(B, D)vaccination 不同字母表示处理间差异显著(P < 0.05)。下同。 Different letters indicate significant differences in different treatments(P < 0.05). The same as follows. |
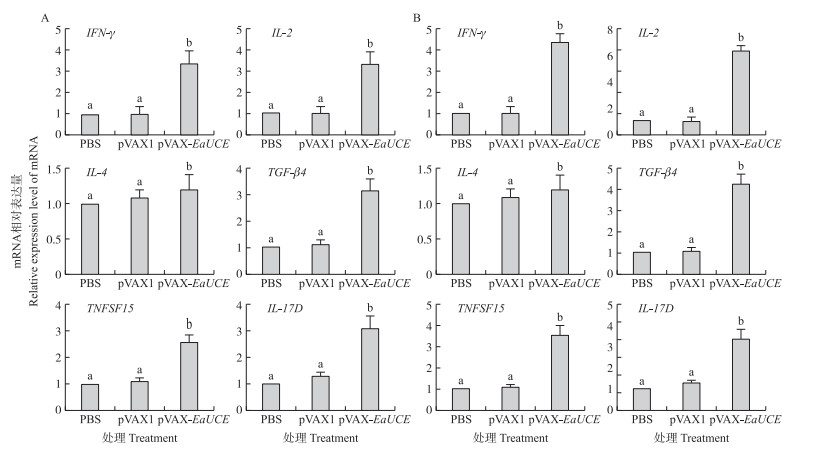
|
图 6 重组质粒pVAX-EaUCE一免(A)和二免(B)后7 d鸡脾脏细胞因子mRNA相对表达水平变化(n=5) Figure 6 Changes of mRNA level of cytokine following the recombinant plasmid pVAX-EaUCE of the 1st(A)and the 2nd(B)vaccination |
如表 2所示:与PBS和pVAX1组相比, pVAX-EaUCE免疫鸡体质量显著增加(P < 0.05), 卵囊产量显著降低, 肠道损伤明显减轻(P < 0.05)。pVAX1与PBS组间无显著差异。
| 试验分组 Group | 免疫攻虫 Challenge with Eimeria spp. | 平均增重/g Average body weight gain | 相对增重率/% Relative body weight gain | 病变计分 Mean lesion scores | 卵囊减少率/% Oocyst decrease ratio |
| pVAX-EaUCE | E.tenella | 37.77±10.17ab | 63.30 | 0.85±0.67b | 35.15 |
| pVAX1 | E.tenella | 35.26±9.89a | 58.00 | 3.59±0.51c | -0.61 |
| 非免疫对照组Challenged control | E.tenella | 32.58±10.29a | 53.11 | 3.78±0.67c | 0.00 |
| 非免疫非感染对照组Unchallenged control | PBS | 61.30±9.29c | 100 | 0±0a | 100 |
| pVAX-EaUCE | E.acervulina | 47.15±11.17b | 76.99 | 1.89±0.62b | 69.52 |
| pVAX1 | E.acervulina | 38.41±10.93a | 63.20 | 3.01±0.81c | 12.67 |
| 非免疫对照组Challenged control | E.acervulina | 37.38±10.27a | 62.37 | 3.26±0.67c | 0.00 |
| 非免疫非感染对照组Unchallenged control | PBS | 61.30±8.89c | 100 | 0±0a | 100 |
| pVAX-EaUCE | E.maxima | 47.78±12.371b | 79.13 | 1.92±0.67b | 51.61 |
| pVAX1 | E.maxima | 35.39±11.52a | 58.62 | 2.56±0.71c | 12.19 |
| 非免疫对照组Challenged control | E.maxima | 35.18±12.21a | 57.18 | 2.90±0.67c | 0.00 |
| 非免疫非感染对照组Unchallenged control | PBS | 61.30±9.29c | 100 | 0±0a | 100 |
| pVAX-EaUCE | 混合卵囊Mix oocysts | 36.13±13.27ab | 60.50 | 2.25±0.48b | 30.90 |
| pVAX1 | 混合卵囊Mix oocysts | 35.10±10.81a | 57.57 | 3.58±0.61c | -1.69 |
| 非免疫对照组Challenged control | 混合卵囊Mix oocysts | 33.08±11.09a | 53.77 | 3.70±0.57c | 0.00 |
| 非免疫非感染对照组Unchallenged control | PBS | 61.30±9.29c | 100 | 0±0a | 100 |
采用间接ELISA法测定EaUCE诱导的血清特异性IgY抗体水平。如图 7所示:7~42 d, 所有pVAX-EaUCE接种组的抗体滴度显著高于PBS和pVAX1组(P < 0.05), 在接种疫苗后7~21 d, 接种疫苗组的抗体滴度缓慢上升, 第4周达到高峰, 之后抗体滴度逐渐下降。PBS组和pVAX1组均未检测到任何特异性抗体。
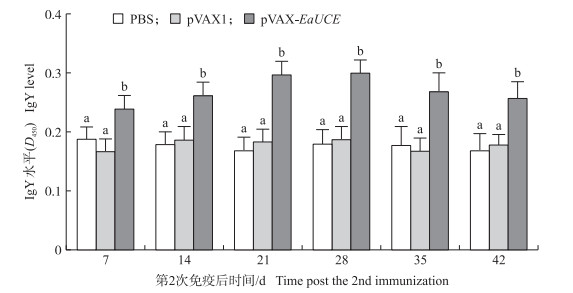
|
图 7 重组质粒pVAX-EaUCE免疫后血清特异性IgY抗体水平(D450)变化(n=5) Figure 7 Serum specific IgY level in chickens following the recombinant plasmid pVAX-EaUCE vaccination |
在自然条件下, 鸡球虫病通常由多种鸡球虫混合感染所引发, 因此理想的疫苗应能抵抗多种艾美耳球的混合感染。存在于多种球虫之间的共同抗原对于研制抗多种球虫混合感染的疫苗至关重要。在本实验室前期的研究中, 已经确定了5种鸡球虫的共同抗原[10], UCE是这5种艾美耳球虫共同抗原之一, 在3种艾美耳球虫属中高度保守。本试验证实了共同抗原UCE不但对柔嫩艾美耳球虫、堆型艾美耳球虫和巨型艾美耳球虫单独感染能够提供部分免疫保护作用, 而且对这3种球虫的混合感染也能提供一定的保护作用, 为研制适用于多种球虫混合感染的预防疫苗提供了候选抗原。
细胞免疫应答在抗球虫免疫中占主导地位[16]。在本试验中, EaUCE诱导的细胞免疫应答结果表明, CD4+/CD3+与CD8+/CD3+细胞比例显著提高, 同时产生了高水平的Th1型(IFN-γ, IL-2)和Th2型细胞因子(IL-4), 说明EaUCE能够引起显著性的细胞免疫反应。Bessay等[17]发现, T细胞在抗堆形艾美耳球虫感染过程中发挥重要作用。Min等[18]使用pcDNA3-1E重组质粒免疫鸡, 经流式细胞术检测结果显示, CD4+/CD3+、CD8+/CD3+值显著增加, 这些报道与本试验pVAX-EaUCE诱导产生的结果类似。虽然在球虫感染期间, 体液反应的作用是有争议的[19], 但也有研究者认为体液反应可能发挥一定的免疫保护效果, 比如Wallach等[20]报道, 用巨型艾美耳球虫配子体抗原免疫母鸡, 可以通过母源抗体保护子代雏鸡免受球虫的感染。在本试验中, 免疫pVAX-EaUCE重组质粒后, IgY水平显著升高。综上所述, EaUCE能够诱导产生显著性的细胞免疫和体液免疫反应, 提示其具有良好的免疫原性。
有研究表明, 与含有免疫刺激细胞因子(IFN-γ、IL-2)的质粒共注射可以增强DNA疫苗的保护效果[21-23]。Song等[24]在堆型艾美耳球虫乳酸脱氢酶(lactate dehydrogenase, LDH)的DNA疫苗免疫保护性试验中发现, 串联了细胞因子的免疫调节型DNA疫苗比单独串联抗原基因的真核表达质粒保护效果要好。其他很多研究也证实, 细胞因子的协同使用能特异性增强病毒、细菌和寄生虫疫苗的免疫效果[22]。因此, 在后续的研究中, 可将细胞因子作为佐剂, 串联到真核表达质粒中, 来进一步改善共同抗原UCE的免疫保护效果。
我们前期研究表明, 鸡球虫DNA疫苗的最佳接种途径为肌肉注射[25]。在本试验中, 为保证获得共同抗原UCE最佳的免疫保护效果, 对共同抗原UCE免疫保护评估中所用的免疫途径为肌肉注射, 首免日龄为14日龄。然而, 在临床上, 由于注射途径费时费力, 并不受人们的欢迎, 而简单方便的非注射免疫途径(如饮水、喷雾等)更容易被接受。而且, 人们更倾向于1周龄内进行免疫。因此, 为了使共同抗原UCE更适合临床使用的需求, 可以对其非注射免疫途径和最小首免日龄进行筛选。另外, 在本试验中, 共同抗原UCE免疫可以显著改善球虫感染对鸡增重的不良影响, 这对临床上肉鸡养殖很有意义。因此, 可以进一步评估共同抗原UCE免疫对肉鸡的免疫保护效果。
| [1] | Morris G M, Gasser R B. Biotechnological advances in the diagnosis of avian coccidiosis and the analysis of genetic variation in Eimeria[J]. Biotechnology Advances, 2006, 24(6): 590-603. DOI: 10.1016/j.biotechadv.2006.06.001 |
| [2] | Blake D P, Tomley F M. Securing poultry production from the ever-present Eimeria challenge[J]. Trends in Parasitology, 2014, 30(1): 12-19. DOI: 10.1016/j.pt.2013.10.003 |
| [3] | Williams R B. Anticoccidial vaccines for broiler chickens:pathways to success[J]. Avian Pathology, 2002, 31(4): 317-353. DOI: 10.1080/03079450220148988 |
| [4] | Kheirabadi P K, Katadj J K, Bahadoran S, et al. Comparison of the anticoccidial effect of granulated extract of Artemisia sieberi with monensin in experimental coccidiosis in broiler chickens[J]. Exp Parasitol, 2014, 141: 129-133. DOI: 10.1016/j.exppara.2014.03.022 |
| [5] | Reid A J, Blake D P, Ansari H R, et al. Genomic analysis of the causative agents of coccidiosis in domestic chickens[J]. Genome Research, 2014, 24(10): 1676-1685. DOI: 10.1101/gr.168955.113 |
| [6] | del Cacho E, Gallego M, Lee S H, et al. Induction of protective immunity against Eimeria tenella, Eimeria maxima, and Eimeria acervulina infections using dendritic cell-derived exosomes[J]. Infect Immun, 2012, 80(5): 1909-1916. DOI: 10.1128/IAI.06413-11 |
| [7] | Alireza T. Protein profiles of five avian Eimeria species[J]. Avian Pathology, 1995, 24(4): 731-735. DOI: 10.1080/03079459508419112 |
| [8] | Sasai K, Lillehoj H S, Matsuda H, et al. Characterization of a chicken monoclonal antibody that recognizes the apical complex of Eimeria acervulina sporozoites and partially inhibits sporozoite invasion of CD8+ T lymphocytes in vitro[J]. The Journal of Parasitology, 1996, 82(1): 82-87. |
| [9] | Constantinoiu C C, Lillehoj H S, Matsubayashi M, et al. Analysis of cross-reactivity of five new chicken monoclonal antibodies which recognize the apical complex of Eimeria using confocal laser immunofluorescence assay[J]. Veterinary Parasitology, 2003, 118(1): 29-35. |
| [10] | Liu L R, Huang X M, Liu J H, et al. Identification of common immunodominant antigens of Eimeria tenella, Eimeria acervulina and Eimeria maxima by immunoproteomic analysis[J]. Oncotarget, 2017, 8(21): 34935-34945. |
| [11] | Tian L, Li W, Huang X, et al. Protective efficacy of coccidial common antigen glyceraldehyde 3-phosphate dehydrogenase(GAPDH)against challenge with three Eimeria species[J]. Front Microbiol, 2017, 8: 1245. DOI: 10.3389/fmicb.2017.01245 |
| [12] | Song X K, Zhao X F, Xu L X, et al. Immune protection duration and efficacy stability of DNA vaccine encoding Eimeria tenella TA4 and chicken IL-2 against coccidiosis[J]. Research in Veterinary Science, 2017, 111: 31-35. DOI: 10.1016/j.rvsc.2016.11.012 |
| [13] | Holdsworth P A, Conway D P, Mckenzie M E, et al. World Association for the Advancement of Veterinary Parasitology(WAAVP)guidelines for evaluating the efficacy of anticoccidial drugs in chickens and turkeys[J]. Veterinary Parasitology, 2004, 121: 189-212. DOI: 10.1016/j.vetpar.2004.03.006 |
| [14] | Johnson J, Reid W M. Anticoccidial drugs:lesion scoring techniques in battery and floor-pen experiments with chickens[J]. Exp Parasitol, 1970, 28(1): 30-36. DOI: 10.1016/0014-4894(70)90063-9 |
| [15] | McManus E C, Campbell W C, Cuckler A C. Development of resistance to quinoline coccidiostats under field and laboratory conditions[J]. The Journal of Parasitology, 1968, 54(6): 1190-1193. DOI: 10.2307/3276989 |
| [16] | Chapman H D. Milestones in avian coccidiosis research:a review[J]. Poultry Science, 2014, 93(3): 501-511. DOI: 10.3382/ps.2013-03634 |
| [17] | Bessay M, Le V Y, Kerboeuf D, et al. Changes in intestinal intra-epithelial and systemic T-cell subpopulations after an Eimeria infection in chickens:comparative study between E.acervulina and E.tenella[J]. Veterinary Research, 1996, 27(4/5): 503-514. |
| [18] | Min W, Lillehoj H S, Burnside J, et al. Adjuvant effects of IL-1beta, IL-2, IL-8, IL-15, IFN-alpha, IFN-gamma TGF-beta4 and lymphotactin on DNA vaccination against Eimeria acervulina[J]. Vaccine, 2001, 20(1/2): 267-274. |
| [19] | Lillehoj H S, Trout J M. Avian gut-associated lymphoid tissues and intestinal immune responses to Eimeria parasites[J]. Clinical Microbiology Reviews, 1996, 9(3): 349-360. |
| [20] | Wallach M, Halabi A, Pillemer G, et al. Maternal immunization with gametocyte antigens as a means of providing protective immunity against Eimeria maxima in chickens[J]. Infect Immun, 1992, 60(5): 2036-2039. |
| [21] | Ivory C, Chadee K. DNA vaccines:designing strategies against parasitic infections[J]. Genet Vaccines Ther, 2004, 2: 17. DOI: 10.1186/1479-0556-2-17 |
| [22] | Lillehoj H S, Min W, Dalloul R A. Recent progress on the cytokine regulation of intestinal immune responses to Eimeria[J]. Poultry Science, 2004, 83(4): 611-623. DOI: 10.1093/ps/83.4.611 |
| [23] | Song X, Huang X, Yan R, et al. Efficacy of chimeric DNA vaccines encoding Eimeria tenella 5401 and chicken IFN-gamma or IL-2 against coccidiosis in chickens[J]. Exp Parasitol, 2015, 156: 19-25. DOI: 10.1016/j.exppara.2015.05.003 |
| [24] | Song H Y, Song X K, Xu L X, et al. Changes of cytokines and IgG antibody in chickens vaccinated with DNA vaccines encoding Eimeria acervulina lactate dehydrogenase[J]. Veterinary Parasitology, 2010, 173(3): 219-227. |
| [25] | Song X K, Xu L X, Yan R F, et al. The optimal immunization procedure of DNA vaccine pcDNA-TA4-IL-2 of Eimeria tenella and its cross-immunity to Eimeria necatrix and Eimeria acervulina[J]. Veterinary Parasitology, 2009, 159(1): 30-36. DOI: 10.1016/j.vetpar.2008.10.015 |




