文章信息
- 李鹏, 崔佳, 王丽清, 吴长新
- LI Peng, CUI Jia, WANG Liqing, WU Changxin
- ASAP1调节巨噬细胞对结核分枝杆菌吞噬作用的研究
- ASAP1 involvement of the phagocytosis of Mycobacterium tuberculosis in macrophages
- 南京农业大学学报, 2018, 41(3): 481-488
- Journal of Nanjing Agricultural University, 2018, 41(3): 481-488.
- http://dx.doi.org/10.7685/jnau.201801042
-
文章历史
- 收稿日期: 2018-01-25
结核病(tuberculosis, TB)是由结核分枝杆菌(Mycobacterium tuberculosis, Mtb)感染引起的一种慢性传染疾病, 人、畜、禽均有可能患此疾病。目前, 结核病依然是最重大的人畜共患传染病之一, 全球每年大约有1 000万人罹患结核病, 是死亡人数最多的十大疾病之一[1]。据报道, 全球范围约有15%的患者是由于食用结核病牛产的牛奶而引起的, 人和牛的结核病流行存在平行性现象, 家畜结核病依然严重威胁着中国畜牧业的发展[2]。
人类被结核分枝杆菌感染后, 多数情况下处于潜伏感染状态, 大约有5%的潜伏感染者会形成有特定临床症状的结核病。出现这种现象的原因是不同宿主的免疫系统抵抗结核分枝杆菌的复制和传播能力存在差异[3]。因此, 免疫细胞的免疫反应是控制结核分枝杆菌感染进程的关键因素。在结核分枝杆菌的感染过程中, 巨噬细胞作为第一道防线通过吞噬结核分枝杆菌限制病原体感染[4], 也在激活适应性免疫反应中发挥重要作用, 最终使人体免疫系统抑制或消除结核分枝杆菌感染[5]。
近年来, 全基因组关联分析(genome-wide association studies, GWAS)已成功用于对人类的一些重大疾病的易感性与基因多态性的关联研究中[6-7]。最近, 剑桥大学通过大规模GWAS研究发现, 人类ASAP1基因的单核苷酸多态性(single nucleotide polymorphisms, SNPs)与结核病易感性显著相关[8]。ASAP1是Arf核糖激化因子GTP酶活化蛋白, 其中ArfGAP是ASAP1的关键结构域, 在调节肌动蛋白组装和细胞膜重构中发挥重要作用[9]。研究报道显示, 在乳腺癌细胞系和NIH3T3成纤维细胞中ASAP1对伪足形成起到关键的作用[10]。在纤维细胞和前列腺癌细胞中降低ASAP1的表达, 能阻止侵袭伪足的形成, 从而抑制了细胞的迁移和侵袭[11]。ASAP1的过表达与一些癌症转移有关[12-14]。ASAP1低表达巨噬细胞使沙门氏菌感染受阻[15]。
在人体中, 结核病最主要的病理生理过程是结核分枝杆菌导致被感染的人肺吞噬细胞以及其他细胞的聚集和肉芽肿的形成。肉芽肿是宿主免疫细胞和结核分枝杆菌相互作用最直接和最集中的部位[16-18]。研究表明, 巨噬细胞生物功能的强弱对结核性肉芽肿组织的形成与转归有重要的影响[5, 19]。因此, 对ASAP1影响巨噬细胞免疫生物学功能进行系统研究, 将为阐明ASAP1影响结核病易感性的生物学机制提供重要的依据。
本研究建立了巨噬细胞模型, 获得了不同ASAP1表达水平的巨噬细胞, 感染结核分枝杆菌后, 检测结核分枝杆菌对ASAP1表达的影响, 解析了ASAP1表达水平与巨噬细胞吞噬结核分枝杆菌的关系, 为解析ASAP1影响巨噬细胞对结核分枝杆菌的免疫能力进行初步研究, 也为阐明ASAP1基因多态性调控宿主对结核病易感性的生物学机制提供了理论依据。
1 材料与方法 1.1 试验材料人急性白血病单核细胞THP-1细胞系来自中国科学院上海细胞库。BCG菌株由英国帝国理工大学馈赠; Mtb H37Ra菌株由宁夏大学王玉炯教授馈赠; pTEC27-td-Tomato质粒由剑桥大学医学系Lalita Ramakrishnan教授馈赠, 用于制备td-Tomato-Mtb H37Ra菌株。结核分枝杆菌增菌液购自索莱宝公司。ASAP1的cDNA序列购自山东唯真生物公司。RPMI-1640培养基购自美国BI公司, 胎牛血清(fetal bovine serum, FBS)购自英国Labtech公司; 佛波酯(PMA)购自美国SIGMA公司; Lipofectamine 3000转染试剂购自美国Thermo Fisher公司。Trizol-RNA提取试剂、逆转录试剂购自日本TaKaRa公司; 荧光定量PCR试剂购自美国Bio-Rad公司。细胞全蛋白提取试剂盒购自索莱宝公司; ASAP1抗体购自美国Santa Cruz公司; β-actin抗体购自武汉Proteintech公司。
1.2 细菌培养与计数BCG菌株以及Mtb H37Ra菌株于含有10%(体积分数)增菌液的7H9液体培养基在37 ℃、200 r·min-1条件下培养3周。取少量菌液经梯度稀释后涂布于含有10%增菌液的7H10固体培养基, 37 ℃静置培养3周, 通过菌落数和菌液稀释倍数确定细菌的数量。
1.3 表达td-Tomato的Mtb H37Ra菌株的转化与筛选用10%的甘油制备电转化Mtb H37Ra感受态细胞, 将pTEC27-td-Tomato质粒通用电转化的方法, 转化到Mtb H37Ra感受态细胞中, 经不含抗生素的液体培养基孵育后, 用含有100 ng·mL-1潮霉素的7H10固体培养基37 ℃静置培养3周。挑选单个荧光较强的菌落, 利用含有100 ng·mL-1潮霉素的7H9液体培养基培养3周, 用荧光显微镜观察td-Tomato红色荧光蛋白在Mtb H37Ra菌株中的表达情况。
1.4 细胞培养与分化THP-1细胞置于含有10% FBS的RPMI-1640培养基, 在含有5% CO2的37 ℃恒温、恒湿培养箱中培养。每隔2~3 d采用半换液方式进行细胞传代。野生型THP-1和ASAP1慢病毒表达系统转导的THP-1细胞系经100 nmol·L-1的PMA诱导48 h, 分别分化为野生型ASAP1表达的巨噬细胞和过表达ASAP1巨噬细胞。此时, 细胞由悬浮状态变为贴壁状态, 获得的野生型ASAP1表达的巨噬细胞和过表达ASAP1巨噬细胞供下游试验使用。
1.5 细胞转染设计合成3对ASAP1特异siRNA, 以及NC(negative control)siRNA序列。将3对ASAP1特异siRNA等比例混合后, 利用Lipo3000转染试剂, 依据操作说明转染至THP-1细胞, 同时将NC-siRNA作为对照转染THP-1细胞。转染后立即加入PMA使THP-1细胞分化为巨噬细胞。siRNA序列分别为:ASAP1-661:5′-CACCUUGGAUUCUUUGUUATT-3′; ASAP1-1382:5′-GACCUGAUAUCACAUAAUATT-3′; ASAP1-2241:5′-CUGCCCUAGACAUAGCAAATT-3′。
1.6 ASAP1慢病毒表达系统构建及慢病毒的制备构建ASAP1-GFP慢病毒过表达载体pLVX-ASAP1-GFP, 将构建好的表达载体与包装载体(pMD2g和pspAx)与Lipo3000形成脂质复合体, 共转染至293T细胞, 分别于48和72 h收集上清液, 混合离心后获得病毒液。病毒液经梯度稀释后转导293T细胞测定病毒滴度。以同样方法制备GFP表达慢病毒, 作为对照。
1.7 细胞的感染按照巨噬细胞数与细菌数的比例为1:10进行感染, 感染4 h后去除细菌, PBS清洗3次, 加50 μmol·L-1庆大霉素2 h, 杀死存留在细胞表面的细菌, 再培养18 h, 用PBS洗3次, 加入含有1 g·L-1 TritonX-100的PBS, 使细胞裂解释放细菌, 利用上述细菌计数方法计算被吞噬细菌的数量。
1.8 RNA提取、反转录及荧光定量PCR分析利用Trizol法提取细胞总RNA, 之后用反转录试剂将mRNA反转录为cDNA, 并稀释5倍。利用荧光定量PCR检测ASAP1的mRNA相对表达。引物序列如下:ASAP1-F:5′-CCCCTTTTGCAGCAACTTACA-3′; ASAP1-R:5′-TCCTATGTCCCACAGTAAGCTGG-3′; β-actin-F:5′-AGTGTGACGTGGACATCCGCA-3′; β-actin-R:5′-ATCCACATCTGCTGGAAGGTGGAC-3′。
1.9 细胞全蛋白提取及Western blotting试验利用加有蛋白酶抑制剂的RIPA蛋白裂解液提取细胞总蛋白, 用BCA法测定蛋白浓度。取60 μg蛋白样品, 用质量分数为10%的分离胶、5%的浓缩胶进行SDS-PAGE电泳, 整个电泳时间约为1.5 h。电泳结束后用0.3 A恒流2 h在冰上将蛋白转移至PVDF膜。采用质量分数5%脱脂奶室温封闭2 h, 一抗过夜孵育, 用TBST洗膜3次后, 孵育红外荧光二抗2 h, 用TBST清洗3次后, 用红外荧光扫膜仪获得特异蛋白的免疫印迹图像。
1.10 细胞免疫荧光染色在24孔板中放入18 mm细胞爬片, 将细胞铺板于孔内。经试验处理后, 用PBS清洗, 加入4%多聚甲醛固定1 h; PBS清洗过后, 加入细胞核染料(DAPI)室温避光放置10 min; PBS清洗3次, 将爬片取出倒置于载玻片并封片。利用Delt Vision荧光显微成像系统, 获取免疫荧光图片。
1.11 数据分析使用Image J软件分析内参蛋白及目的蛋白条带的灰度值, 以目的蛋白与内参蛋白的灰度值之比作为蛋白相对表达数值。采用SPSS 19.0软件进行统计分析, 数据图中用误差线(Error Bar)表示标准差, 2组数据间比较采用t测验, 多组数据间比较采用ANOVA检验。
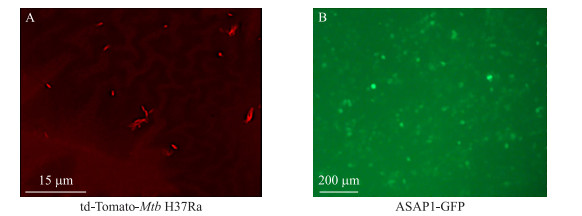
2 结果与分析 2.1 td-Tomato-Mtb H37Ra菌株的制备和ASAP1过表达THP-1细胞系的建立经电转化将pTEC27-td-Tomato质粒导入Mtb H37Ra菌株中, 并通过潮霉素筛选及培养得到红色荧光标记的Mtb H37Ra菌株(td-Tomato-Mtb H37Ra)(图 1-A), 为可视化研究细胞吞噬Mtb的试验提供了荧光标记菌株。
利用制备好的ASAP1-GFP过表达慢病毒, 转导THP-1细胞, 再经嘌呤霉素筛选得到了ASAP1稳定过表达的THP-1细胞(图 1-B), 为研究ASAP1在免疫细胞中的作用提供了过表达细胞模型。
|
图 1 td-Tomato转化的Mtb H37Ra菌株以及ASAP1过表达THP-1细胞系 Figure 1 td-Tomato transformed Mtb H37Ra and ASAP1-GFP overexpression THP-1 cell line A. td-Tomato-Mtb H37Ra菌株(红色荧光)的荧光显微镜图片; B. ASAP1-GFP过表达THP-1细胞系(绿色荧光)的荧光显微镜图片。 A. Image of td-Tomato-Mtb H37Ra(red)was acquired by fluorescence microscope; B. Image of ASAP1-GFP overexpression THP-1 cell line(green)was acquired by fluorescence microscope. |
ASAP1与肌动蛋白相关结构的形成相关, 还参与细胞黏着斑等结构的形成, 同时也影响细胞迁移和扩散[20-22]。为了确定ASAP1是否参与巨噬细胞吞噬Mtb的过程, 我们检测了巨噬细胞吞噬Mtb H37Ra和BCG后ASAP1的表达变化情况。THP-1细胞经PMA诱导分化为巨噬细胞, 再经10倍感染复数(MOI)的Mtb H37Ra和BCG感染24 h, 利用Western blotting以及荧光定量PCR检测感染后巨噬细胞ASAP1的表达。Western blotting结果(图 2)显示:与未感染的巨噬细胞相比, BCG感染后巨噬细胞ASAP1的表达无显著变化; Mtb H37Ra感染使巨噬细胞ASAP1的表达显著上调(P < 0.01)。

|
图 2 巨噬细胞经Mtb H37Ra以及BCG感染后ASAP1蛋白的Western blotting表达分析 Figure 2 Western blotting analysis of ASAP1 expression in macrophages infected by BCG or Mtb H37Ra Control、BCG、Mtb分别代表未感染、BCG感染、Mtb感染巨噬细胞的样品。**P < 0.01。下同。 Control, BCG, Mtb represent the sample of the uninfected, BCG infection, the Mtb infected macrophages, respectively.**P < 0.01. The same as follows. |
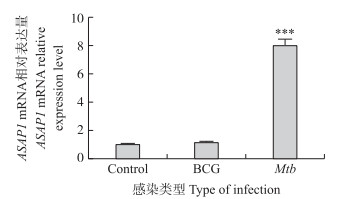
利用荧光定量PCR在转录水平检测ASAP1 的表达结果显示(图 3):与未感染的巨噬细胞相比, Mtb H37Ra显著上调巨噬细胞ASAP1的表达(P < 0.001), 而BCG不能上调巨噬细胞ASAP1 的表达。我们推测ASAP1参与并增强了巨噬细胞对Mtb的吞噬作用。
|
图 3 巨噬细胞经Mtb H37Ra以及BCG感染后ASAP1 的mRNA表达情况 Figure 3 Relative mRNA expression of ASAP1 in macrophages infected by BCG or Mtb H37Ra ***P < 0.001. |
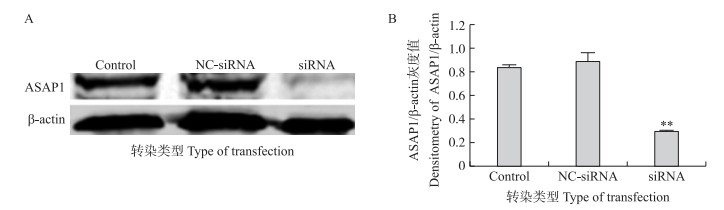
为了进一步确定ASAP1是否参与巨噬细胞对Mtb的吞噬过程, 以及ASAP1对巨噬细胞吞噬Mtb过程的影响, 建立了ASAP1敲低及过表达巨噬细胞。在诱导THP-1分化的同时转染等比混合的ASAP1特异siRNA, 48 h后即得到ASAP1敲低巨噬细胞。将ASAP1-GFP稳定过表达的THP-1细胞, 经PMA诱导即得到ASAP1过表达巨噬细胞。通过Western blotting检测巨噬细胞ASAP1的表达情况(图 4), 与对照巨噬细胞相比, ASAP1特异siRNA能有效降低巨噬细胞ASAP1的表达(P < 0.01);NC-siRNA(非特异siRNA)对巨噬细胞ASAP1的表达无影响。与对照巨噬细胞相比, ASAP1-GFP过表达慢病毒能有效在巨噬细胞中过表达ASAP1(P < 0.01);GFP过表达对ASAP1表达无影响(图 5)。
|
图 4 敲低巨噬细胞中ASAP1的Western blotting蛋白表达分析 Figure 4 Western blotting analysis of ASAP1 protein expression in knockdown macrophages Control、NC-siRNA、siRNA分别代表未转染、阴性对照siRNA、ASAP1-siRNA转染巨噬细胞的样品。 Control, NC-siRNA, siRNA represent the sample of the un-transfection, negative control siRNA transfection and ASAP1-siRNA transfection macrophages, respectively. |

|
图 5 过表达巨噬细胞中ASAP1的Western blotting蛋白表达分析 Figure 5 Western blotting analysis of ASAP1 protein expression in overexpression macrophages Control、GFP、ASAP1-GFP分别代表对照、GFP过表达、ASAP1-GFP过表达巨噬细胞的样品。 Control, GFP, ASAP1-GFP represent the sample of the control, GFP overexpression and ASAP1-GFP overexpression macrophages, respectively. |
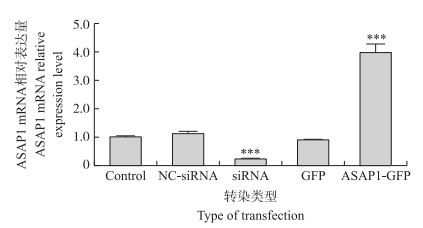
利用荧光定量PCR在转录水平检测ASAP1的表达, 结果显示(图 6):与对照巨噬细胞相比, ASAP1特异siRNA能有效降低巨噬细胞ASAP1的表达(P < 0.001);ASAP1-GFP过表达慢病毒能有效过表达ASAP1(P < 0.001);NC-siRNA以及GFP对巨噬细胞ASAP1的表达无影响。
|
图 6 mRNA水平检测巨噬细胞ASAP1过表达及降低效果 Figure 6 Relative mRNA expression of ASAP1 in ASAP1 knockdown and overexpression macrophages Control、NC-siRNA、siRNA分别代表未转染、阴性对照siRNA、ASAP1-siRNA转染巨噬细胞的样品, GFP、ASAP1-GFP分别代表GFP过表达对照、ASAP1-GFP过表达巨噬细胞的样品。 Control, NC-siRNA, siRNA represent the sample of the un-transfection, negative control siRNA transfection and ASAP1-siRNA transfection macrophages. GFP, ASAP1-GFP represent the sample of the control, GFP overexpression and ASAP1-GFP overexpression macrophages, respectively. |
利用Mtb H37Ra感染ASAP1不同表达的巨噬细胞(MOI=10:1)。24 h以后, 收集并裂解细胞, 通过稀释涂板培养计数, 得到被吞噬细菌的数量。ASAP1过表达巨噬细胞吞噬Mtb的数量与对照细胞相比极显著提高(P < 0.001);ASAP1低表达巨噬细胞对Mtb的吞噬数量与对照细胞相比显著减少(P < 0.05), 结果见图 7。
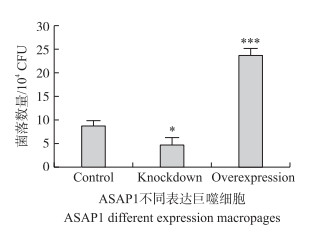
|
图 7 菌落计数检测不同ASAP1表达的巨噬细胞吞噬Mtb能力的差异 Figure 7 Phagocytosis of Mtb H37Ra about different ASAP1 expression macrophages Control、knockdown、overexpression分别代表ASAP1正常表达、ASAP1低水平表达、ASAP1高水平表达巨噬细胞的样品。下同。 Control, knockdown, overexpression represent the sample of normal ASAP1 expression, low ASAP1 expression, high ASAP1 expression macrophages, respectively. The same as follows. |
用td-Tomato-Mtb H37Ra感染不同ASAP1表达的巨噬细胞的细胞免疫荧光试验, 结果显示(图 8):被感染细胞与未被感染的细胞数量有明显差异, 通过对被感染细胞数量占总细胞数量的比例分析, 证实ASAP1过表达巨噬细胞对Mtb吞噬率比对照细胞明显增多; ASAP1低表达巨噬细胞对Mtb吞噬率比对照细胞明显减少。
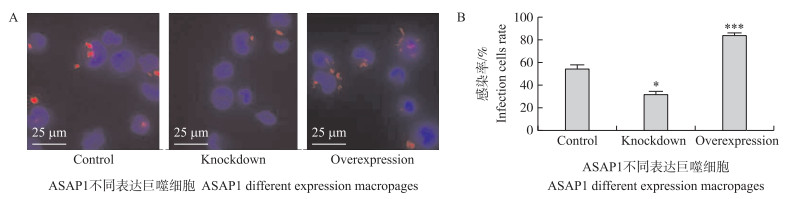
|
图 8 ASAP1不同表达的巨噬细胞吞噬td-Tomato-Mtb H37Ra能力差异 Figure 8 Phagocytosis of td-Tomato-Mtb H37Ra in macrophages expressing different levels of ASAP1 A.在td-Tomato-Mtb H37Ra感染24 h后, 不同ASAP1表达水平的巨噬细胞的图片(细胞核为蓝色); B.被感染细胞所占比例的数据分析。 A. The images of macrophages expressing different levels of ASAP1 at 24 h post-infection of td-Tomato-Mtb H37Ra were shown in top panel(cell nucleus was blue); B. The statistics of the percentage of infected cells was shown above. |
综上, ASAP1不同表达的巨噬细胞对Mtb的吞噬能力不同, 说明ASAP1参与巨噬细胞对Mtb的吞噬作用。另外, ASAP1不但参与巨噬细胞对Mtb的吞噬过程, 同时ASAP1表达水平与巨噬细胞吞噬Mtb的能力呈正相关性, 显示ASAP1的表达水平对巨噬细胞吞噬Mtb有调节作用。
3 讨论ASAP1作为ArfGAP家族的一个重要蛋白, 含有6个主要结构域。早期的研究着重于对该蛋白结构域功能的分析[23]以及ASAP1磷酸化对下游蛋白的调控作用[24]。目前在细菌感染与ASAP1关系的研究中, 主要以ArfGAP家族的其他蛋白为主要研究对象, 且主要以没有吞噬功能的细胞系作为细胞模型。例如, Davidson等[15]研究发现沙门氏菌利用ArfGAP家族蛋白对细胞骨架的调节作用来感染Caco-2结肠癌细胞。Song等[25]文章指出ArfGAP1通过控制肌动蛋白骨架重构来抑制Mtb对Hela细胞的感染。目前, 对ASAP1功能在免疫细胞中的免疫生物学特性的了解甚少, 且在结核病的免疫机制研究中, 也没有明确涉及ASAP1基因对Mtb感染的调控机制。
结核病是由结核分枝杆菌感染引起的传染病, 全基因组关联分析研究发现ASAP1基因多态性与结核病易感性相关, 小规模临床样本试验证实含有特定ASAP1单核苷酸多态性的结核病患者ASAP1表达水平低, 体外试验证实ASAP1低水平表达抑制了被Mtb感染的树突状细胞的迁移[8]。另外, 研究证实ASAP1与细胞迁移、运动以及吞噬小体的形成相关[9], 因此我们通过对结核病病理生理特征及免疫学知识的了解, 进一步推测被感染的异常ASAP1表达的免疫细胞在Mtb感染后, 其免疫生理功能受损, 如迁移受损、吞噬能力受限等, 导致机体对Mtb的固有免疫反应受到限制, 进而影响对Mtb抗原的呈递反应, 导致体内免疫系统对Mtb的抑制作用减弱, 导致易感性的发生。巨噬细胞作为控制Mtb感染的主要固有免疫细胞, ASAP1如何影响巨噬细胞对Mtb的吞噬, 还未有研究。因此, 以巨噬细胞为细胞模型, 研究ASAP1对巨噬细胞吞噬Mtb的作用机制有重要意义。
本研究证实, 巨噬细胞在Mtb感染后ASAP1表达上调, 同时利用ASAP1过表达及沉默的巨噬细胞检测对Mtb的吞噬能力, 说明ASAP1参与巨噬细胞对Mtb的吞噬。同时试验证实ASAP1表达量与巨噬细胞对Mtb的吞噬能力呈正相关, 说明ASAP1能调节巨噬细胞对Mtb的吞噬作用。ASAP1对巨噬细胞的吞噬能力的影响也符合以前对ArfGAP功能的研究结果。
同时, 我们证实了ASAP1对巨噬细胞吞噬Mtb的影响。ASAP1异常表达有可能与结核病易感性相关。本试验建立的与临床样本对应的细胞模型, 为ASAP1与结核病易感性的研究提供了重要的试验材料。我们还确立了ASAP1表达与巨噬细胞吞噬Mtb的关系, 为解析ASAP1影响巨噬细胞对结核分枝杆菌的免疫能力做了初步研究, 为研究ASAP1基因多态性影响结核病易感性提供一定的研究基础。然而, ASAP1如何影响巨噬细胞对Mtb的吞噬能力以及Mtb如何影响巨噬细胞的免疫反应还需进一步研究。
英国帝国理工大学、宁夏大学王玉炯教授和剑桥大学医学系Lalita Ramakrishnan教授为本试验提供了帮助, 谨致谢意。
| [1] | Wang X, Wang X, Ma A, et al. ASAP1 gene polymorphisms are associated with susceptibility to tuberculosis in a Chinese Xinjiang Muslim population[J]. Experimental & Therapeutic Medicine, 2018, 15(4): 3392-3398. |
| [2] |
秦波, 柳桐, 徐聪, 等. CARD15基因StyⅠ酶切多态性与奶牛结核病易感性的相关性分析[J].
中国畜牧兽医, 2015, 42(6): 1553-1558.
Qin B, Liu T, Xu C, et al. Correlation study of CARD15 gene StyⅠ polymorphism and susceptibility of tuberculosis in dairy cows[J]. China Animal Husbandry and Veterinary Medicine, 2015, 42(6): 1553-1558. (in Chinese with English abstract) |
| [3] | Huang Z, Luo Q, Guo Y, et al. Mycobacterium tuberculosis-induced polarization of human macrophage orchestrates the formation and development of tuberculous granulomas in vitro[J]. PLoS One, 2015, 10(6): e0129744. DOI: 10.1371/journal.pone.0129744 |
| [4] | Podinovskaia M, Lee W, Caldwell S, et al. Infection of macrophages with Mycobacterium tuberculosis induces global modifications to phagosomal function[J]. Cellular Microbiology, 2013, 15(6): 843-859. DOI: 10.1111/cmi.2013.15.issue-6 |
| [5] | Guirado E, Schlesinger L S, Kaplan G. Macrophages in tuberculosis:friend or foe[J]. Seminars in Immunopathology, 2013, 35(5): 563-583. DOI: 10.1007/s00281-013-0388-2 |
| [6] | Haines J L, Hauser M A, Schmidt S, et al. Complement factor H variant increases the risk of age-related macular degeneration[J]. Science, 2005, 308(5720): 419-421. DOI: 10.1126/science.1110359 |
| [7] | Fridkis-Hareli M, Storek M, Mazsaroff I, et al. Design and development of TT30, a novel C3d-targeted C3/C5 convertase inhibitor for treatment of human complement alternative pathway-mediated diseases[J]. Blood, 2011, 118(17): 4705-4713. DOI: 10.1182/blood-2011-06-359646 |
| [8] | Curtis J, Luo Y, Zenner H L, et al. Susceptibility to tuberculosis is associated with variants in the ASAP1 gene encoding a regulator of dendritic cell migration[J]. Nature Genetics, 2015, 47(5): 523-527. DOI: 10.1038/ng.3248 |
| [9] | Kahn R A, Lambright D G. A pH domain with dual phospholipid binding sites regulates the ArfGAP, ASAP1[J]. Structure, 2015, 23(11): 1971. DOI: 10.1016/j.str.2015.10.002 |
| [10] | Bharti S, Inoue H, Bharti K, et al. Src-dependent phosphorylation of ASAP1 regulates podosomes[J]. Molecular and Cellular Biology, 2007, 27(23): 8271. DOI: 10.1128/MCB.01781-06 |
| [11] | Lin D, Watahiki A, Bayani J, et al. ASAP1, a gene at 8q24, is associated with prostate cancer metastasis[J]. Cancer Research, 2008, 68(11): 4352-4359. DOI: 10.1158/0008-5472.CAN-07-5237 |
| [12] | Onodera Y, Hashimoto S, Hashimoto A, et al. Expression of AMAP1, an ArfGAP, provides novel targets to inhibit breast cancer invasive activities[J]. EMBO Journal, 2005, 24(5): 963-973. DOI: 10.1038/sj.emboj.7600588 |
| [13] | Ehlers J P, Worley L, Onken M D, et al. DDEF1 is located in an amplified region of chromosome 8q and is overexpressed in uveal melanoma[J]. Clin Cancer Res, 2005, 11(10): 3609-3613. DOI: 10.1158/1078-0432.CCR-04-1941 |
| [14] | Müller T, Stein U, Poletti A, et al. ASAP1 promotes tumor cell motility and invasiveness, stimulates metastasis formation in vivo, and correlates with poor survival in colorectal cancer patients[J]. Oncogene, 2010, 29(16): 2393-2403. DOI: 10.1038/onc.2010.6 |
| [15] | Davidson A C, Humphreys D, Brooks A B E, et al. The Arf GTPase-activating protein family is exploited by Salmonella enterica serovar Typhimurium to invade nonphagocytic host cells[J]. mBio, 2015, 6(1): e02253-14. |
| [16] | Ramakrishnan L. Revisiting the role of the granuloma in tuberculosis[J]. Nature Reviews Immunology, 2012, 12(5): 352-366. DOI: 10.1038/nri3211 |
| [17] | Russell D G, Cardona P J, Kim M J, et al. Foamy macrophages and the progression of the human TB granuloma[J]. Nature Immunology, 2009, 10(9): 943. DOI: 10.1038/ni.1781 |
| [18] | Nunesalves C, Booty M G, Carpenter S M, et al. In search of a new paradigm for protective immunity to TB[J]. Nature Reviews Microbiology, 2014, 12(4): 289-299. DOI: 10.1038/nrmicro3230 |
| [19] | Kleinnijenhuis J, Oosting M, Joosten L A, et al. Innate immune recognition of Mycobacterium tuberculosis[J]. Clinical and Developmental Immunology, 2011. DOI: 10.1155/2011/4050310 |
| [20] | Liu Y, Yerushalmi G M, Grigera P R, et al. Mislocalization or reduced expression of Arf GTPase-activating protein ASAP1 inhibits cell spreading and migration by influencing Arf1 GTPase cycling[J]. Journal of Biological Chemistry, 2005, 280(10): 8884-8892. DOI: 10.1074/jbc.M412200200 |
| [21] | Randazzo P A, Andrade J, Miura K, et al. The Arf GTPase-activating protein ASAP1 regulates the actin cytoskeleton[J]. Proc Natl Acad Sci USA, 2000, 97(8): 4011-4016. DOI: 10.1073/pnas.070552297 |
| [22] | Shiba Y, Randazzo P A. GEFH1 binds ASAP1 and regulates podosome formation[J]. Biochemical and Biophysical Research Communications, 2011, 406(4): 574. DOI: 10.1016/j.bbrc.2011.02.093 |
| [23] | Kruljac-Letunic A, Moelleken J, Kallin A, et al. The tyrosine kinase Pyk2 regulates Arf1 activity by phosphorylation and inhibition of the Arf-GTPase-activating protein ASAP1[J]. Journal of Biological Chemistry, 2003, 278(32): 29560-29570. DOI: 10.1074/jbc.M302278200 |
| [24] | Kam J L, Miura K, Jackson T R, et al. Phosphoinositide-dependent activation of the ADP-ribosylation factor GTPase-activating protein ASAP1[J]. Journal of Biological Chemistry, 2000, 275(13): 9653-9663. DOI: 10.1074/jbc.275.13.9653 |
| [25] | Song O R, Queval C J, Iantomasi R, et al. ArfGAP1 restricts Mycobacterium tuberculosis entry by controlling the actin cytoskeleton[J]. EMBO Reports, 2018, 19: 29-42. DOI: 10.15252/embr.201744371 |




