文章信息
- 李芳芳, 杨娜, 钱猛, 甘立军
- LI Fangfang, YANG Na, QIAN Meng, GAN Lijun
- 生长素参与三十烷醇诱导的拟南芥侧根发育
- Auxin is involved in triacontanol-induced lateral root development in Arabidopsis thaliana
- 南京农业大学学报, 2018, 41(3): 473-480
- Journal of Nanjing Agricultural University, 2018, 41(3): 473-480.
- http://dx.doi.org/10.7685/jnau.201709016
-
文章历史
- 收稿日期: 2017-09-07
拟南芥的侧根源自正对木质部极的中柱鞘细胞, 其发育可以分为3个阶段, 即侧根的起始、侧根原基的形成和侧根的突出及伸长[1]。侧根是根系的重要组成部分, 其发达程度直接决定了根系固着及吸收水分和矿质营养的能力。
侧根的发育受到多种因子的调控[1]。拟南芥侧根起始位点在主根上表现出节律性的出现, 转录因子AUXIN RESPONSIVE FACTOR7(ARF7)和LATERAL ORGAN BOUNDARIES DOMAIN16(LBD16)在此过程中发挥重要的调控作用。突变体arf 7侧根起始位点的节律性异常, 表明其在调控侧根发育相关基因节律表达中起关键作用[1]。转录因子GATA23和MEMVRANE-ASSOCIATED KINASE REGULATORS(MARKR4)调控建成细胞的命运, GATA 23功能获得型及缺失型突变体和markr4功能缺失型突变体的侧根原基数量减少。小肽GOLVEN/ROOT GROWTH FACTOR/CLE-like家族成员GLV6在建成细胞中的水平影响建成细胞的分裂, 其表达水平太低抑制侧根起始, 提高表达水平促进垂周分裂[1]。
侧根的发育受到植物激素生长素的调控。生长素在侧根起始过程中参与了细胞周期的活化和建成细胞的形成[2]。增加木质部极的中柱鞘单个细胞中生长素的形成能够诱导侧根的起始, 而破坏建成细胞中生长素的积累则抑制侧根的起始[3]。生长素调控侧根原基的构建[2]。研究表明侧根原基从基部到顶部的生长素浓度呈梯度分布, 这种分布对侧根原基的构建发挥重要的作用[4]。生长素还调控侧根的突出过程。生长素输入载体影响细胞壁重塑酶的表达, 进而影响皮层细胞的分离和侧根原基突出主根[5]。此外, 生长素还通过调控水孔蛋白基因表达, 影响侧根突出主根[5-6]。
1977年, Ries等[7]发现三十烷醇(triacontanol, TRIA)是天然存在于紫花苜蓿中的一种植物生长物质。TRIA是一种长链的伯醇, 广泛存在于植物的蜡质中, 如紫花苜蓿、蓝莓和水稻等植物[7-8]。TRIA在植物生长发育中发挥重要的作用, 如:促进根和茎的生长、提高植物的光合作用及产量、缓解各种胁迫等[8-9]。外源TRIA的处理增加了1, 5-二磷酸羧化加氧酶的活性, 进而提高植物的光合作用[10]。喷施TRIA能增加扁豆叶片中氮、磷、钾和钙的含量[11]。Muthuchelian等[9]发现TRIA能促进根系的发育。此外, TRIA处理能缓解盐胁迫对加拿大油菜的伤害[12]。Karam等[13]发现TRIA的预处理能通过提高芫荽抗氧化酶的活性来增加其对砷毒害的抗性。TRIA能促进植物生长, 增加产量[8]。然而, 关于TRIA对拟南芥根系发育的作用鲜有报道。本研究旨在研究TRIA对拟南芥侧根发育的影响, 揭示其调控侧根发育的机制, 为生产上的应用提供理论依据。
1 材料与方法 1.1 材料与培养拟南芥野生型种子生态型为Columbia, 突变体为生长素不敏感突变体tir- 1、eir1-1、aux1-7和axr1-3, 均为Columbia背景, 转基因株系DR 5:β-glucuronidase(GUS)和IAA 2:GUS为野生型背景下转入生长素报告基因。
将种子放入1 g·L-1 HgCl2中消毒10 min, 用去离子水洗6次。将消毒后的种子播于含有10 g·L-1蔗糖和琼脂的1/2 MS培养基中, 在4 ℃黑暗条件下放置1 d, 然后将其转移至光照培养箱中, 培养箱昼/夜温度为25 ℃/23 ℃, 光/暗时间为16 h/8 h。用荧光灯提供光源, 光照强度为250 μmol·m-2·s-1。培养5 d后将幼苗转移到新的对照或处理培养基上。培养皿垂直放置以便植物在培养基的表面生长。
1.2 试剂处理TIBA(2, 3, 5-triiodobenzoic acid)、NPA(1-naphthylphthalamic acid)和PCIB(p-chlorophenoxy isobutyric acid)分别溶于一定量的乙醇中, 然后用去离子水稀释到1 mmol·L-1, TIBA的处理浓度为0.1、0.5和2.5 μmol·L-1, NPA的处理浓度为1、5和10 μmol·L-1, PCIB的处理浓度为1、5和10 μmol·L-1。30 mg TRIA溶于10 mL的四氢糠醇中, 加入1 g β-环糊精和5 mL吐温-80于87 ℃加热搅拌30 min, 定容到100 mL, TRIA的处理浓度为0.02、0.10、0.20、0.50和1.00 μmol·L-1。对照溶液中包含等量的四氢糠醇、β-环糊精和吐温-80。所有试剂均来自Sigma-Aldrich。这些试剂均在培养基温度为45~50 ℃时加入。
1.3 侧根、根长和生物量的测定 1.3.1 侧根和根长的测定培养5 d的幼苗转移到新的对照或处理培养基上处理8 d, 将生长拟南芥幼苗的培养皿置于体视显微镜(MZFLⅢ, Leica Microsystem, Wetzlar, Germany)下观察拍照, 根长和侧根均通过软件Motic Images Plus 2.0(Motic China Group)分析。所测定侧根均为已突出主根长度大约0.2 mm(即肉眼可见)。
1.3.2 侧根原基的测定培养5 d的幼苗转移到新的对照或处理培养基上处理4 d, 统计侧根原基的数目。侧根原基(lateral root primordium, LRP)的分析根据Shirakawa等[14]的方法, 将0.5 μmol·L-1 TRIA处理4 d的幼苗透明, 透明液为水合三氯乙醛、水、甘油的混合液(各成分的体积比为8:2:1), 放于载玻片上于光学显微镜(Stemi 2000-C, Zeiss, Germany)下观察。侧根原基的分类参考Zhang等[15]的分类方法:阶段A, LRP包含三层细胞; 阶段B, 超过三层细胞但是没有突出主根; 阶段C, 突出主根的侧根, 长度小于0.5 mm; 阶段D, 侧根长度大于0.5 mm。
1.3.3 生物量的测定培养5 d的幼苗转移到新的对照或处理培养基上处理8 d, 将幼苗地上和地下分别取样, 去离子水清洗附着的琼脂, 吸水纸吸干水后, 称质量。
1.4 生长素的测定内源生长素测定参照文献[16-17]的方法。取500 mg根迅速冻于液氮中, 研磨后用80%(体积分数)的甲醇提取, 并用C18-SepPak cartridge(Waters)纯化, 将内源IAA甲酯化后置于Varian Saturn 2000 GC-MS/MS中测定。
1.5 组织化学分析拟南芥幼苗用去离子水清洗后, 参照Li等[18]的方法进行GUS组织化学染色, 将不同处理的拟南芥幼苗浸在GUS染液(0.5 mg·mL-1 X-Gluc, pH7.0、50 mmol·L-1的PBS, 1 mmol·L-1 K4Fe(CN)6, 1 mmol·L-1 K3Fe(CN)6, 0.1% Triton X-100和1 mmol·L-1 EDTA)中, 染色12 h后, 取样拍照。
1.6 RNA的提取及荧光定量分析将生长5 d的幼苗转移至含有0.5 μmol·L-1 TRIA的培养基中, 处理12 h后取样。用RNA提取试剂盒(TaKaRa)提取拟南芥幼苗总RNA, 参照Ma等[19]的方法及程序进行荧光定量PCR, 以Acti n2为内参基因。ASA1、TAA1、YUC2、YUC3、YUC9、AAO1和AAO3引物参考Liu等[20]设计; CYCB 1、CYCD2、CYCD4和CDKA引物参考Feng等[21]设计。所用引物序列如表 1。
基因Gene | 序列(5′→3′)Sequence |
| ASA1F | ATGTCTTCCTCTATGAACGTAGC |
| ASA1R | ACAGCGGTAAATTGGTATAAGG |
| TAA1F | CTCCAAGATCACAGGCCACGCTGGG |
| TAA1R | GACTCCTTAGACACACCAATCGAGTTC |
| YUC2F | GGTGACACGGATCGGTTAGGGT |
| YUC2R | TGCCGAATAATGCATTACCCGT |
| YUC3F | CTTGAGATTGATTCCGTTATTC |
| YUC3R | GGAGAAGAAGTCGTTGTC |
| YUC9F | ATCTTGCTAACCACAATG |
| YUC9R | CCACTTCATCATCATCAC |
| AAO1F | TGCCTGTTCCAGCAACAATG |
| AAO1R | TAAGCAGAACACCGCCATTG |
| AAO3F | GGAGTCAGCGAGGTGGAAGT |
| AAO3R | TGCTCCTTCGGTCTGTCCTAA |
| CYCB1;1F | AGCCGAAGAAAGTGGCTGGGA |
| CYCB1;1R | TCCACAGCTGCGAGGTCATTCT |
| CYCD2;1F | GTGGTCTCTCCCCTCTCTACCCT |
| CYCD2;1R | TCGCTGGTTTCACCACAAGCA |
| CYCD4;1F | GCCAGCACAACCAAAGGTAT |
| CYCD4;1R | CCCATTGGGTGTTTGTGAAC |
| CDKA ;1F | CCGAGCACCAGAGATACTCC |
| CDKA; 1R | GTTACCCCACGCCATGTATC |
采用SPSS 17.0软件进行数据统计分析, 进行t测验和Duncan ’ s多重比较分析。
2 结果与分析 2.1 外源TRIA处理对拟南芥幼苗根系发育的影响如图 1可知:外源TRIA显著增加拟南芥幼苗地上部鲜质量。0.02和0.10 μmol·L-1 TRIA处理8 d, 对地上部鲜质量没有明显影响, 而0.20、0.50和1.00 μmol·L-1 TRIA处理的幼苗地上部鲜质量分别增加了16.6%、34.0%和17.8%(图 1-A)。TRIA处理对地下部鲜质量没有明显作用。0.50和1.00 μmol·L-1 TRIA处理幼苗根长分别增加了15.4%和18.4%(图 1-B)。上述结果表明:TRIA能够促进拟南芥幼苗的发育。

|
图 1 十三烷醇(TRIA)对拟南芥幼苗生长的影响 Figure 1 Effects of triacontanol(TRIA)on the growth of Arabidopsis seedlings 图中柱上不同小写字母表示差异显著(P < 0.05)。下同。 Different letters indicate significant difference at 5% level. The same as follows. |
如图 2所示:TRIA处理显著促进侧根的发育, 侧根数量和侧根密度都随着处理浓度的增加而增多。0.02和0.10 μmol·L-1 TRIA处理8 d后, 侧根数目和密度没有明显影响, 而0.20、0.50和1.00 μmol·L-1 TRIA处理幼苗侧根数量分别增加了75.1%、118.4%和94.8%, 侧根密度分别增加了59.0%、97.9%和54.2%。其中, 0.50 μmol·L-1 TRIA处理效果最好, 因此后续试验均选择0.50 μmol·L-1 TRIA作为处理浓度。并且根部表型也和试验数据一致(图 2-C)。

|
图 2 TRIA对拟南芥幼苗侧根发育的影响 Figure 2 Effects of TRIA on lateral root formation in Arabidopsis seedlings |
从图 3可见:与对照相比, TRIA处理后阶段A的侧根原基数量和密度分别增加了80.0%和67.8%。上述结果表明TRIA诱导的侧根形成主要是通过产生更多从头形成的侧根原基。此外, 参与细胞周期调控的关键蛋白基因的表达结果显示:CYCB 1、CYCD2、CYCD4和CDKA受到TRIA的上调(图 3-C), 这暗示TRIA调控的细胞分裂与TRIA诱导的侧根原基形成密切相关。

|
图 3 TRIA对拟南芥幼苗侧根原基发育及基因表达的影响 Figure 3 Effects of TRIA on lateral root primordium(LRP)development and gene expression in Arabidopsis seedlings |
与对照相比, TRIA处理的根部内源IAA的含量增加了53.9%(图 4-A)。TRIA处理显著提高了根部生长素合成关键酶基因ASA 1、TAA1、YUC3和YUC9的表达量(图 4-B)。TRIA处理后DR 5:GUS在主根根尖和侧根中的表达量显著增加(图 4-C)。IAA 2:GUS的表达与DR 5:GUS的表达相似。上述结果表明TRIA处理促进了生长素的合成和积累。
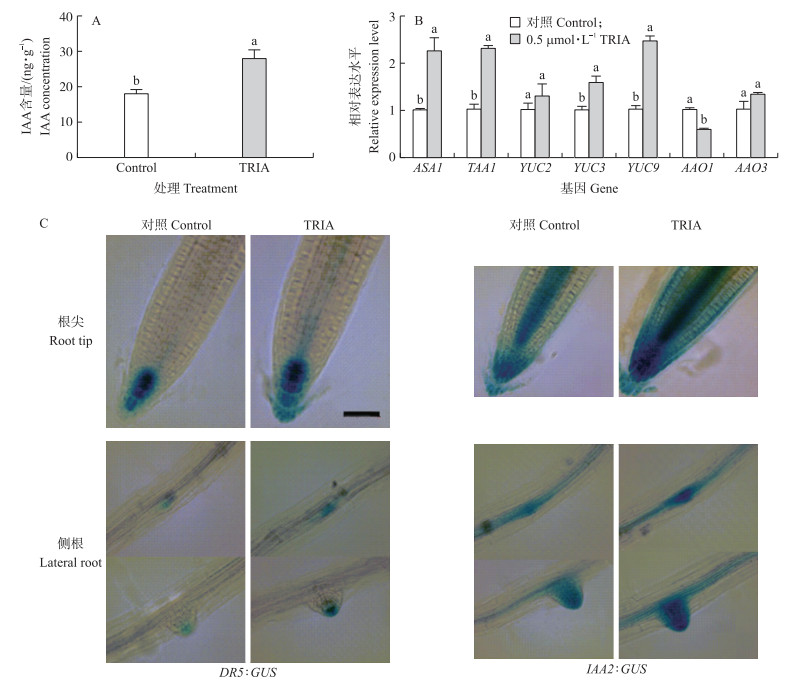
|
图 4 TRIA对拟南芥幼苗IAA合成的影响 Figure 4 Effects of TRIA on IAA biosynthesis in Arabidopsis seedlings A.对照和0.5 μmol·L-1 TRIA处理根部IAA的含量; B.对照和0.5 μmol·L-1 TRIA处理根部IAA合成关键酶基因表达分析; C.对照和0.5 μmol·L-1 TRIA处理根部生长素报告基因DR 5:GUS和IAA 2:GUS的表达分析。 A. IAA content of control roots and 0.5 μmol·L-1 TRIA-treated roots; B. Expression levels of genes encoding enzymes involved in IAA biosynthesis in control roots and 0.5 μmol·L-1 TRIA-treated roots; C. DR 5:GUS and IAA 2:GUS expression in control roots and 0.5 μmol·L-1 TRIA-treated roots. |
从图 5可知:TIBA和NPA均显著抑制了TRIA诱导的侧根发育。在对照生长条件下, 0.1~2.5 μmol·L-1 TIBA处理的幼苗侧根密度降低了34.5%~77.0%, 而在TRIA处理中加入0.1和0.5 μmol·L-1 TIBA, 幼苗侧根密度分别降低了46.5%和80.2%, 2.5 μmol·L-1 TIBA几乎完全抑制TRIA处理幼苗侧根的产生(图 5-A); 5~10 μmol·L-1NPA处理幼苗侧根密度降低了75.1%~94.4%, 而在TRIA处理中加入5 μmol·L-1 NPA, 幼苗侧根密度降低了70.5%, 10 μmol·L-1NPA的加入则几乎完全抑制TRIA处理侧根的产生(图 5-B)。PCIB同样能够抑制对照和TRIA处理侧根的产生(图 5-C)。上述结果表明:生长素的极性运输和信号传递参与TRIA诱导的侧根发生。
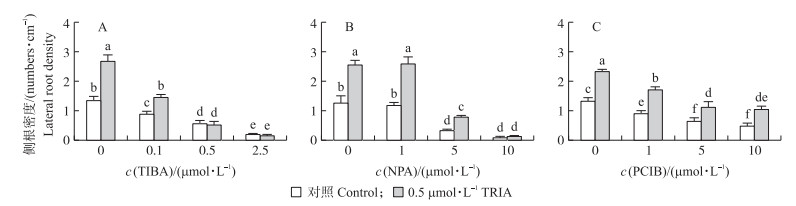
|
图 5 TIBA(A)、NPA(B)和PCIB(C)对TRIA诱导的野生型拟南芥侧根发育的影响 Figure 5 The effects of TIBA(A), NPA(B)and PCIB(C)on TRIA-induced lateral root formation in wild type(WT)Arabidopsis seedlings |
由图 6可知:TRIA处理增加了生长素不敏感型突变体aux 1-7和eir1-1 的侧根密度, 但是低于野生型的侧根密度。上述结果说明如果生长素运输异常, TRIA诱导的侧根发生一定程度上受抑制, 进一步证实生长素的极性运输参与了TRIA诱导的侧根发生。此外, 我们的结果还发现TRIA处理生长素不敏感型突变体tir 1-1和axr1-3不能诱导侧根的产生, 暗示了生长素的信号传递参与TRIA诱导的侧根发生。
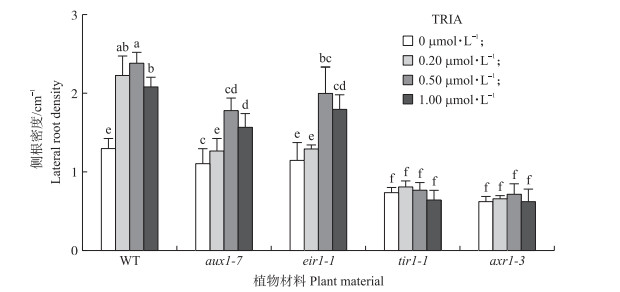
|
图 6 TRIA对拟南芥野生型和生长素不敏感型突变体tir 1-1、axr1-3、aux1-7和eir1-1侧根发育的影响 Figure 6 The effects of TRIA on lateral root formation in WT, tir 1-1, axr1-3, aux1-7, and eir 1-1 seedlings of Arabidopsis |
TRIA是天然存在于植物中的生长调控因子, 能促进植物的生长, 增强植物的光合能力, 提高产量, 促进多种植物对矿质和水分的吸收[8]。我们研究发现, 外源TRIA的添加, 能增加拟南芥地上鲜质量, 这与Waqas等[22]研究叶面喷施TRIA能提高水稻和绿豆的鲜质量及干质量的结果相似。然而, 关于TRIA对根系发育的研究较少。Muthuchelian等[9]研究报道TRIA处理能增加根的数目。本研究中TRIA处理不仅能够促进拟南芥主根的伸长生长, 而且能够促进侧根的发生。侧根的产生包括正对木质部中柱鞘细胞发育为建成细胞, 进而经过多次细胞分裂形成侧根原基, 侧根原基进一步生长突出主根并进行伸长生长[1]。本研究中TRIA处理增加了阶段A侧根原基的数目, 暗示TRIA通过促进侧根原基的从头形成来增加侧根的数量。
TRIA处理能通过诱导细胞分裂促进烟草愈伤组织的生长[23]。Giridhar等[24]报道TRIA的处理能诱导Coffea arabica和Coffea canephora叶片外植体形成胚状体。上述报道说明TRIA是调控细胞周期的关键因子。中柱鞘细胞重新进入细胞周期是侧根原基形成的前提条件[1]。D-type cyclins(CYCDs)是调控细胞周期的关键因子[25]。研究报道CYCD4;1和CYCD2;1与侧根的形成密切相关, 两者表达异常则侧根数量减少[26-27]。本研究中TRIR处理增加CYCB 1、CYCD2、CYCD4和CDKA的表达, 暗示TRIA诱导的侧根原基的形成与细胞重新进入周期过程密切相关。发达的根系对于植物固着、水分和矿质的吸收极为重要, TRIA对侧根发育的作用有利于植物的生长发育。
3.2 TRIA通过影响生长素的合成调控侧根的发育生长素是调控侧根发育的关键因子[1]。侧根的形成依赖生长素的水平, 拟南芥生长素过量产生型突变体superroot 1侧根的数量多于野生型, 减少根部IAA的含量则减少侧根的形成[28-29]。Liu等[20]报道methyl 3-(4-hydroxyphenyl)propionate(MHPP)通过增加生长素的合成促进侧根的形成。本研究中, TRIA处理增加根部IAA水平, 表明生长素的合成参与了TRIA诱导的侧根形成。拟南芥中, 生长素的合成依赖色氨酸途径, 色氨酸在色氨酸氨基转移酶TAA蛋白家族的催化下生成吲哚丙酮酸, 再经黄素单加氧酶家族YUCCA蛋白催化生成IAA, 这条途径为生长素合成的主要途径。TAA和YUC基因协调作用, 共同调控IAA的合成[1-2]。本研究结果显示, TRIA处理提高了生长素合成关键酶基因TAA 1、YUC3、YUC9 等基因的表达。这些结果表明TRIA通过上调生长素合成关键酶基因的表达, 增加根部生长素的水平来促进侧根的发育。
响应生长素的报告基因DR 5:GUS和IAA 2:GUS在根部的表达与生长素的积累和分布相关[1]。我们检测了侧根形成中DR 5:GUS和IAA 2:GUS的表达, 发现外源TRIA处理增加了根尖和不同发育阶段侧根DR 5:GUS和IAA 2:GUS的表达。上述结果暗示生长素的积累和分布参与TRIA诱导的侧根发育。
3.3 生长素的运输和信号传递参与TRIA调控的侧根发育生长素的极性运输, 包括生长素向顶(从地上到根尖)和向基的运输(从根尖到根基部), 在侧根发育中发挥重要作用[1]。生长素极性运输抑制剂NPA显著抑制拟南芥侧根的发育[30]; Khan等[31]报道NPA处理完全抑制Martelella endophytica YC6887诱导的侧根形成。本研究中, TRIA条件下, 外源TIBA和NPA的处理抑制野生型侧根的发育, 表明生长素参与TRIA调控的侧根发育。AUXIN RESISTANCE1(AUX1)是生长素的输入载体, 突变体aux 1 侧根发育受阻。生长素输出载体PIN-FORMED(PIN)是调控侧根发育的关键因子[4, 32]。本研究结果显示, 与野生型相比, 突变体aux 1-7和eir1-1/pin2-1 对TRIA的响应显著降低, 说明干扰生长素的运输抑制侧根的形成。上述结果说明TRIA诱导的侧根发育一定程度上依赖生长素的极性运输。
TIR1是生长素的受体, 生长素存在时, TIR1与其结合, 诱导auxin/indole-3 acetic acid(Aux/IAA)蛋白的降解, 进而生长素响应因子(ARF)与响应生长素的基因结合, 促进其表达[1-2]。生长素的信号传递参与侧根的发育。例如, 低磷诱导TIR 1的表达, 突变体tir1 在低磷条件下侧根发育受抑制, 说明缺乏生长素信号的感受, 侧根发育减少[33]。本研究发现, 与野生型相比, 外源TRIA处理突变体tir 1-1和axr1-3侧根显著降低, 表明TRIA诱导的侧根形成依赖生长素的信号传递。
综上所述, 我们研究发现TRIA能够通过促进侧根原基的从头形成来增加侧根的密度。通过抑制剂和突变体的研究, TRIA诱导的侧根形成依赖生长素的途径。然而, TRIA是如何调控生长素的运输及信号传递来影响侧根发育还需更深入的研究。
| [1] | Du Y J, Scheres B. Lateral root formation and the multiple roles of auxin[J]. J Exp Bot, 2017, 69(2): 155-167. |
| [2] | Lavenus J, Goh T, Roberts I, et al. Lateral root development in Arabidopsis:fifty shades of auxin[J]. Trends Plant Sci, 2013, 18: 450-458. DOI: 10.1016/j.tplants.2013.04.006 |
| [3] | Dubrovsky J G, Sauer M, Napsucialy-Mendivil S, et al. Auxin acts as a local morphogenetic trigger to specify lateral root founder cells[J]. Proc Natl Acad Sci USA, 2008, 105: 8790-8794. DOI: 10.1073/pnas.0712307105 |
| [4] | Benková E, Michniewicz M, Sauer M, et al. Local, efflux-dependent auxin gradients as a common module for plant organ formation[J]. Cell, 2003, 115: 591-602. DOI: 10.1016/S0092-8674(03)00924-3 |
| [5] | Swarup K, Benková E, Swarup R, et al. The auxin influx carrier LAX3 promotes lateral root emergence[J]. Nat Cell Biol, 2008, 10: 946-954. DOI: 10.1038/ncb1754 |
| [6] | Péret B, Li G, Zhao J, et al. Auxin regulates aquaporin function to facilitate lateral root emergence[J]. Nat Cell Biol, 2012, 14: 991-998. DOI: 10.1038/ncb2573 |
| [7] | Ries S K, Wert V F. Growth response of rice seedlings to triacontanol in light and dark[J]. Planta, 1977, 135: 77-82. DOI: 10.1007/BF00387979 |
| [8] | Naeem M, Khan M M A, Moinuddin. Triacontanol:a potent plant growth regulator in agriculture[J]. J Plant Interact, 2012, 7(2): 129-142. DOI: 10.1080/17429145.2011.619281 |
| [9] | Muthuchelian K, Velayutham M, Nedunchezhian N. Ameliorating effect of triacontanol on acidic mist-treated erythrina variegate seedlings changes in growth and photosynthetic activities[J]. Plant Sci, 2003, 165: 1253-1257. DOI: 10.1016/S0168-9452(03)00333-9 |
| [10] | Chen X, Yuan H, Chen R, et al. Biochemical and photochemical changes in response to triacontanol in rice(Oryza sativa L.)[J]. Plant Growth Regul, 2003, 40: 249-256. DOI: 10.1023/A:1025039027270 |
| [11] | Naeem M, Khan M M A, Moinuddin, et al. Triacontanol stimulates nitrogen-fixation, enzyme activities, photosynthesis, crop productivity and quality of hyacinth bean(Lablab purpureus L.)[J]. Sci Hort, 2009, 121: 389-396. DOI: 10.1016/j.scienta.2009.02.030 |
| [12] | Shahbaz M, Noreen N, Perveen S. Triacontanol modulates photosynthesis and osmoprotectants in canola(Brassica napus L.)under saline stress[J]. J Plant Interact, 2013, 8(4): 350-359. DOI: 10.1080/17429145.2013.764469 |
| [13] | Karam E A, Keramat B, Asrar Z, et al. Triacontanol-induced changes in growth, oxidative defense system in coriander(Coriandrum sativum)under arsenic toxicity[J]. Ind J Plant Physiol, 2016, 21(2): 137-142. DOI: 10.1007/s40502-016-0213-8 |
| [14] | Shirakawa M, Ueda H, Shimada T, et al. Arabidopsis Qa-SNARE SYP2 proteins localized to different subcellular regions function redundantly in vacuolar protein sorting and plant development[J]. Plant J, 2010, 64: 924-935. DOI: 10.1111/tpj.2010.64.issue-6 |
| [15] | Zhang H, Jennings A, Barlow P W, et al. Dual pathways for regulation of root branching by nitrate[J]. Proc Natl Acad Sci USA, 1999, 96: 6529-6534. DOI: 10.1073/pnas.96.11.6529 |
| [16] | Ding X, Cao Y, Huang L, et al. Activation of the indole-3-acetic acid-amido synthetase GH3-8 suppresses expansin expression and promotes salicylate-and jasmonate-independent basal immunity in rice[J]. Plant Cell, 2008, 20: 228-240. DOI: 10.1105/tpc.107.055657 |
| [17] | Liu W, Li R J, Han T T, et al. Salt stress reduces root meristem size by nitric oxide-mediated modulation of auxin accumulation and signaling in Arabidopsis[J]. Plant Physiol, 2015, 168: 343-356. DOI: 10.1104/pp.15.00030 |
| [18] | Li G, Zhu C, Gan L, et al. GA3 enhances root responsiveness to exogenous IAA by modulating auxin transport and signaling in Arabidopsis[J]. Plant Cell Rep, 2015, 34: 483-494. DOI: 10.1007/s00299-014-1728-y |
| [19] | Ma X L, Zhu C H, Yang N, et al. γ-Aminobutyric acid addition alleviates ammonium toxicity by limiting ammonium accumulation in rice(Oryza sativa)seedlings[J]. Physiol Plant, 2016, 158: 389-401. DOI: 10.1111/ppl.12473 |
| [20] | Liu Y, Wang R, Zhang P, et al. The nitrification inhibitor methyl 3-(4-hydroxyphenyl)propionate modulates root development by interfering with auxin signaling via the NO/ROS pathway in Arabidopsis[J]. Plant Physiol, 2016, 171: 1686-1703. DOI: 10.1104/pp.16.00670 |
| [21] | Feng Z, Sun X, Wang G, et al. LBD29 regulates the cell cycle progression in response to auxin during lateral root formation in Arabidopsis thaliana[J]. Ann Bot, 2012, 110: 1-10. DOI: 10.1093/aob/mcs019 |
| [22] | Waqas M, Shahzad R, Khan A L, et al. Salvaging effect of triacontanol on plant growth, thermotolerance, macro-nutrient content, amino acid concentration and modulation of defense hormonal levels under heat stress[J]. Plant Physiol Biochem, 2016, 99: 118-125. DOI: 10.1016/j.plaphy.2015.12.012 |
| [23] | Hangarter R, Ries S. Effect of triacontanol on plant cell cultures in vitro[J]. Plant Physiol, 1978, 61: 855-857. DOI: 10.1104/pp.61.5.855 |
| [24] | Giridhar P, Indu E P, Ravishankar G A, et al. Influence of triacontanol on somatic embryogenesis in Coffea arabica L. and Coffea canephora P. ex Fr.[J]. In vitro Cell Dev Biol Plant, 2004, 40: 200-203. DOI: 10.1079/IVP2003519 |
| [25] | Masubelele N H, Dewitte W, Menges M, et al. D-type cyclins activate division in the root apex to promote seed germination in Arabidopsis[J]. Proc Natl Acad Sci USA, 2005, 102: 15694-15699. DOI: 10.1073/pnas.0507581102 |
| [26] | Nieuwland J, Maughan S, Dewitte W, et al. The D-type cyclin CYCD4;1 modulates lateral root density in Arabidopsis by affecting the basal meristem region[J]. Proc Natl Acad Sci USA, 2009, 106: 22528-22533. DOI: 10.1073/pnas.0906354106 |
| [27] | Xie Z, Lee E, Lucas J R, et al. Regulation of cell proliferation in the stomatal lineage by the Arabidopsis MYB FOUR LIPS via direct targeting of core cell cycle genes[J]. Plant Cell, 2010, 22: 2306-2321. DOI: 10.1105/tpc.110.074609 |
| [28] | Boerjan W, Cervera M T, Delarue M, et al. Superroot, a recessive mutation in Arabidopsis, confers auxin overproduction[J]. Plant Cell, 1995, 7: 1405-1419. DOI: 10.1105/tpc.7.9.1405 |
| [29] | Nakazawa M, Yabe N, Ichikawa T, et al. DFL1, an auxin-responsive GH3 gene homologue, negatively regulates shoot cell elongation and lateral root formation, and positively regulates the light response of hypocotyl length[J]. Plant J, 2001, 25: 213-221. DOI: 10.1046/j.1365-313x.2001.00957.x |
| [30] | Raya-González J, Ortiz-Castro R, Ruíz-Herrera L F, et al. PHYTOCHROME AND FLOWERING TIME1/MEDIATOR25 regulates lateral root formation via auxin signaling in Arabidopsis[J]. Plant Physiol, 2014, 165: 880-894. DOI: 10.1104/pp.114.239806 |
| [31] | Khan A, Hossain M T, Park H C, et al. Development of root system architecture of Arabidopsis thaliana in response to colonization by Martelella endophytica YC6887 depends on auxin signaling[J]. Plant Soil, 2016, 405: 81-96. DOI: 10.1007/s11104-015-2775-z |
| [32] | Bennett M J, Marchant A, Green H G, et al. Arabidopsis AUX1 gene:a permease-like regulator of root gravitropism[J]. Science, 1996, 273: 948-950. DOI: 10.1126/science.273.5277.948 |
| [33] | Pérez-Torres C A, López-Bucio J, Cruz-Ramírez A, et al. Phosphate availability alters lateral root development in Arabidopsis by modulating auxin sensitivity via a mechanism involving the TIR1 auxin receptor[J]. Plant Cell, 2014, 20: 3258-3272. |




