文章信息
- 乔俊卿, 刘邮洲, 张荣胜, 刘永锋
- QIAO Junqing, LIU Youzhou, ZHANG Rongsheng, LIU Yongfeng
- 枯草芽胞杆菌T-500产脂肽类抗生素的摇瓶发酵工艺优化
- Optimization of fermentation process of Bacillus subtilis T-500 for production of lipopeptide antibiotics in flask
- 南京农业大学学报, 2018, 41(3): 447-455
- Journal of Nanjing Agricultural University, 2018, 41(3): 447-455.
- http://dx.doi.org/10.7685/jnau.201705017
-
文章历史
- 收稿日期: 2017-05-11
芽胞杆菌是一种研究较为深入的生防菌株资源, 它具有较强的环境适应性, 对多种植物病原菌具有拮抗性, 且无毒、无污染、无残留毒性, 不易使病原菌产生抗药性, 目前已被广泛应用于微生物农药的研发。国内外已推广应用的菌株有解淀粉芽胞杆菌(Bacillus amyloliquefaciens)FZB42、枯草芽胞杆菌(Bacillus subtilis)GB03和短小芽胞杆菌(Bacillus pumilus)GB34等; 陈志谊等和Luo等以枯草芽胞杆菌Bs916为活性成分创制的微生物杀菌剂“纹曲宁”对水稻纹枯病、稻曲病具有良好防效, 2002—2016年累计推广700万hm2, 取得了巨大的社会、经济和生态效益。
芽胞杆菌通过分泌脂肽类抗生素, 如Surfactin(表面活性素)、Iturin(伊枯草菌素)和Fengycin(泛革素)等, 直接杀死或抑制病原菌, 与病原菌进行营养和空间竞争, 诱导植物产生抗病性, 从而发挥其防病的作用。高效发酵技术是生防制剂产品研发的关键技术因素, 目前, 芽胞杆菌发酵的常用培养基主要成分有小麦粉、玉米糊、黄豆饼粉、鱼粉和酵母膏(粉)以及一些微量元素(阳离子)。然而, 不同的菌株、不同的培养基组分对发酵液中的菌含量和抗菌物质含量影响较大。张荣胜等对解淀粉芽胞杆菌Lx-11进行了发酵培养基的优化, 使得发酵液菌含量和抑菌效果分别提高了180%和30%。王美英等通过对多黏芽胞杆菌(Paenibacillus polymyxa)JSa-9发酵优化, 发现CaCO3对芽胞生成影响最大。
枯草芽胞杆菌T-500是本研究室分离获得的1株对水稻纹枯病和稻瘟病均有良好防治效果的生防菌。本研究通过比较10种常用芽胞杆菌发酵的培养基和发酵条件对T-500菌株产脂肽类抗生素的影响, 筛选影响T-500的脂肽类抗生素的关键培养基成分和培养条件因子; 并采用Plackett-Burman试验、中心组合试验和响应曲面法对T-500高产脂肽类抗生素的摇瓶发酵工艺进行优化, 以期为T-500菌株的生防制剂开发提供理论指导和技术支撑。
1 材料与方法 1.1 供试菌株和培养基枯草芽胞杆菌(Bacillus subtilis)T-500和水稻纹枯病菌(Rhizoctonia solani)RH-2由江苏省农业科学院植物保护研究所水稻病害与生物防治研究室保存。
枯草芽胞杆菌T-500常规活化采用LB培养基(胰蛋白胨10.0 g·L-1, 酵母粉5.0 g·L-1, NaCl 10.0 g·L-1), 发酵种子液用常用培养基YPG(胰蛋白胨5.0 g·L-1, 酵母膏5.0 g·L-1, 葡萄糖5.0 g·L-1)制备。水稻纹枯病菌RH-2用PDA培养基(马铃薯200.0 g·L-1, 葡萄糖20.0 g·L-1, 琼脂15.0 g·L-1)活化培养。本研究采用的10种常用基础发酵培养基列于表 1。
| 培养基编号 No.of media |
培养基成分及含量 Media composition and content |
| 1 | 蛋白胨Peptone 5.0 g, 酵母粉Yeast extract 5.0 g, 葡萄糖Glucose 5.0 g, K2HPO4 0.2 g, MgSO4·7H2O 0.2 g, 蒸馏水Distill water 1 000 mL |
| 2 | 小麦粉Wheat powder 10.0 g, 黄豆饼粉Soybean powder 20.0 g, MgSO4 0.2 g, MnSO4 5.0 mg, FeSO4 0.5 mg, 蒸馏水Distill water 1 000 mL |
| 3 | 玉米糊Corn powder 10.0 g, 黄豆饼粉Soybean powder 20.0 g, MgSO4 0.2 g, MnSO4 5.0 mg, FeSO4 0.5 mg, 蒸馏水Distill water 1 000 mL |
| 4 | 大米粉Rice powder 10.0 g, 黄豆饼粉Soybean powder 20.0 g, MgSO4 0.2 g, MnSO4 5.0 mg, FeSO4 0.5 mg, 蒸馏水Distill water 1 000 mL |
| 5 | 蛋白胨Peptone 10.0 g, 酵母粉Yeast extract 5.0 g, NaCl 5.0 g, 蒸馏水Distill water 1 000 mL |
| 6 | 蛋白胨Peptone 5.0 g, 酵母粉Yeast extract 5.0 g, 葡萄糖Glucose 5.0 g, MgSO4 0.5 g, KCl 0.5 g, KH2PO4 1.0 g, FeSO4 0.15 mg, MnSO4 5.0 mg, CuSO4 0.16 mg, 蒸馏水Distill water 1 000 mL |
| 7 | 黄豆饼粉Soybean powder 10.0 g, 玉米糊Corn powder 20.0 g, (NH4)2SO4 2.0 g, Na2HPO4 2.0 g, 蒸馏水Distill water 1 000 mL |
| 8 | 可溶性淀粉Soluble starch 1.0 g, 葡萄糖Glucose 15.0 g, 黄豆饼粉Soybean powder 30.0 g, 酵母粉Yeast extract 0.2 g, KH2PO4 1.5 g, K2HPO4 3.0 g, MgSO4·7H2O 0.5 g, CaCO3 0.1 g, FeSO4 0.1 g, 蒸馏水Distill water 1 000 mL |
| 9 | 葡萄糖Glucose 20.0 g, L-谷氨酸L-glutamate 5.0 g, MgSO4 0.5 g, KCl 0.5 g, KH2PO4 1.0 g, FeSO4 0.15 mg, MnSO4 5.0 mg, CuSO4 0.16 mg, 蒸馏水Distill water 1 000 mL |
| 10 | 蛋白胨Peptone 5.0 g, 酵母粉Yeast extract 5.0 g, 葡萄糖Glucose 5.0 g, 蒸馏水Distill water 1 000 mL |
取-70 ℃冰箱保存的T-500菌种于LB平板活化, 28 ℃静置培养24 h后, 挑取单胞接种于含有20 mL YPG液体的100 mL三角瓶中, 28 ℃、180 r·min-1振荡培养12 h, 即为发酵种子液。
1.3 发酵液菌含量和抑菌活性的测定发酵液菌含量测定采用10倍梯度稀释涂布法。将发酵液稀释至10-8~10-7, 然后取0.1 mL稀释液均匀涂布于LB平板上, 28 ℃培养16~24 h。记录每皿菌落数, 计算发酵液菌含量。
脂肽类抗生素的提取:将T-500发酵过程中得到的发酵液于6 000 r·min-1离心15 min, 上清液用HCl沉淀, pH值调到2.0, 4 ℃过夜; 10 000 r·min-1离心5 min, 收集沉淀, 晾干后(30 ℃温箱)按照1/10体积发酵液的量加入色谱级甲醇溶解沉淀, 并调pH值到7.0;室温溶解24 h, 离心获得上清液, 用0.22 μm滤膜过滤, 得到无菌滤液, 用于抗菌活性测定。
抑菌活性测定采用对峙法。将水稻纹枯病菌在PDA平板活化, 待长满平板后, 用打孔器制作5 mm的菌饼, 并转接入PDA平板中央; 以菌饼为中心, 向十字方位距离中心2.5 cm处用5 mm打孔器打孔, 加入50 μL无菌甲醇提取滤液, 吹干后, 28 ℃培养2~3 d, 测量抑菌带宽。
1.4 发酵工艺的优化 1.4.1 培养基的筛选在含100 mL培养基的500 mL三角瓶中, 接种1%的种子液, 于28 ℃、180 r·min-1培养48 h后, 分别测定发酵液菌含量和脂肽类抗生素的抑菌效果, 比较表 1中各培养基对T-500菌株发酵液菌含量和产脂肽类抗生素的影响, 筛选最佳培养基成分。
1.4.2 培养基组分关键因子筛选根据培养基筛选的试验结果, 发现2号、3号和5号培养基发酵的T-500菌含量较高; 3号和5号培养基发酵液的脂肽类抗生素提取液抑菌效果最好。因此, 以2号、3号和5号培养基组成为基础, 采用Design-expert软件进行Plackett-Burman摇瓶发酵试验设计, 从以下9个因素中筛选关键因子:小麦粉(A)5~10 g·L-1, 黄豆饼粉(B)10~20 g·L-1, 玉米糊(C)5~10 g·L-1, 蛋白胨(D)2.5~10.0 g·L-1, 酵母粉(E)1.25~5.00 g·L-1, NaCl(F)1~5 g·L-1, 阳离子(G)51.37~205.50 mg·L-1(将MgSO4、MnSO4和FeSO4作为整体进行等比例改变), 装液量(H)500 mL三角瓶装80~120 mL, 转速(I)150~180 r·min-1。试验中每因素取2水平:即高水平“1”(范围区间最大值)和低水平“-1”(范围区间最小值), 每组试验3次重复。
1.4.3 培养条件关键因子筛选采用Plackett-Burman设计, 培养条件因素为:温度(A)25~30 ℃, 转速(B)120~180 r·min-1, 装液量(C)500 mL三角瓶装80~120 mL, 接种量(D)1%~3%, 发酵时间(E)48~72 h。从这5个因素中筛选对菌株T-500脂肽类抗生素抑菌能力具有显著影响的因子。试验中每因素取2水平:即高水平“1”和低水平“-1”, 每组试验3次重复。
1.5 中心组合试验设计 1.5.1 培养基关键因子中心组合试验根据培养基成分的Plackett-Burman试验结果, 综合选出3个对发酵液菌含量和脂肽类抗生素抑菌效果均产生显著影响的培养基成分关键因素:A, 黄豆饼粉; B, 蛋白胨; C, 酵母粉。确定中心点数值。利用中心组合试验进行3因素试验, 根据其设计原理, 分别按照轴向点α值为1.681 79, 角点值为1, 设计5水平试验, 共设20组, 每组3个重复。
1.5.2 培养条件关键因子中心组合试验根据培养条件的Plackett-Burman试验结果, 选出3个对脂肽类抗生素抑菌效果产生显著性影响的因素:A, 装液量; B, 接种量; C, 发酵时间。确定中心点数值。利用中心组合试验进行3因素试验, 根据其设计原理, 分别按照轴向点α值为1.681 79, 角点值为1, 设计5水平试验, 共设20组, 每组3个重复。
1.6 脂肽类抗生素的质谱和高效液相色谱检测用0.22 μm有机滤膜过滤甲醇提取的脂肽类抗生素粗提液, 滤液进行高效液相色谱(HPLC)和飞行时间离子质谱(MALDI-TOF-MS)分析, 参考向亚萍等的方法。HPLC分析采用C18(5 μm, 250 mm×4.6 mm; YYDAC 218TP; Hesperia, CA)柱, 流动相为乙腈、水、三氯乙酸(体积比为80:20:0.1, Surfactin; 体积比为40:60:0.1, Iturin; 体积比为50:50:0.1, Fengycin); 流速为0.5 mL·min-1, 进样量为10 μL, 紫外检测波长为210 nm, 柱温为30 ℃。MALDI-TOF-MS以Bruker Reflex MALDI-TOF仪记录, 使用337 nm氮激光源解吸附和电离, 基质为α-氰-4-羟肉桂酸(α-cyano-4-hydroxycinnamic acid), 1 μL样品与等体积的基质混匀, 置于仪器离子源进行测定, 相对分子质量扫描范围为0~2 000。
1.7 数据分析Plackett-Burman试验、中心组合试验及响应曲面试验均利用Design-expert.v.8.0.6.1软件进行设计和分析。
2 结果与分析 2.1 T-500发酵最佳培养基组成成分筛选由图 1显示:在10种培养基中, T-500菌株在培养基2、3和5号中生长较好, 尤其是3号培养基, 菌含量达4.55×109 CFU·mL-1。不同培养基对T-500产生脂肽类抗生素的抑菌效果也有显著影响, 其中, 3号和5号培养基抑菌带宽最大, 分别为9.33和9.13 mm。基于以上结果, 初步确定2、3和5号培养基中的组分是影响T-500发酵液菌含量和抑菌效果的主要成分, 以此为基础进行培养基成分的Plackett-Burman关键因素筛选。
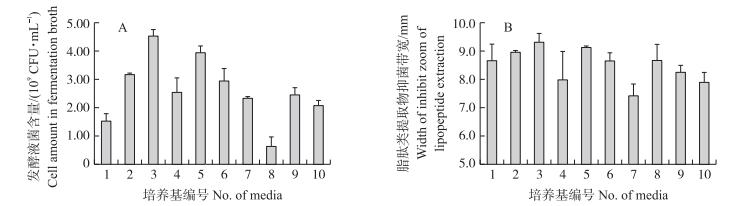
|
图 1 不同培养基对枯草芽胞杆菌T-500菌株发酵液菌含量(A)及产脂肽类抗生素抑菌能力(B)的影响 Figure 1 Effect of different media on the cell density(A)and inhibition of lipopeptide extraction against Rhizoctonia solani RH-2(B)in Bacillus subtilis T-500 culture broth |
对培养基成分的9因素2水平的Plackett-Burman试验数据进行回归分析, 所得主要因子回归方程为:Y=8.54-0.017A-1.07B-0.21C-0.76D-0.32E-0.12F+0.30G-0.85H+0.21I, 校正系数R2=0.979 8。式中:Y为抑菌圈宽度的预测值。由校正系数可知Y的变化中97.98%能被回归方程解释。Design-expert对回归模型的方差分析(表 2)显示:首先, 回归模型是显著的(P=0.016 4);此外, 黄豆饼粉、蛋白胨、酵母粉和装液量对T-500菌株产脂肽类抗生素的抑制纹枯病菌作用有显著性影响(P < 0.05), 而小麦粉、玉米糊、NaCl、阳离子和转速对T-500菌株的抑菌效果没有显著影响。在下一步的中心组合试验设计中主要以培养基成分(黄豆饼粉、蛋白胨、酵母粉)作为研究对象进行优化。
| 来源 Source |
平方和 Sum of squares |
自由度 DF |
均方 Mean square |
F值 F-value |
P值 P-value |
| 模型Model | 32.66 | 9 | 3.63 | 60.31 | 0.016 4* |
| A:小麦粉Wheat powder | 3.333×10-3 | 1 | 3.333×10-3 | 0.06 | 0.835 8 |
| B:黄豆饼粉Soybean powder | 13.65 | 1 | 13.65 | 226.93 | 0.004 4* |
| C:玉米糊Corn powder | 0.50 | 1 | 0.50 | 8.38 | 0.101 5 |
| D:蛋白胨Peptone | 6.96 | 1 | 6.96 | 115.71 | 0.008 5* |
| E:酵母粉Yeast extract | 1.20 | 1 | 1.20 | 20.00 | 0.046 5* |
| F:NaCl | 0.18 | 1 | 0.18 | 2.95 | 0.227 9 |
| G:阳离子Metal ion | 1.08 | 1 | 1.08 | 17.95 | 0.051 4 |
| H:装液量Filling volume | 8.57 | 1 | 8.57 | 142.41 | 0.006 9* |
| I:转速Shaking speed | 0.50 | 1 | 0.50 | 8.38 | 0.101 5 |
| 残差Residual | 0.12 | 2 | 0.06 | ||
| 总计Total | 32.78 | 11 | |||
| 注:*表示该因子在0.05水平差异显著。* indicates that the factor is significant difference at 0.05 level by Duncan’s new multiple range test. | |||||
根据2.2节的试验结果, 获得培养基成分的3个关键因素(黄豆饼粉、蛋白胨、酵母粉), 然后进行3因素5水平的中心组合设计, 进一步优化影响T-500摇瓶发酵脂肽类抗生素抑制纹枯病菌的培养基成分最优组合。对中心组合试验数据进行回归分析, 获得主要因子回归方程为:Y=9.90-0.60A+0.58B-0.033C+0.21AB-0.29AC-0.29BC-0.94A2-0.61B2-0.41C2, 校正系数R2=0.927 6。式中:Y为抑菌圈宽度的预测值。回归方程的方差分析(表 3)显示:模型的P值小于0.000 1, 表明该模型正确, T-500发酵产生的脂肽类抗生素的抑菌带宽实际测定值与方程预测值存在显著相关性。该模型变异系数CV为3.95%, 小于10%, 属于弱变异, 这进一步表明试验数据的可靠性。缺失拟合项值为2.05, 说明该回归方程的失拟不显著(P>0.05), 被认为所建立的回归方程拟合度高。以上结果表明该模型可以用于描述发酵培养基成分对T-500菌株所产生脂肽类抗生素的抑菌效果的影响。
| 来源 Source |
平方和 Sum of squares |
自由度 DF |
均方 Mean square |
F值 F-value |
P值 P-value |
| 模型Model | 28.85 | 9 | 3.21 | 28.06 | < 0.000 1* |
| A:黄豆饼粉Soybean powder | 4.88 | 1 | 4.88 | 42.68 | < 0.000 1 |
| B:蛋白胨Peptone | 4.64 | 1 | 4.64 | 40.64 | < 0.000 1 |
| C:酵母粉Yeast extract | 0.02 | 1 | 0.02 | 0.13 | 0.723 2 |
| AB | 0.34 | 1 | 0.34 | 2.98 | 0.115 1 |
| AC | 0.68 | 1 | 0.68 | 5.94 | 0.035 |
| BC | 0.68 | 1 | 0.68 | 5.94 | 0.035 |
| A2 | 12.64 | 1 | 12.64 | 110.66 | < 0.000 1 |
| B2 | 5.42 | 1 | 5.42 | 47.42 | < 0.000 1 |
| C2 | 2.38 | 1 | 2.38 | 20.82 | 0.001 |
| 残差Residual | 1.14 | 10 | 0.11 | ||
| 缺失拟合项Lack of fit | 0.78 | 5 | 0.16 | 2.15 | 0.210 8 |
| 纯误差Pure error | 0.36 | 5 | 0.07 | ||
| 总计Total | 29.99 | 19 | |||
| 注:*表示该模型在0.05水平差异显著。* indicates that the model is significant difference at 0.05 level by Duncan’s new multiple range test. | |||||
图 2为黄豆饼粉、蛋白胨和酵母粉对T-500菌株摇瓶发酵产脂肽类抗生素抑菌效果影响的响应曲面三维图。图 2-a、b和c都有凸起的最高点, 可以确定3个变量的优化值范围。根据2.3节得到的二阶多元方程求得3个因素的最优值, 分别是:黄豆饼粉7.00 g·L-1, 蛋白胨4.92 g·L-1, 酵母粉1.90 g·L-1。在此条件下, 脂肽类抗生素抑制纹枯病菌的抑菌带宽为10.11 mm。基于此, 我们得到最佳发酵培养基为:黄豆饼粉7.00 g·L-1, 蛋白胨4.92 g·L-1, 酵母粉1.90 g·L-1, 小麦粉5.00 g·L-1, 玉米糊5.00 g·L-1, NaCl 1.00 g·L-1, MgSO4 0.20 g·L-1, MnSO4 5.0 mg·L-1, FeSO4 0.5 mg·L-1。

|
图 2 黄豆饼粉和蛋白胨(a)、黄豆饼粉和酵母粉(b)、蛋白胨和酵母粉(c)的响应曲面图 Figure 2 Images of response surface of soybean powder and peptone(a), soybean powder and yeast extract(b), peptone and yeast extract(c) |
对培养条件的5因素2水平的Plackett-Burman试验数据进行回归分析, 所得主要因子回归方程为:Y=8.83-0.057A-0.17B+0.33C-0.44D-0.66E, 校正系数R2=0.872 5。式中:Y为抑菌圈宽度的预测值。由校正系数可知Y的变化中87.25%能被回归方程解释。回归方程的方差分析(表 4)显示, 该回归模型的P < 0.05, 表明模型是正确的。此外, 装液量、接种量和发酵时间对T-500菌株产脂肽类抗生素的抑制纹枯菌作用有显著影响(P < 0.05), 而温度和转速对T-500菌株的抑菌作用没有显著影响。
| 来源 Source |
平方和 Sum of squares |
自由度 DF |
均方 Mean square |
F值 F-value |
P值 P-value |
| 模型Model | 9.37 | 5 | 1.87 | 16.05 | 0.002 0* |
| A:温度Temperature | 0.04 | 1 | 0.04 | 0.33 | 0.586 6 |
| B:转速Shaking speed | 0.33 | 1 | 0.33 | 2.85 | 0.142 1 |
| C:装液量Filling volume | 1.32 | 1 | 1.32 | 11.30 | 0.015 2* |
| D:接种量Inoculum volume | 2.38 | 1 | 2.38 | 20.35 | 0.004 1* |
| E:发酵时间Fermentation time | 5.31 | 1 | 5.31 | 45.44 | 0.000 5* |
| 残差Residual | 0.70 | 6 | 0.12 | ||
| 总计Total | 10.08 | 11 | |||
| 注:*表示该因子在0.05水平差异显著。* indicates that the factor is significant difference at 0.05 level by Duncan’s new multiple range test. | |||||
根据2.4节的试验结果, 获得培养条件的3个关键因素(装液量、接种量、发酵时间), 然后进行3因素5水平的中心组合设计, 进一步优化影响T-500摇瓶发酵脂肽类抗生素抑制纹枯菌的培养条件最优组合。对中心组合试验所得抑菌带宽度的数据进行回归分析, 获得主要因子回归方程为:Y=10.95+0.65A-0.13B-0.51C-0.45AB+0.80AC+0.55BC-0.89A2-0.53B2-0.53C2, 校正系数R2=0.930 6。式中:Y为抑菌圈宽度的预测值。回归方程的方差分析(表 5)显示, 模型的P值小于0.000 1, 表明该模型正确。该模型的变异系数CV为3.80%, 小于10%, 属于弱变异, 这进一步表明试验数据的可靠性。缺失拟合项值为3.33(P>0.05), 说明所建立的回归方程拟合度高。以上分析表明, 该发酵培养条件的回归模型可以用于描述发酵培养条件对T-500菌株所产生脂肽类抗生素抑菌效果的影响。
| 来源 Source |
平方和 Sum of squares |
自由度 DF |
均方 Mean square |
F值 F-value |
P值 P-value |
| 模型Model | 35.23 | 9 | 3.91 | 29.3 | < 0.000 1* |
| A:装液量Filling volume | 5.82 | 1 | 5.82 | 43.55 | < 0.000 1 |
| B:接种量Inoculum volume | 0.23 | 1 | 0.23 | 1.71 | 0.219 9 |
| C:发酵时间Fermentation time | 3.54 | 1 | 3.54 | 26.51 | 0.000 4 |
| AB | 1.66 | 1 | 1.66 | 12.39 | 0.005 5 |
| AC | 5.06 | 1 | 5.06 | 37.84 | 0.000 1 |
| BC | 2.38 | 1 | 2.38 | 17.78 | 0.001 8 |
| A2 | 11.29 | 1 | 11.29 | 84.52 | < 0.000 1 |
| B2 | 4.07 | 1 | 4.07 | 30.49 | 0.000 3 |
| C2 | 4.07 | 1 | 4.07 | 30.49 | 0.000 3 |
| 残差Residual | 1.34 | 10 | 0.13 | ||
| 缺失拟合项Lack of fit | 1.03 | 5 | 0.21 | 3.33 | 0.106 3 |
| 纯误差Pure error | 0.31 | 5 | 0.06 | ||
| 总计Total | 36.57 | 19 | |||
| 注:*表示该模型在0.05水平差异显著。* indicates that the model is significant difference at 0.05 level by Duncan’s new multiple range test. | |||||
图 3为装液量、接种量和发酵时间3因素对T-500菌株摇瓶发酵产脂肽类抗生素抑菌效果影响的响应曲面三维图。图 3-a、b和c显示3个因素两两交互都有凸起的最高点, 因此可以确定3个变量的优化值范围。根据2.5节得到的二阶多元方程求得3个因素的最优值, 分别是:装液量为500 mL三角瓶装105 mL, 接种量为0.87%, 发酵时间为41.35 h。在此条件下, 脂肽类抗生素抑制纹枯菌的抑菌带宽度达到11.20 mm。基于此, 我们得到最佳发酵培养条件为:装液量500 mL三角瓶装105 mL, 接种量0.87%, 发酵时间41.35 h, 温度28 ℃, 转速180 r·min-1。
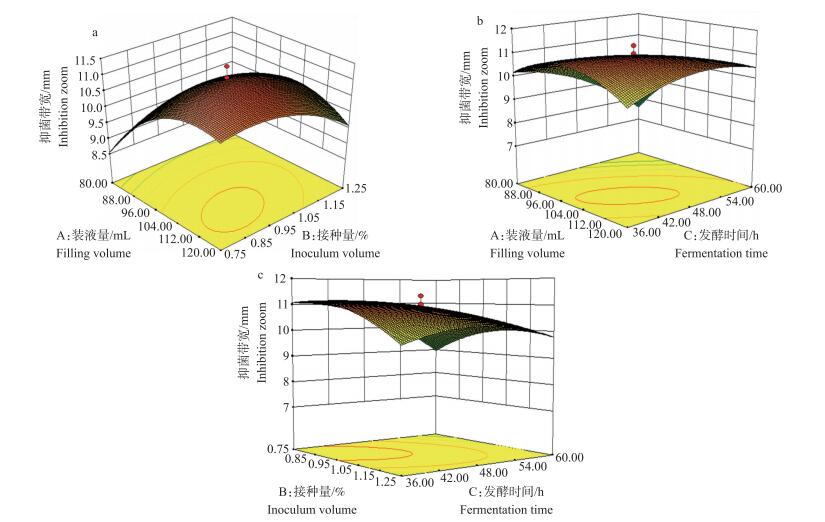
|
图 3 装液量和接种量(a)、装液量和发酵时间(b)、接种量和发酵时间(c)的响应曲面图 Figure 3 Images of response surface of filling volume and inoculum volume(a), filling volume and fermentation time(b), inoculum volume and fermentation time(c) |
基于筛选的最优发酵培养基配方(黄豆饼粉7.00 g·L-1, 蛋白4.92 g·L-1, 酵母粉1.90 g·L-1, 小麦粉5.00 g·L-1, 玉米糊5.00 g·L-1, NaCl 1.00 g·L-1, MgSO4 0.20 g·L-1, MnSO4 5.0 mg·L-1, FeSO4 0.5 mg·L-1)和最佳发酵培养条件下(装液量为500 mL三角瓶装105 mL, 接种量0.87%, 发酵时间41.35 h, 温度28 ℃, 转速180 r·min-1)进行摇瓶发酵培养试验, 结果菌株T-500发酵产生的脂肽类抗生素抑制水稻纹枯病菌的带宽为(11.23±0.15)mm, 与预测值11.20 mm无显著性差异, 发酵液菌含量为(7.41±1.18)×109 CFU·mL-1。与初始筛选T-500最佳培养基组成成分时表现最好的3号培养基相比, 发酵工艺优化后的T-500发酵产生的脂肽类抗生素对水稻纹枯病的抑菌带宽提高了20.4%, 发酵液菌含量也提高了62.9%。
2.7 优化发酵工艺后T-500产脂肽类抗生素分析为了明确T-500所产生的脂肽类抗生素的情况, 利用飞行离子时间质谱(MALDI-TOF-MS)和高效液相色谱(HPLC), 对优化的发酵工艺与基础培养基(3号基础培养基抑菌活性最好, 因此选择3号)发酵的脂肽类物质的种类和产量进行了分析, 结果(表 6)如下:1)通过质谱检测, 我们在基础培养基和优化后的摇瓶发酵中都检测到了Surfactin和Iturin; 此外, 在优化后的发酵工艺中检测到了Fengycin, 但在3号基础培养基中未检测到Fengycin。2)通过HPLC检测脂肽类物质的色谱峰面积, 统计显示, 3号基础发酵培养基中Surfactin峰面积为13 983.47 mAU, 优化发酵工艺后产Surfactin的峰面积为20 717.23 mAU, 比3号基础培养基增加了6 733.76 mAU, 即其相对含量增加48.2%;3号基础培养基产Iturin峰面积为944.93 mAU, 优化发酵工艺后产Iturin峰面积为2 653.903 mAU, 比3号基础培养基增加1 708.973 mAU, 即其相对含量提高了180.9%;3号基础培养基未检测到Fengycin, 优化发酵工艺后检测到了Fengycin, 但其峰面积较小, 仅为718.143 mAU。
| 脂肽类抗生素 Lipopeptide |
飞行离子质谱MALDI-TOF-MS | 高效液相色谱峰面积/mAU Peak area of HPLC | 增加比例/% Increasing rate |
|||
| 3号培养基 No.3 medium |
优化培养基 Optimized medium |
3号培养基 No.3 medium |
优化培养基 Optimized medium |
|||
| 表面活性素Surfactin | + | + | 13 983.47 | 20 717.230 | 48.2 | |
| 伊枯草菌素Iturin | + | + | 944.93 | 2 653.903 | 180.9 | |
| 泛革素Fengycin | - | + | - | 718.143 | - | |
| 注:“+”, 产生Production; “-”, 不产生Not production. | ||||||
抗菌物质是芽胞杆菌的重要生防机制之一, 脂肽类抗生素是芽胞杆菌的主要抗菌活性成分, 它不仅具有拮抗作用, 通过调控生物膜的形成而影响生防菌的定殖能力, 还可以作为激发子引起植物的诱导抗病性。因此, 提高芽胞杆菌脂肽类物质的产量对增强微生物农药制剂的防效具有重要意义。发酵是生防微生物制剂开发过程中的重要环节, Plackett-Burman试验方法和响应曲面分析法被广泛应用于微生物发酵工艺的筛选和优化。刘京兰等利用Plackett-Burman和中心组合试验法优化了解淀粉芽胞杆菌CC09菌株合成Iturin A的条件, 优化后, CC09合成IturinA的产量达501 mg·L-1, 较优化前的138 mg·L-1提高了4.2倍。Sen等采用响应曲面法分别对影响Surfactin产量的关键培养基组分、发酵条件以及种子液菌龄和接种量进行了优化研究。方传记等用Plackett-Burman试验设计对影响B.amyloliquefaciens ES-2-4脂肽类抗菌物质13个因子进行筛选, 并优化发酵培养基成分, 优化后, 脂肽类抗菌物质粗提物的产量高达6.76 g·L-1, 较优化前增加了39.7%。
本研究通过比较菌株T-500在不同培养基中摇瓶发酵产生脂肽类抗生素的抑菌差异, 筛选出对T-500菌株产脂肽类抗生素影响较大的培养基成分, 再通过Plackett-Burman设计和响应曲面试验, 优化了T-500摇瓶发酵的最佳培养基成分和发酵培养条件。与初始筛选T-500最佳培养基组成时表现最好的3号培养基相比, 优化发酵工艺后的T-500发酵产生的脂肽类抗生素对水稻纹枯病的抑菌带宽提高了20.4%, 发酵液菌含量提高了62.9%。质谱和色谱检测表明, 优化发酵工艺后产生的Surfactin含量较基础培养基提高了48.2%, Iturin含量较基础培养基提高了180.9%;优化发酵工艺后检测到了Fengycin的产生, 但优化前未发现Fengycin的产生。本研究结果显示, 影响枯草芽胞杆菌T-500产脂肽类物质的主要培养基成分是黄豆饼粉、蛋白胨和酵母粉, 这与张荣胜等报道的影响解淀粉芽胞杆菌Lx-11的主要培养基成分有共同之处。此外, 我们还发现, 虽然同为芽胞杆菌, 但每个菌株的最佳发酵条件完全不同, 差距较大。菌株T-500的发酵条件为:装液量为500 mL三角瓶装105 mL, 接种量0.87%, 发酵时间41.35 h, 温度28 ℃, 转速180 r·min-1; 而权春善等发现解淀粉芽胞杆菌Q-12最适培养温度为33 ℃, 培养基最适pH为6.0, 最适培养时间为40 h; 信珊珊等研究发现解淀粉芽胞杆菌WH1最佳发酵条件为溶氧在30%以上, 培养48 h。发酵条件差距较大是由于什么原因造成的, 是否有精准的分子调控机制, 有待进一步深入探讨。
本研究只是在摇瓶中对枯草芽胞杆菌T-500高效发酵产生脂肽类抗生素的培养基成分和培养条件进行了优化, 尚需进一步小试、中试完善发酵工艺, 以期为工业化生产发酵提供可靠的理论参数。
| [1] | Beneduzi A, Ambrosini A, Passaglia L M. Plant growth-promoting rhizobacteria(PGPR):their potential as antagonists and biocontrol agents[J]. Genetics and Molecular Biology, 2012, 35(4): 1044-1051. |
| [2] | Rainer B. Use of Plant-Associated Bacillus Strains as Biofertilizers and Biocontrol Agents in Agriculture[M]. Heidelberg: Springer, 2011. |
| [3] |
陈志谊, 许志刚, 高泰东, 等. 水稻纹枯病拮抗细菌的评价及利用[J].
中国水稻科学, 2000, 14(2): 98-102.
Chen Z Y, Xu Z G, Gao T D, et al. Evaluation and utilization of antagonistic bacteria against rice sheath blight[J]. Chinese Journal of Rice Science, 2000, 14(2): 98-102. (in Chinese with English abstract) |
| [4] |
陈志谊, 刘荣, 刘永锋. 水稻纹枯病拮抗细菌B-916的选育[J].
中国生物防治, 2003, 19(1): 15-18.
Chen Z Y, Liu R, Liu Y F. The screening of antagonistic bacteria strain B-916 against rice sheath blight[J]. Chinese Journal of Biological Control, 2003, 19(1): 15-18. (in Chinese with English abstract) |
| [5] | Luo C, Liu X, Zhou H, et al. Nonribosomal peptide synthase gene clusters for lipopeptide biosynthesis in Bacillus subtilis 916 and their phenotypic functions[J]. Applied and Environmental Microbiology, 2015, 81(1): 422-431. DOI: 10.1128/AEM.02921-14 |
| [6] | Chen X H, Koumoutsi A, Scholz R, et al. Comparative analysis of the complete genome sequence of the plant growth-promoting bacterium Bacillus amyloliquefaciens FZB42[J]. Nature Biotechnology, 2007, 25(9): 1007-1014. DOI: 10.1038/nbt1325 |
| [7] | Luo C, Zhou H, Zou J, et al. Bacillomycin L and surfactin contribute synergistically to the phenotypic features of Bacillus subtilis 916 and the biocontrol of rice sheath blight induced by Rhizoctonia solani[J]. Applied Microbiology and Biotechnology, 2015, 99: 1897-1910. DOI: 10.1007/s00253-014-6195-4 |
| [8] |
张荣胜, 梁雪杰, 刘永锋, 等. 解淀粉芽胞杆菌Lx-11生物发酵工艺优化[J].
中国生物防治学报, 2013, 29(2): 254-262.
Zhang R S, Liang X J, Liu Y F, et al. Optimization of fermentation process of Bacillus amyloliquefaciens Lx-11[J]. Chinese Journal of Biological Control, 2013, 29(2): 254-262. (in Chinese with English abstract) |
| [9] |
王美英, 王芳, 韩金志, 等. Paenibacillus polymyxa JSa-9发酵培养基优化及其在黄瓜枯萎病中的应用研究[J].
南京农业大学学报, 2016, 39(4): 673-680.
Wang M Y, Wang F, Han J Z, et al. Optimization fermentation medium and application in cucumber fusarium wilt of Paenibacillus polymyxa JSa-9[J]. Journal of Nanjing Agricultural University, 2016, 39(4): 673-680. DOI: 10.7685/jnau.201512010 (in Chinese with English abstract) |
| [10] |
刘永锋, 陈志谊, 于俊杰, 等. 一株枯草芽胞杆菌及其应用: CN201210328716. 5[P]. 2013-11-06.
Liu Y F, Chen Z Y, Yu J J, et al. The application of a Bacillus subtilis strain: CN201210328716. 5[P]. 2013-11-06(in Chinese). |
| [11] |
刘永锋, 孟祥坤, 尹小乐, 等. 一种枯草芽胞杆菌的干悬浮剂及其制备方法: CN201310301606. 4[P]. 2014-12-24.
Liu Y F, Meng X K, Yin X L, et al. The preparation method of a Bacillus subtilis dry suspension concentration: CN201310301606. 4[P]. 2014-12-24(in Chinese). |
| [12] |
向亚萍, 周华飞, 刘永锋, 等. 解淀粉芽胞杆菌B1619脂肽类抗生素的分离鉴定及其对番茄枯萎病菌的抑制作用[J].
中国农业科学, 2016, 49(15): 2935-2944.
Xiang Y P, Zhou H F, Liu Y F, et al. Isolation and identification of lipopeptide antibiotics produced by Bacillus amyloliquefaciens B1619 and the inhibition of the lipopeptide antibiotics to Fusarium oxysporum f.sp.lycopersici[J]. Scientia Agricultura Sinica, 2016, 49(15): 2935-2944. DOI: 10.3864/j.issn.0578-1752.2016.15.008 (in Chinese with English abstract) |
| [13] | Ongena M, Jacques P. Bacillus lipopeptides:versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2008, 16(3): 115-125. DOI: 10.1016/j.tim.2007.12.009 |
| [14] | Ongena M, Jourdan E, Adam A, et al. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants[J]. Environmental Microbiology, 2007, 9(4): 1084-1090. DOI: 10.1111/emi.2007.9.issue-4 |
| [15] |
代志凯, 张翠, 阮征. 试验设计和优化及其在发酵培养基优化中的应用[J].
微生物学通报, 2010, 37(6): 894-903.
Dai Z K, Zhang C, Ruan Z. The application of experimental design and optimization techniques in optimization of microbial medium[J]. Microbiology China, 2010, 37(6): 894-903. (in Chinese with English abstract) |
| [16] |
郝学财, 余晓斌, 刘志钰, 等. 响应面方法在优化微生物培养基中的应用[J].
食品研究与开发, 2006, 27(1): 38-41.
Hao X C, Yu X B, Liu Z Y, et al. The application of response surface methodology in optimization of microbial media[J]. Food Research and Development, 2006, 27(1): 38-41. (in Chinese with English abstract) |
| [17] |
刘京兰, 蔡勋超, 薛雅蓉, 等. 生防解淀粉芽胞杆菌CC09菌株合成Iturin A条件的响应面优化[J].
中国生物防治学报, 2016, 32(2): 235-243.
Liu J L, Cai X C, Xue Y R, et al. Optimization of Iturin A synthesis by Bacillus amyloliquefaciens CC09 using response surface technique[J]. Chinese Journal of Biological Control, 2016, 32(2): 235-243. (in Chinese with English abstract) |
| [18] | Sen R, Swaminathan T. Response surface modeling and optimization to elucidate and analyze the effects of inoculum age and size on surfactin production[J]. Biochemical Engineering Journal, 2004, 21: 141-148. DOI: 10.1016/j.bej.2004.06.006 |
| [19] |
方传记, 陆兆新, 孙力军, 等. 淀粉液化芽胞杆菌抗菌脂肽发酵培养基及发酵条件优化[J].
中国农业科学, 2008, 41(2): 533-539.
Fang Z J, Lu Z X, Sun L J, et al. Optimization of fermentation technology for lipopeptides producing bacteria Bacillus amyloliquefaciens ES-2-4[J]. Scientia Agricultura Sinica, 2008, 41(2): 533-539. (in Chinese with English abstract) |
| [20] |
权春善, 王军华, 徐洪涛, 等. 一株抗真菌解淀粉芽胞杆菌的分离鉴定及其发酵条件的初步研究[J].
微生物学报, 2006, 46(1): 7-12.
Quan C S, Wang J H, Xu H T, et al. Identification and characterization of a Bacillus amyloliquefaciens with high antifungal activity[J]. Acta Microbiologica Sinica, 2006, 46(1): 7-12. (in Chinese with English abstract) |
| [21] |
信珊珊, 祁高富, 朱发银, 等. 一株解淀粉芽胞杆菌发酵条件的优化及其对油茶炭疽病的防效[J].
华中农业大学学报, 2011, 30(4): 411-415.
Xin S S, Qi G F, Zhu F Y, et al. Optimization of fermentation condition for Bacillus amyloliquefaciens WH1 and its biological control effect on Colletotrichum gloeosporioides[J]. Journal of Huazhong Agricultural University, 2011, 30(4): 411-415. (in Chinese with English abstract) |




