文章信息
- 杨信程, 苏江硕, 吴洋洋, 张飞, 管志勇, 陈发棣, 房伟民
- YANG Xincheng, SU Jiangshuo, WU Yangyang, ZHANG Fei, GUAN Zhiyong, CHEN Fadi, FANG Weimin
- 切花小菊主要分枝性状的混合遗传分析
- Mixed inheritance analysis of branching traits in spray cut chrysanthemum
- 南京农业大学学报, 2018, 41(3): 440-446
- Journal of Nanjing Agricultural University, 2018, 41(3): 440-446.
- http://dx.doi.org/10.7685/jnau.201705040
-
文章历史
- 收稿日期: 2017-05-23
菊花(Chrysanthemum morifolium Ramat)是我国传统名花和世界四大切花之一, 观赏价值和经济价值较高。分枝是菊花重要园艺性状之一, 不同切花菊品种的侧芽数、分枝数、分枝高度、分枝长度和分枝角度等分枝性状变异较大, 分枝性状直接影响其栽培方式、生产成本和观赏品质。目前, 在菊花分枝发育的生理机制与基因工程调控研究方面已取得了一些进展[1-5], 但鲜见关于菊花分枝性状遗传机制方面的报道。近年来, 菊花一级分枝性状的主基因模型和QTL效应已有初步研究[6-7], 但菊花分枝性状的遗传机制仍不十分明确。
本研究连续2年调查了切花小菊'南农雪峰'×'Monalisa'F1分离群体的总侧芽数、中上部一级分枝数、一级分枝长度、一级分枝角度、二级分枝总数、二级分枝长度、二级分枝角度等分枝性状的遗传变异, 利用盖钧镒等[8]提出的主基因+多基因混合遗传模型中单个F2世代的分离分析方法研究了切花小菊分枝性状的主基因效应; 并结合前期研究比较了切花小菊分枝性状在不同遗传背景下的遗传效应, 以期进一步解析切花小菊分枝性状的遗传机制, 为切花菊株型育种提供参考依据。
1 材料与方法 1.1 试验材料与杂交试验试验材料为切花小菊品种'南农雪峰'和'Monalisa', 保存于南京农业大学中国菊花种质资源保存中心。2014年秋以'南农雪峰'为母本(P1), 'Monalisa'为父本(P2)进行人工套袋杂交, 2015年春天进行穴盘播种, 最后获得了162个株系的F1代分离群体。2015年和2016年8月, 将杂交亲本及其162个F1代进行扦插, 采用完全随机区组设计定植于大田。共设置2个区组, 每个区组中设置单株重复1次, 株间距20 cm, 常规大田管理。所有试验均在南京市江宁区湖熟现代农业示范园的南京农业大学花卉基地进行。
1.2 性状调查分别于2015年和2016年秋季菊花盛花期, 调查杂交亲本及F1代分离群体的总侧芽数、中上部一级分枝数、一级分枝长度、一级分枝角度、二级分枝总数、二级分枝长度、二级分枝角度共7个分枝性状。其中, 总侧芽数为地上部分主干上所有着生芽或已萌发成枝的节点数; 中上部一级分枝数为顶部第2枝开始向下直至出现分枝长度明显缩短位置的一级分枝数; 一级分枝长度为中上部一级分枝全部长度的平均数; 一级分枝角度为任意3个中上部一级分枝角度的平均数; 二级分枝总数为中上部一级分枝上所有萌发并具有明显长度的二级分枝数; 二级分枝长度为任意3个生长良好的二级分枝长度的平均值; 二级分枝角度为任意3个生长良好的二级分枝角度的平均值。
1.3 杂种优势杂种优势以中亲优势(Hm)和中亲优势率(RHm)表示[9]。Hm=Fm-MPV, 其中:Hm为中亲优势; Fm为分离群体平均数; MPV为中亲值。中亲优势率(RHm)=(Hm/MPV)×100%。
1.4 主基因+多基因混合遗传分析计算各株系2年性状平均值, 以此为基础采用植物数量性状主基因+多基因混合遗传分析中单个F2世代的分离分析方法[8], 对A、B两类共11个遗传模型计算极大似然函数值, 进一步转换为AIC(Akaike ' s information criterion)值。选出最小或接近最小AIC值的候选遗传模型, 进行样本分布与模型理论分布的适合性检验, 包括均匀性检验(U12、U22、U32)、Smirnov检验和Kolmogorov检验。根据适合性检验的结果及AIC值最小原则选出最优遗传模型[10]。再采用最小二乘法估算遗传方差、主基因效应值、遗传率等遗传参数[8]。通过混合遗传分析R软件包SEA进行计算[11]。
2 结果与分析 2.1 杂交F1代分枝性状的表型分布与杂种优势表现由图 1可以看出:各分枝性状均呈连续线性变异, 符合数量性状的典型分布特征。7个分枝性状的变异系数为12.89%~61.55%, 表型变异范围较大, 适宜进一步开展分枝性状的遗传分析研究。
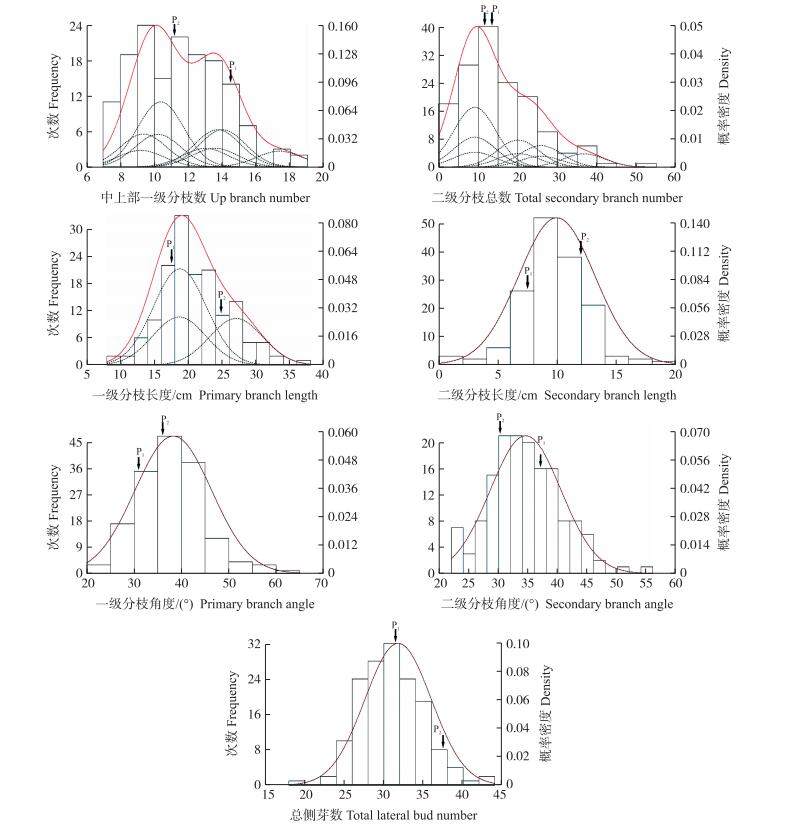
|
图 1 切花小菊'南农雪峰'(P1)×'Monalisa'(P2)杂交F1代群体7个分枝性状的次数分布 Figure 1 Frequency distributions for the seven branch-related traits in F1 population between'Nannongxuefeng'(P1) and'Monalisa'(P2)in spray cut chrysanthemum |
由表 1可以看出:总侧芽数、中上部一级分枝数、一级分枝角度和二级分枝总数的中亲优势较为明显, 中亲优势率分别为-9.69%、-9.10%、12.99%和25.51%。总侧芽数、中上部一级分枝数、一级分枝长度和二级分枝长度的中亲优势为负值, 说明这4个分枝性状的遗传基础中存在显性遗传效应。另外, F1代群体7个性状中均存在正向或负向超亲分离个体, 说明F1代分枝性状的超亲分离现象普遍存在。该F1代各分枝性状的平均值仍介于双亲之间, 并未形成超亲优势。
| 性状 Trait |
P1 | P2 | 中亲值 MPV |
F1分离群体F1 segregating population | ||||||
| 最小值 Minimum |
最大值 Maximum |
平均值 Mean |
标准差 SD |
变异系数/% CV |
中亲优势 Hm |
中亲优势率/% RHm |
||||
| 总侧芽数Total lateral bud number | 31.75 | 37.50 | 34.63 | 18.0 | 43.0 | 31.27 | 4.03 | 12.89 | -3.35 | -9.69 |
| 中上部一级分枝数Up branch number | 14.50 | 11.25 | 12.88 | 7.0 | 18.5 | 11.70 | 2.54 | 21.66 | -1.17 | -9.10 |
| 一级分枝长度Primary branch length | 17.53 | 24.81 | 21.17 | 8.9 | 37.4 | 21.02 | 5.06 | 24.05 | -0.15 | -0.70 |
| 一级分枝角度Primary branch angle | 30.83 | 36.25 | 33.54 | 22.3 | 60.7 | 37.90 | 6.89 | 18.19 | 4.36 | 12.99 |
| 二级分枝总数Total secondary branch number | 12.75 | 12.25 | 12.50 | 1.0 | 54.0 | 15.69 | 9.66 | 61.55 | 3.19 | 25.51 |
| 二级分枝长度Secondary branch length | 7.65 | 11.95 | 9.80 | 1.2 | 18.4 | 9.70 | 2.77 | 28.61 | -0.10 | -1.05 |
| 二级分枝角度Secondary branch angle | 36.92 | 30.33 | 33.63 | 22.3 | 55.8 | 34.68 | 5.88 | 16.95 | 1.05 | 3.13 |
| Note: MPV:Mid-parent value; Hm:Mid-parent heterosis; RHm:Ratio of mid-parent heterosis. | ||||||||||
根据由模型极大似然值计算的AIC值(表 2), 选出可能的候选模型(AIC值最小或接近), 对候选模型进行适合性检验, 选择出检验结果未达显著水平且AIC值最小的模型。以二级分枝总数为例, AIC值中最小的模型有1MG-AD模型(1 117.53)和2MG-AD模型(1 117.20)。利用U12、U22、U32、Smirnov、Kolmogorov测验对这2个备选模型进行适合性检验, 结果发现这2个模型的5个统计数均未达到显著水平。因此, 最后根据最小AIC值的原则选择2MG-AD模型作为最适模型。各分枝性状的最适模型及其测验结果见表 2和表 3。其中, 总侧芽数、二级分枝长度、一级分枝角度和二级分枝角度符合0MG遗传模型, 无主基因控制, 属于微效多基因控制性状, 受环境影响较大; 中上部一级分枝数和二级分枝总数符合2MG-AD模型, 由2对表现为加-显遗传效应的主基因控制; 一级分枝长度符合1MG-AD模型, 由1对主基因表现为加性、部分显性或超显性的主基因控制。
| 模型 Model |
总侧芽数 Total lateralbud number |
中上部一级分枝数 Up branchnumber |
一级分枝长度 Primarybranch length |
一级分枝角度 Primarybranch angle |
二级分枝总数 Total secondarybranch number |
二级分枝长度 Secondarybranch ength |
二级分枝角度 Secondarybranch angle |
| 0MG | 874.98 | 726.54 | 939.09 | 1 074.89 | 1 131.09 | 753.38 | 979.27 |
| 1MG-AD | 878.06 | 726.48 | 937.90 | 1 076.44 | 1 117.54 | 757.07 | 980.94 |
| 1MG-A | 876.09 | 728.52 | 941.10 | 1 076.90 | 1 133.10 | 755.39 | 981.28 |
| 1MG-EAD | 878.99 | 730.54 | 943.09 | 1 078.89 | 1 135.09 | 757.07 | 983.27 |
| 1MG-NCD | 878.98 | 730.54 | 943.09 | 1 078.89 | 1 135.09 | 757.07 | 983.27 |
| 2MG-ADI | 889.60 | 730.07 | 946.67 | 1 077.21 | 1 121.16 | 757.44 | 992.09 |
| 2MG-AD | 882.06 | 722.84 | 941.90 | 1 079.68 | 1 117.20 | 761.07 | 984.44 |
| 2MG-A | 879.00 | 727.91 | 943.10 | 1 078.91 | 1 135.10 | 757.39 | 983.28 |
| 2MG-EA | 876.98 | 728.53 | 941.09 | 1 076.89 | 1 133.10 | 755.39 | 981.27 |
| 2MG-CD | 878.98 | 730.54 | 943.10 | 1 078.89 | 1 135.09 | 757.04 | 983.27 |
| 2MG-EAD | 876.98 | 728.54 | 941.10 | 1 076.89 | 1 133.09 | 755.04 | 981.27 |
| 注:加粗数字为最小AIC值。The number bolded indicates the smallest AIC value. | |||||||
| 性状Trait | 模型Model | U12 | U22 | U32 | nW2 | Dn |
| 总侧芽数 Total lateral bud number |
0MG | 0.070 7(0.790 3) | 0.082 9(0.773 4) | 0.014 8(0.903 0) | 0.068 4(0.767 3) | 0.064 3(0.522 6) |
| 中上部一级分枝数 Up branch number |
2MG-AD | 0.000 0(0.994 9) | 0.001 5(0.969 0) | 0.017 1(0.895 9) | 0.069 8(0.759 4) | 0.059 8(0.618 2) |
| 一级分枝长度 Primary branch length |
1MG-AD | 0.001 1(0.973 1) | 0.010 8(0.917 1) | 0.299 0(0.584 5) | 0.047 1(0.894 0) | 0.051 2(0.795 7) |
| 一级分枝角度 Primary branch angle |
0MG | 0.152 6(0.696 0) | 0.305 0(0.580 8) | 0.484 5(0.486 3) | 0.053 9(0.853 2) | 0.055 2(0.693 9) |
| 二级分枝总数 Total secondary branch number |
2MG-AD | 0.011 4(0.915 1) | 0.088 8(0.765 7) | 0.606 6(0.436 1) | 0.059 7(0.818 4) | 0.051 7(0.787 5) |
| 二级分枝长度 Secondary branch length |
0MG | 0.038 5(0.844 4) | 0.060 3(0.806 1) | 3.034 4(0.081 5) | 0.160 6(0.360 0) | 0.073 7(0.355 9) |
| 二级分枝角度 Secondary branch angle |
0MG | 0.138 7(0.709 5) | 0.174 1(0.676 5) | 0.051 2(0.821 0) | 0.060 3(0.814 5) | 0.049 4(0.830 6) |
| 注:U12、U22、U32、nW2、Dn为5个适合性检验的统计量, 括号内为对应的概率值。 Note: The U12, U22, U32, nW2 and Dn are statistic values for fitness test, and the values in bracket mean probability. | ||||||
在已选出最佳模型的条件下, 采用最小二乘法, 可以由成分分布参数估计主基因的遗传参数。由表 4可知:控制中上部一级分枝数的2对主基因的加性效应分别为1.94和2.14, 显性效应分别为-1.77和-1.34, 主基因遗传率为74%。控制一级分枝长度对主基因的加性效应值为3.98, 显性效应值为-3.89, 主基因遗传率为46%。控制二级分枝总数的2对主基因的加性效应分别为7.50和6.51, 显性效应分别为-10.50和-4.01, 主基因遗传率为72%。
| 遗传参数 Genetic parameters |
中上部一级分枝数 Up branch number |
一级分枝长度 Primary branch length |
二级分枝总数 Total secondary branch number |
| m | 12.92 | 23.01 | 22.70 |
| da(d) | 1.94 | 3.98 | 7.50 |
| db | 2.14 | — | 6.51 |
| ha(h) | -1.77 | -3.89 | -10.50 |
| hb | -1.34 | — | -4.01 |
| σp2 | 6.43 | 25.56 | 93.32 |
| σmg2 | 4.75 | 11.70 | 66.79 |
| hmg2/% | 74 | 46 | 72 |
| 注: m:纯合子中值; d:主基因加性效应; h:主基因显性效应; da:第1对主基因加性效应; db:第2对主基因加性效应; ha:第1对主基因显性效应; hb:第2对主基因显性效应; σp2:表型方差; σmg2:主基因方差; hmg2:主基因遗传率。Note: m:Mean value of two homozygotes; d:Major-gene additive effect; h:Major-gene dominant effect; da:The first couple of major-gene additive effect; db:The second major-gene additive effect; ha:The first couple of major-gene dominant effect; hb:The second major-gene dominant effect; σp2:Phenotypic variance; σmg2:Major-gene variance; hmg2:Major-gene heritability. | |||
分枝是植物生长中普遍存在的现象, 在植物形态建成中占有十分重要的地位, 与许多作物的株型、栽培方式、产量和品质关系密切[12-13]。尽管植物分枝受植物激素、环境因素的调控, 但植物本身的遗传特性是决定分枝的主要因子[14]。目前, 普遍认为植物分枝是一个由多基因控制的数量性状, 因此关于植物分枝的遗传解析主要集中在数量遗传学水平[15-18]。本试验研究了切花小菊一、二级分枝性状的杂种优势和主基因效应, 重点结合前期研究比较了切花小菊分枝性状在不同遗传背景下的遗传差异。
杂种优势利用是菊花遗传育种的重要方面[19]。与纯系作物的杂种优势不同, 菊花无法通过自交获得纯系亲本[20], 且基因组高度杂合, 使得其在两两配合的过程中并不始终朝着有利显性基因增加的方向。因此, 菊花许多性状表现出了负向的杂种优势[21-24]。本研究发现, 切花小菊7个分枝性状普遍存在一定程度的中亲优势和超亲分离个体。其中, 总侧芽数、中上部一级分枝数、一级分枝长度和二级分枝长度的中亲优势为负值, 总侧芽数、中上部一级分枝数、一级分枝角度和二级分枝总数的中亲优势率较大, 分别为-9.69%、-9.10%、12.99%和25.51%。与彭辉等[6]的研究结果不同的是, 在本试验中一级分枝角度并未表现出负向的杂种优势。因此, 在菊花遗传育种中, 应该结合具体的育种群体, 充分发挥杂种优势的作用。
主基因+多基因混合遗传模型是植物数量遗传研究的重要方法之一, 已广泛用于油菜[25]、大豆[26]、花生[27]等作物分枝性状的遗传分析。本研究利用主基因+多基因混合分析中F2代的分离分析方法对切花小菊7个一、二级分枝性状的遗传研究发现, 总侧芽数、二级分枝长度和一、二级分枝角度属于多基因性状, 无主基因, 中上部一级分枝数和二级分枝总数由2对表现为加-显遗传效应的主基因控制, 一级分枝长度由1对表现为负向部分或完全显性的主基因控制。其中, 分枝角度和分枝数等相同类型性状的遗传机制较为相似, 这与汪文祥等[25]的研究结果相同。然而, 这并不适用于所有情况, 如一、二级分枝长度的主基因效应差异较大。在主基因遗传率方面, 一级分枝长度的主基因遗传率为46%, 属于中等遗传率, 受环境影响较大, 早期可适当降低选择标准; 中上部一级分枝数和二级分枝总数的主基因遗传率为74%和72%, 属于高度遗传率, 受环境影响小, 在早期即可适当提高选择标准[28]。需要指出的是, 在总侧芽数和一级分枝角度等性状上没有检测到主基因效应, 但是其在F1代表现出较高的中亲优势。这在一定程度上说明杂种优势的表现与主基因的有无关系不大, 而主要来源于亲本间的异质性[21]。
植物数量性状的主基因遗传效应在不同遗传背景下差异较大[29-30]。彭辉等[6]利用主基因+多基因混合遗传模型研究切花小菊'Qx-145'×'南农银山'F1分离群体的分枝高度、一级分枝数、一级分枝长度和分枝角度等分枝性的主基因效应, 发现切花小菊分枝角度和分枝长度符合0MG模型, 无主基因控制; 而一级分枝数符合1MG-NCD模型, 受1对表现为负向完全显性的主基因控制, 这与本研究结果存在较大差异, 也说明切花小菊分枝性状的主基因效应在不同遗传背景中有差异。
| [1] |
姜贝贝. 菊花侧芽形成过程中内源激素变化及DgLsL基因遗传转化研究[D]. 南京: 南京农业大学, 2009.
Jiang B B. Changes of endogenous hormone during lateral buds formation of chrysanthemum and genetic transformation of DgLSL[D]. Nanjing: Nanjing Agricultural University, 2009(in Chinese with English abstract). |
| [2] | Huh Y J, Lim J H, Park S K, et al. Endogenous indole-3-acetic acid and trans-zeatin ribosides in relation to axillary bud formation in standard chrysanthemum[J]. Horticulture Environment Biotechnology, 2007, 52: 128-132. |
| [3] | Jiang B B, Miao H B, Chen S M, et al. The Lateral Suppressor-like gene, DgLsL, alternated the axillary branching in transgenic chrysanthemum(Chrysanthemum×morifolium)by modulating IAA and GA content[J]. Plant Molecular Biology Reporter, 2010, 28(1): 144-151. DOI: 10.1007/s11105-009-0130-3 |
| [4] |
于静, 董丽丽, 郗琳, 等. 切花菊'神马'细胞分裂素合成酶基因DgIPT3参与侧枝发育的功能分析[J].
园艺学报, 2012, 39(4): 721-728.
Yu J, Dong L L, Xi L, et al. Isolation and characterization of cytokinin synthase gene DgIPT3 in Chrysanthemum 'Jinba'[J]. Acta Horticulturae Sinica, 2012, 39(4): 721-728. (in Chinese with English abstract) |
| [5] | Liang J, Zhao L, Challis R, et al. Strigolactone regulation of shoot branching in chrysanthemum(Dendranthema grandiflorum)[J]. Journal of Experimental Botany, 2010, 61(11): 3069-3078. DOI: 10.1093/jxb/erq133 |
| [6] |
彭辉, 陈发棣, 房伟民, 等. 切花小菊分枝性状杂种优势表现与遗传分析[J].
园艺学报, 2013, 40(7): 1327-1336.
Peng H, Chen F D, Fang W M, et al. Heterosis and mixed genetic analysis of branch traits of cut chrysanthemum[J]. Acta Horticulturae Sinica, 2013, 40(7): 1327-1336. (in Chinese with English abstract) |
| [7] | Peng H, Zhang F, Jiang J, et al. Identification of quantitative trait loci for branching traits of spray cut chrysanthemum[J]. Euphytica, 2015, 202(3): 385-392. DOI: 10.1007/s10681-014-1259-1 |
| [8] |
盖钧镒, 章元明, 王建康.
植物数量性状遗传体系[M]. 北京: 科学出版社, 2003.
Gai J Y, Zhang Y M, Wang J K. Genetic System of Quantitative Traits in Plant[M]. Beijing: Science Press, 2003. (in Chinese with English abstract) |
| [9] | Li B L, Wu R L. Heterosis and genotype×environment interactions of juvenile aspens in two contrasting sites[J]. Canadian Journal of Forest Research, 1997, 73(10): 3671-3675. |
| [10] | Cai C C, Tu J X, Fu T D, et al. The genetic basis of flowering time and photoperiod sensitivity in rapeseed Brassica napus L.[J]. Plant Genetics, 2008, 44(3): 326-333. |
| [11] |
曹锡文, 刘兵, 章元明. 植物数量性状分离分析Windows软件包SEA的研制[J].
南京农业大学学报, 2013, 36(6): 1-6.
Cao X W, Liu B, Zhang Y M. SEA:a software package of segregation analysis of quantitative traits in plants[J]. Journal of Nanjing Agricultural University, 2013, 36(6): 1-6. DOI: 10.7685/j.issn.1000-2030.2013.06.001 (in Chinese with English abstract) |
| [12] | Miura K, Ikeda M, Masubara A, et al. OsSPL14 promotes panicle branching and higher grain productivity in rice[J]. Nature Genetics, 2010, 42(6): 545-592. DOI: 10.1038/ng.592 |
| [13] | Bachlava E, Tang S, Pizarro G, et al. Pleiotropy of the branching locus(B)masks linked and unlinked quantitative trait loci affecting seed traits in sunflower[J]. Theoretical and Applied Genetics, 2010, 120(4): 829-842. DOI: 10.1007/s00122-009-1212-1 |
| [14] | Doust A N. Grass architecture:genetic and environmental control of branching[J]. Current Opinion in Plant Biology, 2007, 10(1): 21-25. DOI: 10.1016/j.pbi.2006.11.015 |
| [15] |
丰光, 李妍妍, 景希强, 等. 玉米雄穗分枝性状的数量遗传分析[J].
沈阳农业大学学报, 2011, 42(1): 94-97.
Feng G, Li Y Y, Jing X Q, et al. Quantitative genetic analysis of tassel branch number traits in maize(Zea mays L.)[J]. Journal of Shenyang Agricultural University, 2011, 42(1): 94-97. (in Chinese with English abstract) |
| [16] |
赵卫国, 王灏, 田建华, 等. 甘蓝型油菜DH群体若干数量性状的遗传分析[J].
中国农学通报, 2014, 30(15): 86-91.
Zhao W G, Wang H, Tian J H, et al. Genetic analysis of quantitative traits with doubled haploid in Brassica napus L.[J]. Chinese Agricultural Science Bulletin, 2014, 30(15): 86-91. DOI: 10.11924/j.issn.1000-6850.2013-2334 (in Chinese with English abstract) |
| [17] | Isemura T, Kaga A, Tabata S, et al. Construction of a genetic linkage map and genetic analysis of domestication related traits in mungbean(Vigna radiata)[J]. PLoS One, 2012, 7(8): e41304. DOI: 10.1371/journal.pone.0041304 |
| [18] | Sadok I B, Moutier N, Garcia G, et al. Genetic determinism of the vegetative and reproductive traits in an F1 olive tree progeny[J]. Tree Genetics and Genome, 2013, 9(1): 205-221. DOI: 10.1007/s11295-012-0548-x |
| [19] |
陈发棣, 蒋甲福, 郭维明. 小菊花器若干性状在F1代的表现[J].
园艺学报, 2003, 30(2): 175-182.
Chen F D, Jiang J F, Guo W M. Heredity of several flower characters in Dendranthema grandiflora with small inflorescences[J]. Acta Horticulturae Sinica, 2003, 30(2): 175-182. (in Chinese with English abstract) |
| [20] |
谭素娥, 费江松, 房伟民, 等. 22份菊属植物自交特性及后代性状分析[J].
南京农业大学学报, 2017, 40(3): 400-407.
Tan S E, Fei J S, Fang W M, et al. Investigation on self-compatibility of 22 materials in genus chrysanthemum and selfing progeny characteristics[J]. Journal of Nanjing Agricultural University, 2017, 40(3): 400-407. DOI: 10.7685/jnau.201606033 (in Chinese with English abstract) |
| [21] |
蒋甲福, 陈发棣, 郭维明. 小菊杂种一代部分性状的遗传与变异[J].
南京农业大学学报, 2003, 26(2): 11-15.
Jiang J F, Chen F D, Guo W M. Heredity of several characters in Dendranthema grandiflora with small inflorescences[J]. Journal of Nanjing Agricultural University, 2003, 26(2): 11-15. DOI: 10.7685/j.issn.1000-2030.2003.02.003 (in Chinese with English abstract) |
| [22] |
张飞, 陈发棣, 房伟民, 等. 菊花花器性状杂种优势与混合遗传分析[J].
中国农业科学, 2010, 43(14): 2953-2961.
Zhang F, Chen F D, Fang W M, et al. Heterosis and mixed genetic analysis of inflorescence traits of chrysanthemum[J]. Scientia Agricultura Sinica, 2010, 43(14): 2953-2961. DOI: 10.3864/j.issn.0578-1752.2010.14.014 (in Chinese with English abstract) |
| [23] |
张飞, 陈发棣, 房伟民, 等. 菊花管状花数量和花心直径的QTL分析[J].
中国农业科学, 2011, 44(7): 1443-1450.
Zhang F, Chen F D, Fang W M, et al. QTL analysis for tubular floret number and flower center diameter of chrysanthemum[J]. Scientia Agricultura Sinica, 2011, 44(7): 1443-1450. (in Chinese with English abstract) |
| [24] |
张飞, 陈发棣, 房伟民, 等. 菊花花期性状的杂种优势与混合遗传分析[J].
南京农业大学学报, 2011, 34(4): 31-36.
Zhang F, Chen F D, Fang W M, et al. Heterosis and mixed genetic analysis for florescence-related traits of chrysanthemum[J]. Journal of Nanjing Agricultural University, 2011, 34(4): 31-36. DOI: 10.7685/j.issn.1000-2030.2011.04.006 (in Chinese with English abstract) |
| [25] |
汪文祥, 胡琼, 梅德圣, 等. 甘蓝型油菜分枝角度主基因+多基因混合遗传模型及遗传效应[J].
作物学报, 2016, 42(8): 1103-1111.
Wang W X, Hu Q, Mei D S, et al. Genetic effects of branch angle using mixture model of major gene plus polygene in Brassica napus L.[J]. Acta Agronomica Sinica, 2016, 42(8): 1103-1111. (in Chinese with English abstract) |
| [26] |
蔡立楠. 大豆主要农艺性状和品质性状的主基因+多基因混合遗传分析[D]. 长春: 吉林农业大学, 2012.
Cai L N. Studies on the major gene plus polygene inheritance of principal agronomy traits and quality traits in soybean[D]. Changchun: Jilin Agricultural University, 2012(in Chinese with English abstract). |
| [27] |
江建华, 王嵩, 汪清, 等. 花生4个主要农艺性状的遗传分析[J].
花生学报, 2015, 44(3): 7-13.
Jiang J H, Wang S, Wang Q, et al. Genetic analysis of 4 main agronomic traits in peanut(Arachis hypogaea L.)[J]. Journal of Peanut Science, 2015, 44(3): 7-13. (in Chinese with English abstract) |
| [28] |
顾万春.
统计遗传学[M]. 北京: 科学出版社, 2004.
Gu W C. Statistical Genetics[M]. Beijing: Science Press, 2004. (in Chinese with English abstract) |
| [29] |
郭海林, 高雅丹, 薛丹丹, 等. 结缕草属植物抗寒性的遗传分析[J].
草业学报, 2009, 18(3): 53-58.
Guo H L, Gao Y D, Xue D D, et al. Genetic analysis of cold tolerance of zaysia grass[J]. Acta Prataculturae Sinica, 2009, 18(3): 53-58. DOI: 10.11686/cyxb20090308 (in Chinese with English abstract) |
| [30] |
狄佳春, 陈旭升, 赵亮, 等. 利用主基因+多基因混合遗传分析解析陆地棉铃重与铃壳率杂种优势的遗传基础[J].
棉花学报, 2016, 28(2): 115-121.
Di J C, Chen X S, Zhao L, et al. Genetic foundation of heterosis for boll weight and shell ratio in upland cotton(Gossypium hirsutum L.)using mixed major-genes plus polygenes inheritance analysis[J]. Cotton Science, 2016, 28(2): 115-121. DOI: 10.11963/issn.1002-7807.201602003 (in Chinese with English abstract) |




