文章信息
- 吴虎虎, 彭麟, 季辉, 刘晓晓, 滕佩, 江善祥
- WU Huhu, PENG Lin, JI Hui, LIU Xiaoxiao, TENG Pei, JIANG Shanxiang
- 鸡饲料中氢溴酸常山酮含量的反相HPLC检测方法的建立
- Development of RP-HPLC method for determination of halofuginone hydrobromide in chicken feeds
- 南京农业大学学报, 2018, 41(2): 377-381
- Journal of Nanjing Agricultural University, 2018, 41(2): 377-381.
- http://dx.doi.org/10.7685/jnau.201701038
-
文章历史
- 收稿日期: 2017-01-20
球虫病是鸡的重要疾病之一, 对鸡球虫病的防控措施主要从饲养环境管理、疫苗免疫、药物预防或治疗等几个方面来进行。所用药物主要有聚醚类离子载体抗生素、人工合成抗球虫药、中草药等[1-4]。
氢溴酸常山酮(halofuginone hydrobromide)属于人工合成的一种广谱抗球虫药, 是从植物中纯化出来的喹唑啉酮类生物碱——常山(dichroa fabrifuga)的卤代衍生物。常山酮分为两种, 分别是氢溴酸盐和乳酸盐。氢溴酸常山酮按推荐剂量3 mg·kg-1添加在饲料中, 用于预防和治疗鸡球虫病, 主要机制是对球虫子孢子、第一代及第二代裂殖体具有明显的抑杀作用, 防止破坏鸡肠上皮细胞, 具有预防球虫病及提高饲料利用率作用。由于氢溴酸常山酮安全范围比较窄, 饲料添加的有效浓度为3 mg·kg-1, 而高于4.5 mg·kg-1则抑制生长, 高于6 mg·kg-1则显著降低饲料转化率, 如果拌料不均匀, 不但疗效不佳, 还导致鸡只出现中毒症状。因此必须加强对饲料中氢溴酸常山酮药物浓度的检测。目前, 国内外报道的氢溴酸常山酮的检测方法有气-液相色谱法[5]、毛细血管电泳法(CE)[6]、高效液相色谱法(HPLC)[7-9]、放射性同位素标记法[10]和高效液相色谱-质谱联用检测法(HPLC-MS)[11]。我国尚未报道鸡饲料中氢溴酸常山酮的检测方法, 因此, 有必要建立一种高效、准确、简单的检测方法, 以便监测饲料中药物的浓度。
1 材料与方法 1.1 试验材料 1.1.1 试验药品与试剂氢溴酸常山酮标准品(质量分数99.28%), 购于南京天海医药科技有限公司; 冰乙酸、乙酸铵、乙酸乙酯等均为分析纯; 乙腈、甲醇为色谱纯。
1.1.2 试验仪器与设备Ultimate 3000高效液相色谱仪系统(Thermo公司); 3K-15低温高速离心机(美国Sigma公司); FE-20K pH计(梅特勒-托利多仪器有限公司); DC-12 H型氮吹仪(上海安普科学仪器有限公司); Oasis® HLB 3CC(60 mg)固相萃取柱(Waters公司)。
1.2 主要溶液的配制 1.2.1 乙酸铵缓冲液的配制称取19.27 g乙酸铵于1 000 mL容量瓶中, 用冰乙酸溶液调为pH4.3, 并用纯净水定容用作流动相。取0.25 mol·L-1乙酸铵溶液稀释至0.125 mol·L-1, 作为萃取液用。
1.2.2 HPLC流动相的配制分别量取250 mL乙腈、150 mL 0.25 mol·L-1乙酸铵溶液、600 mL纯净水, 定容至1 000 mL容量瓶中, 经0.22 μm滤膜过滤, 制成V(乙睛):V(0.25 mol·L-1乙酸铵溶液):V(纯净水)=5:3:12的流动相(用冰乙酸调pH4.3)。
1.2.3 标准储备液(200 μg·mL-1)的配制准确称取10.0 mg氢溴酸常山酮标准品置入50 mL棕色容量瓶中, 用0.25 mol·L-1乙酸铵溶解并定容, 密封, 在4 ℃下避光保存。
1.2.4 标准液的配制从冰箱中取出标准品储备液置于室温环境中, 用移液管移取所需量, 用流动相分别配制150、100、50、20、10、5和2 μg·mL-1的氢溴酸常山酮标准液, 密封, 在4 ℃下避光保存。
1.3 试验方法 1.3.1 样品的采集及保存用抽样锥随机从10袋鸡配合饲料(由南京市江宁区青龙山动物繁殖场提供)的上、下两个部位分别取约2 kg饲料作为原始样品, 然后将原始样品均匀混合, 采用四分法缩减至约1 kg, 作为次级样品。将上述次级样品四分法缩减, 取约200 g粉碎后过1 mm孔筛, 混匀, 装入磨口瓶中备用。
1.3.2 试验色谱检测条件C18色谱柱(4.6 mm×250 mm, 5 μm)。流动相:V(乙睛):V(0.25 mol·L-1乙酸铵溶液):V(纯净水)=5:3:12(pH4.3)[8, 12]。流速1.0 mL·min-1, 检测波长243 nm, 进样量25 μL, 柱温25 ℃。
1.3.3 药物提取与净化称取饲料样品1 g于50 mL离心管中, 加入1 mL 100 g·L-1碳酸钠溶液和乙酸乙酯10 mL, 涡旋3 min, 8 000 r·min-1离心5 min。取上层液体转移至另一50 mL离心管中, 剩余物再用10 mL乙酸乙酯重提1次, 合并2次提取液, 加入5 mL 0.125 mol·L-1乙酸铵溶液萃取, 振摇1 min, 8 000 r·min-1离心5 min。转移下层液体至另一50 mL离心管, 重复提取1次。合并2次的下层溶液, 用40 ℃氮气吹干残余的乙酸乙酯, 作为备用液(含药物)。
HLB柱依次用甲醇、水和0.125 mol·L-1乙酸铵溶液各3 mL活化。取备用液(含药物)10 mL过柱, 加体积分数为1%甲醇溶液洗涤并抽干, 3 mL甲醇洗脱, 洗脱液在50 ℃下用氮气吹干。残渣物加1 mL流动相复溶, 超声振荡2 min, 涡动2 min。经过0.22 μm滤膜过滤, 取25 μL进行HPLC测定。
1.4 方法学考察 1.4.1 方法的特异性取6个不同来源的空白鸡配合饲料, 添加100 μL 2 μg·mL-1氢溴酸常山酮标准液, 制成0.2 μg·g-1 6个配合饲料样品, 按1.3.3节方法处理后进样分析, 观察常山酮保留时间附近是否有杂峰干扰, 判断检测方法的特异性。
1.4.2 方法灵敏度的测定添加适量氢溴酸常山酮标准液到1 g空白配合饲料样品中, 按1.3.3节方法处理后检测, 根据所测药物信噪比(S/N)不小于3和10分别为方法检测限(LOD)和定量限(LOQ)的原则, 测得氢溴酸常山酮在鸡配合饲料中的检测限和定量限。
1.4.3 药物浓度标准曲线的绘制用流动相稀释氢溴酸常山酮标准液分别制成0.2、0.5、1、2、5、10和15 μg·mL-1系列浓度的工作液直接进样测定, 每个浓度5个重复, 以标准溶液浓度(C)为横坐标, 峰面积(S)为纵坐标, 将峰面积与相应的药物质量浓度做线性回归, 绘制标准曲线求出回归方程和相关系数。
1.4.4 基质加标工作曲线绘制准确称取空白鸡配合饲料1 g样品若干份, 加入氢溴酸常山酮标准液, 使饲料中的药物水平分别为0.2、0.5、1、2、5、10和15 μg·g-1, 按1.3.3节方法进行操作, 按照1.3.2节色谱条件进行测定, 记录色谱图, 得峰面积(S), 每个水平5个重复, 以S(峰面积)对C(浓度)回归, 绘制标准曲线并得回归方程。
1.4.5 准确度和精密度的测定采用标准添加法, 在空白配合饲料中分别添加定量限(0.2 μg·g-1)和低(1.0 μg·g-1)、中(5.0 μg·g-1)、高(15.0 μg·g-1)4个质量浓度水平的样品, 按照1.3.3节方法处理样品, 按照1.3.2节色谱条件进行测定, 每批次、每个浓度5个重复, 连续测3 d, 每天测1个批次。将氢溴酸常山酮的峰面积代入1.4.4节的线性方程, 求出回收浓度, 然后回收浓度除以理论浓度, 求得氢溴酸常山酮不同质量浓度下的相对回收率, 并分别计算日内和日间精密度。
1.4.6 方法的稳定性测定分别于0、14 d吸取适量贮存在4 ℃的200 μg·mL-1储备液, 用流动相稀释到20 μg·mL-1进样分析, 每次3个重复, 记录峰面积, 考察氢溴酸常山酮在第14天的稳定性。
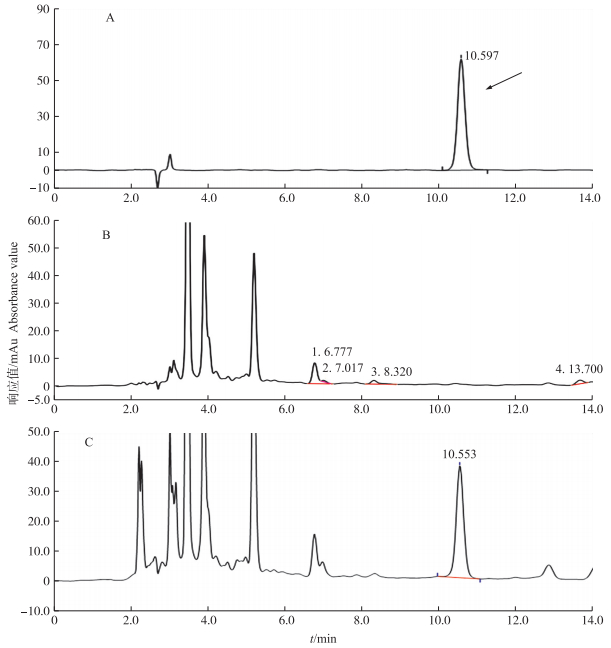
2 结果与分析 2.1 方法的特异性检测结果空白鸡饲料中的氢溴酸常山酮在出峰时间为10.6 min附近无干扰, 峰形良好, 偏差小于2.5%(图 1), 说明该方法能去除基质对氢溴酸常山酮的干扰, 能够用于后期的定性和定量测定。
|
图 1 氢溴酸常山酮检测的色谱图 Figure 1 Detection chromatogram of halofuginone hydrobromide A.标液色谱图; B.空白色谱图; C.空白鸡配合饲料添加氢溴酸色谱图。 A. Standard chromatogram; B. Chromatogram of blank; C. Chromatogram of halofuginone hydrobromide in poultry feeds. |
本试验采用标准添加法考察方法的灵敏度。以信噪比(S/N)不小于3和不小于10为参考, 确定方法的检测限(LOD), 结合回收率及精密度测定结果, 确定方法定量限(LOQ)。测得氢溴酸常山酮在鸡配合饲料中的LOD为0.05 μg·g-1, LOQ为0.2 μg·g-1。
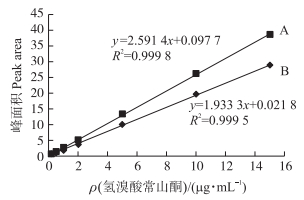
2.3 方法的校准曲线绘制 2.3.1 药物浓度标准曲线将由1.2.4节标准液稀释的质量浓度为0.2、0.5、1、2、5、10和15 μg·mL-1的标准工作液, 按其所得峰面积的平均值与对应的标准溶液质量浓度作标准曲线。由图 2可知, 在0.2~15 μg·mL-1范围内线性回归方程为y=2.591 4x+ 0.097 7。
|
图 2 氢溴酸常山酮标准曲线(A)和鸡配合饲料添加药物标准曲线(B) Figure 2 Standard curve of halofuginone hydrobromide(A) and standard curve of halofuginone hydrobromide in poultry feeds(B) |
饲料样品按含药物0.2、0.5、1、2、5、10和15 μg·g-1添加, 由试验结果可知, 在0.2~15 μg·g-1范围内线性方程为y=1.933 3x+0.021 8。
2.4 方法的准确度和精密度向空白饲料中添加定量限和低、中、高4个水平点的标准工作液, 结果见表 1。4个添加浓度的平均回收率均大于85%, 日内、日间精密度均小于20%。
| 添加水平/(μg·g-1) Spiked level |
回收率/% Recovery |
日内精密度/% Intra-day RSD(n=3) |
日间精密度/% Inter-day RSD(n=5) |
| 0.2 | 107.67±10.02 | 7.0~10.1 | 12.0 |
| 1.0 | 93.67±7.52 | 4.6~7.0 | 10.7 |
| 5.0 | 84.87±3.35 | 1.6~2.4 | 7.1 |
| 15.0 | 97.33±6.43 | 1.1~14.8 | 8.9 |
将在4 ℃贮存0 d和14 d的200 μg·mL-1药物储备液分别稀释为20 μg·mL-1的3个重复的工作液, 进样分析, 经过峰面积值的计算, 得出日间变异系数为0.25%。
3 讨论根据相关报道[8, 12], 流动相为乙腈、0.25 mol·L-1乙酸铵缓冲液、水(体积比5:3:12), 检测波长243 nm, 进样量25 μL。柱温为30 ℃时, 出峰时间较早, 杂峰与目标峰不能分离, 所以本试验将柱温改为25 ℃后分离度良好, 最终符合要求。
分别选取乙腈、甲醇、乙酸乙酯等溶剂对饲料中的药物进行提取并检测, 乙腈和甲醇提取的样品在空白色谱图中有干扰, 回收率低[10, 13]。随后配制甲醇-乙腈溶液(体积比1:1)提取药物, 但并未对样品色谱图和回收率有改善。而用乙酸乙酯提取样品时在空白色谱图上无干扰, 所以首选乙酸乙酯为提取溶剂。
据文献报道[14], 碳酸钠能促进氢溴酸常山酮由离子状态转变为分子状态, 更容易从有机相进入水相。对提取过程中加入不同量碳酸钠的提取效果进行比较, 发现加入1 mL 100 g·L-1碳酸钠溶液最合适。
在对净化条件的摸索中, 通过检测过HLB柱前后的备用液(含药物)、淋洗液、洗脱液中氢溴酸常山酮浓度, 发现备用液(含药物)过HLB柱后药物浓度很高。因此, 判断回收率低的原因主要是HLB柱没能有效保留药物。为了排除各种因素对HLB柱的影响, 经过试验的测定比较, 发现备用液中残留的乙酸乙酯是关键因素, 所以在提取含药物备用液时要在50 ℃下用氮气吹干残余的乙酸乙酯。
加入备用液(含药物)后的HLB柱子, 需要淋洗去除杂质, 通过对比甲苯和体积分数分别为0.5%、1%、5%、10%甲醇淋洗液的除杂能力, 发现甲苯无淋洗效果, 且对柱子有损坏作用, 0.5%甲醇除杂能力较弱, 5%和10%甲醇淋洗后回收率较低, 而1%甲醇淋洗液除杂效果好并且回收率能达到要求。
本试验采用高效液相色谱法测定了饲料中氢溴酸常山酮的含量, 相对于文献[7-9]所建立的方法, 本试验建立的方法操作更快速、简便, 这主要得益于对样品处理方法的改进。试验在0.2~15 μg·g-1范围内, 线性方程相关系数不小于0.999, 回收率大于85%, 日内和日间变异系数小于20%, 达到了相关规定要求, 所以本方法适用于饲料中氢溴酸常山酮的含量检测。
| [1] | Blake D P, Tomley F M. Securing poultry production from the ever-present Eimeria challenge[J]. Trends Parasitology, 2014, 30(1): 12-19. DOI: 10.1016/j.pt.2013.10.003 |
| [2] | Tewari A K, Maharana B R. Control of poultry coccidiosis:changing trends[J]. J Parasitic Diseases, 2011, 35(1): 10-17. DOI: 10.1007/s12639-011-0034-7 |
| [3] |
罗家莹. 氟腺呤溶液剂在肉鸡体内的药动学及药效学初步研究[D]. 南京: 南京农业大学, 2014.
Luo J Y. Study on the pharmacokinetics and pharmacodynamics of arprinocid solution in broiler chickens[D]. Nanjing: Nanjing Agricultural Univeristy, 2014(in Chinese with English abstract). 氟腺呤溶液剂在肉鸡体内的药动学及药效学初步研究 |
| [4] |
潘百明, 雷翠云. 鸡球虫对十二种常用抗球虫药的耐药性试验[J].
畜牧与兽医, 2013, 45(8): 122-123.
Pan B M, Lei C Y. Resistance tests of chicken coccidia to twelve commonly used anticoccidial drugs[J]. Animal Husbandry and Veterinary Medicine, 2013, 45(8): 122-123. (in Chinese with English abstract) |
| [5] | Anderson A, Christopher D H, Woodhouse R N. Analysis of the anti-coccidial drug, halofunginone, in chicken feed using gas-liquid chromatography and high-performance liquid chromatography[J]. Journal of Chromatography A, 1979, 168(2): 471-480. DOI: 10.1016/0021-9673(79)80018-7 |
| [6] | Krivankova L, Foret F, Bocek P. Determination of halofuginone in feedstuffs by the combination of capillary isotachophoresis and capillary zone electrophoresis in a column-switching system[J]. Journal of Chromatography A, 1991, 545(2): 307-313. DOI: 10.1016/S0021-9673(01)88721-5 |
| [7] | Anderson A, Goodall E, Bliss G W, et al. Analysis of the anti-coccidial drug, halofuginone, in chicken tissue and chicken feed using high-performance liquid chromatography[J]. Journal of Chromatography A, 1981, 212(3): 347-355. DOI: 10.1016/S0021-9673(01)84048-6 |
| [8] | Listed N. Determination of halofuginone hydrobromide in medicated animal feeds[J]. Analyst, 1983, 108(1291): 1252-1256. DOI: 10.1039/an9830801252 |
| [9] | Tillier C, Cagniant E, Deevaux P. Determination of halofuginone in poultry feeds by high-performance liquid chromatography[J]. Journal of Chromatography A, 1988, 441(2): 406-416. DOI: 10.1016/S0021-9673(01)83887-5 |
| [10] |
王丽娜, 王姝, 田晓玲, 等. 同位素内标法测定饲料中氢溴酸常山酮——超高效液相色谱-串联质谱法[J].
现代畜牧兽医, 2015(5): 12-18.
Wang L N, Wang S, Tian X L, et al. Determination of halofuginone in feeds by ultra performance liquid chromatography tandem mass spectrometry[J]. Modern Journal of Animal Husbandry, 2015(5): 12-18. (in Chinese with English abstract) |
| [11] |
贾涛. 液相色谱-串联质谱法检测饲料中氢溴酸常山酮的探讨[J].
饲料广角, 2015(6): 16-19.
Jia T. Liquid chromatography of halofuginone hydrobromide tandem mass spectrometry in feed[J]. Feed China, 2015(6): 16-19. (in Chinese with English abstract) |
| [12] |
吴宁鹏. 鸡组织中常山酮残留的ELISA检测方法和HPLC检测方法研究[D]. 北京: 中国农业大学, 2004.
Wu N P. Halofuginone residues in chicken tissues of ELISA detection method and HPLC method[D]. Beijing: China Agricultural University, 2004(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10019-2004078201.htm |
| [13] |
王盈予, 夏曦, 李晓薇, 等. 超高效液相色谱-串联质谱法测定鸡皮及脂肪组织中抗球虫类药物残留[J].
分析化学, 2014, 42(3): 409-414.
Wang Y Y, Xia X, Li X W, et al. Ultra performance liquid chromatography-tandem mass spectrometric method for determination of coccidiostats in chicken skin and fat[J]. Chinese Journal of Analytical Chemistry, 2014, 42(3): 409-414. (in Chinese with English abstract) |
| [14] |
侯亚莉, 唐明, 郭利敏, 等. 鲟鱼肌肉中氢溴酸常山酮残留检测的高效液相色谱法[J].
中国兽药杂志, 2006, 40(5): 15-18.
Hou Y L, Tang M, Guo L M, et al. Determination of halofuginone residues in sturgeon muscle by HPLC[J]. Chinese Journal of Veterinary Drug, 2006, 40(5): 15-18. (in Chinese with English abstract) |




