文章信息
- 李荣阳, 唐小川, 徐世永, 陈清, 吴望军, 刘红林
- LI Rongyang, TANG Xiaochuan, XU Shiyong, CHEN Qing, WU Wangjun, LIU Honglin
- 明胶对鸡胚盘细胞的增殖和多功能性的影响
- Effects of gelatin on proliferation and pluripotency of chicken blastodermal cells
- 南京农业大学学报, 2018, 41(2): 364-369
- Journal of Nanjing Agricultural University, 2018, 41(2): 364-369.
- http://dx.doi.org/10.7685/jnau.201703030
-
文章历史
- 收稿日期: 2017-03-22
2. 广西大学动物科学技术学院, 广西 南宁 530000;
3. 金陵科技学院动物科学与技术学院, 江苏 南京 211169
2. College of Animal Sciences and Technology, Guangxi University, Nanning 530000, China;
3. College of Animal Sciences and Technology, Jinling Institute of Technology, Nanjing 211169, China
胚胎干细胞(embryonic stem cells, ESC)是一类具有自我更新和多向分化潜能的多功能细胞[1], 在新药筛选、细胞再生医学和转基因领域也发挥着重要作用。作为被成功分离并进行体外培养的禽类多功能细胞, 鸡胚盘细胞(chicken blastodermal cell, cBC)在干细胞基础研究以及在转基因鸡的生产上等多个领域具有重要的研究和应用价值。鸡产蛋的时间是在卵子受精20~23 h以后, 从第1次卵裂到原条(primitive streak)形成期间的早期发育分为14个时期, 即Ⅰ~Ⅹ Ⅳ期。刚生出鸡蛋中的鸡胚处于第Ⅹ期, 这个阶段的鸡胚称为胚盘。1990年, Petitte等[2]的试验说明, 胚盘细胞具有多功能性, 在胚盘细胞的基础上培育出的鸡胚胎干细胞(cESC)将在转基因领域具有极大的应用潜力。
cESC在1996年被首次培育成功[3]。此后, 其他研究人员也成功培育了cESC, 他们使用的滋养层虽然都是鼠胚成纤维细胞系(SIM-6-thiogunanie-oualiain, STO), 但使用的培养条件更加简单, 在基础培养基和血清的基础上单独添加细胞因子IL-6或LIF[4]。然而, 上述鸡胚盘细胞的培养条件还不够成熟, 这主要体现在鸡胚盘细胞在培养成鸡胚干细胞以后全能性大幅度降低, 并且在移植到受体鸡胚的胚盘下腔后不能发育为生殖细胞。因此, 目前还不能通过使用鸡胚干细胞作为媒介获得性腺嵌合的转基因鸡[5]。此外, 上述的培养体系都使用了滋养层和血清, 这就导致了培养体系中含有太多的未知成分, 无法系统而严格地评估每个生长因子的实际作用, 从而无法有针对性地对培养体系进行改进。另一方面, 这种成分复杂的培养体系也不利于探究鸡胚盘细胞生长发育过程中的确切机制。因此, 发展一种无血清、无滋养层的鸡胚盘细胞培养体系是十分有必要的。
对于贴壁型细胞而言, 细胞的贴壁能力对于细胞的增殖至关重要。然而, 无滋养层条件下原代cESC的贴壁能力非常差。有文献报道, 用10 g·L-1的明胶包被培养板可以很好地对贴壁能力差的鸡原始生殖细胞(PGCs)进行培养[6]。明胶是用动物(牛、马、猪、鱼、驴)的皮、骨、腱、鳞等含胶原蛋白的组织经过一系列化学处理而降解生成的非均匀多肽混合物, 由20多种氨基酸所组成。明胶的自身结构为细胞提供所需的机械强度和维持细胞内部的活性[7-10]。除了使用明胶以外, 也有研究者使用人重组玻连蛋白(human vitronectin, hVTN)包被的培养板, 利用E8培养基(essential 8 medium)在无血清、无滋养层的条件下培养人多功能干细胞(hPSC)[11-12]。hVTN又称S-蛋白或血清扩散因子, 由2条单链的糖蛋白组成, 存在于血浆和细胞外基质中。玻连蛋白可促进内皮细胞黏附、伸展和增殖, 促进多种正常细胞及癌细胞的分化, 可用于细胞迁移试验的研究[11]。E8培养基包含8种干细胞培养所需要成分, 是一种针对人诱导多功能干细胞(iPS)培养而研制出来的不需要血清和滋养层的培养基, 它可以保证iPS细胞在培养50代以上仍能保持良好的增殖活性和全能性[13]。由于E8培养基是仅在DMEM/F-12基础培养基上添加了7种其他成分, 这使得该培养体系具有极其清晰的背景, 非常有利于iPS细胞的诱导、转化和发育过程中的机制研究。综上所述, 10 g·L-1明胶和hVTN都可以用来包被培养板从而提高干细胞的贴壁能力。
因此, 本研究在E8培养基基础上, 比较10 g·L-1明胶和hVTN两种不同包被方式对鸡胚盘细胞(cBC)的贴壁能力、细胞增殖以及多功能性维持等方面的影响, 来解决鸡胚盘细胞不易贴壁的问题, 进一步优化了cBC的无血清、无滋养层培养体系。
1 材料与方法 1.1 试验材料 1.1.1 试验动物来航鸡种蛋取自南京市溧水区绿星农业科技有限公司。种蛋产出后立刻转移至16 ℃储存室, 并在鸡场到实验室的运输过程中保持低温, 保证鸡胚盘处于未发育状态。
1.1.2 主要器材可调式微量移液器(Eppendorf和Thermo); YS100光学显微镜; 荧光显微镜(Nikon); 实时荧光定量PCR仪(ABI 7300 System, ABI); CO2培养箱(Thermo); 超净工作台(上海博迅实业有限公司医疗设备厂); 细胞培养板(Costar)。
1.1.3 主要试剂及配制E8培养基(Gibco公司), 用时将基础培养基和50×添加物混合, 并加入双抗(100 U·mL-1青霉素和100 μg·mL-1链霉素, Gibco公司)。使用时4 ℃融化, 添加到E8完全培养基中至指定浓度。10 g·L-1明胶溶液(ES-006-B, Millipore, USA)。EdU染色试剂盒(广州锐博生物科技有限公司)。碱性磷酸酶染色试剂盒(上海翊生生物有限公司)。
1.2 试验方法 1.2.1 培养板的包被分别用10 g·L-1明胶和人重组玻连蛋白(hVTN)对培养板进行包被。hVTN干粉用PBS预先溶解成0.25 mg·mL-1的储存液, 置于-20 ℃存储备用, 使用时现配成包被液(0.1 μg·cm-2)。4 ℃包被过夜, 弃hVTN包被液后接种细胞。10 g·L-1明胶的包被条件同为4 ℃过夜。
1.2.2 鸡胚盘细胞的分离和培养种蛋用新洁尔灭和75%(体积分数)乙醇灭菌后平放1 h, 使胚盘移动至种蛋一侧。在无菌环境中敲破种蛋倒入10 cm培养皿中, 用眼科剪把胚盘四周卵黄膜剪开, 用小汤匙把胚盘转移至另一个盛有预热PBS(pH7.2~7.4)的培养皿中, 去除胚盘的暗区, 保留明区。把胚盘明区轻轻转移至1.5 mL的EP管中。采集到足够多(6孔板每孔6个胚盘明区)的胚盘明区后, 在EP管中用PBS将其轻轻吹洗3次, 洗去蛋黄等杂质。EP管中加入适量E8培养基, 用1 000 μL移液枪将胚盘细胞吹散。注意吹吸的力度和频率, 保证将细胞吹散的同时尽可能降低对细胞的损伤。350 g离心, 弃上清液后用E8培养基将细胞重悬。细胞计数器计数后, 以2×104 cm-2的密度将鸡胚盘细胞铺板至预先分别包被好玻连蛋白和10 g·L-1明胶的培养板中; 同时设对照组和PBS组。在37 ℃、5% CO2的恒温细胞培养箱中培养。48 h内不需更换培养基。
1.2.3 5-乙炔基-2′-脱氧尿嘧啶核苷(5-ethynyl-2′-deox-yuridine, EdU)染色与细胞计数鸡胚盘细胞生长48 h时, 根据EdU染色试剂盒(广州锐博)的操作说明对4种不同包被处理(对照组、PBS组、hVTN组、明胶组)的cBC进行染色。每组处理取3个不同视野分别统计阳性细胞数和总细胞数, 计算EdU阳性细胞率。EdU阳性细胞率=EdU阳性细胞数/总细胞数×100%。
1.2.4 碱性磷酸酶(AP)染色鸡胚盘细胞生长48 h时, 根据碱性磷酸酶染色试剂盒的操作说明对对照组、PBS组、hVTN组和明胶组的cBC进行染色。
1.2.5 SSEA-1免疫荧光染色在明胶包被的处理中培养48 h, 采用免疫荧光对鸡胚盘细胞的多功能性鉴定, 具体操作步骤如下:爬片中加入37 ℃预热的PBS, 清洗2次, 用体积分数为4%的多聚甲醛室温固定20 min。PBS清洗3次, 加100 μL 0.5%(体积分数)Triton X-100, 4 ℃打孔10 min, TBS清洗3次, 加入10 g·mL-1 BSA封闭液, 室温封闭1 h, 在盖玻片上加5 μL阶段特异性胚胎抗原1(stage specific embryonic antigen 1, SSEA-1)抗体(Abcam), 敷上封口膜后, 于湿盒中37 ℃避光孵育1 h。PBS清洗3次, 在盖玻片上加5 μL Alexa Fluor 488(绿色荧光)标记的二抗(Abcam), 敷上封口膜, 于湿盒中37 ℃避光孵育1 h。PBS清洗3次, 在盖玻片上加3 μg·mL-1 DAPI 5 μL, 敷上封口膜, 于湿盒中室温避光孵育20 min。PBS清洗3次后, 在干净的载玻片中间滴5 μL荧光抗淬灭剂, 在激光共聚焦显微镜下检测。检测条件:激发波长450~500 nm(蓝), 发射波长515~565 nm(绿)。
1.2.6 反转录实时荧光定量PCR(RT-qPCR)用RNA提取试剂盒(TIANGEN)提取4种不同包被处理、在E8培养基生长48 h时的鸡胚盘细胞总RNA, 用反转录试剂盒(TaKaRa)反转录成cDNA后, 用荧光定量PCR酶(Vazyme)进行试验。以β-actin基因作为内参基因, 其中PouV、Nanog是多功能基因, P21、Fas为凋亡基因。采用相对标准曲线方法进行基因的定量。每个样品3次重复以确定CT值, 计算3次的平均值。每个样品某个基因的相对表达量由该目的基因的表达量数值(即目的基因的C0值)与内参基因的表达量数值(即内参基因的C0值)的比值决定, 即:目的基因的相对表达量=目的基因的C0值/内参基因的C0值。采用Primer Premier 6.0设计qPCR相关引物(表 1)。
| 扩增基因Gene | 引物对序列(5′ → 3′)Primer pairs sequence | 片段长度/bp Fragment length |
| PouV | GCCAAGGACCTCAAGCACAA/ATGTCACTGGGATGGGCAGA | 511 |
| Nanog | CAGCAGACCTCTCCTTGACC/AAGCCCTCATCCTCCACAGC | 586 |
| P21 | ACCACGAGCAGATCCAGAACGA/TCCTCAGCAGCAGCAGTCACA | 396 |
| Fas | TCGGTGTGAACATTGCGAGTCA/CGTGGTGGGTCAGGTCAACATC | 215 |
| β-actin | GAACCCCAAAGCCAACAGA/GGAGGGCGTAGCCTTCATAGA | 185 |
数据分析采用SPSS 20.0软件进行差异显著检验, 试验结果均以平均数±标准误(x±SE)表示。
2 结果与分析 2.1 不同包被方式对cBC贴壁速度及细胞形态的影响如图 1所示:10 g·L-1明胶和hVTN包被的培养板上, cBC均在12 h就能够贴壁生长, 但在对照、PBS处理中, cBC 12 h内几乎不贴壁(黑色箭头所示), 未贴壁的细胞呈克隆团样, 早期贴壁克隆团边缘细胞呈单层状态生长。cBC贴壁之后迅速增殖。48 h, 10 g·L-1明胶处理cBC的汇合度达到90%以上, 明显高于hVTN处理组, 这个形态特征和前人研究中记载的cBC形态一致[14]。
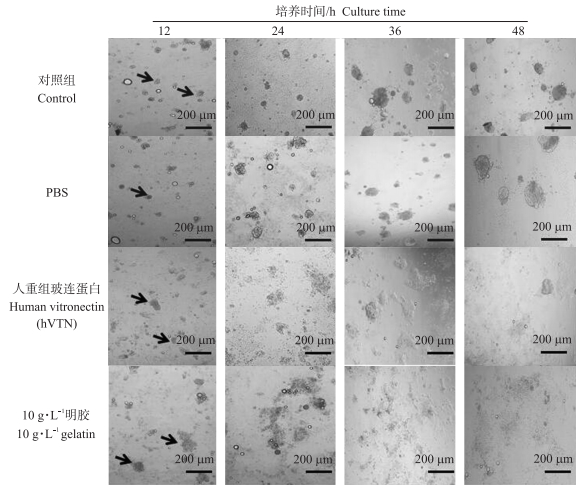
|
图 1 鸡胚盘细胞在不同包被处理组中不同时间的贴壁状态 Figure 1 Adherent state of chicken blastoderm cells in different treatment groups and in different periods |
如图 2所示:原代cBC接种到24孔板并培养48 h后, 用碱性磷酸酶染色, 未分化cBC呈蓝紫色, 已分化的细胞不着色(图 2)。在对照组和PBS组中, 细胞克隆团被染成蓝紫色, 表明培养48 h后, 依然具有多功能性, 但贴壁性较差。而hVTN和10 g·L-1明胶处理中, 细胞呈单层贴壁生长, 经碱性磷酸酶染色鉴定依然具有多功能性。值得注意的是, 10 g·L-1明胶处理的细胞汇合度明显高于hVTN组。为了进一步鉴定鸡胚盘细胞培养48 h后仍具有多功能性, 我们使用免疫荧光染色, 结果(图 3)表明, 10 g·L-1明胶处理培养板培养cBC呈单层贴壁状态且能够表达阶段特异性胚胎抗原1(SSEA-1)。SSEA-1是鸡胚盘细胞特异表达的标志性蛋白, 表明鸡胚盘在此条件下, 培养48 h可以维持cBC多功能性。
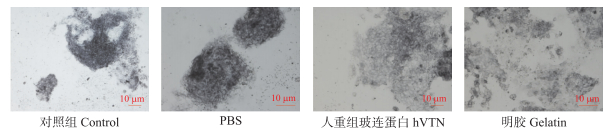
|
图 2 碱性磷酸酶染色法鉴定不同包被处理下的鸡胚盘细胞(48 h) Figure 2 Alkaline phosphatase staining to identify chicken blastoderm cells in different treatment groups(48 h) |
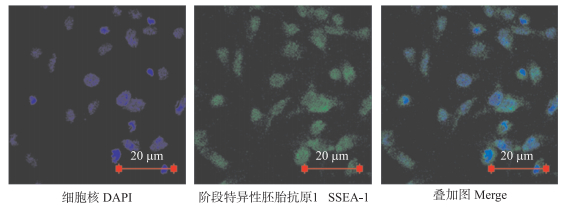
|
图 3 10 g·L-1明胶包被处理下鸡胚盘细胞(48 h)的SSEA-1免疫荧光染色鉴定 Figure 3 Immunofluorescence staining of stage specific embryomic cortigen 1(SSEA-1) in cBC(48 h)on 10 g·L-1 gelatin-coated wells |
为了对比hVTN和10 g·L-1明胶包被的培养板对cBC增殖的影响差异, 采用EdU染色来检测不同包被处理中处于增殖期的细胞数量。如图 4所示:与对照组和PBS组相比, hVTN和10 g·L-1明胶处理中处于增殖期的细胞数量均显著增加。hVTN和10 g·L-1明胶处理的培养板能够明显提高cBC的贴壁能力。与hVTN处理组相比, 明胶处理组的cBC处于增殖期的细胞数量呈上升趋势(P>0.05)。
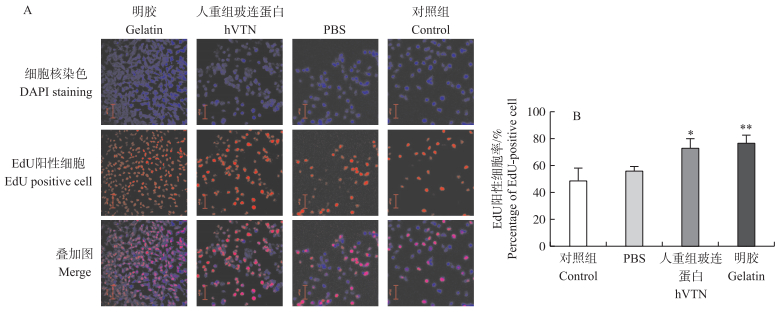
|
图 4 不同处理对鸡胚盘细胞增殖培养(A)和EdU阳性细胞率(B)的影响 Figure 4 Effects on the culture(A)and the percentage of EdU-positive cell(B)of proliferation of chicken blastoderm cell on different treatments 试验结果用平均值±标准误(n=3)表示。Values are the mean ±SE(n=3). *P < 0.05, **P < 0.01. |
从上述试验结果可以看出, 10 g·L-1明胶处理后cBC在贴壁速度和维持多功能性以及细胞的增殖方面体现了优势。为了进一步探究明胶对维持cBC的多功能性和促进cBC增殖方面的影响, 我们通过RT-qPCR检测了多功能基因和凋亡基因在mRNA水平上的表达。结果(图 5)显示:hVTN和10 g·L-1明胶处理的培养板能够显著上调多功能基因PouV和Nanog的表达。在胚胎发育过程中PouV仅表达于多功能相关细胞中[15-16], 而且提高Nanog基因的表达可以使ES细胞在无LIF添加的条件下维持未分化状态[17]。因此, 我们认为hVTN和10 g·L-1明胶处理的培养板能够显著提高cBC多功能性。值得注意的是, hVTN处理组中PouV和Nanog的表达水平约为明胶处理组的3倍, 其原因还有待进一步探讨。
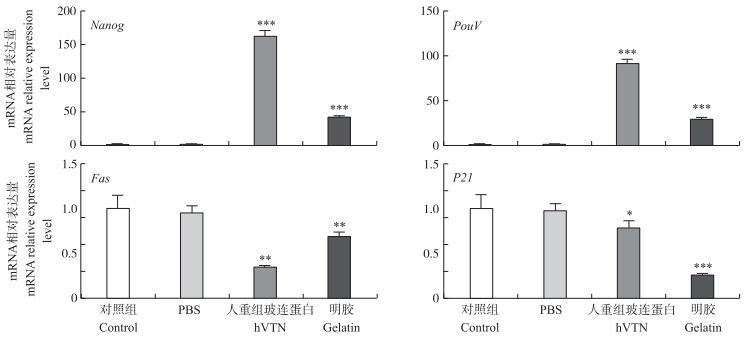
|
图 5 不同包被处理对鸡胚盘细胞的多功能基因和凋亡基因mRNA表达水平的影响 Figure 5 Effect of different treatments on the expression levels of the pluripotency and apoptosis genes of cBC β-actin基因为内参。Each condition is normalized to β-actin abundance. *P < 0.05, **P < 0.01, ***P < 0.001. |
此外, 凋亡基因P21和Fas的表达检测结果显示, hVTN和10 g·L-1明胶处理均显著降低P21和Fas的表达。由此表明, hVTN和10 g·L-1明胶处理均能抑制细胞的凋亡, 在一定程度上促进cBC的增殖。
3 结论与讨论本试验使用E8培养基比较了hVTN和10 g·L-1明胶作为包被试剂的效果, 初步建立了一种无血清、无滋养层的鸡胚盘细胞培养体系, 其培养的鸡胚盘细胞可以在一段时间内保持单层贴壁的状态, 该状态下的鸡胚盘细胞处于未分化状态并且具有较高的增殖活性。
鸡胚盘细胞的贴壁能力很弱, 使用普通培养板进行细胞培养时几乎不能得到任何贴壁生长的鸡胚盘细胞。使用hVTN或10 g·L-1明胶对培养板进行包被以后, 很好地解决了鸡胚盘细胞不能贴壁的问题。在促进鸡胚盘细胞增殖方面, hVTN和10 g·L-1明胶均能显著促进细胞增殖, 但2种处理的cBC处于增殖期的细胞数量没有显著性差异, 2种包被方式在促进细胞增殖方面哪种更有优势, 还需进一步地研究。
10 g·L-1明胶处理组中PouV和Nanog的表达量仅是hVTN处理组的1/3。由于hVTN由2条单链的糖蛋白组成, 而细胞膜表面跟贴壁相关和与自我更新相关的信号通路受体也主要是糖蛋白。因此, 我们推测这可能是由于人重组玻连蛋白处理的培养板不仅能够修复采样过程中用胰酶消化对胚盘细胞膜蛋白造成的损伤, 进而促进细胞贴壁, 而且还能够修复一些信号通路的受体蛋白, 其中包括一些与自我更新相关信号通路受体蛋白, 如白血病抑制因子受体(LIF receptor), 从而能够促进鸡胚盘细胞的多功能基因的表达[18]。此外, hVTN和10 g·L-1明胶都能下调凋亡基因的表达, 从而进一步证明了促进鸡胚盘细胞增殖的结论。与hVTN相比, 明胶比较便宜, 对于普通实验室来说, 明胶不失为一种较好的选择。
综上, 明胶可以作为一种新的包埋试剂与E8培养基结合来进行cBC的培养。与人重组玻连蛋白相比, 明胶体现了更高的性价比, 也进一步优化了鸡胚盘细胞无血清、无滋养层培养体系。
| [1] |
剧世强, 芮荣. MicroRNA在多能干细胞的表达与功能[J].
南京农业大学学报, 2013, 36(2): 1-6.
Ju S Q, Rui R. Expression and function of microRNA in pluripotent stem cells[J]. Journal of Nanjing Agricultural University, 2013, 36(2): 1-6. DOI: 10.7685/j.issn.1000-2030.2013.02.001 (in Chinese with English abstract) |
| [2] | Petitte J N, Clark M E, Liu G, et al. Production of somatic and germline chimeras in the chicken by transfer of early blastodermal cells[J]. Development, 1990, 108(1): 185-189. |
| [3] | Pain B, Clark M E, Shen M, et al. Long-term in vitro culture and characterisation of avian embryonic stem cells with multiple morphogenetic potentialities[J]. Development, 1996, 122(8): 2339-2348. |
| [4] | Horiuchi H, Tategaki A, Yamashita Y, et al. Chicken leukemia inhibitory factor maintains chicken embryonic stem cells in the undifferentiated state[J]. The Journal of Biological Chemistry, 2004, 279(23): 24514-24520. DOI: 10.1074/jbc.M313231200 |
| [5] | van de Lavir M C, Mather-Love C, Leighton P, et al. High-grade transgenic somatic chimeras from chicken embryonic stem cells[J]. Mechanisms of Development, 2006, 123(1): 31-41. DOI: 10.1016/j.mod.2005.10.002 |
| [6] | Naito M, Harumi T, Kuwana T. Long-term culture of chicken primordial germ cells isolated from embryonic blood and production of germline chimaeric chickens[J]. Animal Reproduction Science, 2015, 153: 50-61. DOI: 10.1016/j.anireprosci.2014.12.003 |
| [7] | van Nieuwenhove I, van Vlierberghe S, Salamon A, et al. Photo-crosslinkable biopolymers targeting stem cell adhesion and proliferation:the case study of gelatin and starch-based IPNs[J]. J Mater Sci Mater Med, 2015, 26(2): 104. DOI: 10.1007/s10856-015-5424-4 |
| [8] | Vlierberghe S V, Cnudde V, Dubruel P, et al. Porous gelatin hydrogels:1. Cryogenic formation and structure analysis[J]. Biomacromolecules, 2007, 8(2): 331-337. DOI: 10.1021/bm060684o |
| [9] | van Nieuwenhove I, Stubbe B, Graulus G J, et al. Protein functionalization revised:N-tert-butoxycarbonylation as an elegant tool to circumvent protein crosslinking[J]. Macromolecular Rapid Communications, 2014, 35(15): 1351-1355. DOI: 10.1002/marc.v35.15 |
| [10] | Dubruel P, Unger R, Vlierberghe S V, et al. Porous gelatin hydrogels:2. In vitro cell interaction study[J]. Biomacromolecules, 2007, 8(2): 338-344. DOI: 10.1021/bm0606869 |
| [11] | Chen G, Gulbranson D R, Hou Z, et al. Chemically defined conditions for human iPSC derivation and culture[J]. Nature Methods, 2011, 8(5): 424-429. DOI: 10.1038/nmeth.1593 |
| [12] | Imamura M, Hikabe O, Lin Z Y, et al. Generation of germ cells in vitro in the era of induced pluripotent stem cells[J]. Molecular Reproduction and Development, 2014, 81(1): 2-19. DOI: 10.1002/mrd.22259 |
| [13] | Liu W, Chen G. Cryopreservation of human pluripotent stem cells in defined medium[J]. Curr Protoc Stem Cell Biol, 2014. DOI: 10.1002/9780470151808.SC01C17S31 |
| [14] | van de Lavoir M C, Mather-Love C. Avian embryonic stem cells[J]. Methods Enzymol, 2006, 418: 38-64. DOI: 10.1016/S0076-6879(06)18003-9 |
| [15] | Kirchhof N, Carnwath J W, Lemme E, et al. Expression pattern of Oct-4 in preimplantation embryos of different species[J]. Biology of Reproduction, 2000, 63(6): 1698-1705. DOI: 10.1095/biolreprod63.6.1698 |
| [16] | Palmieri S L, Peter W, Hess H, et al. Oct-4 transcription factor is differentially expressed in the mouse embryo during establishment of the first two extraembryonic cell lineages involved in implantation[J]. Dev Biol, 1994, 166(1): 259-267. DOI: 10.1006/dbio.1994.1312 |
| [17] | Mitsui K, Tokuzawa Y, Itoh H, et al. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells[J]. Cell, 2003, 113(5): 631-642. DOI: 10.1016/S0092-8674(03)00393-3 |
| [18] | Satoshi O, Yoko N F, Hitoshi N. LIF signal in mouse embryonic stem cells[J]. JAKSTAT, 2015, 4(2): 1-9. |




