文章信息
- 解林杰, 李莎, 姜卫华
- XIE Linjie, LI Sha, JIANG Weihua
- 马铃薯甲虫烟碱型乙酰胆碱受体α5亚基基因的克隆及其表达模式分析
- Cloning and expression profile of nicotinic acetylcholine receptor α5 subunit gene from Leptinotarsa decemlineata
- 南京农业大学学报, 2018, 41(2): 293-301
- Journal of Nanjing Agricultural University, 2018, 41(2): 293-301.
- http://dx.doi.org/10.7685/jnau.201707033
-
文章历史
- 收稿日期: 2017-07-24
烟碱型乙酰胆碱受体(nicotinic acetycholine receptor, nAChR)属于配体门控离子通道蛋白, 其功能是在脊椎动物和非脊椎动物中介导兴奋性神经递质在胆碱能突触间的快速传导[1], 也是新烟碱类和多杀菌素等杀虫剂的作用靶标。nAChR由5个亚基形成五聚体跨膜蛋白, 构成功能性受体[2]。脊椎动物的nAChR亚基确定有17种(α1~α10、β1~β4、γ、ε、δ), 昆虫nAChR亚基的已知种类相对较少[3], 如黑腹果蝇(Drosophila melanogaster)有7个α亚基和3个β亚基[4], 家蚕(Bombyx mori)有9个α亚基和3个β亚基[5], 赤拟谷盗(Tribolium castaneum)有11个α亚基和1个β亚基等[6]。近年来, 分子生物学和生物信息学的日益发展极大地促进了对昆虫nAChR亚基分子结构的研究, 也促进了其与药剂的作用及抗性机制的研究。Li等[7]发现褐飞虱中Nlα3/Nlα8/Nlβ1构成的nAChR对吡虫啉亲和性与Nlα1/Nlα2/Nlβ1形成的受体有明显差异; Lansdell等[8]也发现果蝇Dα5、Dα6和Dα7与分子伴侣RIC-3共表达所形成的nAChR对乙酰胆碱的亲和性都要高于其中任何一个单独或其他组合亚基构成的受体。这些研究结果表明:nAChR亚基组成的不同会影响昆虫与激动剂和新烟碱类杀虫剂的结合, 因此明确昆虫nAChR亚基的结构及其组成是了解其与药剂作用机制的重要基础。
马铃薯甲虫(Leptinotarsa decemlineata)是世界上公认的具有毁灭性的检疫害虫之一[9]。其成虫和幼虫都可以对马铃薯造成危害, 将其叶片取食成缺刻或仅留叶脉, 发生严重时可以将叶片全部吃光, 造成产量减少30%~50%, 有时高达90%甚至绝收[10]。马铃薯甲虫于1993年在我国新疆地区首次发现, 近些年来, 其自西向东不断传播, 危害新疆北部的大部分地区, 且疫区面积不断扩大[11-12]。化学防治是控制该虫的重要手段, 但长期单一的使用不可避免地造成了马铃薯甲虫对包括新烟碱类在内的杀虫剂产生了不同程度的抗性[13-15]。因此, 提出有效的治理措施, 延缓和预防马铃薯甲虫抗药性的产生, 对确保我国马铃薯生产安全和持续发展具有重要意义。
目前新烟碱类中吡虫啉、噻虫嗪是用于马铃薯甲虫防治的主要杀虫剂, 马铃薯甲虫nAChR亚基分子结构及功能的阐明无疑有助于了解新烟碱类药剂对该虫的作用机制和抗性机制。根据文献报道及本课题组前期工作, 已经获得马铃薯甲虫9个nAChR α亚基和1个β亚基基因(Ldα1~Ldα4、Ldα6~Ldα10、Ldβ1)的cDNA全长序列[16-17], 本研究进一步克隆得到该虫nAChR α5亚基基因的cDNA全长序列, 并分析了其序列特征以及不同时空和药剂处理后的表达谱, 补充了马铃薯甲虫nAChR亚基的组成, 为进一步的功能研究奠定了基础。
1 材料与方法 1.1 供试虫源2015年6月在新疆乌鲁木齐市安宁渠试验基地(43.71°N, 87.39°E)田间马铃薯苗上采集马铃薯甲虫, 在室内用马铃薯苗饲养, 养虫条件为(28±1)℃, 相对湿度50%~60%, 光周期为光/暗=16 h/8 h。收集马铃薯甲虫卵、1~4龄幼虫、蛹和成虫, 迅速放入液氮冻存, 然后置于-80 ℃备用, 每个虫态样品3~5个重复。
1.2 马铃薯甲虫总RNA提取、cDNA合成及引物设计按照Trizol试剂盒(Invitrogen公司)说明书操作提取马铃薯甲虫成虫(雌、雄混合)总RNA, 然后利用Nanodrop 2000分光光度计(Thermo Electron公司)测定RNA纯度, 利用PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa公司)将提取的总RNA合成cDNA, 具体步骤参照说明书。
马铃薯甲虫nAChR α5基因片段序列验证引物和RACE特异性引物利用Primer Premier 5.0软件(Premier公司)设计, 实时定量PCR引物利用Beacon Designer 7.0软件(PREMIER Biosoft公司)设计, 引物序列具体见表 1, 由南京金斯瑞公司合成。
| 引物名称 Primer names |
引物序列(5′→3′) Primer sequences |
用途 Purpose |
| nAChR α5-1 | GCGGTATCAAAGTCATCAGG/AATCTCCAAGGTTTCTACAAA | 基因片段验证 Fragment verification |
| nAChR α5-5′GSP | CTGAGCCACACCACCTCTCCCGTA | 5′RACE |
| nAChR α5-2 | CTTGCCCGAGTCGTAGAAAT/CAGGACACTGGATTTTTACT | End to end |
| nAChR α5-3 | CGTCTGAATCCGGAGAGAAA/CCAAG ACGACGTTCCTCAAT | 实时定量 PCR Quantitative real-time PCR |
| ARF1 | CGGTGCTGGTAAAACGACAA/TGACCTCCCAAATCCCAAAC | 内参基因 Reference gene |
利用赤拟谷盗nAChR α5的cDNA全长序列在马铃薯甲虫基因组数据库中通过BLASTx筛选马铃薯甲虫的nAChR α5基因片段序列, 然后设计特异性引物, 利用PCR进行克隆验证。PCR反应体系(25.0 μL):1.0 μL cDNA模板, 12.5 μL 2×Taq酶, 正、反向引物(10 μmol·L-1)各1.0 μL, 9.5 μL超纯水。PCR反应条件:95 ℃ 3 min; 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 2 min, 35个循环; 72 ℃ 10 min。PCR产物用10 g·L-1琼脂糖凝胶电泳鉴定后, 进行回收、纯化、连接和转化, 挑取阳性克隆送至南京金斯瑞公司测序。
通过基因组可拼接得到马铃薯甲虫nAChR α5基因3′端侧翼完整序列, 却未获得5′端完整序列, 于是利用RACE技术对该基因5′端进行克隆。按照SMARTer RACE 5′/3′Kit RACE试剂盒(Clontech公司)说明书利用SMART Scribe酶进行反转录获得5′-RACE-Ready cDNA, 作为克隆马铃薯甲虫nAChR α5基因5′的模板。PCR反应体系(50.0 μL):15.5 μL PCR-Grade H2O, 25.0 μL Buffer(2×SeqAmpTM), 1.0 μL SeqAmp DNA Ploymerase, 2.5 μL模板, 5.0 μL UPM(10×), 1.0 μL 5′GSP(10 μmol·L-1)。PCR反应条件:94 ℃ 30 s, 72 ℃ 30 s, 5个循环; 94 ℃ 30 s, 70 ℃ 30 s, 72 ℃ 30 s, 5个循环; 94 ℃ 30 s, 68 ℃ 30 s, 72 ℃ 3 min, 20个循环, 12 ℃保存。PCR产物用20 g·L-1琼脂糖凝胶电泳鉴定后, 进行回收、纯化、连接和转化, 挑取阳性克隆交由南京金斯瑞公司测序。将Ldα5保守序列及5′和3′端序列拼接后得到其完整序列, 并利用end to end PCR进行验证。
1.4 序列分析及系统发育树的构建在NCBI中对马铃薯甲虫nAChR α5亚基的核苷酸序列进行BLASTx同源性搜索, 将搜索到的相关同源基因的氨基酸序列, 以FASTA的形式保存。利用GeneDoc软件对马铃薯甲虫nAChR亚基氨基酸序列进行对比分析; 用SignalP 4.0 Server分析氨基酸序列的信号肽; 用TMHMM Server v.2.0分析氨基酸序列的跨膜区域; 用ExPASy Prosite Server分析氨基酸序列的糖基化位点和双半胱氨酸残基; 利用MAGA 6.0中的Neighbor-jioning法构建系统发育树, 各个分支均进行1 000次的重复检验。
1.5 实时定量PCR分析比较Ldα5在马铃薯甲虫不同生长发育阶段的表达量变化。选取卵、1~4龄幼虫、蛹和成虫分别进行定量测定, 以上样品中每个重复取样量为卵20粒左右、1~3龄幼虫全虫各3头、4龄幼虫和2日龄成虫全虫各1头。选取成虫的头、胸和腹定量测定Ldα5在马铃薯甲虫不同部位的表达差异。利用吡虫啉LD50 (4龄幼虫每头0.003 0 μg、成虫每头0.012 7 μg)和噻虫嗪LD50(4龄每头0.004 8 μg、成虫每头0.009 7 μg)分别采用点滴法处理马铃薯甲虫4龄幼虫和成虫[18-19], 丙酮处理作为对照, 收集对照及药剂处理后24、48和72 h的存活个体, 测定药剂对马铃薯甲虫Ldα5表达量的影响。每个处理3个重复。按照实时定量PCR试剂盒SYBR Premix Ex Taq(TaKaRa公司)说明书操作, 利用ABI7500实时PCR系统(Applied Biosystems公司)测定上述样品的Ldα5基因表达量。反应体系:SYBR Premix Ex Taq(2×)10.0 μL, cDNA模板(50 ng·μL-1)1.0 μL, 上、下游引物(10 μmol·L-1)各0.8 μL, ROX Reference Dye(50×)0.4 μL, 用无RNA酶水补至体系达到20.0 μL。实时定量PCR反应程序:94 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 共40个循环; 绘制60~95 ℃的熔解曲线, 对其熔解曲线进行分析, 对非特异性PCR产物进行排除。每组试验重复3次。用ABI 7500SDS v1.4软件进行数据记录和分析, 采用2-ΔΔCT方法, 以持家基因ADP核糖基化因子(ADP-ribosylation factor, ARF; GenBank登录号:KC190026.1)作为内参基因进行定量分析[20]。
1.6 数据统计与分析利用SPSS 18.0软件进行统计分析, 采用单因素方差分析(one-way ANOVA)和Tukey′s显著性检验对Ldα5基因表达水平进行差异显著性分析。
2 结果与分析 2.1 马铃薯甲虫nAChR α5亚基基因的克隆及序列分析通过马铃薯甲虫基因组数据拼接获得其nAChR α5亚基基因核心保守片段和3′端序列, 并利用PCR进行了验证, 通过对比确定其属于α5亚基, 进一步通过5′RACE扩增测序, 并进行end to end验证, 最终得到马铃薯甲虫nAChR α5亚基基因的全长序列(图 1)。该基因cDNA序列全长1 758 bp, 开放阅读框1 446 bp, 编码481个氨基酸。具有nAChR α亚基的典型结构特征:4个保守的跨膜结构域(TM1~TM4), 13个氨基酸残基构成的半胱氨酸环(Cys~loop), 配体结合相关的环状结构(Loop A~C), nAChR α亚基特有的位于Loop C中的2个相邻半胱氨酸。根据其基因编码的氨基酸序列与其他昆虫nAChR α亚基的相似性, 确定其属于nAChR亚基, 并命名为Ldα5。

|
图 1 马铃薯甲虫Ldα5的核苷酸序列及其推导的氨基酸序列 Figure 1 The nucleotide and deduced amino acid sequences of Ldα5 from Leptinotarsa decemlineata 图中双下划线为N端信号肽序列; 单下划线为配体结合相关环状结构(Loop A~C); 虚线为1个半胱氨酸环(Cys~loop); 糖基化位点加粗; 圆圈为Loop C中nAChR α亚基特有的2个相邻半胱氨酸; 灰色阴影为保守的跨膜结构域(TM1~TM4)。 N-terminal signal peptide is marked with double underline. Ligand binding sites are underlined(single line). The Cys loop domain is indicated botted line.Glycosylation sites are indicated in bold. The circle indicates the two adjacent cysteines in Loop C is specific to nAChR α subunit. Putative transmembrane domains areshaded in grey. |
在NCBI里对Ldα5序列进行同源性BLASTx比对, 发现它与近缘种赤拟谷盗nAChR α5具有高达87%的相似性。
以赤拟谷盗的γ-氨基丁酸GABA和甘氨酸glycine受体为外群, 将黑腹果蝇、家蚕、赤拟谷盗和马铃薯甲虫所有已知的nAChR亚基氨基酸进行分析比较, 用MAGA 6.0软件构建了Ldα5的系统发育树(图 2)。结果表明, 本研究克隆的Ldα5与同为鞘翅目(Coleoptera)的赤拟谷盗Tcasα5亚基基因位于同一分支, 说明它们的亲缘关系最近。

|
图 2 昆虫烟碱型乙酰胆碱受体亚基的系统发育树 Figure 2 Phylogenetic tree of insect nAChR subunits |
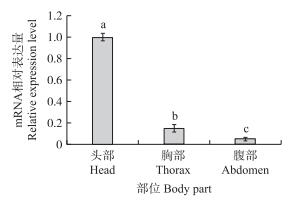
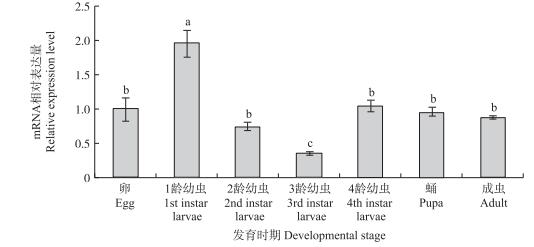
由实时定量PCR测定Ldα5在马铃薯甲虫成虫不同部位的表达量, 结果如图 3显示:Ldα5在成虫头部的表达量最高, 在胸部的表达量次之, 在腹部的表达量最低, 且在3个部位的表达水平差异显著。Ldα5在马铃薯甲虫不同发育阶段的表达量分析结果(图 4)显示:Ldα5在1龄幼虫中的表达量最高, 在卵、2龄及4龄幼虫、蛹和成虫中的表达量次之, 在3龄幼虫的表达量最低。
|
图 3 Ldα5在马铃薯甲虫成虫不同部位的表达水平 Figure 3 Expression of Ldα5 in the head, thorax and abdomen of L.decemlineata adults 不同字母表示同一基因在不同部位差异显著(P < 0.05)。 Different letters above bars indicate significant difference at 0.05 level of Ldα5 in different body parts. |
|
图 4 Ldα5基因在马铃薯甲虫不同发育时期相对表达量 Figure 4 Expression levels of Ldα5 in different development stages of L.decemlineata 不同字母表示同一基因在不同发育时期差异显著(P < 0.05)。 Different letters above bars indicate significant difference at 0.05 level of Ldα5 gene in different development stages. |
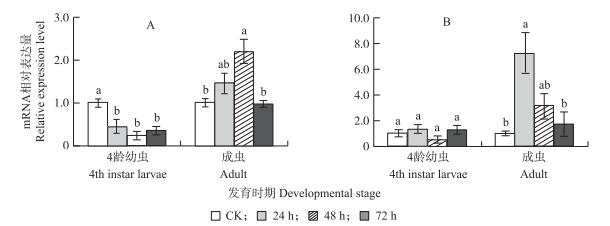
利用实时定量PCR测定吡虫啉、噻虫嗪分别处理的马铃薯甲虫4龄幼虫和成虫中Ldα5的表达量变化, 结果如图 5显示:以同日龄的未处理试虫为参照, 在吡虫啉处理24、48和72 h的4龄幼虫中Ldα5的相对表达量都明显下降, 而在噻虫嗪所有处理时间的Ldα5表达量都没有明显变化(图 5-A); 在成虫中, Ldα5分别在吡虫啉处理48 h、噻虫嗪处理24 h时的表达量明显高于未接触药剂的同日龄试虫, 其他处理时间下都没有明显差异(图 5-B)。
|
图 5 吡虫啉(A)和噻虫嗪(B)处理后马铃薯甲虫4龄幼虫和成虫Ldα5基因的相对表达量 Figure 5 Expression profiles of Ldα5 in the 4th instar larvae and adults of L.decemlineata exposed to the LD50 of imidacloprid(A)and thiamethoxam(B)at different time 不同字母表示同一基因在不同处理条件下差异显著(P < 0.05)。 Different letters above bars indicate significant difference at 0.05 level of Ldα5 gene in different treatments. |
作为目前普遍使用的新烟碱类和多杀菌素类杀虫剂的作用靶标, nAChR一直是昆虫分子生物学及毒理学中的研究热点。马铃薯甲虫的Ldα1~Ldα4、Ldα6~Ldα10和Ldβ1基因cDNA序列已经获得[16-17], 因此, 本研究克隆得到的Ldα5进一步补充了马铃薯甲虫nAChR亚基组成。已知赤拟谷盗nAChR亚基具有11个α亚基和1个β亚基[6], 马铃薯甲虫与赤拟谷盗具有近源关系, 但作者依据现有的基因组及转录组数据库利用BLASTn和BLASTx进行筛查并未获得该虫nAChR α11亚基的片段序列。马铃薯甲虫nAChR亚基组成的完善为深入研究新烟碱类杀虫剂对该虫的作用机制及抗性机制奠定基础。
本研究实时定量PCR结果分析表明Ldα5在马铃薯甲虫成虫头部表达量最高, 腹部的表达量最低。很多研究表明昆虫的nAChR亚基主要分布在头部, 课题组前期研究就发现Ldα1~Ldα4、Ldα6~Ldα10和Ldβ1在马铃薯甲虫成虫的头部表达量最高[16-17]; 橘小实蝇Bdβ3和Bdα9在其成虫头部的表达水平也最高[21-22]。这可能与nAChR主要分布在昆虫神经系统中有关。但亦有不尽一致的报道, 中华蜜蜂Accβ1和Accβ2在腹部的表达量明显高于头部[23], 苹果蠹蛾CpomnAChR α9在成虫头部并没有表达[24], 推测这些基因可能在昆虫身体部位的组织发育中起主要作用。
本研究还发现Ldα5在马铃薯甲虫不同发育阶段的表达也存在差异, 其在1龄幼虫中的表达量最高, 在卵、2龄和4龄幼虫、蛹和成虫的表达量次之, 在3龄幼虫中表达量最低。对马铃薯甲虫其他亚基表达特征的研究发现, Ldα2、Ldα3、Ldα6和Ldβ1在1龄幼虫中的表达量最高; Ldα1、Ldα4、Ldα7、Ldα8、Ldα9和Ldα10分别在卵、成虫、3龄幼虫、2龄幼虫、蛹和4龄幼虫中的表达量最高[16, 25-26]。这可能与不同的亚基基因在马铃薯甲虫不同发育阶段起着特定的作用有关。对其他昆虫nAChR亚基的研究比较发现, 同一个亚基在不同的昆虫中也存在不同的表达模式, Ldα8在马铃薯甲虫2龄幼虫中有最高的表达水平, 但Pxα8基因在小菜蛾成虫期的表达量最高; Ldα9在马铃薯甲虫蛹期表达量最高, Csα9在二化螟卵期有最高表达水平, 而Bdα9在橘小实蝇成虫中的表达水平最高[16, 25-26]。Yu等[23]通过对中华蜜蜂Accβ1和Accβ2启动子的克隆和分析, 预测出这2个基因的启动子序列上有不同的转录因子结合位点, 推测这可能引起基因表达量产生差异, 进而影响其在昆虫不同时空阶段中所发挥的作用。对于昆虫nAChR亚基表达模式的多样性及其机制还有待进一步的探索。
不少研究表明昆虫中nAChR亚基基因表达量的下调可以导致试虫对药剂敏感性的降低。如抗吡虫啉家蝇品系中Mdα 2表达量仅是敏感品系的43%~75%[27]; 棉蚜吡虫啉抗性品系nAChR β1基因的表达量较敏感品系也显著下降[28]; RNAi不仅下调了Nlα8和Ldα1的表达量, 也降低了褐飞虱和马铃薯甲虫对吡虫啉的敏感性[29, 17]。而在药剂的胁迫作用下, nAChR亚基基因在不同昆虫中的表达量却各有变化。吡虫啉处理可导致中华蜜蜂Accβ1和Accβ2基因的表达量下降[23], 却可使豌豆长管蚜(Acyrthosiphon pisum)Apisumβ1的表达量增加, 并且吡虫啉、噻虫嗪和噻虫胺的胁迫都可以导致Apisumα10上调和Apisumβ2的下调。Apisumα10亚基缺乏半胱氨酸环中的一个半胱氨酸, 电鳐中这种类似的α亚基可导致α-银环蛇毒素结合位点的缺失。而在豌豆长管蚜中, 新烟碱类药剂就是结合在相同位点上, 因此作者推测Apisumα10表达量的增加可导致产生更多的对新烟碱类药剂敏感性降低的nAChR亚型。这些结果表明一些nAChR亚基介入了特定药剂的结合作用中[30]。本研究定量测定发现, 吡虫啉可导致幼虫Ldα5明显下调, 而噻虫嗪则无明显影响。吡虫啉和噻虫嗪处理在一定时间段可使马铃薯甲虫成虫Ldα5的表达量明显增加。吡虫啉处理24 h, 成虫Ldα5的表达量有所增加, 48 h达到最高峰(表达量是对照的2.0倍), 至72 h恢复正常; 而噻虫嗪处理24 h就可使成虫Ldα5的表达量达到最高峰(7.3倍), 48 h、72 h其表达量逐步下降至正常水平, 这表明噻虫嗪对成虫Ldα5的胁迫效应更为快速和明显。结合其他研究报道, 推测吡虫啉和噻虫嗪结合了马铃薯甲虫特定的nAChR亚基, 从而可以影响这些基因的表达量, 表达量发生明显变化的基因可能在马铃薯甲虫对新烟碱类杀虫剂抗性的产生中发挥作用。已有的报道表明昆虫对新烟碱类杀虫剂及多杀菌素抗性的形成机制主要与nAChR亚基分子结构的突变、缺失、截短有关[31-34], 但显然nAChR亚基基因表达量的变化在一定程度上也影响着昆虫对杀虫剂抗性的形成, 相关研究有待进一步的深入开展。
致谢:
感谢新疆农业科学院植物保护研究所、新疆伊犁州农业技术推广总站植保站为本研究提供虫源。
| [1] | Millar N S, Denholm I. Nicotinic acetylcholine receptors:targets for commercially important insecticides[J]. Invert Neurosci, 2007, 7(1): 53-66. DOI: 10.1007/s10158-006-0040-0 |
| [2] | Jones A K, Brown L A, Sattelle D B. Insect nicotinic acetylcholine receptor gene families:from genetic model organism to vector, pest and beneficial species[J]. Invert Neurosci, 2007, 7(1): 67-73. DOI: 10.1007/s10158-006-0039-6 |
| [3] |
封云涛, 徐宝云, 吴青君, 等. 杀虫剂分子靶标烟碱型乙酰胆碱受体研究进展[J].
农药学学报, 2009, 11(2): 149-158.
Feng Y T, Xu B Y, Wu Q J, et al. Advances in the molecular target for insecticides of nicotinic acetylcholine receptors[J]. Chinese Journal of Pesticide Science, 2009, 11(2): 149-158. (in Chinese with English abstract) |
| [4] | Sattelle D B, Jones A K, Sattelle B M, et al. Edit, cut and paste in the nicotinic acetylcholine receptor gene family of Drosophila melanogaster[J]. BioEssays, 2005, 27(4): 366-376. DOI: 10.1002/(ISSN)1521-1878 |
| [5] | Shao Y M, Dong K, Zhang C X. The nicotinic acetylcholine receptor gene family of the silkworm, Bombyx mori[J]. BMC Genomics, 2007, 8: 324. DOI: 10.1186/1471-2164-8-324 |
| [6] | Jones A K, Sattelle D B. The cys-loop ligand-gated ion channel gene superfamily of the red flour beetle, Tribolium castaneum[J]. BMC Genomics, 2007, 8: 327. DOI: 10.1186/1471-2164-8-327 |
| [7] | Li J, Shao Y, Ding Z P, et al. Native subunit composition of two insect nicotinic receptor subtypes with differing affinities for the insecticide imidacloprid[J]. Insect Biochemistry and Molecular Biology, 2010, 40(1): 17-22. |
| [8] | Lansdell S J, Collins T, Goodchild J, et al. The Drosophila nicotinic acetylcholine receptor subunits Dα5 and Dα7 from functional homomeric and heteromeric ion channels[J]. BMC Neuroscience, 2012, 13: 73. DOI: 10.1186/1471-2202-13-73 |
| [9] |
郭文超, 吐尔逊, 许建军, 等. 马铃薯甲虫识别及其在新疆的分布、传播和危害[J].
新疆农业科学, 2010, 47(5): 906-909.
Guo W C, Tu erxun, Xu J J, et al. Research on the identification of Colorado potato beetle and its distribution dispersal and damage in Xinjiang[J]. Xinjiang Agricultural Sciences, 2010, 47(5): 906-909. DOI: 10.6048/j.issn.1001-4330.2010.05.012 (in Chinese with English abstract) |
| [10] | Caprio M A, Grafius E J. Effects of light, temperature and feeding status on flight initiation in postdiapause Colorado potato beetles(Coleoptera:Chrysomelidae)[J]. Environmental Entomology, 1990, 19(2): 281-285. DOI: 10.1093/ee/19.2.281 |
| [11] |
郭文超, 邓春生, 李国清, 等. 我国马铃薯甲虫生物防治技术研究进展[J].
新疆农业科学, 2011, 48(12): 2217-2222.
Guo W C, Deng C S, Li G Q, et al. Progress in biological control techniques of Colorado potato beetle in China[J]. Xinjiang Agricultural Sciences, 2011, 48(12): 2217-2222. DOI: 10.6048/j.issn.1001-4330.2011.12.010 (in Chinese with English abstract) |
| [12] |
郭文超, 吐尔逊, 程登发, 等. 我国马铃薯甲虫主要生物学、生态学技术研究进展及监测与防控对策[J].
植物保护, 2014, 40(1): 1-11.
Guo W C, Tu erxun, Cheng D F, et al. Main progress on biology and ecology of Colorado potato beetle and countermeasures of its monitoring and controlling in China[J]. Plant Protection, 2014, 40(1): 1-11. (in Chinese with English abstract) |
| [13] | Zhao J Z, Bishop B A, Grafius E J. Inheritance and synergism of resistance to imidacloprid in the Colorado potato beetle(Coleoptera:Chrysomelidae)[J]. Journal of Economic Entomology, 2000, 93(5): 1508-1514. DOI: 10.1603/0022-0493-93.5.1508 |
| [14] | Mota-Sanchez D, Hollingworth R M, Grafius E J, et al. Resistance and cross-resistance to neonicotinoid insecticides and spinosad in the Colorado potato beetle, Leptinotarsa decemlineata(Say)(Coleoptera:Chrysomelidae)[J]. Pest Management Science, 2006, 62(1): 30-37. DOI: 10.1002/(ISSN)1526-4998 |
| [15] | Jiang W H, Wang Z T, Xiong M H, et al. Insecticide resistance status of Colorado potato beetle(Coleoptera:Chrysomelidae)adults in northern Xinjiang Uygur autonomous region[J]. Journal of Economic Entomology, 2010, 103(4): 1365-1371. DOI: 10.1603/EC10031 |
| [16] |
李晨歌, 琚阳, 韩召军, 等. 马铃薯甲虫3个烟碱型乙酰胆碱受体α亚基基因的克隆及表达分析[J].
南京农业大学学报, 2014, 37(3): 65-71.
Li C G, Ju Y, Han Z J, et al. Cloning and expression analysis of three genes encoding nicotinic acetylcholine receptor α subunit in Leptinotarsa decemlineata[J]. Journal of Nanjing Agricultural University, 2014, 37(3): 65-71. DOI: 10.7685/j.issn.1000-2030.2014.03.009 (in Chinese with English abstract) |
| [17] | Qu Y, Chen J H, Li C G, et al. The subunit gene Ldα1 of nicotinic acetylcholine receptors plays important roles in the toxicity of imidacloprid and thiamethoxam against Leptinotarsa decemlineata[J]. Pesticide Biochemistry and Physiology, 2016, 127(2): 51-58. |
| [18] |
卢伟平, 刘萍, 姜卫华, 等. 4种新烟碱类杀虫剂对马铃薯甲虫的触杀毒力比较[J].
农药, 2011, 50(2): 137-140.
Lu W P, Liu P, Jiang W H, et al. Comparison of contact toxicities of 4 neonicotinoids against Leptinotarsa decemlineata[J]. Agrochemicals, 2011, 50(2): 137-140. (in Chinese with English abstract) |
| [19] |
刘萍, 姜卫华, 卢伟平, 等. 新疆北疆马铃薯甲虫成虫对新烟碱类杀虫剂的敏感性变化[J].
农药学学报, 2011, 13(3): 271-275.
Liu P, Jiang W H, Lu W P, et al. Susceptibility of Colorado potato beetle Leptinotarsa decemlineata adults from northern Xinjiang Uygur autonomous region to 4 neonicotinoids[J]. Chinese Journal of Pesticide Science, 2011, 13(3): 271-275. (in Chinese with English abstract) |
| [20] | Shi X Q, Guo W C, Wan P J, et al. Validation of reference genes for expression analysis by quantitative real-time PCR in Leptinotarsa decemlineata(Say)[J]. BMC Research Notes, 2013, 6: 93. DOI: 10.1186/1756-0500-6-93 |
| [21] |
杨文佳, 丛林, 谢逸菲, 等. 桔小实蝇烟碱型乙酰胆碱受体β亚基基因的克隆及mRNA表达分析[J].
应用昆虫学报, 2012, 49(2): 335-341.
Yang W J, Cong L, Xie Y F, et al. Cloning and mRNA expression analysis of the nicotinic acetylcholine receptor β subunit in Bactrocera dorsalis[J]. Chinese Journal of Applied Entomology, 2012, 49(2): 335-341. DOI: 10.7679/j.issn.2095-1353.2012.045 (in Chinese with English abstract) |
| [22] |
袁国瑞, 杨文佳, 许抗抗, 等. 橘小实蝇nAChR α9亚基基因的鉴定及其时空表达[J].
昆虫学报, 2016, 59(11): 1189-1198.
Yuan G R, Yang W J, Xu K K, et al. Identification and expression profiling of nicotinic acetylcholine receptor α9 subunit gene in Bactrocera dorsalis(Diptera:Tephritidae)[J]. Acta Entomologica Sinica, 2016, 59(11): 1189-1198. (in Chinese with English abstract) |
| [23] | Yu X L, Wang M, Kang M J, et al. Molecular cloning and characterization of two nicotinic acetylcholine receptor β subunit genes from Apis cerana cerana[J]. Archives of Insect Biochemistry and Physiology, 2011, 77(4): 163-178. DOI: 10.1002/arch.20432 |
| [24] | Martin J A, Garczynski S F. Putative nicotinic acetylcholine receptor subunits express differentially through the life cycle of codling moth, Cydia pomonella(Lepidoptera:Tortricidae)[J]. Insect Science, 2016, 23(2): 277-287. DOI: 10.1111/ins.2016.23.issue-2 |
| [25] |
赵宇, 杨亦桦, 武淑文, 等. 小菜蛾烟碱型乙酰胆碱受体α亚基cDNA的克隆、序列分析与不同发育阶段表达分析[J].
昆虫学报, 2009, 52(1): 17-26.
Zhao Y, Yang Y H, Wu S W, et al. Cloning seqCloning sequence analysis and developmental expression of a cDNA encoding nicotinic acetylcholine receptors α subunit from Plutella xylostella(L.)(Lepidoptera:plutellidae)[J]. Acta Entomologica Sinica, 2009, 52(1): 17-26. DOI: 10.7679/j.issn.2095-1353.2009.003 (in Chinese with English abstract) |
| [26] | Xu G, Wu S F, Teng Z W, et al. Molecular characterization and expression profiles of nicotinic acetylcholine receptors in the rice striped stem borer, Chilo suppressalis(Lepidoptera:Crambidae)[J]. Insect Science, 2017, 24(3): 371-384. DOI: 10.1111/ins.2017.24.issue-3 |
| [27] | Markussen M D, Kristensen M. Low expression of nicotinic acetylcholine receptor subunit Mdα2 in neonicotinoid resistant strains of Musca domestica L.[J]. Pest Management Science, 2010, 66(11): 1257-1262. DOI: 10.1002/ps.v66:11 |
| [28] | Chen X W, Li F, Chen A Q, et al. Both point mutations and low expression levels of the nicotinic acetylcholine receptor β1 subunit are associated with imidacloprid resistance in an Aphis gossypii(Glover)population from a Bt cotton field in China[J]. Pesticide Biochemistry and Physiology, 2017, 141(9): 1-8. |
| [29] | Zhang Y X, Wang X, Yang B J, et al. Reduction in mRNA and protein expression of a nicotinic acetylcholine receptor α8 subunit is associated with resistance to imidacloprid in the brown planthopper, Nilaparvata lugens[J]. Journal of Neurochemistry, 2015, 135(4): 686-694. DOI: 10.1111/jnc.2015.135.issue-4 |
| [30] | Taillebois E, Beloula A, Quinchard S, et al. Neonicotinoid binding, toxicity and expression of nicotinic acetylcholine receptor subunits in the aphid Acyrthosiphon pisum[J]. PLoS ONE, 2014, 9(5): e96669. DOI: 10.1371/journal.pone.0096669 |
| [31] | Liu Z W, Williamson M S, Lansdell S J, et al. A nicotinic acetylcholine receptor mutation conferring target-site resistance to imidacloprid in Nilaparvata lugens(brown planthopper)[J]. Proc Natl Acad Sci USA, 2005, 102(24): 8420-8425. DOI: 10.1073/pnas.0502901102 |
| [32] | Bass C, Puinean A M, Andrews M, et al. Mutation of a nicotinic acetylcholine receptor β subunit is associated with resistance to neonicotinoid insecticides in the aphid Myzus persicae[J]. BMC Neuroscience, 2011, 12: 51. DOI: 10.1186/1471-2202-12-51 |
| [33] | Puinean A M, Lansdell S J, Collins T, et al. A nicotinic acetylcholine receptor transmembrane point mutation(G275E)associated with resistance to spinosad in Frankliniella occidentalis[J]. Journal of Neurochemistry, 2013, 124(5): 590-601. DOI: 10.1111/jnc.2013.124.issue-5 |
| [34] | Perry T, McKenzie J A, Batterham P. A Dα6 knockout strain of Drosophila melanogaster confers a high level of resistance to spinosad[J]. Insect Biochemistry and Molecular Biology, 2007, 37(2): 184-188. DOI: 10.1016/j.ibmb.2006.11.009 |




