文章信息
- 曾丹丹, 戎振洋, 袁咏天, 王晓莉, 郑小波
- ZENG Dandan, RONG Zhenyang, YUAN Yongtian, WANG Xiaoli, ZHENG Xiaobo
- LAMP快速诊断由拟轮枝镰孢引起的水稻恶苗病
- Rapid diagnosis of rice bakanae disease caused by Fusarium verticillioides using a loop-mediated isothermal amplification assay
- 南京农业大学学报, 2018, 41(2): 286-292
- Journal of Nanjing Agricultural University, 2018, 41(2): 286-292.
- http://dx.doi.org/10.7685/jnau.201705023
-
文章历史
- 收稿日期: 2017-05-16
拟轮枝镰孢[Fusariumverticillioides(Sacc.)Nirenberg]是水稻恶苗病的重要病原菌。它的有性态是串珠赤霉(Gibberella moniliformis), 属于藤仓赤霉复合种(G.fujikuroi species complex, GFC)。该菌可引起多种作物的严重病害, 可以引起玉米幼苗、茎、穗、籽粒病害[1]; 是西南地区引起玉米穗腐病的主要病原真菌[2-3]; 也可以引起骏枣黑点病[4]; 还能为害香蕉[5]、高粱[6]等。另外, 该病原菌在定殖过程中会产生一些结构相关的聚酮毒素, 其中B1型伏马菌素(FB1)是最主要的伏马菌素类型, 可导致马的脑白质软化症以及猪的肺水肿, 还会引起人类疾病如癌症和先天性畸形等[7]。
水稻恶苗病的发生遍及亚洲和其他的水稻产区, 该病最明显的症状是感染的水稻幼苗黄化和徒长, 成株的根、冠、茎、叶鞘和穗也会受到感染。水稻恶苗病是种传病害, 并且主要是通过种子调运而传播的[8-9]。目前的研究表明, 水稻恶苗病是拟轮枝镰孢(F.verticillioides)、藤仓镰孢(F.fujikuroi)、层出镰孢(F.proliferatum)和F.andiyazi[10]导致的。其中, 拟轮枝镰孢、藤仓镰孢、层出镰孢都属于GFC复合种。到目前为止, GFC复合种至少由10个不同的交配型群体(A~J)组成[11-12], 拟轮枝镰孢属于交配型群体A, 藤仓镰孢属于交配型群体C, 层出镰孢属于交配型群体[13-14]。GFC复合种内成员形态特征非常相似, 难以区分, 如藤仓镰孢和层出镰孢, 仅采用形态分类学方法常导致鉴定错误[15]。过去已有的水稻恶苗病诊断方法包括病原菌分离鉴定和基于PCR的分子检测, 这些技术或所需诊断时间长, 或诊断结果准确度低。因此, 有必要建立快速诊断由拟轮枝镰孢引起的水稻恶苗病的新技术。
环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)是由日本荣研株式会社的Notomi等[16]研发的。该技术的特点是设计4条特异性引物, 包括正向外引物、正向内引物、反向外引物和反向内引物, 对应于6个区域的靶基因序列; 它可以在恒定温度扩增目标基因(60~65 ℃), 这是由于链置换DNA聚合酶(即Bst DNA polymerase)的作用; 30~80 min便可观测结果, 具有操作简单、特异性强、灵敏度高、产物易检测等特点[17]。由于反应前在反应管内加入了羟基萘酚蓝(HNB), 反应结束后可对结果进行直接的判定。阳性呈天蓝色, 阴性则仍然为紫色[18],
本研究将3-磷酸甘油酸激酶(3-phosphoglyceric phosphokinase)基因Pgk作为靶标, 建立了拟轮枝镰孢的LAMP检测技术。通过直接检测田间疑似病害样本病组织中的拟轮枝镰孢, 可以快速诊断由拟轮枝镰孢引起的水稻恶苗病。
1 材料与方法 1.1 供试菌株拟轮枝镰孢标准菌株(ATCC MYA-4922)购自美国模式培养物保藏所(ATCC)。所有供试菌株(表 2)经过形态学观察和ITS(内转录间隔区)、TEF-1α(翻译延伸因子)序列比对鉴定, 保存在南京农业大学植物保护学院卵菌与真菌分子生物学实验室。
| 种名 Species | 寄主 Host | 来源 Origin | 菌株数量 No.of strain |
检测结果 Results |
| 拟轮枝镰孢 F.verticillioides | 玉米 Maize | America (ATCC MYA-4922) |
1 | + |
| 水稻 Rice | 江苏 Jiangsu | 4 | + | |
| 大豆 Soybean | 山东 Shandong | 1 | + | |
| 大豆 Soybean | 江苏 Jiangsu | 1 | + | |
| 大豆 Soybean | 安徽 Anhui | 1 | + | |
| 藤仓镰孢 F.fujikuroi | 水稻 Rice | 江苏 Jiangsu | 2 | - |
| 大豆 Soybean | 山东 Shandong | 1 | - | |
| 层出镰孢 F.proliferatum | 水稻 Rice | 江苏 Jiangsu | 2 | - |
| 大豆 Soybean | 山东 Shandong | 1 | - | |
| F.andiyazi | 水稻 Rice | 江苏 Jiangsu | 1 | - |
| 尖镰孢 F.oxysporum | 大豆 Soybean | 湖北 Hubei | 1 | - |
| 木贼镰孢 F.equiseti | 大豆 Soybean | 安徽 Anhui | 5 | - |
| 禾谷镰孢 F.graminearum | 小麦 Wheat | 江苏 Jiangsu | 1 | - |
| 茄腐镰孢 F.solani | 大豆 Soybean | 安徽 Anhui | 1 | - |
| 黄色镰孢 F.culmorum | 大麦 Barley | Denmark (CBS 417.86) | 1 | - |
| 燕麦镰孢 F.avenaceum | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 厚垣镰孢 F.chlamydosporum | 大豆 Soybean | 北京 Beijing | 1 | - |
| 三线镰孢 F.tricinctum | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 长足镰孢 F.longipes | 大豆 Soybean | 山东 Shandong | 1 | - |
| 甘蔗镰孢 F.sacchari | 大豆 Soybean | 山东 Shandong | 1 | - |
| 变红镰孢 F.incarnatum | 大豆 Soybean | 山东 Shandong | 1 | - |
| 锐顶镰孢 F.acuminatum | 大豆 Soybean | 北京 Beijing | 1 | - |
| 稻瘟病菌 Magnaporthe grisea | 水稻 Rice | 江苏 Jiangsu | 1 | - |
| 平头炭疽 Colletotrichum truncatum | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 胶孢炭疽 C.gloeosporioides | 大豆 Soybean | 山东 Shandong | 1 | - |
| 多主棒孢 Corynespora cassiicola | 大豆 Soybean | 未知 Unknown | 1 | - |
| 大豆炭腐病菌 Macrophomina phaseolina | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 大豆紫斑病菌 Cercospora kikuchii | 大豆 Soybean | 湖北 Hubei | 1 | - |
| 立枯丝核 Rhizoctonia solani | 大豆 Soybean | 安徽 Anhui | 1 | - |
| 冬青丽赤壳 Calonectria ilicicola | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 玉蜀黍平脐蠕孢 Bipolaris maydis | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 米曲霉 Aspergillus oryzae | 大豆 Soybean | 美国 America | 1 | - |
| 大豆北方茎溃疡病菌 Diaporthe phaseolorum var. caulivora | 大豆 Soybean | 未知 Unknown | 1 | - |
| 大豆南方茎溃疡病菌 Diaporthe phaseolorum var. meridionalis | 大豆 Soybean | 未知 Unknown | 1 | - |
| 大豆茎褐腐病菌 Phialophora gregata f.sp. sojoae | 大豆 Soybean | 未知 Unknown | 1 | - |
| 大豆拟茎点种腐病菌 Phomopsis longicolla | 大豆 Soybean | 湖北 Hubei | 1 | - |
| 大豆疫霉 Phytophthora sojae | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 瓜果腐霉 Pythium aphanidermatum | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 终极腐霉 P.ultimum | 大豆 Soybean | 江苏 Jiangsu | 1 | - |
| 大丽轮枝 Verticillium dahliae | 棉花 Cotton | 江苏 Jiangsu | 1 | - |
将供试腐霉和疫霉转接到V8固体培养基平板上[19], 其他菌株转接到PDA(马铃薯葡萄糖固体培养基)平板上, 25 ℃黑暗条件下培养3 d后, 在菌落边缘切取10个菌丝块(2 mm×2 mm)。腐霉和疫霉菌丝块转移至V8液体培养基, 其他菌株菌丝块转移至PDB(马铃薯葡萄糖液体培养基)[20], 25 ℃培养5~7 d, 过滤PDB液体后收集菌丝, 并经灭菌滤纸吸干后液氮冷冻研磨成菌丝粉, -70 ℃冰箱保存备用。运用CTAB法提取菌丝DNA[21], 并保存于-20 ℃。采用Nanodrop 2000分光光度计测定DNA浓度。
1.3 引物设计与筛选选择合适的靶标基因是建立具有种间特异性的LAMP检测技术的关键环节。首先查找相关文献选取TEF-1α(translation elongation factor 1 alpha)基因、RPB1 (RNA polymerase Ⅱ subunit 1)基因及Pgk基因等一系列潜在靶标。在NCBI网站查找并下载拟轮枝镰孢及其相近种的靶标序列, 然后使用BioEdit软件进行序列比对, 对各个靶标依次比对筛选。在序列比对分析时, 我们发现Pgk基因在拟轮枝镰孢种内的不同菌株间高度保守, 在镰孢菌种间有明显差异, 因此将Pgk基因作为检测拟轮枝镰孢的首要备选靶标。在拟轮枝镰孢的Pgk序列中选取一段特异序列(300~400 bp)作为目标序列, 用Primer Explore V4软件在线设计引物。根据引物长度、引物自由能及GC含量等, 从软件设计的多组引物中选取部分进行筛选。我们对种内不同来源的菌株进行通用性试验, 与属内相近种以及属间多种病原菌进行特异性试验, 最终筛选出一组通用性好、特异性强、灵敏度高、能快速准确地检测拟轮枝镰孢的引物(表 1)。引物由金斯瑞公司合成后用ddH2O溶解。
| 引物名称 Primer name |
引物序列(5′→3′) Primer sequence |
长度/bp Length |
| F3(forward outer primer) | CCCACGCTACATGATGCTAA | 20 |
| B3(backward outer primer) | GATCTTGTCGGAGACCTTGG | 20 |
| FIP(forward inner primer)(F1c+F2) | GAAACCGGAGGCCTTCTGGGCTTTCGGCACTGCTCACC | 38 |
| BIP(backward inner primer)(B1c+B2) | GAAGGAGCTCGAGTACTTCGCCAGGATGGCGAGGAAAGGA | 40 |
| LF(loop forward primer) | AGGTCGACACCGACCATG | 18 |
| LB(loop backward primer) | AAGGCTCTCGAGGAGCCCAAG | 21 |
本研究使用的LAMP反应体系(26 μL)为:2.5 μL 10×ThermoPol Buffer[0.1% Triton-X, 20mml· L-1 Tris-HCl, 10 mmol·L-1 KCl, 10 mmol·L-1(NH4)2SO4, pH8.8], 4 μL MgSO4(50 mmol·L-1), 4 μL甜菜碱(5 mol·L-1), 3.5 μL dNTPs(10 mmol·L-1), FIP和BIP引物(20 μmol·L-1)各2 μL, F3和B3引物(10 μmol·L-1)各0.5 μL, LF和LB引物(10 μmol·L-1)各1 μL, 2 μL HNB(2.4 mmol·L-1), 1 μL Bst DNA聚合酶(8 U·μL-1), 2 μL模板DNA。62 ℃恒温反应70 min。每次反应设置阳性对照(标准拟轮枝镰孢DNA作为模板)和阴性对照(ddH2O作为模板), 试验至少重复3次。以HNB为反应指示剂, 反应后肉眼观测反应管颜色变化判断结果, 阳性为天蓝色, 阴性为紫色。
1.5 特异性试验为了评价拟轮枝镰孢LAMP检测方法的特异性, 首先, 通过检测不同来源的拟轮枝镰孢菌株(表 2)基因组DNA来进行试验; 然后选择水稻上其他的病原菌, 其他寄主上的镰孢菌和非镰孢菌(表 2)的基因组DNA进行LAMP扩增。反应结束后观察颜色的变化, 判定LAMP反应的特异性。
1.6 灵敏度试验测定标准拟轮枝镰孢基因组DNA的浓度后, 进行10倍梯度浓度稀释, 获得质量浓度分别为10 ng·μL-1、1 ng·μL-1、100 pg·μL-1、10 pg·μL-1、1 pg·μL-1和100 fg·μL-1的拟轮枝镰孢基因组DNA, 进行LAMP扩增。反应结束后观察颜色的变化, 确定拟轮枝镰孢LAMP检测体系的灵敏度。
1.7 人工接种水稻发病组织中拟轮枝镰孢的检测将水稻种子催芽后播种于装满蛭石和营养土的塑料盆中, 在25 ℃温室中生长20 d。取培养3~5 d的拟轮枝镰孢, 切取5 mm×5 mm的菌丝块接种水稻下胚轴, 继续置于25 ℃温室培养5 d。取病组织200 mg, 使用天根生化(北京)公司的新型植物组织提取基因组试剂盒(离心柱型), 按照说明书的方法提取病组织DNA。将提取的病组织DNA作为模板用于LAMP扩增, 同时提取接种空白PDA的健康植株组织DNA作为对照。
1.8 水稻恶苗病样本中拟轮枝镰孢的检测为了验证所建立的拟轮枝镰孢LAMP检测技术诊断由该病原菌所致水稻恶苗病的可行性, 于2016年从江苏南京和镇江采集疑似水稻恶苗病样本, 选取典型发病部位, 清洗晾干, 使用DNAsecure Plant Kit提取病组织DNA, 将其作为模板用于LAMP扩增, 并以标准拟轮枝镰孢菌株DNA作为阳性对照, ddH2O作为阴性对照。
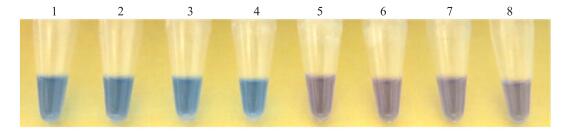
2 结果与分析 2.1 拟轮枝镰孢LAMP(FvPgk-LAMP)检测的特异性以拟轮枝镰孢标准菌株DNA为阳性对照, 以ddH2O代替DNA为阴性对照, 检测了不同来源的拟轮枝镰孢菌株, 结果(图 1、表 2)显示所有菌株均呈阳性反应。这表明本研究所建立的LAMP检测技术可以用于检测不同来源的拟轮枝镰孢。

|
图 1 LAMP检测不同来源的拟轮枝镰孢 Figure 1 Specificity of the LAMP assay using F.verticillioides strains from various origins 1.阳性对照Positive control; 2~4.拟轮枝镰孢(水稻, 南京)F.verticillioides(rice, Nanjing, Jiangsu Province); 5~7.拟轮枝镰孢(水稻, 镇江)F.verticillioides(rice, Zhenjiang, Jiangsu Province); 8.拟轮枝镰孢(大豆, 南京)F.verticillioides(soybean, Nanjing, Jiangsu Province); 9.拟轮枝镰孢(大豆, 宿州)F.verticillioides(soybean, Suzhou, Anhui Province); 10.拟轮枝镰孢(大豆, 济宁)F.verticillioides(soybean, Jining, Shandong Province); 11.阴性对照Negative control. |
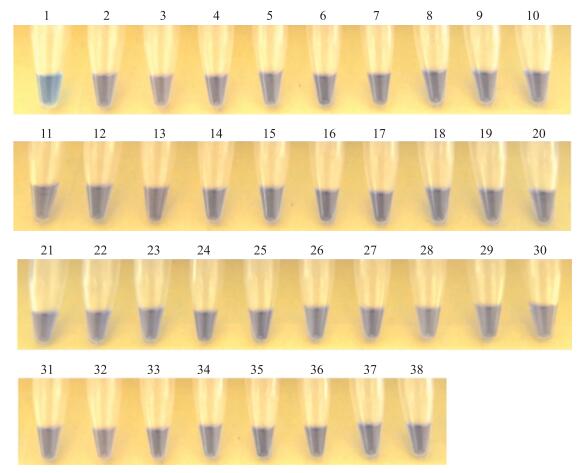
以拟轮枝镰孢标准菌株DNA作为阳性对照, 以ddH2O代替DNA作为阴性对照, 用镰孢菌近似种和其他非镰孢菌(表 2)的基因组DNA为模板进一步验证该检测技术的特异性。结果显示除阳性对照外均呈阴性反应, 表明建立的FvPgk-LAMP体系具有的特异性, 可以将拟轮枝镰孢与其他病原菌区分开来(表 2、图 2)。
|
图 2 LAMP检测其他病原菌的特异性 Figure 2 Specificity of the LAMP assay for other pathogens 1.阳性对照Positive control; 2~4.藤仓镰孢F.fujikuroi; 5~6.层出镰孢F.proliferatum; 7.F.andiyazi; 8.尖镰孢F.oxysporum; 9.木贼镰孢 F.equiseti; 10.禾谷镰孢 F.graminearum; 11.茄腐镰孢 F.solani; 12.黄色镰孢 F.culmorum; 13.燕麦镰孢 F.avenaceum; 14.厚垣镰孢 F.chlamydosporum; 15.三线镰孢 F.tricinctum; 16.长足镰孢 F.longipes; 17.甘蔗镰孢 F.sacchari; 18.变红镰孢 F.incarnatum; 19.锐顶镰孢 F.acuminatum; 20.稻瘟病菌 Magnaporthe grisea; 21.平头炭疽 Colletotrichum truncatum; 22.胶孢炭疽 C.gloeosporioide; 23.多主棒孢 Corynespora cassiicola; 24.大豆炭腐病菌 Macrophomina phaseolina; 25.大豆紫斑病菌 Cercospora kikuchii; 26.立枯丝核 Rhizoctonia solani; 27.冬青丽赤壳 Calonectria ilicicola; 28.玉蜀黍平脐蠕孢 Bipolaris maydis; 29.米曲霉 Aspergillus oryzae; 30.大豆南方茎溃疡病菌 Diaporthe phaseolorum var.caulivora; 31.大豆北方茎溃疡病菌 Diaporthe phaseolorum var.meridionalis; 32.大豆茎褐腐病菌 Phialophora gregata f.sp.sojae; 33.大豆拟茎点种腐病菌 Phomopsis longicolla; 34.大豆疫霉 Phytophthora sojae; 35.瓜果腐霉 Pythium aphanidermatum; 36.终极腐霉 P.ultimum; 37.大丽轮枝 Verticillium dahliae; 38.阴性对照Negative control. |
对拟轮枝镰孢基因组DNA进行10倍梯度稀释(从10 ng·μL-1到100 fg·μL-1), 以其作为模板进行LAMP扩增反应。结果如图 3所示:1号为阳性对照, 8号为阴性对照, 2~4号均呈阳性反应, 而5~7号呈阴性反应, 表明该检测体系的灵敏度为100 pg·μL-1。

|
图 3 LAMP体系的灵敏度 Figure 3 Sensitivity of LAMP assay using serially diluted genomic DNA from F.verticillioides 1.阳性对照Positive control; 2.10 ng·μL-1; 3.1 ng·μL-1; 4.100 pg·μL-1; 5.10 pg·μL-1; 6.1 pg·μL-1; 7.100 fg·μL-1; 8.阴性对照Negative control. |
提取接种发病的水稻病组织基因组DNA, 用LAMP技术进行检测, 结果如图 4显示:接种发病的水稻病组织样本均呈阳性, 而健康的水稻植株检测结果为阴性。这表明建立的LAMP检测体系可以从发病的水稻病组织中准确地检测出拟轮枝镰孢, 因而可以用于拟轮枝镰孢引起的水稻恶苗病的快速诊断。
|
图 4 FvPgk-LAMP检测水稻发病组织中的拟轮枝镰孢 Figure 4 Detection of F.verticillioides in inoculated rice by FvPgk-LAMP assay 1.阳性对照 Positive control; 2~4.接种拟轮枝镰孢的水稻病组织 DNA from inoculated tissues; 5~7.健康植物组织 DNA from healthy tissues; 8.阴性对照 Negative control. |
使用该技术对2016年从江苏南京和镇江采集的21份疑似水稻恶苗病样本进行检测, 其中10份样本检出拟轮枝镰孢。同时, 我们对所有21份样本进行分离, 并从10份阳性样本中的4份分离到拟轮枝镰孢, 而阴性样本未分离到该菌。结果表明, 本研究所建立的FvPgk-LAMP检测技术可以从田间采集的病组织中直接特异性地检测出拟轮枝镰孢, 从而可以用于由该病原菌引起的水稻恶苗病的诊断。与传统诊断方法相比, 此技术能够更加快速准确地得到诊断结果, 从发病组织DNA提取到获得LAMP检测结果只需2 h左右。
3 结论与讨论水稻恶苗病是重要的种传病害, 在国内外均有发生, 我国许多稻区发病尤为普遍。水稻恶苗病常导致谷粒播后不发芽或不出土, 这造成了水稻严重减产[22-24]。常见的症状是水稻苗徒长, 但也有部分病株呈现矮化或外观正常, 这为水稻恶苗病的诊断带来了极大的困难。目前, 关于水稻恶苗病病原菌的研究大都集中于传统的分离鉴定技术[25-26], 但分离方法不易得到全部的病原菌, 而且耗时费力。分子鉴定技术主要是PCR-RFLP鉴定, Steenkamp等[27]基于H3基因建立了Fusarium circinatum(属于GFC复合种交配型群体H)的PCR-RFLP鉴定方法, 该方法可以区分几乎所有GFC复合种交配型群体A~H的物种, 但是无法区别藤仓镰孢菌和层出镰孢菌。Suga等[28]基于TEF基因建立了藤仓镰孢菌(F.fujikuroi)的PCR-RFLP鉴定方法, 可以与GFC复合种的其他物种进行区分。然而, 这种检测方法存在需要热循环、特异性不足、扩增效率较低等缺陷[17]。本研究建立的LAMP技术体系有以下优点:对模板DNA的纯度要求较低, 可以从田间样本病组织的混合DNA中检测到目标菌; 反应更快速, 2 h左右即可完成病害诊断; 反应结果更容易判别, 由于HNB的加入, 反应后可通过肉眼观察颜色变化直接判别结果。
近年来, 操作简单、特异性强、灵敏度高、结果易判别的优势使得LAMP方法被广泛应用到多个领域, 如细菌、病毒、寄生虫的检测, 还被用于真菌和卵菌的鉴定。戴婷婷等[29]建立了橡树疫霉(P.ramorum)的LAMP检测技术; 陆辰晨[30]基于CYP51C基因建立了可以分别特异性检测引起大豆镰孢根腐病的尖镰孢(F.oxysporum)、木贼镰孢(F.equiseti)、禾谷镰孢(F.graminearum)的3个LAMP技术体系, 基于TEF-1α基因建立了茄腐镰孢(F.solani)和层出镰孢(F.proliferatum)的2个LAMP技术体系, 还基于ITS基因建立了检测导致大豆立枯病的立枯丝核(Rhizoctonia solani)与导致大豆炭腐病的菜豆壳球孢(Macrophomina phaseolina)的2个LAMP技术体系; 曾丹丹等[31]还将环介导等温扩增技术应用于大豆种子带菌的检测。将LAMP应用于真菌和卵菌的检测, 设备简单、反应时间短、结果易判定, 特别适用于在检验检疫机构和基层农业科研与管理单位使用。
本研究以Pgk基因作为靶标, 设计并筛选出一组特异性引物, 建立了从水稻组织中直接鉴定拟轮枝镰孢的FvPgk-LAMP检测技术, 为从发病水稻样本检测拟轮枝镰孢, 进而快速诊断由拟轮枝镰孢引起的水稻恶苗病提供了一种有效的方法。该技术已被成功应用于中国江苏南京和镇江疑似水稻恶苗病的快速诊断。
| [1] | Oren L, Ezrati S, Cohen D, et al. Early events in the Fusarium verticillioides-maize interaction characterized by using a green fluorescent protein-expressing transgenic isolate[J]. Applied and Environmental Microbiology, 2003, 69(3): 1695-1701. DOI: 10.1128/AEM.69.3.1695-1701.2003 |
| [2] |
陈晓娟, 文成敬. 四川省玉米穗腐病研究初报[J].
西南农业大学学报, 2002, 24(1): 21-23.
Chen X J, Wen C J. Preliminary study of maize ear rot in Sichuan[J]. Journal of Southwest Agricultural University, 2002, 24(1): 21-23. (in Chinese with English abstract) |
| [3] |
张小飞, 邹成佳, 李晓, 等. 西南地区玉米穗腐病病原分离鉴定及接种方法研究[J].
西南农业大学学报, 2012, 25(6): 2078-2082.
Zhang X F, Zou C J, Li X, et al. Identification of pathogen causing maize ear rot and inoculation technique in southwest China[J]. Journal of Southwest Agricultural University, 2012, 25(6): 2078-2082. (in Chinese with English abstract) |
| [4] |
陈小飞, 熊仁次, 王兰, 等. 新疆首次报道轮枝镰孢菌引起骏枣果实黑点病[J].
植物病理学报, 2014, 44(6): 709-712.
Chen X F, Xiong R C, Wang L, et al. First report of black spot disease on fruit of Jun jujube caused by Fusarium verticillioides in Xinjiang[J]. Acta Phytopathologica Sinica, 2014, 44(6): 709-712. (in Chinese with English abstract) |
| [5] | Jiménez M, Logrieco A, Bottalico A. Occurrence and pathogenicity of Fusarium species in banana fruits[J]. Journal of Phytopathology, 1993, 137(3): 214-220. DOI: 10.1111/j.1439-0434.1993.tb01341.x |
| [6] | Frederiksen R A, Odvody G N. Compendium of Sorghum Diseases[M]. 2nd ed. St.Paul, Minn: APS Press, 2000. |
| [7] | Hendricks K. Fumonisins and neural tube defects in South Texas[J]. Epidemiology, 1999, 10(2): 198-200. DOI: 10.1097/00001648-199903000-00022 |
| [8] | Sun S K, Snyder W C. The bakanae disease of the rice plant[M]. Nelson P E, Toussoun T A, Cook R J. Fusarium: Diseases, Biology and Taxonomy. University Park: The Pennsylvania University Press, 1981: 104-113. |
| [9] | Webster R K, Gunnell P S. Compendium of Rice Diseases[M]. St.Paul, Minn: The American Phytopathological Society Press, 1992. |
| [10] | Wulff E G, Sørensen J L, Lübeck M, et al. Fusarium spp.associated with rice Bakanae:ecology, genetic diversity, pathogenicity and toxigenicity[J]. Environmental Microbiology, 2010, 12(3): 649-657. DOI: 10.1111/emi.2010.12.issue-3 |
| [11] | Leslie J F, Anderson L, Bowden R L, et al. Inter-and intra-specific genetic variation in Fusarium[J]. International Journal of Food Microbiology, 2007, 119: 25-32. DOI: 10.1016/j.ijfoodmicro.2007.07.059 |
| [12] | Kvas M, Marasas W F O, Wingfield B D, et al. Diversity and evolution of Fusarium species in the Gibberella fujikuroi complex[J]. Fungal Diversity, 2009, 34(2): 1-21. |
| [13] | Amoah B K, Rezanoor H N, Nicholson P, et al. Variation in the Fusarium section Liseola:pathogenicity and genetic studies of isolates of Fusarium moniliforme Sheldon from different hosts in Ghana[J]. Plant Pathology, 1995, 44(3): 563-572. DOI: 10.1111/ppa.1995.44.issue-3 |
| [14] | Desjardins A E, Manandhar H K, Plattner R D, et al. Fusarium species from nepalese rice and production of mycotoxins and gibberellic acid by selected species[J]. Applied and Environmental Microbiology, 2000, 66(3): 1020-1025. DOI: 10.1128/AEM.66.3.1020-1025.2000 |
| [15] | Heng M H, Salleh B, Zakaria L. Molecular identification of Fusarium species in Gibberella fujikuroi species complex from rice, sugarcane and maize from Peninsular Malaysia[J]. International Journal of Molecular Sciences, 2011, 12(10): 6722-6732. DOI: 10.3390/ijms12106722 |
| [16] | Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): e6. |
| [17] | Mori Y, Nagamine K, Tomita N, et al. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochemical and Biophysical Research Communications, 2001, 289(1): 150-154. DOI: 10.1006/bbrc.2001.5921 |
| [18] | Goto M, Honda E, Ogura A, et al. Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxy naphthol blue[J]. Biotechniques, 2009, 46(3): 167-172. DOI: 10.2144/000113072 |
| [19] |
郑小波.
疫霉菌及其研究技术[M]. 北京: 中国农业出版社, 1997.
Zheng X B. Phytophthora spp.and Its Research Technique[M]. Beijing: Chinese Agriculture Press, 1997. (in Chinese with English abstract) |
| [20] | Erwin D C, Ribeiro O K. Phytophthora diseases worldwide[J]. Plant Pathology, 1998, 47(2): 224-226. |
| [21] | Sikora K, Verstappen E, Mendes O, et al. A universal microarray detection method for identification of multiple Phytophthora spp.using padlock probes[J]. Phytopathology, 2012, 102(6): 635-645. DOI: 10.1094/PHYTO-11-11-0309 |
| [22] |
陈利锋, 徐敬友.
农业植物病理学[M]. 北京: 中国农业出版社, 2007.
Chen L F, Xu J Y. Agricultural Phytopathology[M]. Beijing: Chinese Agriculture Press, 2007. (in Chinese with English abstract) |
| [23] |
季芝娟, 马良勇, 李西明, 等. 水稻品种恶苗病抗性快速鉴定方法研究[J].
浙江农业科学, 2008, 1(1): 89-91.
Ji Z J, Ma L Y, Li X M, et al. Study on rapid identification of rice bakanae disease resistant varieties[J]. Journal of Zhejiang Agricultural Sciences, 2008, 1(1): 89-91. (in Chinese with English abstract) |
| [24] |
赵淑元, 产祝龙, 丁克坚. 水稻恶苗病对使百克、多菌灵的抗性遗传研究[J].
安徽农业大学学报, 2008, 35(1): 46-48.
Zhao S Y, Chan Z L, Ding K J. The resistant inheritance of Fusarium monilifore to prochloraz and cabendazim[J]. Journal of Anhui Agricultural University, 2008, 35(1): 46-48. (in Chinese with English abstract) |
| [25] |
王拱辰, 陈鸿逵, 徐沛生, 等. 水稻恶苗病病原菌的研究[J].
植物病理学报, 1990(2): 93-97.
Wang G C, Chen H K, Xu P S, et al. Study on the pathogens of rice bakanae disease[J]. Acta Phytopathologica Sinica, 1990(2): 93-97. (in Chinese with English abstract) |
| [26] |
陈夕军, 卢国新, 童蕴慧, 等. 江苏水稻恶苗病病原菌研究[J].
扬州大学学报(农业与生命科学版), 2008, 29(3): 88-90.
Chen X J, Lu G X, Tong Y H, et al. Study on the pathogens of rice bakanae disease in Jiangsu[J]. Journal of Yangzhou University(Agricultural and Life Science Edition), 2008, 29(3): 88-90. (in Chinese with English abstract) |
| [27] | Steenkamp E T, Wingfield B D, Coutinho T A, et al. Differentiation of Fusarium subglutinans f.sp.pini by histone gene sequence data[J]. Applied & Environmental Microbiology, 1999, 65(8): 3401-3406. |
| [28] | Suga H, Kitajima M, Nagumo R, et al. A single nucleotide polymorphism in the translation elongation factor 1α gene correlates with the ability to produce fumonisin in Japanese Fusarium fujikuroi[J]. Fungal Biology, 2014, 118(4): 402-412. DOI: 10.1016/j.funbio.2014.02.005 |
| [29] |
戴婷婷, 陆辰晨, 王源超, 等. 基于环介导等温扩增技术检测橡树疫霉[J].
南京农业大学学报, 2013, 36(3): 23-28.
Dai T T, Lu C C, Wang Y C, et al. Rapid diagnostic methods for Phytophthora ramorum using LAMP[J]. Journal of Nanjing Agricultural University, 2013, 36(3): 23-28. DOI: 10.7685/j.issn.1000-2030.2013.03.004 (in Chinese with English abstract) |
| [30] |
陆辰晨. 基于环介导等温扩增技术快速诊断大豆根部主要病害的研究[D]. 南京: 南京农业大学, 2015.
Lu C C. Rapid diagnosis of soybean root diseases based on loop-mediated isotheral amplication(LAMP)[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). |
| [31] |
曾丹丹, 张海峰, 田擎, 等. 基于环介导等温扩增技术检测黄淮地区大豆主栽品种种子携带的病原菌[J].
南京农业大学学报, 2016, 39(6): 947-953.
Zeng D D, Zhang H F, Tian Q, et al. Detection of soybean seed-borne pathogens in Huang-huai area using LAMP assays[J]. Journal of Nanjing Agricultural University, 2016, 39(6): 947-953. DOI: 10.7685/jnau.201512038 (in Chinese with English abstract) |




