文章信息
- 刘众杰, 李傲, 崔梦杰, 许瀛之, 上官凌飞, 贾海锋, 王晨, 房经贵
- LIU Zhongjie, LI Ao, CUI Mengjie, XU Yingzhi, SHANGGUAN Lingfei, JIA Haifeng, WANG Chen, FANG Jinggui
- 铜胁迫下葡萄植株的生理响应和铜转运蛋白基因VvCTR1的克隆及分析
- Physiological responses to copper stress in grape plants and cloning and analysis of copper transport VvCTR1 gene
- 南京农业大学学报, 2018, 41(2): 256-265
- Journal of Nanjing Agricultural University, 2018, 41(2): 256-265.
- http://dx.doi.org/10.7685/jnau.201706002
-
文章历史
- 收稿日期: 2017-06-03
近年来, 随着化肥和农药普遍施用, 果园重金属污染日益严重。土壤中的重金属元素主要是指镉、汞、铜、铅、铬、锌、镍和类金属元素砷[1], 其中锌和铜还是植物的必需元素。适合植物生长的铜含量范围很小, 当土壤中的有效铜含量低于5 mg·kg-1时, 植株就会出现缺素症, 高于30 mg·kg-1时植株则表现中毒症状[2]。由于含铜杀菌剂的使用以及工业上含铜污染物的排放, 果园中铜含量严重超过正常范围。卢树昌等[3]研究结果表明, 山东苹果园土壤铜含量达44.8 mg·kg-1。当重金属积累到一定程度就会对果园土壤造成污染, 进而影响果树的生长发育和果品质量, 再通过食物链危害人体健康。因此铜污染已成为世界性问题。
葡萄(Vitis vinifera)是我国重要的果树, 在生长发育过程中常常受到黑痘病、霜霉病、灰霉病、炭疽病和白腐病等真菌性病害的影响, 因此喷施药剂是葡萄园管理不可缺少的环节, 而波尔多液是使用频率比较高的杀菌剂, 其主要成分是硫酸铜。一般在葡萄生长季节需喷波尔多液3~6次, 长期高剂量喷施波尔多液会造成土壤中铜的积累, 最终导致树体中重金属的积累[4]; 法国部分葡萄园土壤含铜量高达1 280 mg·kg-1[5]; 天津郊区不同果园土壤中含铜差异很大, 最高的葡萄园铜累积量高达216.7 mg·kg-1[6]。铜在果园土壤中比非果园土壤中的积累明显, 且园龄越大土壤中的铜积累越多。植物遭受铜毒害时, 最先感受毒害的器官是根。铜被根系吸收后通过铜转运蛋白运输至植物的其他器官, 铜在不同器官的积累规律由大到小依次为根系、枝干、新梢、叶片[7]。铜的有效态被植物吸收后大部分富集于根部。过量的铜会导致膜脂过氧化、碱基突变、DNA链的断裂、蛋白质的损伤, 导致植物代谢紊乱, 甚至植物死亡[8-9]。研究表明高浓度铜胁迫下, 柑橘须根腐烂, 根干质量显著下降, 根中的铜含量显著升高[10]; 苹果幼树的株高、根长、根系活力、叶绿素含量及各部位干质量等显著降低[11]; 苹果花粉萌发及花粉管伸长[12]、欧洲越橘种子的发芽等受到抑制[13]。本研究以栽培品种‘夏黑’幼苗为研究对象, 分析了铜在植株中的积累和植株的生理及分子变化, 为探究葡萄对铜胁迫的应答以及果树产业应对铜污染提供依据。
1 材料与方法 1.1 植物材料试验材料为南京农业大学实验农场的1年生葡萄品种‘夏黑’, 其生长于营养土与蛭石(质量比为1 : 1)的花盆中。在采集苗木前2个月, 每2周用Hoagland植物营养液进行浇灌, 期间用水浇灌1次。待植株生长至0.5 m时, 用硫酸铜进行处理。
1.2 试验处理与样品采集试验设置4个处理:1)1 mmol·L-1 CuSO4+1 mmol·L-1人工螯合剂EDTA(CuSO4+EDTA); 2)1 mmol·L-1 CuSO4+1 mmol·L-1柠檬酸(CuSO4+CA); 3)单施1 mmol·L-1 CuSO4(CuSO4); 4)Hoagland溶液(CK)。将葡萄植株放置于含上述溶液的玻璃杯中, 并在溶液中安置通气装置防止植株因缺少氧气而快速致死。所用材料共3种取样方式:1)葡萄植株在上述溶液中分别放置2、4和6 d, 分别取植株的上部、中部和下部叶片, 上部、中部和下部茎段, 幼根和老根, 用去离子水洗涤2次, 烘干至恒质量。称取0.5 g样品于液氮中研磨, 然后用1 mL水溶解至匀浆。2)植株在不同的溶液中生长6 d, 取出植株, 统计新根数量, 测量新根长度, 计算平均值。重复3次。3)植株在不同的溶液中生长12 d, 期间每隔2 d统计叶片数量, 测定叶片叶绿素含量, 并取12 d时脱落叶片叶柄底端, 测定乙烯含量。
对于果实样品的采集, 采用5年生‘夏黑’葡萄, 分别在花后2、4、6、8(转色期)、10、12、14周(成熟期)采集果实, 去掉果皮后液氮中速冻, 放置-80 ℃保存备用。
1.3 指标测定铜含量的测定参照潘逸等[14]的方法。总叶绿素的含量测定:称取0.2 g叶片, 用80%(体积分数)丙酮研磨, 然后用滤纸过滤、洗涤, 定容至25 mL, 立即在645和663 nm波长下测定吸光值[15]。叶绿素总含量=(8.04A663+20.29A645)×V/W×1 000。式中:V为提取液的体积(mL); W为叶片的质量(g)。
乙烯含量的测定:取叶柄基部离层组织放入密闭盒子内, 1 h后利用气相色谱法测定乙烯含量[16]。样品中乙烯含量(μL·L-1)=样品峰高×标样浓度/标准峰高。样品乙烯生成速率(μL·g-1·h-1)=乙烯含量(μL·L-1)×容器体积(L)/[密封时间(h)×样品质量(g)]。多聚半乳糖醛酸酶(PG)和纤维素酶活性的测定参照Sun等[16]的方法。重复3次。
1.4 RNA的提取纯化与cDNA合成总RNA的提取和消化参照贾海锋等[17]的方法。PowerScriptⅡTM反转录酶购自Clontech公司, DNaseⅠ酶、Taq酶、dNTPs、DNA Marker, 荧光定量染料SYBR GreenⅠ均购自TaKaRa公司。所用引物由上海英骏生物技术有限公司合成。
1.5 生物信息学分析利用MEGA 5软件将葡萄VvCTR1与其他11个物种的CTR蛋白序列进行分析并构建进化树。
1.6 RT-qPCR利用软件Primer Premier 5.0设计荧光引物。以葡萄中的Actin基因为内参基因, 根据葡萄中铜转运蛋白序列设计荧光定量qPCR引物(表 1)。按照SYBR Premix Ex TaqTM试剂盒(宝生物工程有限公司)操作指导, 采用实时荧光定量PCR(RT-qPCR)的方法, 检测基因的稀释相对表达量。对反转录所得的cDNA分别进行5个梯度(1、10-1、10-2、10-3和10-4)稀释, 实施荧光定量反应, 然后绘制相对标准曲线。相关基因和Actin基因RT-qPCR扩增的总反应体系为20 μL, 包括:10 μL SYBR Premix Ex TaqTM混合液, 2 μL cDNA, 0.4 μL上游引物(10 μmol·L-1), 0.4 μL下游引物(10 μmol·L-1), 7.2 μL无核酸污染的灭菌水。反应程序为:94 ℃ 2 min; 94 ℃ 20 s, 55 ℃ 30 s, 72 ℃30 s, 40个循环, 每次循环第3步进行荧光采集, 最后从60 ℃升温至95 ℃即每隔30 s上升0.5 ℃, 总共71个循环, 检测其荧光值, 并绘制熔点曲线, 标准品cDNA和待测样品均重复3次。采用2-ΔΔCT法进行数据处理。
| 基因 Gene |
引物序列 Sequence of primer |
片段大小/bp Fragment size |
登录号 Accession number |
用途 Usage |
| VvCTR1 | 5′-CCTATTCAAACTCCGACGC-3′ 5′-TCCACCACCTCTTCCTGAT-3′ |
206 | NM_001281256 | qPCR |
| Actin | 5′-GGATTCTGGTGATGGTGTG-3′ 5′-CAGCAAGGTCAAGACGAA-3′ |
150 | XM_002273532 | qPCR |
| VvACO1 | 5′-CTTGTTTCCAGGTTGTGTC-3′ 5′-TGTGTGAGGAGAGACTAACT-3′ |
121 | NM_001280942 | qPCR |
| VvCTR1 | 5′-ATGATGCACATGACTCTGTAC-3′ 5′-TCAGGAACAGGCACACGAGT-3′ |
446 | 全长Full-length | |
| VvCTR1 | 5′-TCTTCTCCGTCTTCTACCA-3′ 5′-ATCTCAGGAACAGGCACA-3′ |
343 | 半定量 Semi-quantitative |
|
| VvCTR2 | 5′-ATGTATGCTCTCGCCTTG-3′ 5′-CTAACCAAACACACCATCAC-3′ |
321 | HQ108186 | 半定量 Semi-quantitative |
| VvCTR3 | 5′-ATGTCTCAGCATGGTGGCAT-3′ 5′-AGGTGCCACAGAGAGTGCAC-3′ |
391 | HQ108187 | 半定量 Semi-quantitative |
| VvCTR4 | 5′-ATCAGCCTCTTCCCAGAA-3′ 5′-GGACATCAAAGCCAGCAT-3′ |
380 | HQ108188 | 半定量 Semi-quantitative |
| VvCTR5 | 5′-GAGTGGCTTTCCTATTGCC-3′ 5′-ATTTCCGTCCTTACACAGAC-3′ |
368 | HQ108189 | 半定量 Semi-quantitative |
| VvCTR6 | 5′-AACATCCACCACCACAAG-3′ 5′-CAGCAACTCATAGAAGGAAG-3′ |
415 | HQ108190 | 半定量 Semi-quantitative |
| VvCTR7 | 5′-ATGGTGCCAATGAACAGCAC-3′ 5′-TCAGAGGCTTTCTCATAAGG-3′ |
500 | HQ108191 | 半定量 Semi-quantitative |
| VvCTR8 | 5′-ATGACCTTCTACTGGAGCA-3′ 5′-AAGCAGAGAGAGAGAGAGG-3′ |
456 | HQ108192 | 半定量 Semi-quantitative |
采用SPSS 18.0软件进行单因素方差分析, Duncan′s法进行多重比较。数据均以x±SE表示。
2 结果与分析 2.1 铜胁迫对葡萄植株中铜离子积累的影响由表 2可见:随着处理时间的延长, 铜胁迫后葡萄植株各部位铜含量明显升高。幼嫩根中积累的铜离子多于老根, 而且植株各部位中的铜离子积累量由下到上逐渐减少, 由小到大依次为上部叶片、中部叶片、下部叶片, 上部茎、中部茎、下部茎, 老根、幼根。
| mg·g-1 | |||||||||
| 处理 Treatment |
处理时间/d Treatment time |
上部叶片 Up leaf |
中部叶片 Middle leaf |
下部叶片 Low leaf |
上部茎 Up stem |
中部茎 Middle stem |
下部茎 Low stem |
幼根 New root |
老根 Old root |
| 2 | 0.25±0.08d | 0.41±0.15d | 0.49±0.10d | 0.19±0.03c | 0.27±0.05d | 0.33±0.07d | 0.89±0.09d | 0.67±0.13d | |
| CK | 4 | 0.29±0.05d | 0.43±0.03d | 0.65±0.06d | 0.12±0.04d | 0.21±0.09d | 0.32±0.08d | 1.21±0.22d | 0.92±0.15d |
| 6 | 0.36±0.06d | 0.45±0.08d | 0.69±0.11d | 0.29±0.06d | 0.23±0.08d | 0.50±0.11d | 1.52±0.33d | 1.63±0.62d | |
| 2 | 0.49±0.14c | 0.88±0.17bc | 1.03±0.22bc | 0.29±0.08bc | 0.39±0.07c | 0.77±0.16c | 1.79±0.27c | 1.55±0.32c | |
| CuSO4 | 4 | 0.68±0.11ab | 1.06±0.27b | 1.38±0.34b | 0.42±0.08b | 0.88±0.13ab | 1.47±0.14b | 3.27±0.45b | 4.27±0.27b |
| 6 | 0.87±0.08a | 2.19±0.52a | 2.53±0.17a | 0.87±0.09a | 1.16±0.21a | 2.23±0.37a | 5.46±0.55a | 5.73±0.47a | |
| 2 | 0.60±0.04c | 1.37±0.15c | 7.41±0.87c | 0.53±0.21bc | 2.25±0.33c | 5.98±0.45c | 2.84±0.52c | 3.88±0.66c | |
| CuSO4+CA | 4 | 1.80±0.12ab | 2.60±0.53ab | 9.69±0.67ab | 0.70±0.20b | 4.53±0.66b | 10.76±0.52b | 5.37±0.87b | 8.76±0.82b |
| 6 | 2.36±0.64a | 3.03±0.43a | 11.89±1.22a | 1.29±0.24a | 7.37±0.88a | 17.90±1.86a | 8.54±0.93a | 11.57±0.82a | |
| 2 | 0.63±0.07c | 1.53±0.09c | 10.67±0.82bc | 0.47±0.11c | 1.23±0.23c | 2.34±0.53c | 6.54±0.77bc | 8.47±0.53bc | |
| CuSO4+EDTA | 4 | 1.42±0.37b | 3.21±0.54b | 13.98±1.38b | 4.70±0.37ab | 3.10±0.15b | 10.00±0.78b | 7.54±0.85b | 9.54±1.21b |
| 6 | 3.62±0.24a | 4.26±0.32a | 21.81±2.38a | 5.50±1.08a | 9.68±1.60a | 23.26±2.61a | 14.70±1.83a | 13.72±1.52a | |
| 注: 1) CK:对照; CuSO4:1 mmol·L-1 CuSO4; CuSO4+CA:1 mmol·L-1 CuSO4+1 mmol·L-1 CA(柠檬酸); CuSO4+EDTA:1 mmol·L-1 CuSO4+1 mmol·L-1 EDTA。 2)不同字母表示处理间差异显著(P < 0.05)。下同。 Note: 1) CK:Control; CuSO4:1 mmol·L-1 CuSO4; CuSO4+CA:1 mmol·L-1 CuSO4+1 mmol·L-1 CA(citric acid); CuSO4+EDTA:1 mmol·L-1 CuSO4+1 mmol·L-1 EDTA. 2)Different letters indicate significant difference at 0.05 level among different treatments. The same as follows. | |||||||||
由图 1可见:对照植株在Hoagland营养液中已经开始有新根生出, 数量为38条, 根长19 cm左右, 显著高于3种铜胁迫处理。根生长状态最好的是单施CuSO4处理, 新生根数为19条, 显著高于CuSO4+EDTA和CuSO4+CA处理; 单施CuSO4处理根的平均长度11 cm左右, 显著高于CuSO4+EDTA处理, 但与CuSO4+CA处理差异不显著。
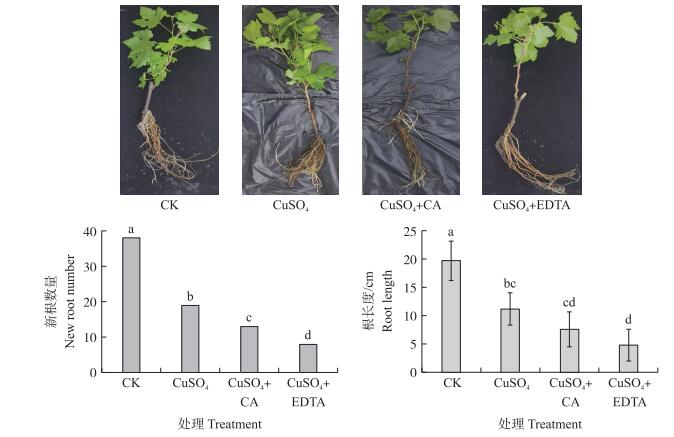
|
图 1 铜胁迫对葡萄植株根生长的影响 Figure 1 Effects of copper stress on grape root growth |
从图 2可见:铜胁迫使幼苗叶片从下部到上部开始脱落, 其中CuSO4+EDTA处理的葡萄幼苗生长状态最差, 单施CuSO4和CuSO4+CA处理的叶片脱落趋势相似。在铜胁迫6 d时, 单施CuSO4和CuSO4+CA处理的幼苗, 植株底端的叶片已有脱落, 但是中上部的叶片长势良好; 而CuSO4+EDTA处理植株底端和中部的叶片都已经脱落, 只有最上部的幼嫩叶片未脱落。铜胁迫12 d后, 3种处理的剩余叶片量都已低于20%, 其中CuSO4+EDTA处理的葡萄幼苗叶片在12 d时已全部脱落。

|
图 2 铜胁迫对葡萄叶片生长的影响 Figure 2 Effects of copper stress on grape leaf growth |
由图 3可见:铜处理葡萄植株12 d后会使叶片黄化。单独CuSO4处理的植株脱落的叶片还带青色; 而CuSO4+CA处理的植株其脱落的叶片呈黄色; CuSO4+EDTA处理的植株其脱落的叶片已经干枯。表明铜处理后的植株叶绿素降解严重。
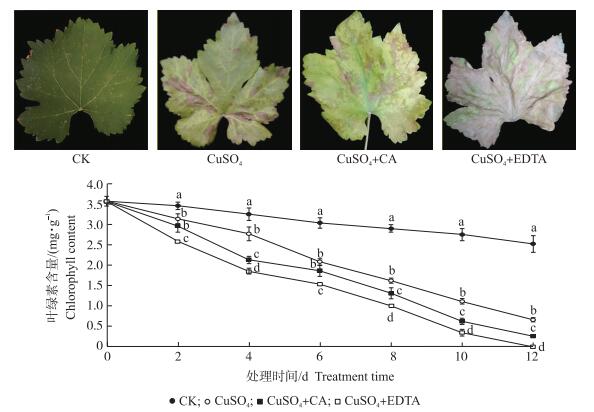
|
图 3 铜胁迫对葡萄植株叶绿素含量的影响 Figure 3 Effects of copper stress on grape leaf chlorophyll content |
从图 4可以看出:对照植株叶柄底端的乙烯含量为0.23 μL·L-1, 而CuSO4处理乙烯含量升高了十几倍, 尤其是CuSO4+EDTA处理乙烯含量达到了3.25 μL·L-1。同时, 乙烯合成路径中的VvACO1基因的表达量也在铜胁迫下升高, 说明铜胁迫诱导了叶柄底端乙烯的产生。而且乙烯含量的上升也使得多聚半乳糖醛酸酶(PG)和细胞纤维素酶活性升高, 并显著高于对照。这些生理现象的变化导致了叶柄底端离层的产生, 最后导致叶片脱落。
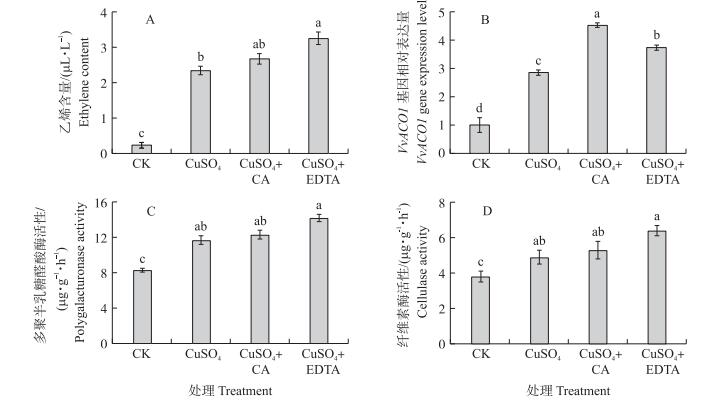
|
图 4 铜胁迫对葡萄叶柄基部乙烯和细胞壁酶活性的影响 Figure 4 Effects of copper stress on ethylene content and cell wall enzyme activity of the grape leaf petiole base |
由图 5可见:从植株的幼嫩叶片中扩增了VvCTR1基因, 全长为447 bp, 编码149个氨基酸序列。同时提取了幼嫩叶片的DNA进行了VvCTR1基因的扩增, 与mRNA扩增的序列相比, 发现VvCTR1基因没有内含子序列, 这说明VvCTR1基因对铜胁迫可快速应答。VvCTR1基因在果实发育成熟过程前期表达量很高, 在果实成熟后开始有些下降。同时对葡萄中的其他铜转运蛋白基因的表达量也进行了分析, VvCTR8基因在果实发育前期表达量很高, 但是在第8周的转色期开始下降直至成熟; VvCTR2、VvCTR3、VvCTR4、VvCTR5、VvCTR6、VvCTR7等基因在果实发育过程中的表达量均比较低, 而且没有发生剧烈的变化。在8个铜转运蛋白基因中, 只有VvCTR1受铜处理的强烈诱导, 因此选择VvCTR1做进一步的研究。
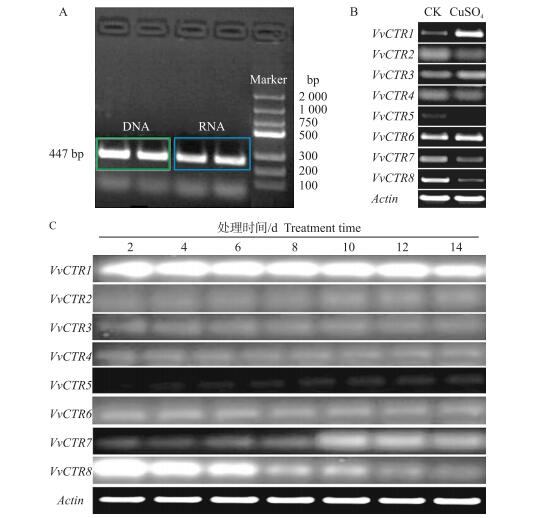
|
图 5 铜转运蛋白基因的克隆及表达量 Figure 5 Copper transport gene clone and expression levels |
铜转运蛋白含有3个明显的跨膜区域:跨膜区2(TMD2)和3(TMD3)保守, 跨膜区1(TMD1)物种间变化较大, 相似性为20%~40%(图 6)。并且从最后一个甲硫氨酸Met到TMD1之间有20个氨基酸残基, 相似性为15%~50%。除了VvCTR2和VvCTR6, 其他的铜转运蛋白都含有3~5个Met残基, 并且以M××M或者M×M的形式排列(M代表甲硫氨酸, ×代表任意氨基酸)。在跨膜区2内, 有以M×××M形式的氨基酸残基序列(M代表甲硫氨酸, ×代表疏水氨基酸)。而在跨膜区3内, 有以G×××G形式的氨基酸残基序列(G代表甘氨酸, ×代表疏水氨基酸)。在M×××M和G×××G残基之间有12个任意氨基酸。
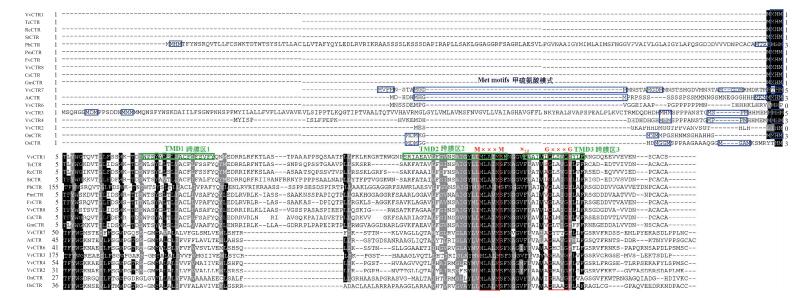
|
图 6 铜转运蛋白氨基酸序列比对
Figure 6 Alignment of COPT/Cr family copper transport proteins
1)Vv:葡萄Vitis vinifera; Tc:可可Theobroma cacao; Rc:蓖麻Ricinus communis; St:马铃薯Solanum tuberosum; Pb:梨Pyrus×bretschneideri; Pm:梅Prunus mume; Fv:草莓Fragaria vesca; Cs:柑橘Citrus sinensis; Gm:大豆Glycine max; At:拟南芥Arabidopsis thaliana; Om:文心兰Oncidium hybridum; Os:水稻Oryza saliva. 2)3个跨膜区1~3用绿色的方框标出, 跨膜区2中的富含甲硫氨酸区域和跨膜区3中的富含甘氨酸区域都用红框标出。跨膜区1前面的甲硫氨酸残基用蓝色框标出。The three transmembrane region of 1-3 marked with the green box, the glycine rich in transmembrane region 2 and methionine rich regions in transmembrane region 3 marked with a red box. Methionine residues before the transmembrane region 1 marked with the blue box. |
葡萄VvCTR1与可可的CTR蛋白亲缘关系很近, 相似性为64.86%, 与梨、梅、草莓、葡萄CTR8、大豆、马铃薯和蓖麻在一个小分支上, 与柑橘在一个大分支上, 这些物种亲缘关系很近, 但与另一个大的分支上的文心兰, 水稻, 葡萄CTR2、CTR3、CTR4、CTR5、CTR6、CTR7及拟南芥的亲缘关系较远(图 7)。
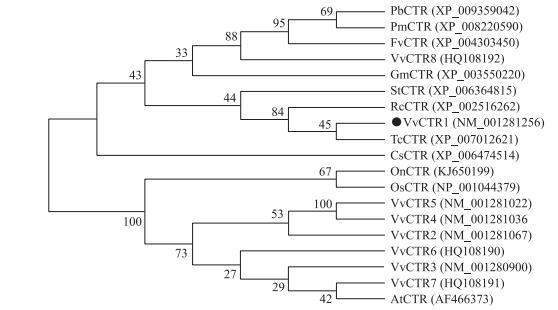
|
图 7 CTR蛋白进化树构建 Figure 7 Phylogenic tree of CTR |
由图 8可见:CuSO4处理葡萄植株后, 铜转运蛋白强烈应答。无论是在植株的上部叶片、中部叶片还是下部叶片, VvCTR1基因的表达量均升高了, 在茎中也出现同样现象, 同时植株的老根和幼根中VvCTR1基因表达量也急剧上升, 尤其是CuSO4+EDTA处理的葡萄植株, 说明CuSO4已经被运输到了整棵植株中。除了CuSO4外, CuCl2和CaCl2也能促进VvCTR1基因的表达, 而且铜吸收抑制剂浴铜灵二磺酸(BCS)同样也能促进VvCTR1基因的表达, 而其他金属离子, 如CoCl2、FeSO4、MnCl2、MgCl2、NaCl和ZnSO4均不能促进VvCTR1基因的表达。
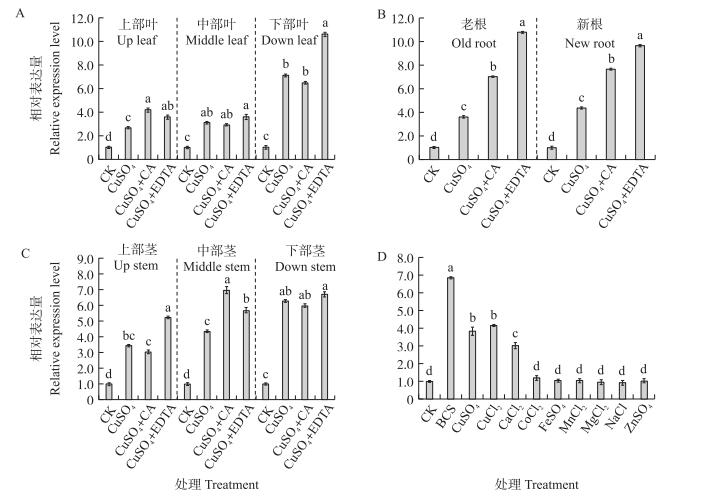
|
图 8 葡萄植株中各个部位及各种金属离子诱导的VvCTR1基因表达分析 Figure 8 Analysis of VvCTR1 gene expression in various parts of grape plants and induced by various metal ions BCS:浴铜灵二磺酸Bathocuproinedisulfonic acid. |
葡萄是多年生果树, 作为多用途经济型水果无论在栽培面积还是产量上都占据水果家族中的重要地位, 但是其在生长过程中会不断地富集重金属, 破坏果实的品质。本研究表明:CuSO4使葡萄叶绿素含量降低, 而CuSO4+CA和CuSO4+EDTA处理使CuSO4更容易被植物吸收, 导致叶片叶绿素降解更快。CuSO4处理的植株根部积累了大量的铜, 铜胁迫下葡萄的新根数量减少, 而且平均根长也降低。铜可以作用于蛋白功能位点调控蛋白进而对细胞产生毒性, 转移植物所必需的其他元素, 或产生一系列活性氧(ROS), 如: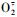
Cu在植物光合作用、呼吸作用、碳氮代谢、抗氧化胁迫中扮演重要角色[19]。在真核生物中, 一个保守的高亲和力铜转运蛋白, 称为CTR/COPT家族, 可介导环境中的铜运输到细胞质中[20]。第1个COPT家族成员是在拟南芥发现的, 它可弥补ctr1dctr3d突变体酵母呼吸缺陷表型[21]。对野生型和COPT1缺陷型拟南芥的研究表明COPT1是细胞膜蛋白, 在根对铜吸收和花粉发育方面具有重要功能[22]。过表达COPT1可使植物铜积累, 产生铜过量的表型, 比如抑制生长和改变叶片形态[23]。拟南芥COPT2也能够弥补ctr1dctr3d酵母突变株产生的铜缺陷表型, 并且其mRNA水平在低铜情况下升高。COPT2可在根、幼叶、子叶、茎尖分生组织、表皮毛和花药中表达[24]。COPT2可促使植物吸收铜, 在铁缺少应答和低磷信号中起作用。生化、遗传和结构数据表明, CTR/COPT蛋白具有3个跨膜结构域(TMDS), 形成了一个对称三聚体并含有一个N末端的细胞外区域[25]。CTR/COPT蛋白含有保守且能有效运输铜的区域, 包括N末端的富含甲硫氨酸的结构域、1个TMD2区域的M×××M和1个TMD3区域的G×××G。这些结构特征是铜有效转运的关键因素[26]。本研究表明:在所有的铜转运蛋白中都含有TMD1、TMD2和TMD3共3个跨膜区域, 但是N端的甲硫氨酸富含区的数量在物种之间, 甚至CTR家族成员之间都不一样。在葡萄果实发育过程中, VvCTR1基因高水平表达, 显著高于铜转运蛋白家族中其他7个成员, 除了VvCTR 8在葡萄幼果期高水平表达外, 在转色期至成熟期只有VvCTR1高水平表达, 说明VvCTR1基因在果实转运过程中起着关键作用。由于CTR1在铜离子运输过程中起着重要的作用, 因此VvCTR1基因会对外源铜产生快速应答。CuSO4处理后, 无论是在根中, 还是在不同部位的茎和叶中, VvCTR1基因的表达量均升高, 说明CuSO4溶液中的铜离子已通过根部运输到植物的各个器官, 并且根、茎和叶中铜含量的增加也表明这些组织开始积累大量的铜。
本研究中, 与铜过量相反, 若用铜螯合剂浴铜灵二磺酸(BCS)处理植株, 使植株出现铜缺失现象, 植物为了弥补这种现象, 会升高VvCTR1基因的表达量, 使植物从环境中获取更多的铜。总之, 过量的铜和低水平的铜对葡萄植株的生长发育都是不利的, 而CTR蛋白对铜在植物体内的运输起着关键的作用, 可通过调控CTR蛋白活性来平衡植物体内的铜水平, 为果树在重金属铜含量高的区域种植提供理论基础。
| [1] |
宋谦, 王凤仙.
农业环境研究[M]. 北京: 中国农业出版社, 1993, 143-167.
Song Q, Wang F X. Agricultural Environment Research[M]. Beijing: China Agriculture Press, 1993, 143-167. (in Chinese with English abstract) |
| [2] |
常红岩, 孙百晔, 刘春生. 植物铜素毒害研究进展[J].
山东农业大学学报, 2000, 31(2): 227-230.
Chang H Y, Sun B Y, Liu C S. Advances in the study of plants copper toxicity[J]. Journal of Shandong Agricultural University, 2000, 31(2): 227-230. (in Chinese with English abstract) |
| [3] |
卢树昌, 高悦. 天津市郊区果园土壤重金属铜积累状况调查分析[J].
天津农业科学, 2009, 15(1): 41-45.
Lu S C, Gao Y. Investigation and analyses on metal copper accumulation of orchard soil in Tianjin suburb[J]. Tianjin Agricultural Sciences, 2009, 15(1): 41-45. (in Chinese with English abstract) |
| [4] |
王正直, 邱德峰. 果园土壤铜素的含量、形态及剖面特征研究[J].
土壤通报, 2002, 33(5): 369-371.
Wang Z Z, Qiu D F. Study on the content, form and characteristics of copper in orchard soils[J]. Bulletin of Soil Science, 2002, 33(5): 369-371. (in Chinese with English abstract) |
| [5] |
单正军, 王连生, 蔡道基, 等. 果园土壤铜污染状况及其对作物生长的影响[J].
农业环境保护, 2002, 21(2): 119-121.
Shan Z J, Wang L S, Cai D J, et al. Pollution of copper in orchard soil and it's effects on plant growth[J]. Agro-Environmental Protection, 2002, 21(2): 119-121. (in Chinese with English abstract) |
| [6] |
郑袁明, 陈同斌, 郑国砥, 等. 不同土地利用方式对土壤铜积累的影响——以北京市为例[J].
自然资源学报, 2005, 20(5): 690-696.
Zheng Y M, Chen T B, Zheng G D, et al. Soil copper accumulation under different land use types:the case of Beijing[J]. Journal of Natural Resources, 2005, 20(5): 690-696. DOI: 10.11849/zrzyxb.2005.05.008 (in Chinese with English abstract) |
| [7] |
张连忠, 路克国, 杨洪强. 苹果幼树铜、镉分布特征与累积规律研究[J].
园艺学报, 2006, 33(1): 111-114.
Zhang L Z, Lu K G, Yang H Q. The distribution and accumulation of cuprum and cadmium in young apple tree[J]. Acta Horticulturae Sinica, 2006, 33(1): 111-114. (in Chinese with English abstract) |
| [8] |
陈玉胜, 陈亚华, 王桂萍, 等. 硫对水稻种子萌发过程中铜毒害的缓解效应[J].
南京农业大学学报, 2007, 30(2): 44-48.
Chen Y S, Chen Y H, Wang G P, et al. The alleviation effect of exogenous sulfate on copper toxicity in seed germination of rice(Oryza sativa L.)[J]. Journal of Nanjing Agricultural University, 2007, 30(2): 44-48. DOI: 10.7685/j.issn.1000-2030.2007.02.009 (in Chinese with English abstract) |
| [9] |
王友保, 刘登义. Cu、As及其复合污染对小麦生理生态指标的影响[J].
应用生态学报, 2001, 12(5): 773-776.
Wang Y B, Liu D Y. Effect of Cu, As and their combination pollution on eco-physiological index of wheat[J]. Chinese Journal of Applied Ecology, 2001, 12(5): 773-776. (in Chinese with English abstract) |
| [10] | Alva A K, Chen E Q. Effects of external copper concentrations on uptake of trace elements by citrus seedlings[J]. Soil Science, 1995, 159: 59-64. DOI: 10.1097/00010694-199501000-00007 |
| [11] |
阚世红, 孙百晔, 刘春生. 棕壤中长期低剂量铜胁迫对苹果幼树的毒性效应[J].
农业环境科学学报, 2010, 29(1): 38-42.
Kan S H, Sun B Y, Liu C S. Toxic effects of long-term low-dose copper(Cu)stress on apple trees in brown soils[J]. Journal of Agro-Environment Science, 2010, 29(1): 38-42. (in Chinese with English abstract) |
| [12] |
孙百晔, 阚世红, 刘春生, 等. 农艺措施对苹果幼树长期低剂量铜胁迫的影响及缓解效果分类[J].
农业环境科学学报, 2010, 29(2): 251-257.
Sun B Y, Kan S H, Liu C S, et al. Effects of agronomic measures on long-term toxicity of low-dose copper for apple trees and classification of amelioration[J]. Journal of Agro-Enviroment Science, 2010, 29(2): 251-257. (in Chinese with English abstract) |
| [13] | Lyanguzova I V. Effect of nickel and copper on bilberry seed germination and seedling development[J]. Russian J Plant Physiol, 1999, 46: 431-432. |
| [14] |
潘逸, 周立祥. 施用有机物料对土壤中Cu、Cd形态及小麦吸收的影响:田间微区试验[J].
南京农业大学学报, 2007, 30(2): 142-146.
Pan Y, Zhou L X. Influence of applying organic manures on the chemical form of Cu and Cd in the contaminated soil and on wheat uptake:field micro-plot trials[J]. Journal of Nanjing Agricultural University, 2007, 30(2): 142-146. DOI: 10.7685/j.issn.1000-2030.2007.02.030 (in Chinese with English abstract) |
| [15] |
李得孝, 郭月霞, 员海燕, 等. 玉米叶绿素含量测定方法研究[J].
中国农学通报, 2005, 21(6): 153-155.
Li D X, Guo Y X, Yuan H Y, et al. Determined methods of chlorophyll from maize[J]. Chinese Agricultural Science Bulletin, 2005, 21(6): 153-155. (in Chinese with English abstract) |
| [16] | Sun L, Sun Y, Zhang M, et al. Suppression of 9-cis-epoxycarotenoid dioxygenase, which encodes a key enzyme in abscisic acid biosynthesis, alters fruit texture in transgenic tomato[J]. Plant Physiology, 2012, 158(1): 283-298. DOI: 10.1104/pp.111.186866 |
| [17] |
贾海锋, 刘众杰, 赵鹏程, 等. 转录因子ABI4调控草莓果实成熟的分子机制[J].
南京农业大学学报, 2015, 38(6): 908-914.
Jia H F, Liu Z J, Zhao P C, et al. The molecular mechanism of transcription factors ABI4 in regulation of strawberry fruit ripening[J]. Journal of Nanjing Agricultural University, 2015, 38(6): 908-914. DOI: 10.7685/j.issn.1000-2030.2015.06.006 (in Chinese with English abstract) |
| [18] | Contreras L, Mella D, Moenne A, et al. Differential responses to copper-induced oxidative stress in the marine macroalgae Lessonia nigrescens and Scytosiphon lomentaria(Phaeophyceae)[J]. Aquatic Toxicology, 2009, 94: 94-102. DOI: 10.1016/j.aquatox.2009.06.004 |
| [19] | Marschner. The role of the rhizosphere in nutrient use efficiency in crops[C]//Hawkesford M J, Barraclough P. The Molecular and Physiological Basis of Uutrient Use Efficiency in Crops. Wilipedia: Wiley, 2011: 47-63. |
| [20] | Nevitt T, Ohrvik H, Thiele D J. Charting the travels of copper in eukaryotes from yeast to mammals[J]. Biochimica Biophysica Acta, 2012, 1823: 1580-1593. DOI: 10.1016/j.bbamcr.2012.02.011 |
| [21] | Sancenon V, Puig S, Mateu-Andres I, et al. The Arabidopsis copper transporter COPT1 functions in root elongation and pollen development[J]. The Journal of Biological Chemistry, 2004, 279: 15348-15355. DOI: 10.1074/jbc.M313321200 |
| [22] | Garcia A, Andres N, Perea A, et al. The Arabidopsis COPT6 transport protein functions in copper distribution under copper-deficient conditions[J]. Plant Cell Physiol, 2013, 54(8): 1378-1390. DOI: 10.1093/pcp/pct088 |
| [23] | Andres-Colas N, Perea-Garcia A, Puig S, et al. Deregulated copper transport affects Arabidopsis development specially in the absence of environmental cycles[J]. Plant Physiology, 2010, 153: 170-184. DOI: 10.1104/pp.110.153676 |
| [24] | Perea-Garcia A, Garcia-Molina A, Andres-Colas N, et al. Arabidopsis copper transport protein COPT2 participates in the cross talk between iron deficiency responses and low-phosphate signaling[J]. Plant Physiology, 2013, 162: 180-194. DOI: 10.1104/pp.112.212407 |
| [25] | de Feo C J, Aller S G, Siluvai G S, et al. Three-dimensional structure of the human copper transporter hCTR1[J]. Proc Natl Acad Sci USA, 2009, 106: 4237-4242. DOI: 10.1073/pnas.0810286106 |
| [26] | Aller S G, Eng E T, de Feo C J, et al. Eukaryotic CTR copper uptake transporters require two faces of the third transmembrane domain for helix packing, oligomerization, and function[J]. The Journal of Biological Chemistry, 2004, 279: 53435-53441. DOI: 10.1074/jbc.M409421200 |




