文章信息
- 张飞雪, 虞章红, 刘坤宇, 文锴, 王建军, 侯喜林, 李英
- ZHANG Feixue, YU Zhanghong, LIU Kunyu, WEN Kai, WANG Jianjun, HOU Xilin, LI Ying
- 不结球白菜醛酮还原酶BcAKR4C9基因的克隆及表达分析
- Cloning and expression analysis of aldo-keto reductase gene BcAKR4C9 from non-heading Chinese cabbage
- 南京农业大学学报, 2018, 41(2): 240-247
- Journal of Nanjing Agricultural University, 2018, 41(2): 240-247.
- http://dx.doi.org/10.7685/jnau.201705022
-
文章历史
- 收稿日期: 2017-05-15
在植物生长发育的各个阶段, 植物会不可避免地遇到一些生物和非生物胁迫[1]。研究表明:植物在遭遇非生物胁迫时, 活性氧与活性乙醛水平增加, 导致植物的胁迫诱导损伤[2], 为了清除植物体内产生的活性氧、活性乙醛等有毒物质, 植物会利用大量具有氧化还原活性的酶类使有毒物质分解为毒性较小的乙醇和碳水化合物[3], 而醛酮还原酶(AKR)家族通常催化醛、酮、类固醇以及其他羰基化合物的还原[3]。AKR家族在逆境防御中起重要作用, 能够被多种逆境胁迫诱导[4-7]; 在植物中它们起着反应性醛解毒、渗透压生成和次级代谢物合成的关键作用[8]。
AKR家族, 是以NADP(H)为辅酶而催化一系列醛酮底物发生氧化还原反应, 具有经典的(α/β)8桶状折叠结构, 在进化上高度保守。其中, (α/β)8桶状结构羧基端的3个环(LooP A、LooP B、LooP C)的不同组成和大小决定了其底物的特异性[9]。AKR催化活性位点是由N末端(Asp50、Tyr55、Lys84)所构成[9], 催化四联体(Asp50、Tyr55、Lys84、His117)被认为是醛酮还原酶负责底物催化的关键氨基酸[10]; 另外, 发现C末端形成的高度保守的氨基酸残基(Ser271、Arg276)在辅因子结合中起重要作用[9]。
AKR4C亚家族与植物的耐受性相关[3]。AKR4C能够被高CO2浓度和高光照下诱导表达, 使细胞内光合速率增强[11]。在单子叶植物中首先鉴定到的AKR4C1被认为是耐旱性相关的蛋白并能够被脱落酸诱导表达[12]。AKR4C9为AKR4C亚家族的成员, 在逆境胁迫中能够起到醛酮解毒的作用[13], 被认为是保护植物免受应激氧化胁迫的重要的候选基因[3]。在大麦中过表达拟南芥AKR4C9基因可以在氧化胁迫和镉胁迫中增强其醛酮解毒反应, 转基因植株呼吸速率降低, 叶绿素含量增加并且光合速率提高[13]; 山梨醇浓度相对于野生型提高2~4倍, 其耐寒性和再生能力得到显著提高[14]。
本研究以不结球白菜品种‘苏州青’为试验材料, 克隆了AKR4C9同源基因, 并且进行了相关的生物信息学分析。利用实时荧光定量PCR技术分别测定了高温、低温、NaCl、伤害处理下的基因表达水平, 以及在脱落酸、茉莉酸甲酯和水杨酸激素处理下基因的表达变化, 旨在进一步了解BcAKR4C9基因在不结球白菜中的功能。
1 材料与方法 1.1 材料及处理供试材料为不结球白菜(Brassica campestris ssp. chinensis Makino)品种‘苏州青’, 由南京农业大学园艺学院不结球白菜课题组提供。将‘苏州青’种植于南京农业大学人工气候室, 在植株4叶1心期时, 选取生长整齐一致的幼苗作为试验材料。以42 ℃热激和4 ℃低温处理幼苗, 处理设备为RXZ智能型人工气候培养箱, 光照强度为100 μmol·m-2·s-1, 处理后0、4、6、8和24 h取样, 每处理10株, 3次重复。在每片叶上打3个孔(保留圆片不致脱离, 孔径大小为1 cm)作为伤害处理, 未打孔的作为对照, 分别在0、4、8、12和24 h后取样, 每处理10株, 3次重复。分别以5、10、15、20、25 g·L-1的NaCl溶液喷洒叶片背面, 以清水为对照, 然后用透光塑料罩罩住, 处理12 h后取样, 每处理10株, 3次重复。选用2 mmol·L-1水杨酸(SA)、50 μmol·L-1茉莉酸甲酯(JA)和50 μmol·L-1脱落酸(ABA)溶液分别喷施4叶1心期的叶片, 然后用透光塑料罩罩住, 处理时间为0、4、8、12和24 h, 每处理10株, 3次重复。材料收集后液氮速冻, 存放-80 ℃保存备用。
1.2 RNA的提取与cDNA的合成RNA提取试剂盒购自天根生化科技有限公司, 具体方法参照RpPureNApre植物总RNA提取试剂盒说明书。用‘苏州青’叶片的总RNA为模板, 按照PrimeScript RT试剂盒(TaKaRa)说明书反转录合成cDNA。
1.3 不结球白菜BcAKR4C9基因的克隆根据大白菜数据库(http://brassicadb.org/brad/searchGene.php)的基因序列编号Bra000018, 利用Primer Premier 6.0软件设计1对引物, 引物分别为AKR4C9-F:ATGGCTAACGCAATTAGAT, AKR4C9-R:TTATATCTCGCCATCCCATAAGT。以不结球白菜‘苏州青’叶片cDNA作为模板进行PCR反应, 反应体系按照TaKaRa公司的rTaq酶说明书进行。反应程序为:95 ℃ 5 min; 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 1 min, 35个循环; 72 ℃ 10 min, 4 ℃保存。PCR产物进行琼脂糖凝胶电泳检测, 用DNA凝胶回收试剂盒对目的片段进行回收、纯化。回收产物用T4-DNA连接酶连接到pMD18-T-simple载体, 连接产物转化大肠杆菌DH5α(由本实验室保存), 涂于氨苄青霉素抗性的LB平板37 ℃暗培养12 h, 挑取阳性单克隆送到南京金斯瑞生物科技有限公司测序分析。
1.4 序列分析用BioEdit软件查找不结球白菜BcAKR4C9基因序列的开放阅读框(ORF)。不同物种AKRC49的氨基酸序列从NCBI(http://www.ncbi.nih.gov/)GenBank数据库中搜索获得, 同源性计算利用NCBI网站BLAST程序。氨基酸编码的蛋白质相对分子质量、理论等电点、不稳定指数等通过在线软件Protparam tool(http://web.Expasy.org/protparam/)完成。疏水性预测采用ProtScale(http://web.expasy.org/protscale/), 信号肽预测采用Signalp 4.0(http://www.cbs.dtu.dk/services/SignalP/), 跨膜区域预测采用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/), 蛋白质二级结构预测采用SOPMA(http://pbil.ibcp.fr/)等在线工具。蛋白质三级结构分析通过SWISS-MODEL(https://www.swissmodel.expasy.org/)完成。多重序列比对通过DNAMAN 6.0进行, 进化树构建用MEGA 5.2软件[15]进行。
1.5 实时荧光定量PCR实时荧光定量PCR体系参照SYBR PrimeScript RT-PCR Kit Ⅱ试剂盒(TaKaRa, Japan)说明书。内参基因为Actin(登录号:AF111812), 内参引物序列为Actin-F:GTTGCTATCCAGGCTGTTCT, Actin-R:AGCGTGAGGAAGAGCATAAC; AKR4C9引物序列为qAKR4C9-F:GCCGCAGCTGTTAAGATCGGAT; qAKR4C9-R:GGTCATGATCCGTACACCAG。PCR程序采用两步法:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 40个循环; 设置65 ℃到95 ℃的熔解曲线。目标基因表达量的计算按照ΔΔCT法。相对表达量等于2-ΔΔCT, 即相对定量是基于对照和处理之间, 目标基因和内参基因表达量的比值。所得数据用Excel 2010软件分析。
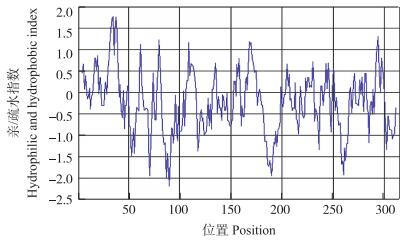
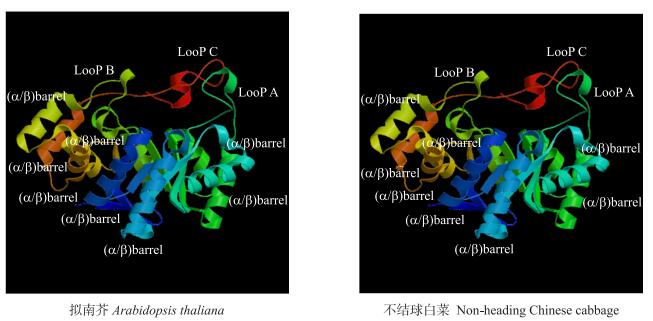
2 结果与分析 2.1 不结球白菜BcAKR4C9基因的克隆和序列分析测序结果表明:不结球白菜BcAKR4C9基因与拟南芥序列长度一致, 序列相似度为88.7%, 包含1个长度为948 bp的开放式阅读框(ORF), 编码315个氨基酸, 包含AKR家族共有的催化四联体(Asp47、Tyr52、Lys81、His114)(图 1)。预测该基因编码蛋白质相对分子质量为35.126×103, 理论等电点为6.61, 不稳定指数为39.81, 属于不稳定蛋白。ProtScale亲/疏水性预测显示:该蛋白属于疏水性蛋白(图 2), 总平均疏水指数(GRAVY)为-0.440。该蛋白无信号肽, 也无分泌蛋白, 并且不存在跨膜区域。蛋白二级结构预测结果显示:其主要为α螺旋, 无规则卷曲, 分别占39.37%和31.11%, 其余为β转角和延伸链。以拟南芥AKR4C9的结构为模型, 利用SWISS-MODEL进行同源建模, 预测了其三维空间结构。由图 3可以看出:AKR4C9在不结球白菜与拟南芥中具有相似的三维空间结构,都拥有醛酮还原酶所具备的8个(α/β)8桶状折叠结构, 螺旋在外围, 折叠在里面, 中间形成一个疏水结构。其晶体结构揭示了底物结合位点的开放性和适应性与广泛的底物特征相关[3]。

|
图 1 不结球白菜BcAKR4C9基因的核苷酸序列及其编码的氨基酸序列 Figure 1 Nucleotide sequence and its encoded amino acid sequence of BcAKR4C9 gene from non-heading Chinese cabbage 方框内为催化四联体(Asp47、Tyr52、Lys81、His114)位点。 The box is a catalytic residue(Asp47, Tyr52, Lys81, and His114)locus. |
|
图 2 不结球白菜BcAKR4C9氨基酸序列亲/疏水性预测 Figure 2 Predicted hydrophilic and hydrophobic properties of BcAKR4C9 amino acid sequences from non-heading Chinese cabbage |
利用BLASTp对BcAKR4C9基因推导的氨基酸序列进行同源性检索与多重比对, 结果(图 4)显示, 其与萝卜(XP_018465613.1)、欧洲油菜(CDY64988.1)和大白菜(XP_009133204.1)相似性达95%以上, 与拟南芥(3H7U)、亚麻芥(XP_010509278.1)相似性分别为90%和89%;与中棉(XP_012458618.1)、苹果(XP_008387826.1)、野草莓(XP_004302704.1)、葡萄(XP_002273035.1)、可可(XP_007026918.2)的相似性均在80%以上, 表明同科植物的氨基酸序列相似度较高。该基因具有保守的结构区域, 并且比对结果发现LooP A、LooP B、LooP C这3个环在不同的物种中存在氨基酸的不同(图 3), 不结球白菜与拟南芥相比较LooP A中117位点处由丙氨酸变为缬氨酸, 在LooP B中不结球白菜与拟南芥不存在氨基酸的变异, 而LooP C中主要在291、292、293氨基酸位点处由亮氨酸、天冬酰胺、丙氨酸分别改变为缬氨酸、苏氨酸和甘氨酸。与以上序列比对中的植物物种进行同源进化分析并构建进化树, 结果(图 5)显示:十字花科的拟南芥、亚麻芥、大白菜、不结球白菜、油菜各自聚集在同一分支中, 而蔷薇科的苹果、野草莓同样聚集在同一分支中。

|
图 4 不结球白菜BcAKR4C9与其他物种氨基酸序列同源性比对 Figure 4 Alignment of amino acid sequences of BcAKR4C9 and homologs from other plants |
|
图 3 不结球白菜与拟南芥AKR4C9蛋白的三维结构模型比较 Figure 3 Tertiary structure prediction of AKR4C9 from non-heading Chinese cabbage and Arabidopsis thaliana LooP A、LooP B、LooP C分别为(α/β)8桶状结构羧基端的3个环。下同。 LooP A, LooP B, LooP C represent the three rings of the carboxyl terminal of the(α/β)8 barrel structure, respectively. The same as follows. |

|
图 5 不结球白菜与其他植物BcAKR4C9氨基酸序列的系统进化树 Figure 5 Phylogenetic tree of BcAKR4C9 of non-heading Chinese cabbage and other plants |
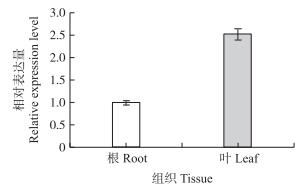
由图 6可见:不结球白菜BcAKR4C9在根和叶片中均有表达, 在叶中的表达量要高于根中。
|
图 6 不结球白菜BcAKR4C9基因在不同组织中的相对表达量 Figure 6 Relative expression level of BcAKR4C9 gene in different tissues from non-heading Chinese cabbage |
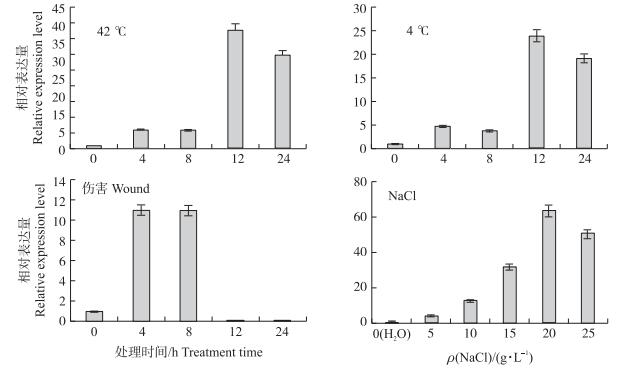
由图 7可见:高温和低温胁迫处理均能使不结球白菜BcAKR4C9基因的表达量升高, 且高温和低温处理下, BcAKR4C9具有相似的表达趋势, 即在12 h表达量达到最高, 随后表达水平有所降低。在0~20 g·L-1 NaCl质量浓度范围内, BcAKR4C9基因表达水平随NaCl质量浓度的升高而升高, 当NaCl为20 g·L-1时, 基因相对表达量达到初始量的70倍左右。伤害处理4 h, 该基因表达量明显上升, 而12 h后该基因表达量则低于对照水平。
|
图 7 不结球白菜BcAKR4C9基因在不同胁迫条件下的相对表达水平 Figure 7 Relative expression level of BcAKR4C9 gene in non-heading Chinese cabbage under different stresses |
由图 8可见:水杨酸、脱落酸、茉莉酸甲酯均能诱导不结球白菜BcAKR4C9基因的表达。水杨酸和茉莉酸甲酯处理下, 该基因具有相似的表达趋势, 即在处理4 h后表达量明显上升, 之后表达量下降, 至24 h又急剧升高。脱落酸处理12 h时, 该基因相对表达量急剧增加, 24 h时又明显下降。
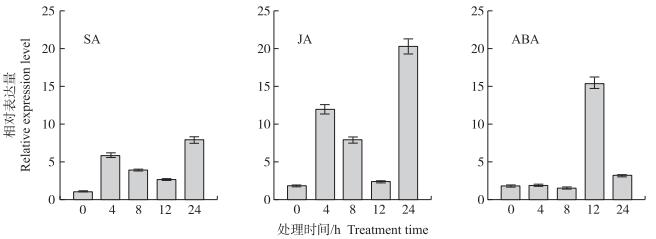
|
图 8 不结球白菜BcAKR4C9基因在不同激素处理后的相对表达水平 Figure 8 Relative expression level of BcAKR4C9 gene in non-heading Chinese cabbage under different hormones SA:水杨酸Salicylic acid; JA:茉莉酸甲酯Methyl jasmonate; ABA:脱落酸Abscisic acid. |
拟南芥AKR4C9基因被认为是植物AKR家族中一个保护植物免受应激氧化胁迫的重要候选基因[8], 对其酶动力学参数研究表明AKR4C9可以活化类固醇, 降解糖类和一系列脂肪醛等化合物, X-ray晶体结构构建也证明了其具有广泛的底物特征, 并且比其他AKR亚家族成员有更开放和更适宜的催化活性位点[3]。因此AKR4C9同源基因可以作为重要经济作物培育多抗品种的目标[4]。
本研究从不结球白菜‘苏州青’中克隆到BcAKR4C9基因, 发现与拟南芥基因序列具有较高同源性, 其序列相似度为88.7%, 序列同源性比对表明AKRC49基因具有保守的结构区域。蛋白进化树分析发现不结球白菜与同属于十字花科的萝卜、油菜进化距离较近, 且同属于一个分支, 同属于蔷薇科的苹果和野草莓也被分到同一分支上, 并且与鼠李科的枣具有相对较近的进化距离。同属于锦葵目的锦葵科中棉与梧桐科的可可树也具有相对较近的进化距离, 并在同一进化分支上, 可以看出各科的进化关系均比较保守。通过蛋白三级结构的预测分析发现拟南芥与不结球白菜具有相似的空间结构, 某些氨基酸改变并没有改变AKR4C9的构象, 推测其存在相似功能。
本研究通过对BcAKR4C9基因的4 ℃低温处理和42 ℃热激处理发现不结球白菜BcAKR4C9基因具有相似的表达趋势, 推测该基因在低温和高温的胁迫响应中可能具有一致的响应模式, 推测AKR基因与醛酮解毒的作用有关, 其调控机制有待进一步明确。通过不同浓度的NaCl处理发现, 在0~20 g·L-1的NaCl质量浓度范围内, 该基因表达量随NaCl质量浓度升高而升高。在麻风树中表达JcAKR基因的细菌和酵母细胞对NaCl(200 mmol·L-1)、甲基乙二醛(MG, 5 mmol·L-1)处理有更高的耐受性[16], 表明AKR基因在非生物胁迫耐受性中发挥作用。本研究发现不结球白菜BcAKR4C9基因能够被水杨酸、脱落酸和茉莉酸甲酯诱导表达, 脱落酸处理12 h, 表达量迅速达到峰值, 随后又迅速下降到接近对照水平。AKR在多种作物中被证明能够被脱落酸诱导表达[17]。目前关于该基因与不同激素之间的作用并未见报道。
由于非生物胁迫为降低作物产量的重要因素[1], 因此提高作物的抗逆性已经成为育种工作的重要目标之一。不结球白菜在长江中下游及以南地区被广泛种植[18], 不可避免会遭遇高温、低温、旱涝等多种逆境胁迫, 因此发掘不结球白菜的抗逆基因以及研究抗逆基因的功能不仅可以加深对作物抗逆机制的理解, 同时对于如何提高种质抗逆性具有重要的意义。
| [1] | Mittler R. Oxidative stress, antioxidants andstress tolerance[J]. Trends in Plant Science, 2002, 9(7): 405-410. |
| [2] | Pogány M, Pintye A, Simoneau P, et al. Dual roles ofreactive oxygen species and NADPH oxidase RBOHD in an Arabidopsis-Alternaria pathosystem[J]. Plant Physiology, 2009, 151: 1459-1475. DOI: 10.1104/pp.109.141994 |
| [3] | Simpson P J, Anna M C T, Owen C R, et al. Characterization of two novel aldo-keto reductases from Arabidopsis:expression patterns, broad substrate specificity, and an open active-site structure suggest a role in toxicant metabolism following stress[J]. Journal of Molecular Biology, 2009, 392: 465-480. DOI: 10.1016/j.jmb.2009.07.023 |
| [4] | Karuna S B, Rajendrakumar C S V, Reddy A R. Aldose reductase in rice(Oryza sativa L.):stress response and developmental specificity[J]. Plant Science, 2000, 160: 149-157. DOI: 10.1016/S0168-9452(00)00376-9 |
| [5] | Gavidia I, Pérez-Bermúdez P, Seitz H U. Cloning and expression of two novel aldo-keto reductases from Digitalis purpurea leaves[J]. European Journal of Biochemistry, 2002, 269: 2842-2850. DOI: 10.1046/j.1432-1033.2002.02931.x |
| [6] | Oberschall A, Deák K M, Török L, et al. A novel aldose/aldehyde reductase protects transgenic plants against lipid peroxidation under chemical and drought stresses[J]. The Plant Journal, 2000, 24(4): 437-446. DOI: 10.1046/j.1365-313x.2000.00885.x |
| [7] | Turóczy Z, Kis P K, Török M, et al. Overproduction of a rice aldo-keto reductase increases oxidative and heat stress tolerance by malondialdehyde and methylglyoxal detoxification[J]. Plant Molecular Biology, 2011, 75: 399-412. DOI: 10.1007/s11103-011-9735-7 |
| [8] | Senguptaab D, Naika D, Reddyb A. Plant aldo-keto reductases(AKRs)as multi-tasking soldiers involved in diverse plant metabolic processes and stress defense[J]. Journal of Plant Physiology, 2015, 179: 40-55. DOI: 10.1016/j.jplph.2015.03.004 |
| [9] | Jez J M, Bennett B, Schlegel M, et al. Penning comparative anatomy of the aldo-keto reductase superfamily[J]. The Biochememical Journal, 2001, 130/131/132: 499-525. |
| [10] | Petschacher B, Leitgeb S, Kavangagh K L, et al. The coenzyme specificity of Candida tenuis xylose reductase(AKR2B5)explored by site-directed mutagensis and X-ray crystallography[J]. Biochem, 2005, 385: 75-83. DOI: 10.1042/BJ20040363 |
| [11] | Ryota S, Ginga S, Akiko N. Functional analysis of the AKR4C subfamily of Arabidopsis thaliana:model structures, substrate specificity, acrolein toxicity, and responses to light and[CO2][J]. Biosci Biotechnol Biochem, 2013, 77(10): 2038-2045. DOI: 10.1271/bbb.130353 |
| [12] | Bartels D, Engelhardt K, Roncarati R, et al. An ABA and GA modulated gene expressed in the barley embryoencodes an aldose reductase related protein[J]. The EMBO Journal, 1991, 10(5): 1037-1043. |
| [13] | Éva C, Tóth G, Oszvald M, et al. Overproduction of an Arabidopsis aldo-keto reduc-tase increases barley tolerance to oxidative and cadmium stress by an in vivo reactive aldehyde detoxification[J]. Plant Growth Regul, 2014, 74: 55-63. DOI: 10.1007/s10725-014-9896-x |
| [14] | Éva C, Zelenyánszki H, Tömösközi-Farkas R, et al. Transgenic barley expressing the Arabidopsis AKR4C9 aldo-keto reductase enzyme exhibits enhanced freezing tolerance and regenerative capacity[J]. South African Journal of Botany, 2014, 93: 179-184. DOI: 10.1016/j.sajb.2014.04.010 |
| [15] | Tamura K, Peterson D, Peterson N. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Mol Biol Evol, 2011, 28(10): 2731-2739. DOI: 10.1093/molbev/msr121 |
| [16] | Mudalkar S, Sreeharsha R V, Reddy A R. A novel aldo-keto reductase from Jatropha curcas L. (JcAKR)plays a crucial role in the detoxification of methylglyoxal, a potent electrophile[J]. Plant Physiology, 2016, 195: 39-49. DOI: 10.1016/j.jplph.2016.03.005 |
| [17] | Kanayama Y, Mizutani R, Nishiyama M, et al. Characterization of an uncharacterized aldo-keto reductase gene from peach and its rolein abiotic stress tolerance[J]. Phytochemistry, 2014, 104: 30-36. DOI: 10.1016/j.phytochem.2014.04.008 |
| [18] |
李妍, 王雪花, 陈忠文, 等. 不结球白菜抗坏血酸合成基因BcGME的同源克隆及胁迫下的表达分析[J].
南京农业大学学报, 2016, 39(2): 205-212.
Li Y, Wang X H, Chen Z W, et al. Homologous cloning and expression analysis of ascorbic acid biosynthesis gene BcGME under stress from non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 205-212. DOI: 10.7685/jnau.201507026 (in Chinese with English abstract) |




