文章信息
- 李莹, 刘源, 张丹妮, 周光宏, 徐幸莲, 李春保, 郑福平
- LI Ying, LIU Yuan, ZHANG Danni, ZHOU Guanghong, XU Xinglian, LI Chunbao, ZHENG Fuping
- 传统与现代工艺金华火腿蛋白质的体外消化特性研究
- Study on in vitro digestibility of proteins from Jinhua ham between traditional and modern processes
- 南京农业大学学报, 2018, 41(1): 163-171
- Journal of Nanjing Agricultural University, 2018, 41(1): 163-171.
- http://dx.doi.org/10.7685/jnau.201704007
-
文章历史
- 收稿日期: 2017-04-07
2. 北京工商大学食品质量与安全北京实验室/北京食品营养与人类健康高精尖创新中心, 北京 100048;
3. 上海交通大学农业与生物学院, 上海 200240
2. Beijing Laboratory for Food Quality and Safety/Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Technology and Business University, Beijing 100048, China;
3. School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China
金华火腿是我国传统肉制品的典型代表, 具有1 200多年的历史, 以其色泽鲜艳、外形美观、香气浓郁、滋味鲜美、保存期长等特色而闻名中外[1-3]。蛋白质是火腿最主要的化学成分, 其分解氧化也是影响火腿营养品质的主要因素, 而干腌火腿是高生物价值蛋白质的良好来源[1, 4]。研究表明从不同成熟时期干腌火腿肌原纤维蛋白中分离出的肌动蛋白、原肌球蛋白和肌球蛋白重链发生了强烈的水解[5-7]。曹锦轩等[8]发现肌原纤维蛋白的主链及二级结构在腊肉整个加工过程中发生了变化, 氨基酸残基的疏水性在风干过程中得到了增强。邢路娟等[9]研究发现, 宣威火腿发酵过程中所形成的粗肽物质具有抗氧化活性。关于金华火腿加工过程中蛋白质变化的研究, 主要集中于蛋白质降解及影响因素、生物活性肽等方面, 而关于金华火腿中蛋白质营养特性及其消化产物的分析鲜有报道。
传统金华火腿加工周期为10个月, 主要依赖自然条件生产, 存在卫生质量难以控制等缺点[10]。而现代加工工艺是在可控的温度和湿度下的规模化清洁生产[11]。与传统工艺相比, 加工周期明显缩短, 用盐量明显降低, 产品的适口性明显改善[12-15]。Zhou等[16]研究发现干腌鹅腌制过程中盐分含量仅在干腌、湿腌和风干成熟3 d时影响组织蛋白酶B+L的活性, 且样品中肌原纤维蛋白的降解主要受组织蛋白酶B+L的影响。郑锦晓等[17]的研究显示:传统工艺金华火腿粗肽液螯合亚铁离子的能力及清除自由基的能力强于新工艺。随着生活水平的提高, 人们在关注金华火腿风味的同时, 也更加注重其品质与自身健康的关系, 由于蛋白质是影响火腿品质的主要因素之一, 并且2种工艺之间存在的差异(如加工时间、含盐量等因素的不同), 可能会影响相关酶与蛋白的附着、接触等, 因而使其在品质上有所差异, 但国内关于传统工艺和现代工艺对金华火腿蛋白质营养特性及在胃肠道消化产物的比较研究尚未见报道。因此, 本试验以传统和现代工艺下加工时间为2年的金华火腿中的蛋白质为对象, 以体外模拟胃肠道消化模型为载体, 采用蛋白质组学等技术, 研究不同加工工艺下金华火腿的蛋白质消化率及胃肠道消化产物的差异, 为金华火腿工艺改进及其蛋白质营养特性的认识提供理论基础。
1 材料与方法 1.1 材料与试剂金华火腿(分别为传统和现代加工工艺制作)购于浙江省金华市某火腿公司。试验样品由经验丰富的火腿技师分别随机选择8份两年陈火腿中的代表性火腿。样品取回后于-20 ℃保存。
胃蛋白酶(酶活力≥400 U·mg-1)和胰蛋白酶(酶活力≥1 645 U·mg-1), 购于Sigma-Aldrich (美国)公司; BCA蛋白定量试剂盒购于美国Thermo Scientific公司; 4%~12% Bis-Tris标准预制胶、XT样品缓冲液、XT MES上样缓冲液和蛋白标准品均购自美国Bio-Rad公司; Ultracel-10超滤管, 每管处理量0.5 mL, 截留相对分子质量≥10×103; ZipTip C18枪头皆购自美国Millipore公司。
1.2 仪器与设备GM200刀式研磨仪购于德国Retsech公司; TW20水浴锅购于德国Julabo公司; T25匀浆机购于德国IKA公司; Avanti J-C高速冷冻离心机购于美国Beckman Coulter公司; M2多功能酶标仪购于美国Molecular Devices公司; Fiveeasy台式pH计购于Mettler Toledo公司; LCG冷冻干燥机购于德国Christ公司; 中型垂直电泳系统购于美国Bio-Rad公司; Little Chalfont成像仪购于美国GE Health Care公司; 马尔文3000激光粒度仪购于英国Malvern公司; Nano LC-LTQ-Orbitrap XL MS/MS纳升级液相串联质谱仪购于美国Thermo Fisher公司。
1.3 体外模拟胃肠道消化试验根据Wen等[18]的方法并稍作修改。取火腿股二头肌几何中心部位瘦肉约200 g, 去除可见的脂肪层、皮层、肌腱和肌膜, 切成约1 cm3正方体大小后用研磨仪绞碎, 每份样品取1 g并加入4 mL PBS缓冲液(10 mmol·L-1 Na2HPO4-NaH2PO4, pH7.0)在冰浴下匀浆, 9 800 r·min-1匀浆30 s, 重复2次, 然后13 400 r·min-1匀浆30 s, 重复2次, 每次匀浆间隔30 s。用1 mol·L-1 HCl将匀浆液pH值调至2.0±0.1。每份样品加入1 mL胃蛋白酶预混液, 胃蛋白酶质量浓度为0.032 g·mL-1, 相当于加入0.032 g胃蛋白酶冻干粉。混合液在37 ℃的条件下匀速摇晃反应2 h。用1 mol·L-1的NaOH将混合液pH值快速调至7.0左右终止酶解反应, 调整最终pH值为7.5±0.1。从混合液中取出1 mL混合液即为胃蛋白酶水解产物。剩余混合液(约3 mL)中加入1 mL胰蛋白酶预混液, 胰蛋白酶的质量浓度为0.024 g·mL-1, 相当于加入0.024 g胰蛋白酶冻干粉。混合液在37 ℃下继续持续匀速摇晃反应2 h后, 在100 ℃沸水浴中加热5 min终止酶解反应, 取出1 mL混合液即为胃蛋白酶和胰蛋白酶两步水解产物。将胃蛋白酶水解产物以及两步所得水解产物分别加入3 mL无水乙醇, 在4 ℃的条件下静置12 h后离心(10 000 g, 4 ℃, 20 min), 分离上清液和沉淀分别用于后续试验。
1.4 蛋白质消化率的测定参照Wen等[18]的方法并稍作修改。称取2种工艺的火腿各2份, 每份3 g。一份只加胃蛋白酶进行消化, 另一份加胃蛋白酶和胰蛋白酶进行两步分步消化, 具体消化过程与1.3节相同。消化后的混合物冷却后直接离心(10 000 g, 4 ℃, 20 min), 弃去上清液, 沉淀放入50 ℃恒温干燥器中烘干至恒质量。消化率由如下方程计算:
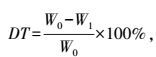
|
式中:DT为蛋白消化率; W1为消化后沉淀物质干燥后的质量(g), W0为消化前肉的总质量(g)。
1.5 消化粒径的测定参照Li等[19]的方法并稍作修改。取2种工艺下的金华火腿样品的匀浆液、胃蛋白酶酶解液以及经过胃蛋白酶和胰蛋白酶两步酶解的溶液, 使用马尔文3000激光粒度仪测定物质粒度大小。
1.6 全蛋白一维凝胶电泳参照Li等[19]的方法并稍作修改。称取消化前火腿样品1.0 g, 分别加入15 mL全蛋白提取液(5 g·L-1SDS, 10 mmol·L-1 PBS)在冰浴下匀浆, 先9 800 r·min-1匀浆30 s, 重复2次, 再13 400 r·min-1匀浆30 s, 重复2次, 每次匀浆间隔30 s。放入恒温水浴锅中80 ℃水浴20 min。对于已经消化的样品, 取离心后的沉淀, 每份样品中加入15 mL全蛋白提取液, 并放入恒温水浴锅中80 ℃水浴20 min。水浴后的样品混合液在1 500 g、4 ℃下离心20 min并取上清液。用BCA试剂盒测定上清液中蛋白质浓度。在96孔酶标板上每孔中各加入25 μL的待测样品和200 μL的工作液, 以全蛋白提取液作为空白对照。在562 nm下测定, 每个样品测定3次。
在电泳前取一定量上述上清液并与适量样品缓冲液混匀, 制成蛋白质量浓度为1.5 μg·μL-1总量为200 μL的上样准备液。准备液在100 ℃沸水浴加热5 min。采用40~120 g·L-1 Bis-Tris标准预制胶, 每条泳道上样12 μL, 每管样品平行上样2次以减少误差。将XT MES电泳缓冲液用双蒸水稀释20倍后加入电泳槽中, 在120 V、4 ℃下电泳约2 h, 直至电泳条带前端的溴酚蓝消失即可终止电泳。
在电泳结束后, 用考马斯亮蓝R-250溶液(1 g考马斯亮蓝R-250, 甲醇、冰醋酸、双蒸水体积比为450:100:450)对胶进行染色, 脱色(甲醇、冰醋酸、双蒸水体积比为100:100:800)至背景无颜色, 条带清晰可见。脱色完成后, 用成像仪扫描凝胶并保存图像, 用Quantity One (Bio-Rad)软件对捕获到的条带光密度进行定量分析, 以标准品中250×103条带光密度为基准, 计算每张胶上条带光密度的相对量作为相对浓度。每组样品进行SDS-PAGE电泳试验时均为8个重复, 2个平行。
1.7 消化产物中多肽序列的鉴定消化产物中多肽序列的鉴定参照Li等[19]的方法并稍作修改。取只经过胃蛋白酶消化和经过胃蛋白酶与胰蛋白酶两步消化的火腿消化液中醇溶性上清液(1.3节所述), 运用纳升级液相串联质谱仪(Nano LC-LTQ-Orbitrap XL MS/MS)来鉴定酶解消化产物。在上清液中加入10 mL蒸馏水混匀后倒入塑料平皿中, 然后放入冷冻干燥器中冻干36 h, 用1 mL PBS缓冲液复溶后转移至5 mL离心管中, 继续放入冷冻干燥器中冻干48 h, 冻干后取出样品并用400 μL的A液(含60%乙腈, 0.2%甲酸)复溶, 转移至1.5 mL离心管中离心(6 500 g, 4 ℃, 20 min), 取上清液。样品过Ultracel-10超滤管离心(14 000 g, 4 ℃, 20 min), 去除10×103以上的大分子杂质, 然后通过ZipTip C18 pipette tips进行脱盐。用Nano-drop测定脱盐后酶解消化产物中的蛋白质浓度, 吸取一定体积的溶液, 保证上样蛋白量为1.5 μg。
利用Proteome Discover-1.4(Thermo Fisher Scientific, USA)在SWISS-PROT家猪(Sus scrofa)数据库(http://www.uniprot.org/)中搜索与其匹配的肽段二级质谱数据。搜索的参数设置:母离子质量浓度公差为10 mg·L-1, Oxidation of Met设为可变修饰, 允许漏切位点目数为2。针对胃蛋白酶消化产物, 选择胃蛋白酶酶切方式; 而针对两步消化产物, 选择胃蛋白酶和胰蛋白酶2种酶切方式搜索结果的并集, 用维恩图来分析传统与现代工艺金华火腿蛋白质酶解肽段的相似程度。
1.8 数据统计分析采用SAS 9.2软件进行单因素方差分析和差异显著比较。
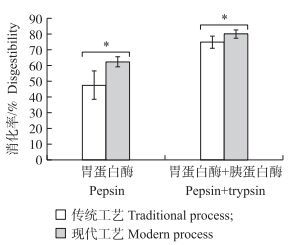
2 结果与分析 2.1 传统与现代工艺金华火腿蛋白质体外消化率的比较由图 1可知:2种工艺下加工的金华火腿经过消化酶酶解后, 蛋白质消化率差异显著(P < 0.05), 且现代工艺火腿的消化率显著高于传统工艺。这可能是由于现代工艺火腿蛋白质降解程度更高, 更有利于酶解。结果表明金华火腿经过现代工艺的改进, 其蛋白质的营养价值明显提高。
|
图 1 传统与现代工艺金华火腿蛋白质的体外消化率(x±SD, n=8) Figure 1 In vitro protein digestibility of Jinhua ham made by traditional process and modern process *P < 0.05. |
由表 1可以看出:在体外模拟消化过程中, 传统工艺和现代工艺火腿在经过胃蛋白酶一步消化以及胃蛋白酶和胰蛋白酶两步消化后, 粒径数值均表现出明显的减小趋势。2种工艺下的火腿在3种处理下粒径数值均呈显著差异。传统工艺的金华火腿粒径数值大部分均显著大于现代工艺。
| 处理Treatment | 工艺Process | D3, 2 | D4, 3 | Dx(10) | Dx(50) | Dx(90) |
| 未消化 Undigested | 传统工艺 Traditional process | 47.43±6.45a | 182.60±7.73a | 22.10±5.85a | 117.40±7.50a | 458.67±9.07a |
| 现代工艺 Modern process | 22.20±5.58b | 99.10±5.78b | 7.23±2.47b | 92.36±9.78b | 316.75±13.18b | |
| 胃蛋白酶消化 Pepsin-digested | 传统工艺 Traditional process | 18.17±2.18a | 97.50±8.25a | 5.64±0.54a | 72.05±4.55a | 199.40±6.95a |
| 现代工艺 Modern process | 13.54±2.44b | 88.65±5.90b | 5.45±0.89a | 69.04±4.46b | 130.75±7.93b | |
| 胃蛋白酶和胰蛋白酶消化 Pepsin/trypsin-digested | 传统工艺 Traditional process | 14.41±2.20a | 43.38±2.79b | 5.01±1.02a | 31.53±2.06a | 107.33±3.56b |
| 现代工艺 Modern process | 10.47±1.58b | 46.47±4.33a | 4.48±1.28b | 20.57±2.80b | 110.25±8.38a | |
| 注:1) D3, 2表示在表面积中的平均直径; D4, 3表示在体积中的平均直径; Dx(10) 表示样品中有10%的颗粒粒径小于该数值; Dx(50) 表示样品中有50%的颗粒粒径小于该数值; Dx(90) 表示样品中有90%的颗粒粒径小于该数值。 2)不同字母表示不同工艺间差异显著(P < 0.05)。 Note:1) D3, 2 represents the mean diameter in surface; D4, 3 represents the mean diameter in volume; Dx(10) represents the size for which 10% of the sample particles have a lower size; Dx(50) represents the size for which 50% of the sample particles have a lower size; Dx(90) represents the size for which 90% of the sample particles have a lower size. 2) The different letters between different processes indicate significant difference at 0.05 level. | ||||||
由图 2可知:在酶解前, 传统与现代工艺火腿蛋白质电泳图谱存在明显差异, 传统工艺火腿的大部分蛋白质条带光密度要显著高于现代工艺火腿(图 2-a和表 2), 表明加工工艺的不同导致蛋白质降解程度的差异。现代工艺的火腿高分子质量蛋白条带区光密度要明显高于传统工艺火腿(图 2-a)。经过胃蛋白酶消化后, 火腿中大分子蛋白质被降解成小分子的肽和氨基酸, 传统工艺火腿的大部分蛋白质条带光密度要显著低于现代工艺火腿(图 2-b和表 2)。而再进一步经过胰蛋白酶酶解后, 几乎没有明显的条带出现, 表明2种工艺火腿的蛋白质降解均较为彻底(图 2-c)。

|
图 2 传统与现代工艺金华火腿蛋白质消化前后SDS-PAGE代表性图谱 Figure 2 SDS-PAGE profiles of proteins from the Jinhua ham made by traditional process and modern process before and after digestion a.消化前全蛋白样品; b.胃蛋白酶消化产物; c.胃蛋白酶+胰蛋白酶消化产物。M:蛋白标准品; TP:传统工艺; MP:现代工艺。数字1~10分别是泳道上检测到的条带编号, 详细的条带鉴定信息见表 2。 a.Whole protein samples before digestion; b.Pepsin-digested products; c.Pepsin and trypsin-digested products. M:Marker; TP:Traditional process; MP:Modern process. 1-10:The numbers of the bands detected on the lanes, respectively, and more details seen in Table 2. |
| 条带 Band | 全蛋白Whole proteins | 胃蛋白酶消化产物Pepsin digested products | |||
| 传统工艺Traditional process | 现代工艺Modern process | 传统工艺Traditional process | 现代工艺Modern process | ||
| 1 | 0.81±0.05a | 0.75±0.02b | 0.36±0.04b | 0.44±0.04a | |
| 2 | 0.80±0.03a | 0.76±0.04a | 0.36±0.05b | 0.44±0.03a | |
| 3 | 0.83±0.02a | 0.73±0.02b | 0.49±0.16a | 0.54±0.21a | |
| 4 | 0.88±0.02a | 1.11±0.59a | 1.05±0.88a | 0.71±0.04a | |
| 5 | 0.90±0.03a | 1.57±1.32a | 0.60±0.16a | 0.58±0.03a | |
| 6 | 0.88±0.02a | 1.11±0.38a | 0.66±0.05a | 0.58±0.03b | |
| 7 | 1.42±0.61a | 0.69±0.13b | 0.59±0.04b | 0.73±0.03a | |
| 8 | 0.85±0.11a | 0.57±0.02b | 0.63±0.05b | 0.69±0.02a | |
| 9 | 0.76±0.03a | 0.53±0.03b | 0.64±0.03 | — | |
| 10 | 0.69±0.02 | — | 0.66±0.03 | — | |
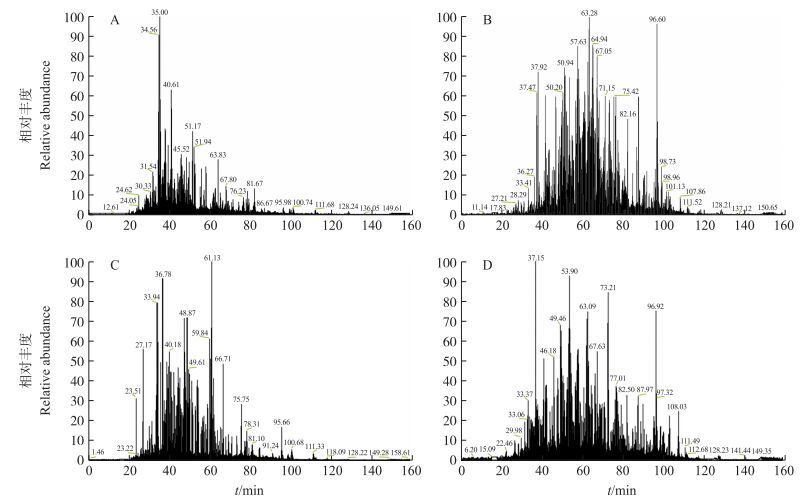
由图 3可以看出:2种工艺下的金华火腿蛋白质醇溶性肽段存在显著差异。质谱图的数据结果包含了相对分子质量为800~3 500之间的肽段。2种工艺下的金华火腿经过胃蛋白酶(图 3-A、C), 以及胃蛋白酶和胰蛋白酶(图 3-B、D)酶解后的总离子流图有明显差异。现代工艺的金华火腿酶解肽段中较早被C18反相柱洗脱出来的数量较传统工艺多, 说明现代工艺的金华火腿酶解肽段中极性较大的肽段更多, 更容易被胰蛋白酶或者其他酶水解, 这和体外消化率的变化规律一致。
|
图 3 传统与现代工艺金华火腿的蛋白质酶解产物LC-MS/MS总离子流图 Figure 3 Representative TIC spectra of ethanol-soluble fragments from in vitro digested products of Jinhua ham made by traditional process and modern process A:传统工艺胃蛋白酶酶解产物; B:传统工艺胃蛋白酶和胰蛋白酶酶解产物; C:现代工艺胃蛋白酶酶解产物; D:现代工艺胃蛋白酶和胰蛋白酶酶解产物。 A:In vitro digested products with pepsin by traditional process; B:In vitro digested products with pepsin and trypsin by traditional process; C:In vitro digested products with pepsin by modern process; D:In vitro digested products with pepsin and trypsin by modern process. |
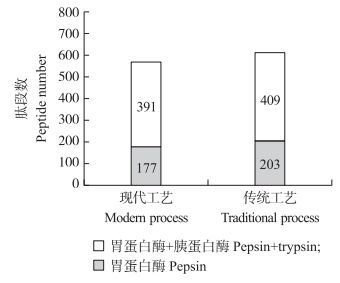
由图 4可见:经过胃蛋白酶消化后, 传统工艺火腿中酶解出更多的肽段, 传统与现代工艺火腿中分别被检测到203个肽段和177个肽段, 肽段相对分子质量主要集中于1 500~2 500(图 5)。
|
图 4 传统与现代工艺金华火腿的蛋白质酶解产物肽段总数 Figure 4 Total numbers of identified peptides from Jinhua ham made by traditional process and modern process |

|
图 5 传统与现代工艺金华火腿的蛋白质胃蛋白酶酶解产物肽段数统计 Figure 5 Statistics of peptides on the basis of molecular weights from Jinhua ham made by traditional process and modern process after pepsin digestion |
经过胰蛋白酶酶解后, 传统工艺火腿的肽段总数仍高于现代工艺, 分别被检测到409和391个肽段。但传统工艺火腿的消化率低于现代工艺, 可能是因为现代工艺火腿蛋白质被酶解消化后得到的消化产物片段大小为800, 未能被仪器检测到。由图 6可知:肽段相对分子质量仍然主要分布于1 500~2 500。与经过胃蛋白酶一步消化后的肽段数相比, 传统工艺和现代工艺的火腿肽段数分别增加了2.0倍和2.2倍。并且一些经过胃蛋白酶消化后的肽段在经过胰蛋白酶消化后仍可以被检测到, 表明这些肽段并未被胰蛋白酶消化。由质谱鉴定结果可知:2种工艺火腿蛋白质酶解肽段主要来自于肌原纤维蛋白, 尤其是肌球蛋白。
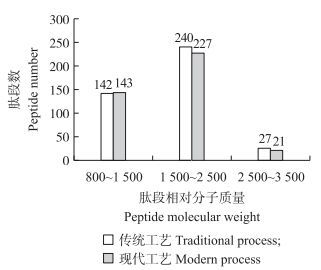
|
图 6 传统与现代工艺金华火腿的胃蛋白酶和胰蛋白酶酶解产物肽段数统计 Figure 6 Statistics of peptides on the basis of molecular weights from Jinhua ham made by traditional process and modern process after pepsin and trypsin digestion |
进一步分析表明:2种工艺下的金华火腿经过胃蛋白酶消化后有141个相同的肽段, 传统工艺和现代工艺火腿分别有59和31个特异性肽段(图 7)。再经过胰蛋白酶消化后有283个相同的肽段, 传统工艺和现代工艺火腿分别有99和75个特异性肽段。
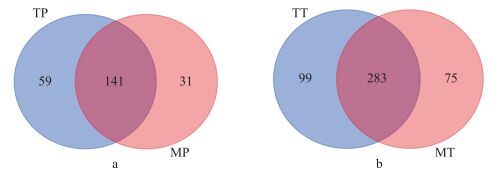
|
图 7 传统与现代工艺金华火腿蛋白质消化产物的韦恩图(n=8)
Figure 7 Venn diagrams of peptides from Jinhua ham made by traditional process and modern process
1) a.胃蛋白酶消化产物序列差异数量分析; b.胃蛋白酶和胰蛋白酶消化产物序列数量差异分析。 2) TP:经过胃蛋白酶消化的传统工艺金华火腿的蛋白质酶解肽段; MP:经过胃蛋白酶消化的现代工艺金华火腿的蛋白质酶解肽段; TT:进一步经过胰蛋白酶消化的传统工艺金华火腿的蛋白质酶解肽段; MT:进一步经过胰蛋白酶消化的现代工艺金华火腿的蛋白质酶解肽段。 1) a.Quantitative analysis of in vitro pepsin digestion sequence differences; b.Quantitative analysis of in vitro pepsin and trypsin digestion sequence differences. 2) TP:Peptides from Jinhua ham made by traditional process after pepsin digestion; MP:Peptides from Jinhua ham made by modern process after pepsin digestion; TT:Peptides from Jinhua ham made by traditional process after pepsin and trypsin digestion; MT:Peptides from Jinhua ham made by modern process after pepsin and trypsin digestion. |
Toldrá等[20]研究发现火腿加工过程中肌肉蛋白质会发生强烈的水解, 产生大量至关重要的氨基酸。在金华火腿加工过程中超过10%的肌肉蛋白发生降解[21]。于荟等[22]研究表明现代工艺金华火腿的蛋白质降解率高于传统工艺。本研究进一步发现, 现代工艺金华火腿的蛋白质消化率要显著高于传统工艺产品。说明金华火腿生产由传统的依靠自然条件革新为全智能控温控湿的现代化工艺后, 其蛋白质的营养价值有所提高。
蛋白酶种类以及酶切过程都会影响蛋白质的消化率[23]。蛋白质消化率的影响因素还包括蛋白质来源、原料粒径等[24-25]。Sun等[26]通过对广式腊肠的体外消化研究发现, 胃蛋白酶活性与羰基的形成、二硫键连接、蛋白质表面疏水性以及D4, 3指标呈负相关。由于蛋白质氧化导致蛋白质聚集、二级结构以及分子疏水性的改变, 更进一步的影响了蛋白质体外消化率。因此, 通过比较2种工艺金华火腿粒径值的变化也可以从某种程度上解释金华火腿蛋白质消化率差异的原因。本研究结果发现, 现代工艺金华火腿的粒径值在未经过酶解前、经过胃蛋白酶消化后以及经过胃蛋白酶和胰蛋白酶消化后均显著低于传统工艺。这可能是由于传统工艺的盐量高, 脱水作用更强, 使蛋白质的分子结构更加紧凑; 蛋白质的聚集影响其与消化酶的接触, 导致消化率降低。干腌制品的盐腌和干燥均会引起蛋白质表面疏水性的增加, 且蛋白质氧化和聚集也会引起分子结构的凝集[27]。因此也可能是由于传统工艺较长时间的风干成熟引起其蛋白质分子结构凝集, 导致物质粒径值较大。
本研究中SDS-PAGE结果表明, 在未经酶解反应前的样品中, 传统工艺金华火腿大部分蛋白条带的光密度显著高于现代工艺的金华火腿。结合现代工艺火腿蛋白质消化率高且粒径小的特点推测这可能是由于依赖自然条件生产的传统工艺产品的蛋白质聚集和氧化程度更严重所致, 也可能是由于现代工艺的火腿在内源蛋白酶和肽酶等的作用下蛋白水解程度高于传统工艺所致。而经过胃蛋白酶消化后, 传统工艺金华火腿大部分蛋白条带的光密度显著低于现代工艺的金华火腿, 但其胃蛋白酶消化率显著低于现代工艺, 因此该结果可能是由于其被胃蛋白酶消化后的肽段颗粒较大, 从而未能进入泳道所致。传统工艺火腿存在一部分较高分子质量的蛋白条带。Li等[19]通过SDS-PAGE研究了不同肉制品加工方式对蛋白质体外消化的影响, 结果表明干腌猪肉的电泳条带光密度值为4种加工方式中最高, 并与Wen等[18]得到的研究结果类似, 这可能是由于较长成熟时间和较高加工温度导致蛋白质交联引起的。
Paolella等[28]通过纳升级液相色谱串联质谱仪鉴定了巴玛火腿中的体外消化酶解肽段, 最终鉴定出了81个不同肽段, 主要来自于肌原纤维蛋白和肌浆蛋白, 且相对分子质量主要在200~1 700之间, 其中包括了大量较短序列的肽段。本研究结果表明, 金华火腿酶解出的肽段大多来自于肌原纤维蛋白, 主要是肌球蛋白。并且2种工艺下金华火腿的质谱鉴定结果显示, 传统工艺火腿酶解产物的种类和数量均高于现代工艺, 但是现代工艺火腿无论是经过胃蛋白酶一步消化还是经过胃蛋白酶和胰蛋白酶两步消化, 其极性肽段均多于传统工艺, 因此更容易与酶结合而被酶解消化, 消化率高于传统工艺。由维恩图结果可知, 由消化酶酶解后的2种工艺的火腿分别具有许多特异性肽段, 而这些特异性肽段所具有的生物功能有待进一步研究。
综上, 本研究通过体外模拟胃肠道消化对2种加工工艺金华火腿蛋白质的消化率、酶解产物进行分析后得知, 现代工艺金华火腿的消化特性要优于传统工艺, 而对于引起这些差异的具体原因仍然有待于进一步研究。
| [1] |
张亚军, 陈有亮. 金华火腿蛋白降解及其影响因素的研究[J].
中国食品学报, 2005, 5(3): 16-24.
Zhang Y J, Chen Y L. Degradation of protein and its influencing factors in Jinhua ham[J]. Journal of Chinese Institute of Food Science and Technology, 2005, 5(3): 16-24. (in Chinese with English abstract) |
| [2] |
乔发东. 干腌火腿皮下脂肪的特性与食用品质的关系[J].
食品与发酵工业, 2006, 32(1): 134-137.
Qiao F D. The relationship between the characteristics of subcutaneous fat and the edible quality of dry-cured ham[J]. Food and Fermentation Industries, 2006, 32(1): 134-137. (in Chinese with English abstract) |
| [3] |
要萍, 乔发东, 闫红, 等. 宣威火腿挥发性风味成分的分离与鉴定[J].
食品科学, 2004, 25(2): 146-150.
Yao P, Qiao F D, Yan H, et al. Isolation and identification of volatile compounds of Xuanwei ham[J]. Food Science, 2004, 25(2): 146-150. (in Chinese with English abstract) |
| [4] |
佟彤, 杨浩, 王桂瑛, 等. 干腌火腿营养成分的研究进展[J].
农产品加工(学刊), 2013(5): 47-49.
Tong T, Yang H, Wang G Y, et al. Advance of nutritional composition of dry-cured ham[J]. Academic Periodical of Farm Products Processing, 2013(5): 47-49. (in Chinese with English abstract) |
| [5] | Di L A, Picariello G, Trani A, et al. Occurrence of beta-casein fragments in cold-stored and curdled river buffalo (Bubalus bubalis L.) milk[J]. Journal of Dairy Science, 2009, 92(4): 1319-1329. DOI: 10.3168/jds.2008-1220 |
| [6] | Larrea V, Hemando I, Quiles A, et al. Changes in proteins during Teruel dry-cured ham processing[J]. Meat Science, 2006, 74(3): 586-593. DOI: 10.1016/j.meatsci.2006.05.009 |
| [7] | Gallego M, Mora L, Aristoy M C, et al. Evidence of peptide oxidation from major myofibrillar proteins in dry-cured ham[J]. Food Chemistry, 2015, 187: 230-235. DOI: 10.1016/j.foodchem.2015.04.102 |
| [8] |
曹锦轩, 张玉林, 韩敏义, 等. 腊肉加工过程中肌原纤维蛋白结构的变化[J].
中国农业科学, 2013, 46(18): 3871-3877.
Cao J X, Zhang Y L, Han M Y, et al. Changes of the construction of myofibrillar proteins in Chinese traditional bacon during processing[J]. Scientia Agricultura Sinica, 2013, 46(18): 3871-3877. DOI: 10.3864/j.issn.0578-1752.2013.18.017 (in Chinese with English abstract) |
| [9] |
邢路娟, 胡亚亚, 周光宏, 等. 宣威火腿中粗肽的提取与抗氧化活性鉴定[J].
南京农业大学学报, 2015, 38(4): 661-666.
Xing L J, Hu Y Y, Zhou G H, et al. The extraction and antioxidant activities of crude peptides from Xuanwei ham[J]. Journal of Nanjing Agricultural University, 2015, 38(4): 661-666. DOI: 10.7685/j.issn.1000-2030.2015.04.021 (in Chinese with English abstract) |
| [10] |
夏博能. 传统工艺与现代工艺金华火腿的品质比较研究[D]. 杭州: 浙江大学, 2016.
Xia B N. Study on the quality comparison of Jinhua ham made by traditional technology and modern technology[D]. Hangzhou:Zhejiang University, 2016(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10335-1016327432.htm |
| [11] |
章建浩, 唐志勇, 曾弢, 等. 金华火腿发酵成熟现代工艺及装备研究[J].
农业工程学报, 2006, 22(8): 230-234.
Zhang J H, Tang Z Y, Zeng T, et al. Modern process and equipment for fermenting-ripening of Jinhua ham[J]. Transactions of the CSAE, 2006, 22(8): 230-234. (in Chinese with English abstract) |
| [12] | Benedini R, Parolari G, Toscani T, et al. Sensory and texture properties of Italian typical dry-cured hams as related to maturation time and salt content[J]. Meat Science, 2012, 90(2): 431-437. DOI: 10.1016/j.meatsci.2011.09.001 |
| [13] | Laureati M, Buratti S, Giovanelli G, et al. Characterization and differentiation of Italian Parma, San Daniele and Toscano dry-cured hams:a multi-disciplinary approach[J]. Meat Science, 2014, 96(1): 288-294. DOI: 10.1016/j.meatsci.2013.07.014 |
| [14] | Toldrá F, Flores M. The role of muscle proteases and lipases in flavor development during the processing of dry-cured ham[J]. Critical Reviews in Food Science and Nutrition, 1998, 38(4): 331-352. DOI: 10.1080/10408699891274237 |
| [15] | Virgilii R, Saccani G, Gabba L, et al. Changes of free amino acids and biogenic amines during extended ageing of Italian dry-cured ham[J]. LWT-Food Science and Technology, 2007, 40(5): 871-878. DOI: 10.1016/j.lwt.2006.03.024 |
| [16] | Zhou C Y, Wang Y, Cao J X, et al. The effect of dry-cured salt contents on accumulation of non-volatile compounds during dry-cured goose processing[J]. Poultry Science, 2016, 95(9): 2160-2166. DOI: 10.3382/ps/pew128 |
| [17] |
郑锦晓, 胡亚亚, 邢路娟, 等. 传统工艺和新工艺金华火腿中抗氧化肽的比较[J].
南京农业大学学报, 2016, 39(2): 312-317.
Zheng J X, Hu Y Y, Xing L J, et al. Research about peptides extracted from Jinhua ham under different processing technology[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 312-317. DOI: 10.7685/jnau.201508028 (in Chinese with English abstract) |
| [18] | Wen S, Zhou G, Song S, et al. Discrimination of in vitro and in vivo digestion products of meat proteins from pork, beef, chicken, and fish[J]. Proteomics, 2015, 15(21): 3688-3698. DOI: 10.1002/pmic.201500179 |
| [19] | Li L, Liu Y, Zou X, et al. In vitro protein digestibility of pork products is affected by the method of processing[J]. Food Research International, 2017, 92: 88-94. DOI: 10.1016/j.foodres.2016.12.024 |
| [20] | Toldrá F, Aristoy M C. Availability of essential amino acids in dry-cured ham[J]. International Journal of Food Sciences and Nutrition, 2009, 44(3): 215-219. |
| [21] | Zhao G M, Tian W, Liu Y X, et al. Proteolysis in biceps femoris, during Jinhua ham processing[J]. Meat Science, 2008, 79(1): 39-45. DOI: 10.1016/j.meatsci.2007.07.030 |
| [22] |
于荟, 陈有亮, 王联潮, 等. 全程智能化控制生产的金华火腿蛋白质降解情况研究[J].
肉类工业, 2011(11): 3-5.
Yu H, Chen Y L, Wang L C, et al. Protein degradation of Jinhua ham under intelligent control of whole process[J]. Meat Industry, 2011(11): 3-5. DOI: 10.3969/j.issn.1008-5467.2011.11.002 (in Chinese with English abstract) |
| [23] | Esm A A. Effects of baking on protein digestibility of organic spelt products determined by two in vitro digestion methods[J]. LWT-Food Science and Technology, 2008, 41(7): 1282-1288. DOI: 10.1016/j.lwt.2007.07.018 |
| [24] |
袁磊, 唐瑜, 刘晓庚. 蛋白质消化率的影响因素研究[J].
粮食科技与经济, 2015, 40(3): 43-46.
Yuan L, Tang Y, Liu X G. Study on influencing factors of protein digestibility[J]. Grain Science and Technology and Economy, 2015, 40(3): 43-46. (in Chinese with English abstract) |
| [25] | Duodu K G, Taylor J R N, Belton P S, et al. Factors affecting sorghum protein digestibility[J]. Journal of Cereal Science, 2003, 38(2): 117-131. DOI: 10.1016/S0733-5210(03)00016-X |
| [26] | Sun W Z, Zhao H F, Zhao Q Z, et al. Structural characteristics of peptides extracted from Cantonese sausage during drying and their antioxidant activities[J]. Innovative Food Science and Emerging Technologies, 2009, 10(4): 558-563. DOI: 10.1016/j.ifset.2009.07.006 |
| [27] | Wen S Y, Zhou G H, Li L, et al. Effect of Cooking on in vitro digestion of pork proteins:a peptidomic perspective[J]. Journal of Agriculture and Food Chemistry, 2015, 63(1): 250-261. DOI: 10.1021/jf505323g |
| [28] | Paolella S, Falavigna C, Faccini A, et al. Effect of dry-cured ham maturation time on simulated gastrointestinal digestion:characterization of the released peptide fraction[J]. Food Research International, 2014, 67: 136-144. |




