文章信息
- 付园园, 陈坤琳, 王振云, 周光宏, 李惠侠
- FU Yuanyuan, CHEN Kunlin, WANG Zhenyun, ZHOU Guanghong, LI Huixia
- Chemerin调控牛肌内成熟脂肪细胞脂解的作用机制
- Lipolysis mechanism of Chemerin in bovine intramuscular mature adipocytes
- 南京农业大学学报, 2018, 41(1): 120-125
- Journal of Nanjing Agricultural University, 2018, 41(1): 120-125.
- http://dx.doi.org/10.7685/jnau.201703100
-
文章历史
- 收稿日期: 2017-03-28
2. 南京农业大学肉品加工与质量控制教育部重点实验室, 江苏 南京 210095
2. Key Laboratory of Meat Products Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China
肌内脂肪(intramuscular fat, IMF)含量与肉品质呈正相关, 直接影响肉的嫩度和多汁性, 是肉质指标中的重要参数[1]。脂肪在动物体内总是处于动态平衡状态, 脂肪合成和分解相对速度决定了机体内脂肪含量[2]。有研究表明, 脂肪细胞自分泌细胞因子Chemerin是调节脂肪沉积量的重要因素, 但其在大型家畜肌内脂肪沉积中的具体机制仍不清楚[3]。
Chemerin也称作视黄酸受体反应蛋白2(retinoic acid receptor responder 2, RARRES2), 是2007年发现的一种新型脂肪因子, 主要作用于G蛋白偶联受体1(CMKLR1, 或ChemR23), 并通过自分泌或旁分泌途径作用于脂肪细胞[4]。早期研究结果表明, Chemerin经半胱氨酸蛋白酶作用而产生的Chemerin同源肽具有很强的抗炎活性[5]。随着研究深入, 发现Chemerin及其受体能够通过诱导前体脂肪细胞的早期分化, 在脂肪沉积过程中可能起着重要作用[6-8]。过氧化物酶体增殖物激活受体α(PPARα)、脂蛋白脂酶(LPL)与敏感性甘油三酯脂肪酶(HSL)是脂肪分解的关键调控蛋白[9-10]。在脂解过程中, PPARα激活后能够调节糖脂代谢并促进LPL的表达, 其中LPL以同源二聚体的形式发挥甘油三酯水解酶的功能分解甘油三酯(TG)[11], 而HSL具有脂解级联性, 能执行脂解的第二步骤和分解甘油二酯(DG), 最终分解为甘油和游离脂肪酸(FFA)[12]。本研究以牛肌内成熟脂肪细胞为试验材料, 分析Chemerin对牛肌内成熟脂肪细胞的脂解作用及其调节机制, 探索大型肉用家畜肌内脂肪沉积分子途径, 为改善肉品质提供试验依据。
1 材料与方法 1.1 试验材料与试剂肌内脂肪采自西门塔尔牛(来自江苏省灌南县悦诚牧业有限公司)背最长肌肌肉内。Chemerin (2325-CM-025)购于R & D公司, 溶解于含有10 g·L-1的牛血清白蛋白(FBS)的PBS中, 稀释成100 μg·mL-1母液, 过滤除菌, -20 ℃保存。高糖DMEM培养基购自Hyclone公司; 胎牛血清(FBS)购于浙江天杭生物科技有限公司; 脂肪细胞分化诱导液(Cyagen Biosciences Inc产品)、甘油测定试剂盒(Applygen Technologies产品)、游离脂肪酸测定试剂盒购于南京建成生物研究所; Trizol试剂购自Invitrogen公司; PrimeScriptTM RT Master Mix、SYBR Premix Ex Taq Ⅱ购自TaKaRa公司; Ⅰ型胶原酶(Sigma产品); PPARα多抗(ab126285)购于Abcam公司; LPL多抗(sc-32382)、HSL多抗(sc-25843)购于Santa Cruz公司; α-tubulin (2125)购于Cell Signaling Technology公司。
1.2 牛肌内成熟脂肪细胞培养和处理成熟脂肪细胞的分离、培养采用李惠侠等[13]方法。即切取牛背部最长肌组织块, 经体积分数为75%的乙醇浸泡30 s, 再用PBS (含双抗)冲洗2次后置于一次性培养皿中移入超净工作台, 在酒精灯下严格操作。分离肌内脂肪组织, 然后用PBS洗涤并切成约1 mm3的小组织块。在37 ℃水浴中用1 mg·mL-1的Ⅰ型胶原酶消化脂肪组织1 h, 然后立即加入DMEM完全培养基(含100 g·L-1 FBS和10 g·L-1双抗)进行终止消化, 然后连续通过100 μm和70 μm尼龙网过滤, 并以1 000 r·min-1离心5 min, 收集上清液并在装有完全培养基的25 cm2培养瓶中倒置培养。因脂肪细胞浮力小, 会贴壁培养瓶“天花板”生长。7 d后, 将培养瓶正常放置, 继续培养。每隔3 d用完全培养基换液, 直至脂肪细胞去分化, 产生没有可见脂滴的成纤维细胞样形状。以5×104 mL-1细胞密度接种于6孔板中, 加入含100 g·L-1 FBS的DMEM/HIGH培养基, 在37 ℃、5% CO2培养箱中培养。2 d后除去含有血清的培养基, 加入分化诱导液, 在诱导分化12 d后, 即获得牛肌内成熟脂肪细胞。将分化液换成培养基培养细胞, 设为脂解0 d。试验设对照组, Chemerin组(0.1 μg·mL-1), 处理4 d。
1.3 油红O染色与量化将各组细胞制成细胞爬片, 处理4 d后移去细胞培养液, 用PBS洗1次, 加入2 mL 4%(体积分数)多聚甲醛固定液固定细胞30 min, PBS洗1次后, 油红O染色细胞30 min, 70%乙醇清洗, 最后用PBS清洗2次, 倒置显微镜下观察染色结果。染色后用异丙醇萃取细胞中的脂质, 测定萃取溶液的D510值。
1.4 甘油释放量测定收集处理组和对照组细胞培养基, 通过比色法测定培养基中甘油的含量。将50 μL培养基加入150 μL甘油测定工作液中, 37 ℃反应10 min后测定D550值, 利用标准曲线求相应的甘油释放。
1.5 游离脂肪酸释放量测定收集处理组和对照组细胞培养基, 200 μL培养基加入0.5 mL缓冲液, 加入1 mL铜试剂(Cu Reagent), 旋涡振荡30 s, 充分抽提2 min。3 500 g离心10 min后取2 mL下层抽提液, 加0.25 mL显色试剂, 混匀, 室温孵育2 min后测定D440值。
1.6 RNA的提取与RT-qPCR测定收集处理组和对照组细胞, 按Trizol试剂盒说明书提取细胞总RNA, 琼脂糖电泳检测RNA质量, 超微量分光光度计测定其浓度。用反转录试剂盒(TaKaRa)进行反转录(RT), 采用SYBR Green qPCR法检测RNA的表达水平。反应体系:SYBR Greenl 10 μL, 上、下游引物(10 μmol·L-1)各0.2 μL, cDNA 2 μL, 补充ddH2O至20 μL。反应条件:95 ℃变性2 min, 95 ℃变性20 s, 60 ℃退火20 s, 72 ℃复性延伸1 min, 40个循环。引物序列见表 1。
| 基因Gene | 基因登录号GenBank ID | 引物对序列(5′→3′)Prime pairs sequences |
| PPARα | NM_001034036.1 | GCTGCAAGGGTTTCTTTAGG/CTGAAAGGCACTTGTGGAAA |
| LPL | DQ186789.1 | TTCTTCTCCCTGGCAGAGTT/GCTGCTTCTGTGATTGGAAA |
| HSL | NM_001080220.1 | GAGTTTGAGCGGATCATTCA/TGAGGCCATGTTTGCTAGAG |
| Chemerin | FJ594406.1 | GGAGGAGTTCCACAAGCATC/CTTGAACTCCAGCCTCACAA |
| CMKLR1 | FJ594407.1 | GTGGTCAGGATCCTTCTGGT/GATCATGACGATCACCAAGC |
| β-actin | NM_173979.3 | ACCACACCTTCTACAACGAG/GAACATGATCTGGGTCATCTTC |
收集细胞, 加入含PMSF的裂解液提取细胞总蛋白。用BCA法测定蛋白浓度, 调整总蛋白浓度后按1:4体积比加入5×上样缓冲液, 煮沸10 min, 用预制胶进行电泳分离, 电泳完毕后电转移到硝酸纤维素膜上, 用50 g·L-1脱脂牛奶室温封闭1 h, 一抗(1:1 000)稀释4 ℃孵育过夜, 加HRP标记的羊抗兔IgG (1:2 000)孵育1 h, 最后用化学发光法显示结果, 用Image J软件进行条带的灰度分析。
1.8 统计分析所有试验均重复3次, 试验数据以平均值±标准误(x±SE)表示, 采用SPSS 20.0分析软件中的One-way ANOVA进行方差分析和显著性检验, 两组间比较采用独立样本t测验。
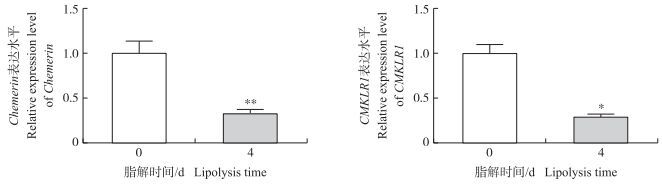
2 结果与分析 2.1 Chemerin及其受体CMKLR1在脂解过程中的表达脂解过程中, 牛肌内成熟脂肪细胞去分化为前体脂肪细胞。收集细胞, 提取细胞内总RNA进行RT-qPCR测定。结果显示:与0 d相比, Chemerin mRNA表达在4 d时显著降低(P < 0.01)。同时, 受体CMKLR1 mRNA表达也显著降低(P < 0.05) (图 1)。
|
图 1 牛肌内成熟脂肪细胞脂解过程中Chemerin与CMKLR1 mRNA的表达 Figure 1 mRNA expression of Chemerin and CMKLR1 in the process of bovine intramuscular mature adipocytes lipolysis |
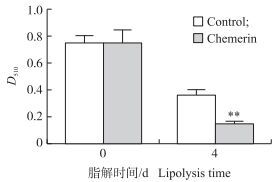
随着脂解的进行, 牛肌内成熟脂肪细胞中脂肪含量呈下降趋势, 油红O染色可以直观反映脂肪细胞的脂解程度。如图 2所示:在脂解开始(0 d), 成熟脂肪细胞中聚集大量成熟的脂滴(图 2-A、B), 油红O染色可以清晰地显示出脂肪细胞脂滴的含量及大小(图 2-A1)。脂解4 d时, 与对照组(图 2-C)相比, 0.1 μg·mL-1 Chemerin处理(图 2-D)可以显著促进脂肪细胞的脂解作用, Chemerin处理组的脂肪细胞比对照组细胞中存在更少的脂滴(图 2-D1)。脂肪细胞经油红O染色、异丙醇萃取后测D510值, 油红O量化结果显示脂解4 d后Chemerin组脂滴含量显著降低(图 3)。

|
图 2 Chemerin对牛肌内成熟脂肪细胞脂解代谢中细胞脂滴数量的影响 Figure 2 Effect of Chemerin on content of lipid droplets during bovine intramuscular mature adipocytes lipolysis |
|
图 3 脂解代谢中细胞内脂肪含量的变化 Figure 3 Changes of lipid droplets during mature adipocytes lipolysis |
为了检测Chemerin对牛肌内成熟脂肪细胞脂解的影响, 收集处理4 d的细胞培养液, 采用试剂盒检测甘油和游离脂肪酸(FFA)的释放。如图 4所示, 0.1 μg·mL-1 Chemerin处理组甘油释放量与对照组相比明显增加(P < 0.05), 且FFA释放量显著增加(P < 0.01), 说明Chemerin促进了牛肌内成熟脂肪细胞的脂解。

|
图 4 Chemerin对牛肌内成熟脂肪细胞脂解代谢中甘油和游离脂肪酸释放的影响 Figure 4 Effect of Chemerin on glycerol and FFA release during bovine intramuscular mature adipocytes lipolysis |
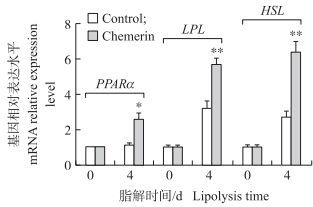
收集脂解4 d的细胞, 提取细胞内总RNA, RT-qPCR检测牛肌内脂肪细胞脂解关键基因PPARα、LPL与HSL mRNA的表达。如图 5所示:处理4 d, Chemerin组与对照组相比PPARα、LPL与HSL mRNA表达极显著上调(P < 0.01)。促进脂解关键基因的表达, 能够加速脂肪的脂解。结果表明, 在牛肌内成熟脂肪细胞中, Chemerin能够通过上调脂解关键基因mRNA的表达来促进牛肌内脂肪细胞的脂解作用。
|
图 5 Chemerin对脂解关键基因PPARα、LPL与HSL mRNA表达的影响 Figure 5 Effect of Chemerin on mRNA expression of key lipolytic genes PPARα, LPL and HSL |
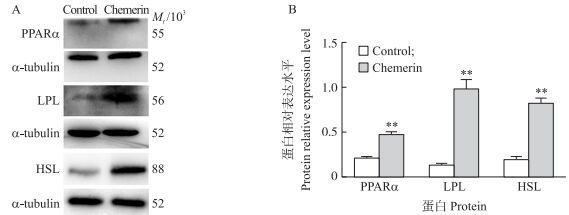
为了进一步验证Chemerin对肌内脂肪细胞脂解作用的机制, 检测了脂代谢过程中PPARα、LPL与HSL蛋白水平的变化。收集脂解4 d的细胞, 提取各组细胞蛋白, Western blot检测脂肪细胞脂解关键蛋白PPARα、LPL与HSL的表达水平。通过Image J图像处理软件对Western blot检测灰度值进行测量。结果表明:脂解4 d, Chemerin处理组的PPARα、LPL与HSL蛋白水平较对照组极显著上调(P < 0.01) (图 6), 表明在牛肌内成熟脂肪细胞中, Chemerin能够通过调控脂解关键基因的表达发挥促脂解作用。
|
图 6 Chemerin对脂解关键蛋白PPARα、LPL与HSL表达水平的影响 Figure 6 Effects of Chemerin on protein expression level of key lipolytic pxotein PPARα, LPL and HSL |
Chemerin信号传导机制表明, Chemerin与其G蛋白偶联受体CMKLR1结合能够促进ERK1/2信号通路磷酸化从而激活脂解相关基因来发挥其促脂解作用[14]。有研究表明Chemerin及其受体CMKLR1在小鼠和人脂肪分解过程中表达降低[4, 15-16]。本试验显示, 牛肌内成熟脂肪细胞中Chemerin表达较高, 脂解过程中Chemerin及其受体CMKLR1表达显著降低, 与上述对人和啮齿类动物的研究结果相一致, 表明Chemerin在大型家畜成熟脂肪细胞脂解过程中也起着调控作用。
成熟的脂肪细胞含有大量脂滴, 随着脂解的进行, 大脂滴逐渐分裂成小脂滴, 并且伴随着去分化(成熟脂肪细胞变成成纤维状前体脂肪细胞)的发生。本试验用Chemerin处理肌内脂肪细胞4 d后, Chemerin能够促进脂肪细胞中脂滴的分解; 甘油和FFA的释放量是衡量脂解速度的标准。本试验结果表明, Chemerin作用牛肌内脂肪细胞后, 甘油和FFA的释放量明显增加, 进一步表明Chemerin通过增加甘油三酯的分解促进了牛肌内成熟脂肪细胞的脂解。
脂解关键基因的表达变化是反映脂肪细胞脂解作用的有效指标。PPARα是配体激活的转录因子, 可被其天然配体脂肪酸激活, 增加LPL的表达, 减少载脂蛋白C Ⅲ(apoli-poprotein C Ⅲ, ApoC Ⅲ)的表达, 在调节脂类代谢和细胞分化中起重要作用[17-18]。此外, 激活的PPARα可介导载脂蛋白Ⅰ(apoAⅠ)和载脂蛋白Ⅱ(apoAⅡ)的表达。LPL是脂肪细胞、骨骼肌细胞等细胞合成和分泌的一种糖蛋白, 与apoAⅡ结合发挥其脂解活性, 从而降解循环中的甘油三酯[19]。已有研究显示, PPARα与LPL表达上调可促进脂肪分解代谢过程[20-21]。本研究显示Chemerin作用于肌内脂肪细胞4 d, PPARα与LPL表达显著上调, 说明促进了细胞脂解。另外, HSL是甘油二酯分解成甘油一酯的调控蛋白, 激活的HSL会转移至脂滴表面, 加快脂解速度[22]。同时, Chemerin作用促进了牛肌内成熟脂肪细胞的HSL mRNA与蛋白的表达。推测Chemerin与受体CMKLR1结合, 活化了成熟脂肪细胞内HSL。另外, Chemerin处理牛肌内脂肪细胞8 d, Chemerin对脂解相关基因的表达已无显著影响(数据未列出), 推测大部分成熟脂肪细胞已去分化为不含脂滴的前体脂肪细胞。
综上所述, 在牛肌内成熟脂肪细胞脂解过程中, Chemerin通过上调脂解关键基因PPARα、LPL与HSL的表达, 增加了细胞内甘油和FFA的释放, 最终促进了成熟脂肪细胞脂解的发生。此研究进一步加深了对反刍动物肌肉内脂肪代谢机制的认识。
| [1] | Troy D J, Tiwari B K, Joo S T. Health implications of beef intramuscular fat consumption[J]. Korean Journal for Food Science of Animal Resources, 2016, 36(5): 577-582. DOI: 10.5851/kosfa.2016.36.5.577 |
| [2] |
孙文星, 南文婷, 谷淑华, 等. miR-27b及其靶基因PPARγ在肌内和皮下脂肪细胞中的差异表达分析[J].
南京农业大学学报, 2016, 39(2): 249-254.
Sun W X, Nan W T, Gu S H, et al. Differential expression of miR-27b and its target gene PPARγ in intramuscular and subcutaneous adipocytes[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 249-254. DOI: 10.7685/jnau.201505022 (in Chinese with English abstract) |
| [3] | Pannier L, Sweeney T, Hamill R M, et al. Lack of an association between single nucleotide polymorphisms in the bovine leptin gene and intramuscular fat in Bos taurus cattle[J]. Meat Science, 2009, 81(4): 731-737. DOI: 10.1016/j.meatsci.2008.11.014 |
| [4] | Bozaoglu K, Bolton K, McMillan J, et al. Chemerin is a novel adipokine associated with obesity and metabolic syndrome[J]. Endocrinology, 2007, 148(10): 4687-4694. DOI: 10.1210/en.2007-0175 |
| [5] | Cash J L, Hart R, Russ A, et al. Synthetic Chemerin-derived peptides suppress inflammation through ChemR23[J]. The Journal of Experimental Medicine, 2008, 205(4): 767-775. DOI: 10.1084/jem.20071601 |
| [6] | Roh S G, Song S H, Choi K C, et al. Chemerin:a new adipokine that modulates adipogenesis via its own receptor[J]. Biochemical and Biophysical Research Communications, 2007, 362(4): 1013-1018. DOI: 10.1016/j.bbrc.2007.08.104 |
| [7] | Roman A A, Parlee S D, Sinal C J. Chemerin:a potential endocrine link between obesity and type 2 diabetes[J]. Endocrine, 2012, 42(2): 243-251. DOI: 10.1007/s12020-012-9698-8 |
| [8] | Ernst M C, Sinal C J. Chemerin:at the crossroads of inflammation and obesity[J]. Trends in Endocrinology and Metabolism, 2010, 21(11): 660-667. DOI: 10.1016/j.tem.2010.08.001 |
| [9] | Wolfgang M J, Cha S H, Sidhaye A, et al. Regulation of hypothalamic malonyl-CoA by central glucose and leptin[J]. Proc Natl Acad Sci USA, 2007, 104(49): 19285-19290. DOI: 10.1073/pnas.0709778104 |
| [10] | Zhao S, Wang J, Song X, et al. Impact of dietary protein on lipid metabolism-related gene expression in porcine adipose tissue[J]. Nutrition and Metabolism, 2010, 7(6): 3-13. |
| [11] | Cwiklinska A, Gliwinska A, Senderowska Z, et al. Impact of phosphatidylcholine liposomes on the compositional changes of VLDL during lipoprotein lipase (LPL) -mediated lipolysis[J]. Chemistry and Physics of Lipids, 2016, 195: 63-70. DOI: 10.1016/j.chemphyslip.2015.12.007 |
| [12] | Zimmermann R, Strauss J G, Haemmerle G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase[J]. Science, 2004, 306(5700): 1383-1386. DOI: 10.1126/science.1100747 |
| [13] |
李惠侠, 罗肖, 刘荣鑫, 等. 用成熟脂肪建立一种新的猪前体脂肪细胞培养模型[J].
中国生物化学与分子生物学报, 2009, 25(3): 270-275.
Li H X, Luo X, Liu R X, et al. Novel preadipocyte cell model estabolished via pig mature adipocytes[J]. Chinese Journal of Biochemistry and Molecular Biology, 2009, 25(3): 270-275. (in Chinese with English abstract) |
| [14] | Yoshimura T, Oppenheim J J. Chemokine-like receptor 1(CMKLR1) and chemokine (C-C motif) receptor-like 2(CCRL2), two multifunctional receptors with unusual properties[J]. Experimental Cell Research, 2011, 317(5): 674-684. DOI: 10.1016/j.yexcr.2010.10.023 |
| [15] | Goralski K B, McCarthy T C, Hanniman E A, et al. Chemerin, a novel adipokine that regulates adipogenesis and adipocyte metabolism[J]. The Journal of Biological Chemistry, 2007, 282(38): 28175-28188. DOI: 10.1074/jbc.M700793200 |
| [16] | Sell H, Laurencikiene J, Taube A, et al. Chemerin is a novel adipocyte-derived factor inducing insulin resistance in primary human skeletal muscle cells[J]. Diabetes, 2009, 58(12): 2731-2740. DOI: 10.2337/db09-0277 |
| [17] |
胡越, 许军, 刘燕华, 等. PPARα激动剂降血脂作用的研究进展[J].
中国药科大学学报, 2016, 47(1): 118-124.
Hu Y, Xu J, Liu Y H, et al. Advances in lipid-lowering effect of PPARα agonists[J]. Journal of China Pharmaceutical University, 2016, 47(1): 118-124. DOI: 10.11665/j.issn.1000-5048.20160118 (in Chinese with English abstract) |
| [18] | Fruchart J C. Peroxisome proliferator-activated receptor-alpha (PPARalpha):at the crossroads of obesity, diabetes and cardiovascular disease[J]. Atherosclerosis, 2009, 205(1): 1-8. DOI: 10.1016/j.atherosclerosis.2009.03.008 |
| [19] | Duez H, Lefebvre B, Poulain P, et al. Regulation of human apoA-I by gemfibrozil and fenofibrate through selective peroxisome proliferator-activated receptor alpha modulation[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2005, 25(3): 585-591. DOI: 10.1161/01.ATV.0000154140.73570.00 |
| [20] | Berman D M, Nicklas B J, Ryan A S, et al. Regulation of lipolysis and lipoprotein lipase after weight loss in obese, postmenopausal women[J]. Obesity Research, 2004, 12(1): 32-39. DOI: 10.1038/oby.2004.6 |
| [21] |
姜延志, 邢淑华, 岑王敏, 等. 脂蛋白脂酶调控因子研究进展[J].
遗传, 2013, 35(7): 830-838.
Jiang Y Z, Xing S H, Cen W M, et al. New insights in regulation factors of lipoprotein lipase[J]. Hereditas, 2013, 35(7): 830-838. (in Chinese with English abstract) |
| [22] | Nielsen T S, Jessen N, Jorgensen J O, et al. Dissecting adipose tissue lipolysis:molecular regulation and implications for metabolic disease[J]. Journal of Molecular Endocrinology, 2014, 52(3): 199-222. DOI: 10.1530/JME-13-0277 |




