文章信息
- 于东立, 宋晓欧, 鲍亚林, 林思远, 王建升, 王秀娟, 卢唯, 赵弘巍
- YU Dongli, SONG Xiao'ou, BAO Yalin, LIN Siyuan, WANG Jiansheng, WANG Xiujuan, LU Wei, ZHAO Hongwei
- 通过定量蛋白组学研究OsGLO1对稻瘟病抗性的调控机制
- A quantitative proteomic study of the OsGLO1-mediated resistance against the rice blast disease
- 南京农业大学学报, 2018, 41(1): 71-78
- Journal of Nanjing Agricultural University, 2018, 41(1): 71-78.
- http://dx.doi.org/10.7685/jnau.201703039
-
文章历史
- 收稿日期: 2017-03-27
稻瘟病是水稻的第一大病害, 在世界范围内影响水稻的产量。抗性品种的使用是目前主要的稻瘟病控制手段。因此, 鉴定抗性基因或数量性状(QTL)及其调控通路具有重要意义。近几年来, 借助蛋白质定量技术的飞速发展所带来的蛋白质表达量精确测定, 植物抗病机制研究得到了较快的发展。
植物许多不同的亚细胞区域(例如叶绿体、线粒体、过氧化物酶体和质外体空间)以及许多生理途径中都可以产生过氧化氢(H2O2)[1]。通常在无外源刺激下, H2O2作为植物氧代谢的高毒性副产物, 产生有害的氧化损伤作用, 导致诸如脂膜过氧化、蛋白质变性、碳水化合物氧化、色素分解和DNA损伤等结果[2]。在非生物胁迫如臭氧、紫外线辐射、干旱、重金属、高光、高盐度和寒冷等条件下, 植物产生过量的H2O2。许多情况下, H2O2清除突变体经常与耐受性缺陷表型相联系[3]。同样, 应激性H2O2的产生和及时地清除对于植物应对生物胁迫也是必需的, 例如在植物感知PAMP(病原体相关分子模式)的情况下, 细胞外也会出现明显的活性氧迸发[4]。在H2O2清除突变体中, 经常会观察到自发病斑(lesion mimic)[1, 5]。上述观察显示维持稳定的H2O2合成与清除体系对于保证植物的正常生理功能至关重要。因此, 研究水稻H2O2的动态平衡及其在稻瘟病抗性中的作用具有重要意义。
定位于过氧化物酶体的葡糖酸氧化酶(GLO)催化乙醇酸转化为乙醛酸, 同时产生H2O2。Chaouch等[6]与Zhang等[7]发现, 产生于过氧化物酶体的H2O2在拟南芥和水稻中均与水杨酸(SA)介导的抗性相关。因此, GLO很有可能在调控植物对病原物的抗性中起作用。本研究对亲和型和非亲和型稻瘟病菌侵染后水稻蛋白的表达进行了定量比较, 旨在明确其在水稻对稻瘟病抗性中的功能, 为开发有效的稻瘟病防控手段提供理论支持。
1 材料与方法 1.1 菌株、植物材料以及总蛋白提取本研究以‘日本晴’(Oryza sativa L. japonica‘Nipponbare’)为材料, 参照文献[8]分别使用亲和型(Guy11)及非亲和型稻瘟病菌菌株(2539)孢子悬浮液(1×105mL-1)接种水稻叶片, 对照为孢子悬浮液但是无孢子, 于28 ℃恒温箱中避光保湿培养24 h, 然后置于28 ℃恒温温室(16 h光照)培养。收集侵染96 h的水稻叶片20 g, 经冷冻研磨后立即置于100 mL UEB缓冲液中[150 mmol·L-1 Tris-HCl(pH7.6), 8 mol·L-1 Urea, 17 mmol·L-1 SDS, 186 mmol·L-1 Triton X-100, 50 mmol·L-1 NaF, 580 mmol·L-1甘油2-磷酸, 5 mmol·L-1 DTT, 5 mmol·L-1抗坏血酸, 0.2 mmol·L-1PVPP, 1 mmol·L-1 PMSF], 分别使用iTRAQ(isobaric tagging for relative and absolute quantification, 同位素标记定量)和Di-methyl(the stable isotope dimethyl labeling method, 同位素二甲基标记定量)方法按照相关文献对样品进行标记及LC-MS/MS检测和分析[9-10]。蛋白质GO分析(功能富集度分析)使用PIR在线分析(pir.georgetown.edu)。
1.2 水稻原生质体提取和转化水稻原生质体提取操作参见文献[11]。每1 mL原生质体与10 μg质粒DNA混合, 再加入1 mL 25 mmol·L-1 PEG4000。在28 ℃孵育15 min, 加入4 mL W5溶液[154 mmol·L-1 NaCl, 125 mmol·L-1 CaCl2, 5 mmol·L-1 KCl, 2 mmol·L-1MES(pH5.7)], 轻轻混合均匀。于200 r·min-1离心3 min, 重悬于200 μL W5溶液, 于28 ℃避光孵育过夜。
1.3 细胞壁水解物提取水稻细胞壁水解物提取操作参见文献[12]。在CM培养基培养2 d后, 取1 g菌丝重悬于5 mL 20 mmol·L-1 K3PO4溶液中(含0.3 mmol·L-1吐温20)。121 ℃蒸汽灭菌20 min, 用超声波破碎6次(每次10 min, 间隔10 min)。于15 000 g离心1 h, 再用蒸馏水于4 ℃透析过夜后冻干保存。
1.4 活性氧检测活性氧积累量检测操作参见文献[13]。按照试验要求, 于300 g离心3 min收集水稻原生质体后, 重悬于1 mL W5溶液中。与0.5 μL 2′, 7′-二氯荧光素二乙酸酯(DCFH-DA)在22 ℃混合孵育。分别于不同处理时间取样后在荧光显微镜下观察原生质体荧光信号的强度。激发波长488 nm; 发射波长525 nm。
1.5 胼胝质沉积检测胼胝质沉积检测参见文献[14]。胼胝质沉积量为试验组和对照组之间苯胺蓝处理后吸光值的相对差异值。激发波长393 nm; 发射波长479 nm。
1.6 防卫相关基因表达的检测防卫相关基因表达的检测使用荧光定量PCR方法, 引物信息见表 1。
| 基因名称 Gene name |
基因位点 Gene locus |
引物对名称 Primer pairs name |
引物对序列(5′→3′) Primer pairs sequence |
| OsActin2 | LOC_Os03g50885 | OsAct-F/R | TTGCCAAGGCTGAGTACGACGA/AAACAAGCAGGAGGACGGCGAT |
| OsGLO1 | LOC_Os03g57220 | OsGLO1-F/R | GATCTACGACTACTACGCCTCT/GCCACTTCACATCCTTCCA |
| OsPAD4 | LOC_Os11g09010 | OsPAD4-F/R | CGGTGCTTTGTGTCACATTC/GACATTGAGTGGGCAGAAGA |
| OsAOS2 | LOC_Os03g12500 | OsAOS2-F/R | CAATACGTGTACTGGTCGAATGG/AAGGTGTCGTACCGGAGGAA |
| OsPBZ1 | LOC_Os12g36880 | OsPBZ1-F/R | CTACTATGGCATGCTCAAGAT/ATAGAAAGGCACATAAACACAA |
我们使用iTRAQ方法[10]对对照、Guy11和2539侵染的水稻蛋白进行了标记, 然后使用LC-MS/MS对蛋白表达进行了测定和比较, 一共鉴定到1 671个具有定量信息的水稻蛋白(可信度≥99%)。对亲和型和非亲和型反应的比较显示, 一共有200个在亲和与非亲和型反应中都上调表达的蛋白(处理/对照≥1.5)。基因功能富集度分析(GO)结果显示:这些蛋白功能集中在代谢(GO:0008152, 16%)、氧化还原(GO:0055114, 11%)、刺激响应(GO:0050896, 11%)、生物调控(GO:0050789, 7%)和磷代谢(GO:0006793, 7%)等生理过程(biological process)(图 1-A)。此外, 还有114个蛋白在亲和与非亲和型反应中都下调表达(处理/对照≤0.67)。这些蛋白功能集中在代谢(GO:0008152, 14%)、翻译(GO:0006412, 14%)、磷代谢(GO:0006793, 11%)、生物调控(GO:0050789, 11%)和蛋白修饰(GO:0006464, 10%)等生理过程(图 1-B), 表明在水稻对稻瘟病的抗性中, 上述几个特定的生理过程被特异性地激活或抑制。

|
图 1 在亲和与非亲和反应中均差异表达的水稻蛋白的基因功能富集度分析(GO) Figure 1 Gene ontology(GO)analysis of rice proteins differentially expressed in both compatible and incompatible interactions A.上调(Guy11/对照≥1.5, 2539/对照≥1.5);B.下调(Guy11/对照≤0.67, 2539/对照≤0.67)。 A.Up-regulated(Guy11/mock≥1.5, 2539/mock≥1.5);B.Down-regulated(Guy11/mock≤0.67, 2539/mock≤0.67). |
在此基础上, 我们又对在亲和与非亲和型反应中呈现不同表达趋势的蛋白进行了鉴定。选取表达变化量大于或等于1.5倍为诱导表达阈值(Guy11/对照≥1.5并且2539/对照 < 1.5), 以及小于或等于0.67为抑制表达阈值(Guy11/对照≤0.67并且2539/对照>0.67), 筛选得到在亲和作用或非亲和作用中差异表达的蛋白。通过使用严格的筛选条件(特异肽段数不小于3并且覆盖率不小于10%), 最终得到19个受稻瘟菌亲和型菌株诱导的水稻蛋白(表 2), 其中5个蛋白(Q9FE01、Q9ZP20、Q7XSV2、Q5U1N1、Q8LQN2)功能归属于“氧化还原(GO:0055114)”生理过程; 5个蛋白(Q9FE01、Q7XSV2、Q5U1N1、Q69K00、P51823)功能归属于“刺激响应(GO:0050896)”生理过程。同时还鉴定到了14个受稻瘟菌亲和型菌株抑制表达的水稻蛋白(表 2), 其中, 4个蛋白(B8AKX6、Q10I42、P0C367、Q53RM0)功能归属于“光合作用(GO:0015979)”生理过程; 3个蛋白(B8AKX6、Q851R5、Q9SNK3)功能归属于“氧化还原(GO:0055114)”生理过程。上述结果表明:与稻瘟病菌非亲和型菌株侵染相比, “刺激响应”生理过程在水稻受稻瘟病菌亲和型菌株侵染后被特异性激活, 而“光合作用”等生理过程被特异性抑制。
| 蛋白编号 Accession |
蛋白描述 Description |
iTRAQ | Di-methyl GO功能 | |||||||
| 非亲和反应 2539/Mock |
亲和反应 Guy11/Mock |
覆盖率/% Coverage rate |
特异肽段数 Unique Peptides |
Guy11/ Mock |
氧化还原 Oxidation/ reduction |
刺激响应 Stimulus response |
光合作用 Photo synthesis |
|||
| Q9FE01 | L-ascorbate peroxidase 2, cytosolic | 1.49 | 1.55 | 29.88 | 4 | 1.03 | √ | √ | ||
| Q0J8G4 | Fructokinase-2 | 1.48 | 1.54 | 10.42 | 3 | 0.93 | ||||
| Q7XV86 | Putative uncharacterized protein | 1.48 | 1.59 | 14.15 | 5 | |||||
| Q9ZP20 | Thioredoxin M5, chloroplastic | 1.47 | 1.53 | 20.93 | 3 | 0.88 | √ | |||
| Q7XSV2 | CAA303717.1 protein | 1.47 | 2.31 | 14.33 | 4 | √ | √ | |||
| Q5Z4C9 | Os06g0306600 protein | 1.45 | 1.90 | 22.5 | 5 | |||||
| Q10LR9 | Uroporphyrinogen decarboxylase 2 | 1.43 | 1.58 | 14.36 | 3 | 0.73 | ||||
| Q40680 | Elongation factor 1-delta 1 | 1.37 | 1.77 | 19.21 | 3 | 1.72 | ||||
| Q6H6C7 | Phosphoglycerate kinase | 1.36 | 1.85 | 19.65 | 5 | |||||
| Q5U1N1 | Class Ⅲ peroxidase 62 | 1.35 | 1.65 | 22.16 | 4 | √ | √ | |||
| Q8LQN2 | Putative uncharacterized protein | 1.35 | 1.57 | 29.56 | 3 | √ | ||||
| Q10M12 | Expressed protein | 1.30 | 2.48 | 21.84 | 5 | |||||
| Q69K00 | Triosephosphate isomerase | 1.30 | 2.01 | 14.47 | 3 | √ | ||||
| Q6ZLA9 | Os07g0575900 protein | 1.29 | 1.73 | 15.71 | 6 | |||||
| Q6Z6A7 | Annexin 2 | 1.29 | 1.86 | 11.78 | 3 | |||||
| Q7XEL9 | Putative uncharacterized protein | 1.21 | 1.54 | 17.71 | 3 | |||||
| P51823 | ADP-ribosylation factor 2 | 1.11 | 1.86 | 30.94 | 4 | 0.52 | √ | |||
| Q8W3J0 | Os03g0278000 protein | 1.09 | 1.52 | 10.29 | 3 | |||||
| Q75M32 | Peptidyl-prolyl cis-trans isomerase | 1.02 | 1.68 | 18.4 | 3 | |||||
| A3AV21 | Putative uncharacterized protein | 1.51 | 0.45 | 15.04 | 5 | |||||
| B9FDD5 | Putative uncharacterized protein | 1.06 | 0.64 | 19.19 | 3 | |||||
| C7J6Y0 | Os09g0482780 protein | 0.90 | 0.65 | 11.67 | 3 | |||||
| Q10CE4 | Peroxisomal(S)-2-hydroxy-acid oxidase GLO1 | 0.79 | 0.52 | 13.55 | 3 | 0.17 | √ | √ | ||
| Q2QM69 | 37×103 inner envelope membrane protein | 0.78 | 0.65 | 10.63 | 3 | 0.43 | ||||
| Q10I42 | HAD-superfamily hydrolase | 0.77 | 0.62 | 10.31 | 3 | √ | ||||
| Q6ZLB8 | Putative uncharacterized protein | 0.77 | 0.51 | 15.56 | 3 | |||||
| Q851R5 | Thioredoxin H2-2 | 0.75 | 0.43 | 29.85 | 3 | 0.04 | √ | |||
| Q6K9T1 | Oligopeptidase A-like | 0.73 | 0.60 | 13.51 | 7 | |||||
| P0C367 | Photosystem Ⅱ CP43 chlorophyll apoprotein | 0.72 | 0.52 | 12.9 | 4 | 0.79 | √ | |||
| Q53RM0 | Putative uncharacterized protein | 0.70 | 0.61 | 13.98 | 4 | 0.46 | √ | |||
| Q9SNK3 | Predicted gene | 0.69 | 0.66 | 28.15 | 8 | √ | ||||
| Q0IWS0 | Os10g0492300 protein | 0.69 | 0.52 | 20.61 | 6 | |||||
| P93431 | Ribulose bisphosphate carboxylase/ oxygenase activase | 0.68 | 0.56 | 28.33 | 10 | 0.4 | ||||
| 注: Di-Methyl:使用Di-methyl方法得到验证的蛋白; “√”:分别归属于“氧化还原”“刺激响应”和“光合作用”等生理功能的蛋白。 Note: Di-methyl:proteins confirmed by Di-methyl method. Proteins belong to GO categories such as“oxidation/reduction”“stimulus response”, and“photo synthesis”are marked by a“√”. |
||||||||||
为了进一步对iTRAQ定量结果进行验证, 我们使用了另外一种标记法(Di-methyl)对样品进行了定量标记[9]。HPLC-MS/MS结果显示, 共有157个蛋白在2种标记方法中均可以检测到。其中, 在19个Guy11特异诱导表达蛋白中, 有6个蛋白是用2种独立的定量方法均可以验证到的(表 2)。iTRAQ和Di-methyl的一致性在Guy11抑制表达的蛋白中表现得更为明显:在6个共同检测到的水稻蛋白中, 5个表现出一致的表达趋势(表 2)。其中, MPBQ(Q2QM69)是一个定位于叶绿体的生育酚(tocopherols)合成因子; OsTrxh2-2(Q851R5)参与氧化还原电势调控; CHL9(Q53RM0)与叶绿素的合成相关; RuBisCO活性酶(P93431)与核酮糖二磷酸缩化酶(RuBisCO)的功能相关; OsGLO1(B8AKX6)蛋白参与光呼吸过程中H2O2的合成。鉴于来源于过氧化物酶体的H2O2在水稻和拟南芥等植物防卫反应中的重要作用, 我们将OsGLO1在受到Guy11侵染后的下调表达与‘日本晴’对Guy11的感病性关联起来, 推测OsGLO1与水稻对稻瘟病的抗性相关, 因而对其进行了进一步研究。
2.3 OsGLO1激活水稻早期防卫反应采用水稻原生质体瞬时转化系统, 我们检测了对照(Vector)、OsGLO1过表达(OsGLO1-OX)以及OsGLO1沉默(OsGLO1-RNAi)原生质体中的活性氧和胼胝质水平。结果显示:OsGLO1-OX明显促进了活性氧的积累, 而OsGLO1-RNAi则对活性氧积累有抑制作用(图 2-A和B)。证明OsGLO1的表达水平与水稻细胞内的活性氧水平呈正相关(图 2-B)。
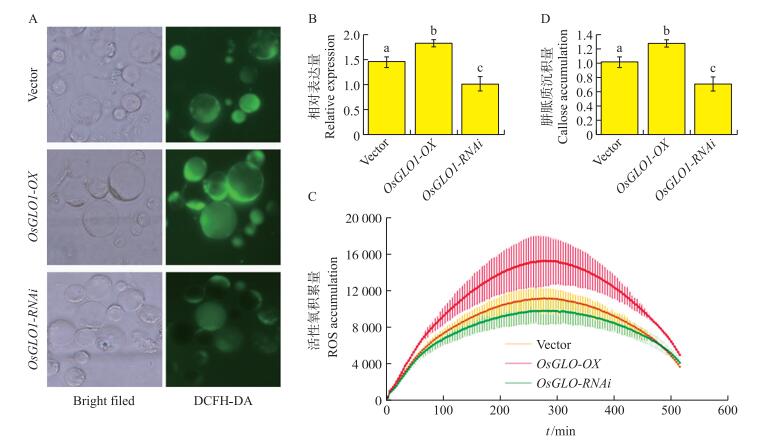
|
图 2 OsGLO1促进活性氧积累和胼胝质沉积(n=8) Figure 2 OsGLO11 induces H2O2 accumulation and callose deposition 1)A.DCFH-DA方法检测水稻原生质体中的活性氧积累; B.图A的定量结果; C.细胞壁水解物共孵育不同时间后的活性氧积累; D.苯胺蓝染色测定胼胝质沉积。沉积量等于处理组与对照组之间吸光度的相对差异值。对照组的胼胝质沉积量为1。2)不同字母代表显著差异(P < 0.05)。3)Vector:对照; OsGLO1-OX:OsGLO1过表达; OsGLO1-RNAi:OsGLO1沉默。下同。 1)A.ROS accumulation is detected by DCFH-DA; B.Quantified ROS accumulation in Fig.A; C.ROS accumulation; D.Callose deposition, which is the difference of measurement between the Aniline blue and control treatments. Callose deposition in the control treatment is set to 1. 2)Different letters indicate significant differences between samples according to Student′s t test(P < 0.05). 3)Vector:control; OsGLO1-OX:OsGLO1 over-expression; OsGLO1-RNAi:OsGLO1 silencing. The same as follows. |
进一步使用水稻原生质体-稻瘟病菌激发子(稻瘟病菌细胞壁水解物)[6]互作系统验证我们的假设。结果显示:使用100 μg·mL-1稻瘟病菌细胞壁水解物处理12 h可以诱导水稻原生质体产生明显的胼胝质沉积。比较细胞壁水解物处理后对照、OsGLO1-OX和OsGLO1-RNAi处理的原生质体中活性氧积累量, 较之对照, OsGLO1-OX可以诱导更明显的活性氧产生, 而OsGLO1-RNAi的活性氧迸发则相对较弱(图 2-C)。此外, 对激发子处理后胼胝质沉积量进行考察, 发现在OsGLO1-OX原生质体中, 胼胝质沉积比对照高约25%(图 2-D); 而在OsGLO1-RNAi原生质体中, 胼胝质沉积降低30%(图 2-D)。综上所述, OsGLO1可以激活水稻早期防卫反应如活性氧积累和胼胝质的沉积, 进而增强了水稻对稻瘟病的抗性。
2.4 OsGLO1调控水稻防卫相关基因的表达通过原生质体系统中瞬时表达OsGLO1-OX和OsGLO1-RNAi后, OsGLO1分别呈显著上调和下调表达(图 3-A), 表明该系统是检测OsGLO1过表达和沉默条件下抗病相关基因表达的有力工具。在OsGLO1-OX原生质体中, OsPBZ1的增长幅度达到10倍以上; 然而, 在OsGLO1-RNAi原生质体中, OsPBZ1表达水平却没有明显变化(图 3-B)。在OsGLO1-OX原生质体中, OsPAD4表达水平比对照组增加约5倍; 而在OsGLO1-RNAi原生质体中, OsPAD4表达明显下降(图 3-C)。表明OsPAD4介导的防卫反应受到OsGLO1的调控。在OsGLO1-OX原生质体中, OsAOS2表达量比对照组增加约6倍; 与之相反, 在OsGLO1-RNAi原生质体中, OsAOS2表达水平约为对照组的50%(图 3-D)。因此, 我们的结果表明OsGLO1可以调节OsAOS2的表达水平。
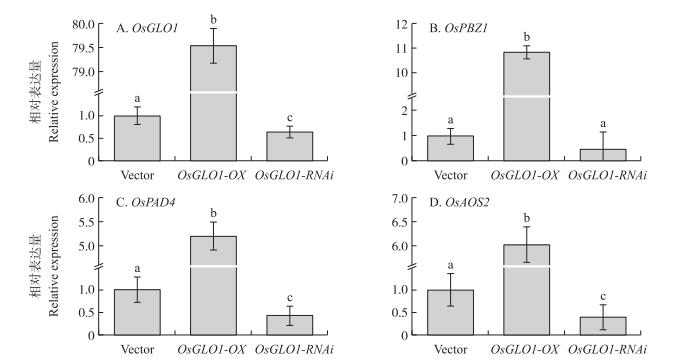
|
图 3 OsGLO1诱导防卫相关基因的表达(n=9) Figure 3 OsGLO1 induces defense-related gene expression |
OsGLO1对上述防卫相关基因的激活还体现在不同原生质体转化试验中二者之间的协同表达关系(图 4)。在不同的原生质体转化批次中, OsGLO1的表达水平显示出一定程度的差异。与此对应, 在OsGLO1表达量较高的原生质体中, 上述防卫相关基因表达量也较高; 在OsGLO1中等水平表达的原生质体中, 这些防卫相关基因也显示出中等水平的表达; 而在OsGLO1表达较低的原生质体中, 这些基因的表达与对照接近。上述协同表达现象表明原生质体内防卫相关基因的变化并非由于原生质体对于环境的敏感性而引起的波动, 而是由于其内源OsGLO1的表达所引起的。
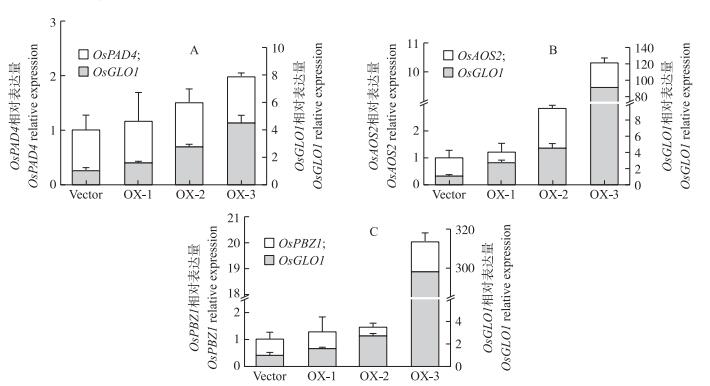
|
图 4 OsGLO1与防卫相关基因之间的协同表达(n=10) Figure 4 Cognate relationship between expression level of OsGLO1 and defense signaling pathway component genes OX-1、OX-2和OX-3分别代表OsGLO1表达具有差异的不同转化批次。 OX-1, OX-2 and OX-3 represent rice protoplasts with different OsGLO1 expression level. |
综上所述, OsGLO1可能参与稻瘟病抗性反应的调控过程。在正常条件下, OsGLO1持续表达, 引起适当的活性氧积累和胼胝质沉积以及防卫相关基因的表达, 维持水稻对稻瘟病的抗性。SA和JA等多种信号通路参与该过程。而某些稻瘟病菌菌株可以通过抑制OsGLO1的表达, 破坏OsGLO1介导的抗性, 从而增强其致病性。有研究显示GLO蛋白在强光、盐, 以及其他刺激诱发的H2O2调控中起主要作用[6]。因此我们的研究结果揭示:水稻对非生物胁迫和对生物胁迫的抗性有可能是通过OsGLO1协调的(图 5)。
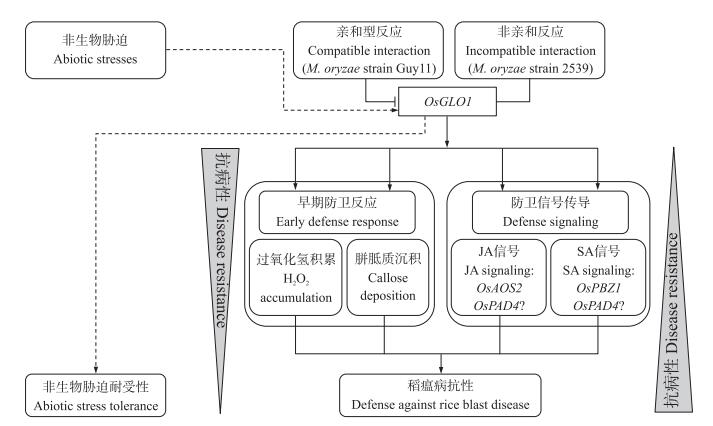
|
图 5 OsGLO1调控水稻稻瘟病抗性模型图 Figure 5 A proposed model of OsGLO1-mediated defense against rice blast disease “←”正向调节; “|”抑制作用; “---”可能的功能联系; “?”OsPAD4可能参与JA或SA信号通路。 "←"indicates positive regulatory or biological connections; "|"indicates suppression; "---"indicates potential connections; "?"indicates the involvement of OsPAD4 in JA or SA signaling pathway is undetermined. |
在C3植物中H2O2的产生主要是通过GLO所参与的光呼吸作用途径完成的[15]。H2O2不仅可以引起细胞程序性死亡(PCD), 而且是重要的防卫信号[16]。H2O2快速产生是植物感受到病原物侵染后的重要反应之一[4]。水稻基因组编码4个GLO基因。其中OsGLO1和OsGLO4主要在水稻叶片中表达[17], 这种表达偏好性似乎与水稻苗期稻瘟病菌的侵染主要发生在水稻叶片相一致。考虑到产生于过氧化物酶体的H2O2在植物抗病性中的重要作用[6], 我们推断OsGLO1可能在水稻的稻瘟病抗性进程中起调控作用。
本研究结果及前人研究均显示OsGLO1在非侵染条件下持续正常表达[17]。我们推测OsGLO1在未受到侵染的植物中维持在一个相对稳定的状态, 以防止潜在病害的侵染。其作用方式可能包括维持一定水平的H2O2积累和胼胝质沉积以及某些抗病相关基因的稳定表达, 如OsPBZ1、OsPAD4和OsAOS2等。这些基础防卫机制对于某些病原物如稻瘟病菌菌株2539的侵染非常有效。例如, 当水稻受到稻瘟菌菌株2539侵染后, OsGLO1持续表达, 从而维持了下游防卫反应的正常功能。与此相反, 当水稻受到其他稻瘟病菌菌株如Guy11的侵染后, OsGLO1的表达受到抑制。在该情况下, 细胞内的H2O2和胼胝质沉积下降, 防卫相关基因如OsPBZ1、OsPAD4和OsAOS2等下调表达, 表现为稻瘟病抗性减弱。值得一提的是, 上述3个基因在水稻中都和JA信号通路相关。OsPBZ1是一个SA信号通路相关的基因[18]; OsAOS2是JA信号通路的成分[19]; 而OsPAD4在水稻中的功能较为独特。拟南芥PAD4(AtPAD4)基因编码1个类脂酶, 是SA合成和系统抗病性(SAR)的重要因子[20]。然而, OsPAD4介导的对水稻白叶枯病(Xoo)的抗性却依赖于JA, 而不是SA信号通路[21]。虽然在水稻对稻瘟病抗性中, OsPAD4参与JA或是SA信号通路还有待于进一步研究, 但是本研究结果显示OsPAD4参与的信号通路可能是受到OsGLO1调控的。本研究结果使我们对水稻抗稻瘟病机制的理解进一步加深, 为通过分子育种手段选育具有广谱抗性的水稻品种提供了基因资源, 具有重要的理论意义和实际应用价值。
| [1] | Kaurilind E, Xu E, Brosche M. A genetic framework for H2O2 induced cell death in Arabidopsis thaliana[J]. BMC Genomics, 2015, 16: 837. DOI: 10.1186/s12864-015-1964-8 |
| [2] | Moller I M, Jensen P E, Hansson A. Oxidative modifications to cellular components in plants[J]. Annual Review of Plant Biology, 2007, 58: 459-481. DOI: 10.1146/annurev.arplant.58.032806.103946 |
| [3] | Pavet V, Olmos E, Kiddle G, et al. Ascorbic acid deficiency activates cell death and disease resistance responses in Arabidopsis[J]. Plant Physiology, 2005, 139(3): 1291-1303. DOI: 10.1104/pp.105.067686 |
| [4] | Jones J D G, Dangl J L. The plant immune system[J]. Nature, 2006, 444(7117): 323-329. DOI: 10.1038/nature05286 |
| [5] | Matin M N, Pandeya D, Baek K-H, et al. Phenotypic and genotypic analysis of rice lesion mimic mutants[J]. Plant Pathology Journal, 2010, 26(2): 159-169. DOI: 10.5423/PPJ.2010.26.2.159 |
| [6] | Chaouch S, Queval G, Vanderauwera S, et al. Peroxisomal hydrogen peroxide is coupled to biotic defense responses by ISOCHORISMATE SYNTHASE1 in a daylength-related manner[J]. Plant Physiology, 2010, 153(4): 1692-1705. DOI: 10.1104/pp.110.153957 |
| [7] | Zhang Z, Xu Y, Xie Z, et al. Association-dissociation of glycolate oxidase with catalase in rice:a potential switch to modulate intracellular H2O2 levels[J]. Molecular Plant, 2016, 9(5): 737-748. DOI: 10.1016/j.molp.2016.02.002 |
| [8] | Zhang H, Xue C, Kong L, et al. A Pmk1-interacting gene is involved in sppressorium fifferentiation and plant infection in Magnaporthe oryzae[J]. Eukaryotic Cell, 2011, 10(8): 1062-1070. DOI: 10.1128/EC.00007-11 |
| [9] | Boersema P J, Raijmakers R, Lemeer S, et al. Multiplex peptide stable isotope dimethyl labeling for quantitative proteomics[J]. Nature Protocols, 2009, 4(4): 484-494. DOI: 10.1038/nprot.2009.21 |
| [10] | Kovanich D, Cappadona S, Raijmakers R, et al. Applications of stable isotope dimethyl labeling in quantitative proteomics[J]. Analytical and Bioanalytical Chemistry, 2012, 404(4): 991-1009. DOI: 10.1007/s00216-012-6070-z |
| [11] | Bart R, Chern M, Park C J, et al. A novel system for gene silencing using siRNAs in rice leaf and stem-derived protoplasts[J]. Plant Methods, 2006, 2: 13. DOI: 10.1186/1746-4811-2-13 |
| [12] | Forlani G, Occhipinti A, Bossi S, et al. Magnaporthe oryzae cell wall hydrolysate induces ROS and fungistatic VOCs in rice cell cultures[J]. Journal of Plant Physiology, 2011, 168(17): 2041-2047. DOI: 10.1016/j.jplph.2011.06.014 |
| [13] | Khokon M A R, Okuma E, Hossain M A, et al. Involvement of extracellular oxidative burst in salicylic acid-induced stomatal closure in Arabidopsis[J]. Plant Cell and Environment, 2011, 34(3): 434-443. DOI: 10.1111/pce.2011.34.issue-3 |
| [14] | Luna E, Pastor V, Robert J, et al. Callose deposition:a multifaceted plant defense response[J]. Molecular Plant-Microbe Interactions, 2011, 24(2): 183-193. DOI: 10.1094/MPMI-07-10-0149 |
| [15] | Noctor G, Veljovic-Jovanovic S, Driscoll S, et al. Drought and oxidative load in the leaves of C-3 plants:a predominant role for photorespiration?[J]. Annals of Botany, 2002, 89: 841-850. DOI: 10.1093/aob/mcf096 |
| [16] | Torres M A, Dangl J L. Functions of the respiratory burst oxidase in biotic interactions, abiotic stress and development[J]. Current Opinion in Plant Biology, 2005, 8(4): 397-403. DOI: 10.1016/j.pbi.2005.05.014 |
| [17] | Zhang Z, Lu Y, Zhai L, et al. Glycolate oxidase isozymes are coordinately controlled by GLO1 and GLO4 in rice[J]. PloS ONE, 2012, 7(6): e39658. DOI: 10.1371/journal.pone.0039658 |
| [18] | Rojas C M, Senthil-Kumar M, Wang K, et al. Glycolate oxidase modulates reactive oxygen species-mediated signal transduction during nonhost resistance in nicotiana benthamiana and Arabidopsis[J]. Plant Cell, 2012, 24(1): 336-352. DOI: 10.1105/tpc.111.093245 |
| [19] | Mei C, Qi M, Sheng G, et al. Inducible overexpression of a rice allene oxide synthase gene increases the endogenous jasmonic acid level, PR gene expression, and host resistance to fungal infection[J]. Molecular Plant-Microbe Interactions, 2006, 19(10): 1127-1137. DOI: 10.1094/MPMI-19-1127 |
| [20] | Jirage D, Tootle T L, Reuber T L, et al. Arabidopsis thaliana PAD4 encodes a lipase-like gene that is important for salicylic acid signaling[J]. Proc Natl Acad Sci USA, 1999, 96(23): 13583-13588. DOI: 10.1073/pnas.96.23.13583 |
| [21] | Ke Y, Liu H, Li X, et al. Rice OsPAD4 functions differently from Arabidopsis AtPAD4 in host-pathogen interactions[J]. Plant Journal, 2014, 78(4): 619-631. DOI: 10.1111/tpj.12500 |




