文章信息
- 潘俏, 张舒玥, 沈迪, 吴家琪, 陈春莲, 陈洁, 陈劲枫, 娄群峰
- PAN Qiao, ZHANG Shuyue, SHEN Di, WU Jiaqi, CHEN Chunlian, CHEN Jie, CHEN Jinfeng, LOU Qunfeng
- 黄瓜耐盐突变体材料的筛选与鉴定
- Screening and identification of salt tolerant mutants of cucumber
- 南京农业大学学报, 2018, 41(1): 64-70
- Journal of Nanjing Agricultural University, 2018, 41(1): 64-70.
- http://dx.doi.org/10.7685/jnau.201704010
-
文章历史
- 收稿日期: 2017-04-07
盐胁迫是影响全球作物产量的重要非生物胁迫之一[1]。全世界大约有100多个国家受到盐渍化的困扰, 占总陆地面积的30%, 尤其在干旱、半干旱国家影响更为突出[2]。在我国, 盐渍土是最主要的低产土壤类型之一, 早在十几年前盐渍化土地面积就占到全国耕地面积的6.62%[3]。近些年我国设施园艺栽培面积不断扩大, 占世界总面积85%以上, 设施蔬菜栽培面积已超过400万hm2[4]。设施栽培中化肥的过量使用等因素致使我国盐碱化土地面积加速扩大。
黄瓜(Cucumis sativus L., 2n=2x=14)是全世界广泛种植的蔬菜作物, 我国的种植面积和产量都位居世界第一。黄瓜在我国设施蔬菜栽培中尤其重要, 其种植面积位于设施蔬菜的前3位。黄瓜对盐胁迫较敏感, 尤其在萌发期和早期生长阶段。由于设施栽培中化肥、农药的应用, 黄瓜常常受盐胁迫的影响, 产量与效益明显降低, 但目前黄瓜主栽品种中缺乏强耐盐的优良品种。
一般认为盐胁迫对种子发芽有显著的抑制作用, 这可能是由于高浓度的NaCl对细胞生理代谢中酶活性及渗透调节作用、膜脂和脂肪酸的组成等产生了不良影响, 导致种子代谢紊乱, 种子活力降低甚至失去萌发能力[5-6]。盐胁迫会对植物的营养生长产生影响, 主要体现在植株外部形态及生长量的差异上[7], 因此, 在植物耐盐性研究中, 苗期形态指标如株高、根长、茎粗、茎节数等成为评价其耐盐能力的重要指标[8-9]。另外, 盐胁迫还会导致植物内膜结构破坏, 大量活性氧产生, 代谢失调, 光合作用下降[10], 衰老凋亡加速等[11]。因此关于植物耐盐性鉴定研究, 除了调查其生长指标外, 还要对植物的光合作用、渗透调节物质、抗氧化系统等生理指标进行分析测定[12]。
近年来, 随着农业生产的发展和研究的深入, 人们对黄瓜品种的要求也越来越高。由于一些优良性状无法从现有的种质资源中获得, 或者很难通过传统育种方式改良得到, 人工诱变便成为一种快速有效的实现方法。本研究利用已建立的‘长春密刺’黄瓜突变体库, 通过盐胁迫处理分析黄瓜发芽率、发芽势和相对发芽率, 评价芽期耐盐程度的差别, 并在此基础上进一步比较分析盐胁迫下黄瓜突变体幼苗相关形态指标和生理指标, 最后筛选出耐盐性较好的黄瓜突变体材料, 为今后深入研究黄瓜的耐盐机制以及进一步培育耐盐黄瓜品种提供研究基础和试验材料。
1 材料与方法 1.1 试验材料试验材料由南京农业大学葫芦科作物遗传与种质创新实验室提供。前期已获得华北型黄瓜品种‘长春密刺’诱变处理后自交三代的突变体库[13]。所用种子为2015年秋季收获, 挑选饱满种子用于试验。
1.2 方法 1.2.1 发芽期耐盐筛选对948份突变体株系进行编号, 每个株系选取籽粒饱满、大小一致的种子10粒放在纸杯中, 用55 ℃温水浸泡6 h后将水倒掉, 加入少量210 mmol·L-1的NaCl溶液, 置于光照培养箱中催芽, 以野生型‘长春密刺’为对照, 重复3次。每天定时观察、记录种子发芽数及对应时间, 计算种子发芽势、发芽率和相对发芽率, 对突变体材料进行初步筛选。
1.2.2 苗期耐盐鉴定从芽期筛选出的耐盐突变体材料中选取耐盐性明显的12个编号, 每个编号选取饱满一致的种子进行浸种催芽。出芽后播种于塑料盘(以石英砂为基质)中, 每天更换盘中清水; 待幼苗子叶展开时, 改换1/2 Hoagland营养液培养; 待幼苗展开2片真叶时, 在营养液中加入适量NaCl溶液。为避免盐冲击效应, 按照溶液浓度递增的方式更换营养液, 即采用30、60、90和120 mmol·L-1 NaCl 4个浓度依次递进, 每个浓度处理3 d。整个过程均在光照培养箱中进行, 昼/夜温度为28 ℃/20 ℃, 光照/黑暗时间为16 h/8 h。当NaCl最终浓度到达120 mmol·L-1 7 d后进行观测调查。
1.3 测定项目及方法 1.3.1 发芽期测定黄瓜种子的发芽势、发芽率和相对发芽率。发芽势=第3天发芽粒数/供试粒数×100%;发芽率=第5天发芽粒数/供试粒数×100%;相对发芽率=种子发芽率-对照‘长春密刺’种子发芽率[14]。
1.3.2 幼苗期茎粗:用游标卡尺在子叶着生部位向下0.5 cm处测量茎粗(mm); 株高:用直尺测量从基质表面到幼苗最高生长点部位的距离(cm); 根长:用直尺测量从一级侧根处到根系最长位置的距离(cm); 地上鲜质量:将幼苗地上部分剪下, 用电子天平称质量(g); 地下鲜质量:将幼苗地下部分从石英砂中分离出来, 用吸水纸轻轻吸干根系上营养液, 用电子天平称质量(g); 茎节数:黄瓜幼苗节数。
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光化还原法; 过氧化物酶(POD)活性测定采用愈创木酚法; 过氧化氢酶(CAT)活性测定采用紫外分光光度计法; 叶绿素含量测定采用乙醇溶液浸提法; 可溶性蛋白含量测定釆用考马斯亮蓝法。
1.3.3 隶属函数值计算目前运用较为广泛的抗逆性综合评定方法为Fuzzy数学中隶属函数法, 对各个耐盐性指标隶属函数值进行累加, 求平均数以评定植物的耐盐性。
耐盐性隶属函数值的计算方法如下:
若所测指标与耐盐性呈正相关, 则采用公式:U=(X-Xmin)/(Xmax-Xmin);
若所测指标与耐盐性呈负相关, 则采用公式:U=1-(X-Xmin)/(Xmax-Xmin)。
式中:U表示某一指标的隶属函数值; X表示某一指标的测定值; Xmax表示某一指标测定值中的最大值; Xmin为某一指标测定值中的最小值。将各品种的若干指标隶属函数值的算数平均值作为平均隶属度。平均隶属度越大, 就说明耐盐性越好。
1.4 数据处理采用Excel 2003和SPSS 20.0软件进行数据处理。
2 结果与分析 2.1 黄瓜突变体发芽期耐盐材料的筛选用210 mmol·L-1 NaCl溶液处理948份黄瓜突变体种子, 发现这些材料的种子发芽能力差异显著。其中, 大部分材料耐盐能力都要弱于对照‘长春密刺’, 表现为发芽率、发芽势低, 胚根不生长等现象。试验以相对发芽率作为耐盐筛选指标, 将948份突变体材料分为:耐盐型(相对发芽率≥80%)、中间型(相对发芽率为40%~60%)和盐敏感型(相对发芽率 < 20%)。其中, 耐盐型材料最少, 只有25份, 占试验材料总数的2.64%;中间型材料共有152份, 占16.03%;其余771份为盐敏型材料, 占总数的81.33%。
根据其种子发芽时间早晚、整齐度和胚根长度等指标, 从25份耐盐型材料中选取12份作为进一步幼苗期筛选的材料(表 1)。
| % | |||
| 编号 Code |
发芽势 Germination potential |
发芽率 Germination rate |
相对发芽率 Relative germination rate |
| Mu-2-1 | 100 | 100 | 80 |
| Mu-8-1 | 0 | 100 | 80 |
| Mu-34-2 | 0 | 100 | 80 |
| Mu-40-6 | 100 | 100 | 80 |
| Mu-42-5 | 20 | 100 | 80 |
| Mu-43-4 | 80 | 100 | 80 |
| Mu-60-9 | 0 | 100 | 80 |
| Mu-61-2 | 0 | 100 | 80 |
| Mu-144-3 | 60 | 100 | 80 |
| Mu-144-10 | 0 | 100 | 80 |
| Mu-70-11 | 20 | 100 | 80 |
| Mu-94-6 | 0 | 100 | 80 |
由表 2可见:相同性状在不同突变体间表现出明显差异, 同一突变体不同性状也存在显著差异。在12个突变体材料中, 有8个突变体株高显著高于对照‘长春密刺’; 2个突变体茎粗显著大于对照; 4个突变体根长显著大于对照; 3个突变体地上部鲜质量显著大于对照; 4个突变体地下部鲜质量显著大于对照; 9个突变体茎节数显著大于对照。其中, Mu-34-2和Mu-94-6的6项指标都显著优于对照; Mu-43-4有5项指标优于对照; Mu-144-3有3项指标优于对照; Mu-61-2和Mu-144-10有2项指标优于对照, 其他与对照表现差异不明显。Mu-34-2、Mu-94-6和Mu-43-4属于耐盐性较好的材料。盐胁迫对不同突变体不同性状的影响程度也不相同, 所以需要多个性状进行综合对比分析。
| 编号 Code |
株高/cm Plant height |
茎粗/mm Stem diameter |
根长/cm Root length |
地上部鲜质量/g Fresh weight of shoot |
地下部鲜质量/g Fresh weight of root |
茎节数 Internode number |
| CK | 8.450±0.275fg | 1.585±0.344cd | 3.625±0.787d | 0.427±0.051cd | 0.017±0.007b | 2.50±0.50bc |
| Mu-2-1 | 7.100±0.903g | 1.437±0.089d | 4.275±0.451cd | 0.367±0.106cd | 0.008±0.002b | 2.00±0.00c |
| Mu-8-1 | 11.025±0.464cde | 2.025±0.193abcd | 5.825±1.467bcd | 0.438±0.072cd | 0.023±0.011b | 4.00±0.00a |
| Mu-34-2 | 12.900±0.273bc | 2.512±0.125a | 9.275±0.775a | 1.035±0.107a | 0.086±0.009a | 3.75±0.25a |
| Mu-40-6 | 12.400±0.623bcd | 2.155±0.114abcd | 4.225±0.976cd | 0.565±0.021cd | 0.028±0.010b | 4.00±0.00a |
| Mu-42-5 | 9.825±0.743ef | 2.317±0.282abc | 6.600±1.454abc | 0.640±0.173bc | 0.013±0.001b | 2.50±0.29bc |
| Mu-43-4 | 12.900±0.612bc | 1.647±0.275bcd | 8.000±0.348ab | 0.968±0.191ab | 0.077±0.006a | 4.00±0.00a |
| Mu-60-9 | 10.100±1.005def | 1.737±0.188bcd | 5.275±0.451bcd | 0.305±0.043cd | 0.012±0.006b | 3.50±0.29a |
| Mu-61-2 | 11.800±0.793bcde | 1.592±0.133cd | 3.825±1.212cd | 0.370±0.040cd | 0.007±0.002b | 3.75±0.25a |
| Mu-144-3 | 14.025±0.653ab | 2.012±0.104abcd | 4.875±0.973cd | 0.516±0.052cd | 0.094±0.004a | 4.25±0.25a |
| Mu-144-10 | 15.725±0.225a | 1.935±0.025abcd | 4.900±0.445cd | 0.235±0.050d | 0.015±0.005b | 4.00±0.00a |
| Mu-70-11 | 8.200±0.974fg | 2.080±0.238abcd | 4.500±0.424cd | 0.455±0.077cd | 0.004±0.000b | 2.75±0.25bc |
| Mu-94-6 | 13.450±1.656abc | 2.377±0.452ab | 7.800±0.506ab | 1.187±0.253a | 0.086±0.012a | 3.75±0.25a |
| 注:CK:对照‘长春密刺’。不同字母表示不同处理间差异显著(P < 0.05)。下同。 Note: CK:Contol‘Changchunmici’. The different letters indicate significant difference at 0.05 level among different treatments. The same as follows. |
||||||
由表 3可见:有6个突变体叶片SOD活性显著高于对照, 4个突变体叶片CAT活性显著高于对照; 其中, Mu-34-2、Mu-43-4和Mu-94-6的这2种酶活性显著高于对照。12个突变体叶片POD活性与对照相比差异均不显著。总体来看, 不同突变体对盐胁迫的反应存在差异, SOD活性差异较POD、CAT更大, SOD可能对抵御盐胁迫伤害起到更大作用。
| 编号 Code |
SOD活性/(U·g-1) SOD activity |
POD活性/(U·g-1·min-1) POD activity |
CAT活性/(U·g-1·min-1) CAT activity |
| CK | 0.052±0.001c | 4.472±0.156abc | 0.799±0.132c |
| Mu-2-1 | 0.097±0.003b | 2.288±0.191c | 1.181±0.306c |
| Mu-8-1 | 0.044±0.015c | 9.776±2.047abc | 1.769±0.446bc |
| Mu-34-2 | 0.117±0.034ab | 15.446±2.849ab | 6.251±0.856a |
| Mu-40-6 | 0.031±0.014c | 7.278±1.381abc | 0.284±0.071c |
| Mu-42-5 | 0.151±0.002a | 2.241±0.680c | 0.644±0.154c |
| Mu-43-4 | 0.119±0.016ab | 17.154±6.559ab | 5.847±0.944a |
| Mu-60-9 | 0.028±0.012c | 12.148±4.922abc | 2.300±1.358bc |
| Mu-61-2 | 0.034±0.014c | 16.358±8.702ab | 0.921±0.218c |
| Mu-144-3 | 0.050±0.015c | 15.597±5.383ab | 3.596±0.415b |
| Mu-144-10 | 0.043±0.013c | 4.272±1.693bc | 0.601±0.107c |
| Mu-70-11 | 0.152±0.004a | 9.221±2.902abc | 0.491±0.056c |
| Mu-94-6 | 0.162±0.000a | 17.619±0.466a | 3.226±0.819b |
由表 4可见:黄瓜突变体叶片中叶绿素a、叶绿素b和类胡萝卜素含量均呈不同程度的下降。其中, Mu-34-2、Mu-43-4、Mu-94-6的3项指标均显著高于对照, 耐盐性最佳; 除类胡萝卜素含量外, Mu-144-10其余2种色素含量也显著高于对照, 也属于耐盐品种; Mu-2-1、Mu-8-1、Mu-60-9的3种色素含量均显著低于对照, 耐盐性最差。
| mg·g-1 | |||
| 编号Code | 叶绿素a含量Chlorophyll a content | 叶绿素b含量Chlorophyll b content | 类胡萝卜素含量Carotenoids content |
| CK | 12.584±0.059cd | 5.033±0.270bc | 3.341±0.269cde |
| Mu-2-1 | 5.181±0.522f | 2.160±0.113d | 1.160±0.117gh |
| Mu-8-1 | 3.624±1.684f | 1.796±0.513d | 0.648±0.417h |
| Mu-34-2 | 20.438±2.376ab | 10.251±0.648a | 5.610±0.680a |
| Mu-40-6 | 8.556±0.393edf | 3.648±0.177cd | 2.229±0.180efg |
| Mu-42-5 | 16.321±2.488bc | 6.544±1.140b | 4.432±0.471abc |
| Mu-43-4 | 20.277±2.866ab | 10.298±0.662a | 5.408±0.770ab |
| Mu-60-9 | 7.074±1.617df | 1.919±0.568d | 1.523±0.325fgh |
| Mu-61-2 | 10.748±0.344ed | 4.020±0.077cd | 2.893±0.073def |
| Mu-144-3 | 16.707±1.458bc | 5.796±0.525bc | 4.402±0.298abc |
| Mu-144-10 | 20.644±2.361ab | 10.296±1.654a | 4.099±0.673bcd |
| Mu-70-11 | 13.438±0.830cd | 5.255±0.437bc | 3.489±0.106cde |
| Mu-94-6 | 22.641±1.357a | 10.242±0.482a | 5.638±0.661a |
由图 1可见:不同突变体可溶性蛋白含量存在差异。其中, Mu-34-2、Mu-43-4、Mu-94-6幼苗的可溶性蛋白含量显著高于对照, 耐盐性更好; Mu-60-9的可溶性蛋白含量显著低于对照, 耐盐性最差; 其他突变体与对照差异不显著。
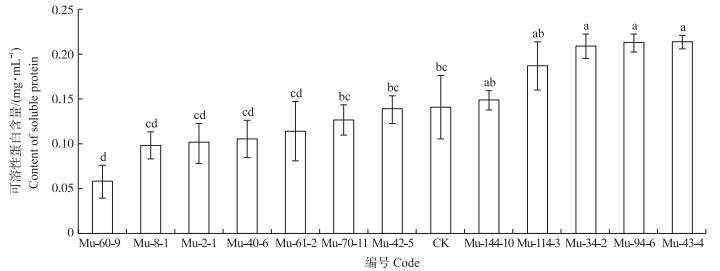
|
图 1 NaCl处理下黄瓜突变体幼苗的可溶性蛋白含量 Figure 1 Soluble protein content in cucumber mutant under NaCl treatment |
由表 5可见:有的突变体会出现某个指标隶属函数值很高而其他性状指标隶属函数值很低的现象, 且不同突变体材料对盐胁迫的耐受程度和性状表现都不同, 因此, 单个指标反映耐盐性往往具有一定的片面性, 仅仅根据单个指标很难判定耐盐性强弱。为了克服这种弊端, 我们引用不同时期各个性状指标的隶属函数值和平均隶属度对突变体材料耐盐性进行综合研究。本试验结果是以对照为基准进行区分, 根据平均隶属度大小结果可知有5份材料表现差于对照‘长春密刺’, 即为不耐盐, 而有7份材料耐盐性优于对照, 耐盐性强弱依次为Mu-94-6、Mu-34-2、Mu-144-10、Mu-70-11、Mu-42-5、Mu-61-2、Mu-43-4, 这与方差分析结果基本一致。
| 编号 Code |
SOD | POD | CAT | 叶绿素a Chlorophyll a |
叶绿素b Chlorophyll b |
类胡萝卜素 Carotenoids |
可溶性蛋白 Soluble protein |
株高 Plant height |
根长 Root length |
茎粗 Stem diameter |
地下部鲜质量 Fresh weight of root |
地上部鲜质量 Fresh weight of shoot |
茎节数 Internode number |
平均隶属度 Average membership |
| Mu-2-1 | 0.60 | 0.43 | 0.36 | 0.60 | 0.36 | 0.56 | 0.42 | 0.52 | 0.30 | 0.49 | 0.38 | 0.48 | 0 | 0.423 |
| Mu-40-6 | 0.38 | 0.52 | 0.35 | 0.55 | 0.65 | 0.59 | 0.69 | 0.43 | 0.45 | 0.37 | 0.34 | 0.41 | 0 | 0.441 |
| Mu-144-3 | 0.54 | 0.47 | 0.62 | 0.39 | 0.39 | 0.40 | 0.36 | 0.42 | 0.39 | 0.57 | 0.40 | 0.56 | 0.25 | 0.443 |
| Mu-8-1 | 0.54 | 0.41 | 0.40 | 0.61 | 0.62 | 0.75 | 0.47 | 0.42 | 0.29 | 0.44 | 0.33 | 0.56 | 0 | 0.449 |
| Mu-60-9 | 0.64 | 0.34 | 0.42 | 0.35 | 0.42 | 0.36 | 0.47 | 0.57 | 0.30 | 0.71 | 0.48 | 0.57 | 0.25 | 0.452 |
| CK | 0.41 | 0.50 | 0.50 | 0.42 | 0.58 | 0.56 | 0.66 | 0.54 | 0.45 | 0.34 | 0.38 | 0.31 | 0.25 | 0.454 |
| Mu-43-4 | 0.58 | 0.40 | 0.43 | 0.41 | 0.42 | 0.54 | 0.52 | 0.67 | 0.38 | 0.44 | 0.48 | 0.55 | 0.50 | 0.486 |
| Mu-61-2 | 0.64 | 0.40 | 0.39 | 0.52 | 0.53 | 0.63 | 0.63 | 0.37 | 0.48 | 0.50 | 0.50 | 0.52 | 0.38 | 0.499 |
| Mu-42-5 | 0.40 | 0.52 | 0.42 | 0.65 | 0.59 | 0.72 | 0.57 | 0.51 | 0.32 | 0.59 | 0.62 | 0.46 | 0.25 | 0.509 |
| Mu-70-11 | 0.38 | 0.59 | 0.66 | 0.45 | 0.64 | 0.59 | 0.57 | 0.59 | 0.40 | 0.50 | 0.47 | 0.40 | 0.38 | 0.509 |
| Mu-144-10 | 0.52 | 0.57 | 0.61 | 0.66 | 0.64 | 0.64 | 0.60 | 0.62 | 0.35 | 0.59 | 0.38 | 0.52 | 0 | 0.515 |
| Mu-34-2 | 0.53 | 0.53 | 0.54 | 0.43 | 0.42 | 0.41 | 0.49 | 0.54 | 0.55 | 0.59 | 0.52 | 0.41 | 0.75 | 0.516 |
| Mu-94-6 | 0.60 | 0.47 | 0.43 | 0.43 | 0.36 | 0.56 | 0.42 | 0.47 | 0.59 | 0.70 | 0.54 | 0.42 | 0.75 | 0.518 |
本研究获得了耐盐突变体Mu-94-6、Mu-34-2、Mu-144-10、Mu-70-11、Mu-42-5、Mu-61-2和Mu-43-4, 这为进一步研究提供了材料。盐胁迫会加速植物叶绿素分解[15], 并阻止叶绿素合成[16-17], 因此盐胁迫对色素含量影响很大。本试验中, 经过盐处理后不同突变体叶片叶绿素a、叶绿素b、类胡萝卜素含量均出现明显的差异, 且叶绿素a含量的波动幅度明显大于另外2种色素。叶绿素a主要存在于2个光系统PSⅠ和PSⅡ核心复合物中; 叶绿素b主要为2个光系统的天线组分; 类胡萝卜素则是一种光合作用的辅助色素, 对叶绿素起到保护作用。因此, 叶绿素a更敏感的反应可能证明盐胁迫对光合机构损伤产生的原始部位在光系统反应中心而非外周天线[18]。
盐胁迫可引起黄瓜幼苗膜脂过氧化, 使细胞膜受到伤害, 这时植物抵御盐胁迫的活性氧清除系统产生应激反应。SOD、POD、CAT等膜保护酶在逆境中维持较高的酶活性, 从而能有效地清除过量的活性氧, 减少对膜结构和功能的破坏, 同样盐胁迫对大多数非盐生植物SOD、POD、CAT活性有明显的抑制作用[19]。本试验通过对保护酶活性下降程度的对比筛选出了比对照表现更好的耐盐突变体材料。黄瓜耐盐机制十分复杂, 耐盐性受气候条件、品种自身、生长发育时期等多方面因素影响, 不同品种对盐胁迫的表现方式也不尽相同, 因此不同的处理时期、处理条件和评价指标都可能导致最后结果的偏差。考虑到植物萌发期和幼苗期对盐胁迫最为敏感, 其他发育阶段对盐胁迫相对不敏感[20], 本试验选取了黄瓜突变体发芽期和幼苗期2个时期耐盐性水平进行综合对比, 筛选出耐盐突变体材料。在评价指标方面, 利用种子发芽特性进行耐盐性的鉴定已得到了广泛应用[21]。虽然形态指标检测方便, 易于观察, 但这些指标很容易受到外界环境影响, 因此本文又进一步将幼苗期形态指标和生理指标相结合, 更能保证筛选结果的准确性, 该方法对今后大群体耐盐性筛选起到一定借鉴作用。筛选过程是以‘长春密刺’为对照, 从分子生物学角度来看, 可以更容易找到相关突变位点以及调控耐盐性状的基因。筛选获得的耐盐材料, 在育种方面存在很大的价值, 可运用于盐碱化地区从而提高农业生产效益。
本研究中, 通过发芽期筛选出的耐盐突变体在幼苗期表现不尽相同, 但大部分发芽期表现耐盐的品种在幼苗期依然会保持同样良好的耐盐性。因此, 在发芽期进行耐盐性筛选具有重要的参考价值, 可以简便、迅速地筛选出耐盐品种, 对大批量品种筛选具有一定优势, 但是不排除出现发芽期表现耐盐性不佳而幼苗期表现相反的情况。在幼苗期筛选过程中, 同一突变体的生理指标与形态指标也存在差异, 可能会出现大部分性状表现耐盐性突出, 而少数性状与对照水平差不多或差于对照的现象。这可能因为不同突变体的不同性状受盐胁迫程度不同。因此, 不能因为单一某个性状表现优良而片面地推断其耐盐性好坏。我们利用平均隶属度对所有测量性状进行综合评价, 从而能够比较准确地从大量材料中筛选出耐盐株系。当然, 这种筛选方法还需要进一步的试验验证和完善。
盐胁迫问题往往存在于栽培土壤, 而不同地区土壤盐分含量差异很大。普通的土壤栽培试验不能准确说明盐胁迫是主效胁迫因素, 此前已有研究采用水培法控制栽培环境盐浓度[22-23]。本试验采用水培法, 直接将营养液中加入NaCl, 减少栽培环境带来的影响, 并且综合不同时期的多种性状进行筛选, 得到准确可靠的耐盐突变体, 为今后更深入研究黄瓜耐盐机制及品种改良提供材料。
| [1] | Hasegawa P M, Bressan R A, Zhu J K, et al. Plant cellular and molecular responses to high salinity[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2000, 51: 463-499. DOI: 10.1146/annurev.arplant.51.1.463 |
| [2] |
蔺娟, 地里拜尔·苏力坦. 土壤盐渍化的研究进展[J].
新疆大学学报(自然科学版), 2007, 24(3): 318-323.
Lin J, Dilbar Sultan. Progress in the study on soil salinization[J]. Journal of Xinjiang University(Natural Science Edition), 2007, 24(3): 318-323. (in Chinese with English abstract) |
| [3] |
杨劲松. 中国盐渍土研究的发展历程与展望[J].
土壤学报, 2008, 45(5): 837-845.
Yang J S. Development and prospect of the research on salt-affected soils in China[J]. Acta Pedologica Sinica, 2008, 45(5): 837-845. (in Chinese with English abstract) |
| [4] |
郭世荣, 孙锦, 束胜, 等. 我国设施园艺概况及发展趋势[J].
中国蔬菜, 2012, 1(18): 1-14.
Guo S R, Sun J, Shu S, et al. Analysis of general situation, characteristics, existing problems and development trend of protected horticulture in China[J]. China Vegetables, 2012, 1(18): 1-14. (in Chinese with English abstract) |
| [5] |
程大友, 张义, 陈丽. 氯化钠胁迫下甜菜种子的萌发[J].
中国糖料, 1996(2): 21-23.
Cheng D Y, Zhang Y, Chen L. Germination of sugar beet seeds under chloride stress[J]. Sugar Crops of China, 1996(2): 21-23. (in Chinese with English abstract) |
| [6] |
贺军民, 佘小平, 张键. 番茄种子吸湿-回干处理对盐胁迫伤害的缓解效应[J].
园艺学报, 2000, 27(2): 123-126.
He J M, She X P, Zhang J. Effects of hydration-dehydration treatment on salt stress-induced injuries to tomato seed germination[J]. Acta Horticulture Sinica, 2000, 27(2): 123-126. (in Chinese with English abstract) |
| [7] | Zandt P A V, Tobler M A, Mouton E, et al. Positive and negative consequences of salinity stress for the growth and reproduction of the clonal plant, Iirs hexagona[J]. Journal of Ecology, 2003, 91(5): 837-846. DOI: 10.1046/j.1365-2745.2003.00806.x |
| [8] |
陈竹生, 聂华堂, 计玉, 等. 柑桔种质的耐盐性鉴定[J].
园艺学报, 1992, 19(4): 289-295.
Chen Z S, Nie H T, Ji Y, et al. Identification of salt tolerance of citrus germplasm[J]. Acta Horticulture Sinica, 1992, 19(4): 289-295. (in Chinese with English abstract) |
| [9] |
罗庆云, 於丙军, 刘友良. 大豆苗期耐盐性鉴定指标的检验[J].
大豆科学, 2001, 20(3): 177-182.
Luo Q Y, Yu B J, Liu Y L. Examination of salt tolerance identification index in soybean seedling[J]. Soybean Science, 2001, 20(3): 177-182. (in Chinese with English abstract) |
| [10] |
王丽萍, 郭世荣, 孙锦, 等. Ca(NO3) 2和NaCl胁迫下耐盐砧木嫁接黄瓜光合特性及碳同化关键酶基因表达分析[J].
南京农业大学学报, 2012, 35(3): 31-36.
Wang L P, Guo S R, Sun J, et al. Analysis of photosynthetic characteristics and enzyme genes expression of carbon assimilation in cucumber by grafting onto salt-tolerant rootstock under iso-osmotic Ca(NO3) 2 or NaCl stress[J]. Journal of Nanjing Agricultural University, 2012, 35(3): 31-36. DOI: 10.7685/j.issn.1000-2030.2012.03.006 (in Chinese with English abstract) |
| [11] | Parida A K, Das A B. Salt tolerance and salinity effects on plants:a review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3): 324-349. DOI: 10.1016/j.ecoenv.2004.06.010 |
| [12] |
魏国强, 朱祝军, 方学智, 等. NaCl胁迫对不同品种黄瓜幼苗生长、叶绿素荧光特性和活性氧代谢的影响[J].
中国农业科学, 2004, 37(11): 1754-1759.
Wei G Q, Zhu Z J, Fang X Z, et al. The Effects of NaCl stress on plant growth, chlorophyll fluorescence characteristics and active oxygen metabolism in seedlings of two cucumber cultivars[J]. Scientia Agricultura Sinica, 2004, 37(11): 1754-1759. DOI: 10.3321/j.issn:0578-1752.2004.11.031 (in Chinese with English abstract) |
| [13] |
王晶, 娄群峰, 魏庆镇, 等. 长春密刺黄瓜突变体库的构建和部分性状分析[J].
核农学报, 2015, 29(8): 1479-1486.
Wang J, Lou Q F, Wei Q Z, et al. Construction of changchunmici mutant library and analysis of some mutants[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(8): 1479-1486. DOI: 10.11869/j.issn.100-8551.2015.08.1479 (in Chinese with English abstract) |
| [14] |
顾少涵, 潘俏, 李子昂, 等. 黄瓜耐低温突变体材料的筛选与鉴定[J].
南京农业大学学报, 2017, 40(2): 219-224.
Gu S H, Pan Q, Li Z A, et al. Identification and screening of cold tolerant mutants of cucumber[J]. Journal of Nanjing Agricultural University, 2017, 40(2): 219-224. DOI: 10.7685/jnau.201606025 (in Chinese with English abstract) |
| [15] |
马丽清, 韩振海, 周二峰, 等. 盐胁迫对珠美海棠和山定子膜保护酶系统的影响[J].
果树学报, 2006, 23(4): 495-499.
Ma L Q, Han Z H, Zhou E F, et al. Effect of salt stress on protective enzyme system of membrane in Malus zumi and M. baccata[J]. Journal of Fruit Science, 2006, 23(4): 495-499. (in Chinese with English abstract) |
| [16] |
刘家尧, 衣艳君, 张其德. 盐胁迫对不同抗盐性小麦叶片荧光诱导动力学的影响[J].
植物学通报, 1998, 15(2): 46-49.
Liu J R, Yi Y J, Zhang Q D. Effects of salt stress on chlorophtyll a fluorescence induction kinetics oin wheat leaves with different salt tolerance-different[J]. Chinese Bulletin of Botany, 1998, 15(2): 46-49. (in Chinese with English abstract) |
| [17] | Santos C L V D, Caldeira G. Comparative responses of Helianthus annuus plants and calli exposed to NaCl:Ⅰ. Growth rate and osmotic regulation in intact plants and calli[J]. Journal of Plant Physiology, 1999, 155(6): 769-777. DOI: 10.1016/S0176-1617(99)80095-9 |
| [18] |
张淑红, 张恩平, 庞金安, 等. NaCl胁迫对黄瓜幼苗光合特性及水分利用率的影响[J].
中国蔬菜, 2005, 1(1): 11-13.
Zhang S H, Zhang E P, Pang J A, et al. Effect of NaCl stress on photosynthetic characteristics and water use efficiency of cucumber seedlings[J]. China Vegetables, 2005, 1(1): 11-13. (in Chinese with English abstract) |
| [19] | Hernández J A, Corpas F J, Gómez M, et al. Salt-induced oxidative stress mediated by activated oxygen species in pea leaf mitochondria[J]. Physiologia Plantarum, 1993, 89(1): 103-110. DOI: 10.1111/ppl.1993.89.issue-1 |
| [20] |
龚明, 刘友良, 丁念诚, 等. 大麦不同生育期的耐盐性差异[J].
西北植物学报, 1994, 14(1): 1-7.
Gong M, Liu Y L, Ding N C, et al. Difference of salt tolerance in Hordeum vulgare at different growth stages[J]. Acta Botanica Boreali-Occidentakia Sinica, 1994, 14(1): 1-7. (in Chinese with English abstract) |
| [21] |
陈国雄, 李定淑, 张志谦, 等. 盐胁迫对西葫芦和黄瓜种子萌发影响的对比研究[J].
中国沙漠, 1996, 16(3): 307-310.
Chen G X, Li D S, Zhang Z Q, et al. Comparative study on the effects of salt stress on seed germination of summer squash and cucumber[J]. Journal of Desert Research, 1996, 16(3): 307-310. (in Chinese with English abstract) |
| [22] |
陈丽芳, 陆巍, 孙锦, 等. 外源亚精胺对盐胁迫下黄瓜幼苗光合作用和根叶碳水化合物积累的影响[J].
南京农业大学学报, 2011, 34(3): 31-36.
Chen L F, Lu W, Sun J, et al. Effects of exogenous spermidine on photosynthesis and carbohydrate accumulation in roots and leaves of cucumber(Cucumis sativus L.) seedlings under salt stress[J]. Journal of Nanjing Agricultural University, 2011, 34(3): 31-36. DOI: 10.7685/j.issn.1000-2030.2011.03.006 (in Chinese with English abstract) |
| [23] |
严蓓, 孙锦, 束胜, 等. 外源钙对NaCl胁迫下黄瓜幼苗叶片光合特性及碳水化合物代谢的影响[J].
南京农业大学学报, 2014, 37(1): 31-36.
Yan B, Sun J, Shu S, et al. Effects of exogenous calcium on photosynthesis characteristics and carbohydrate metabolism in leaves of cucumber(Cucumis sativus L.) seedlings under salt stress[J]. Journal of Nanjing Agricultural University, 2014, 37(1): 31-36. DOI: 10.7685/j.issn.1000-2030.2014.01.006 (in Chinese with English abstract) |




