文章信息
- 刘晨, 魏全伟, 李平华, 吴燕, 吴望军, 李强, 黄瑞华, 石放雄
- LIU Chen, WEI Quanwei, LI Pinghua, WU Yan, WU Wangjun, LI Qiang, HUANG Ruihua, SHI Fangxiong
- 抑制素α亚基基因5'UTR区在苏淮猪中的多态性分析
- Association of polymorphism of 5'UTR region at the INHA gene and the litter size in the Suhuai pig
- 南京农业大学学报, 2017, 40(6): 1119-1124
- Journal of Nanjing Agricultural University, 2017, 40(6): 1119-1124.
- http://dx.doi.org/10.7685/jnau.201609038
-
文章历史
- 收稿日期: 2016-09-27
2. 南京农业大学淮安研究院, 江苏 淮安 223005;
3. 淮安市淮阴种猪场, 江苏 淮安 223322
2. Huaian Research Institute of Nanjing Agricultural University, Huaian 223005, China;
3. Huaian Huaiyin Pig Farm, Huaian 223322, China
中国地方品种猪高繁殖力及其调控机制一直是中外相关学者研究的热点。研究和开发本土种质资源的优势对于发展我国的畜牧业具有重要意义。苏淮猪是在新淮猪基础上再导入大白猪血统, 通过横交、多世代选育而成, 新淮猪和大白猪血统各占50%。苏淮猪被毛黑色(极少数有白蹄), 头中等大, 额宽, 耳大, 略向前倾, 面微凹, 背腰平直而长, 腹不下垂, 后躯发育良好, 四肢结实。乳房发育良好, 有效乳头在14个以上。而且苏淮猪具有良好的生产性能, 成年公猪平均体质量可达157 kg以上, 母猪平均体质量可达115 kg以上, 40日龄断乳窝总质量101.55 kg, 肥育猪平均日增重662 g, 料重比3.09:1[1]。经产苏淮母猪产仔数11~12头[2], 与高繁殖力的母猪繁殖性能尚有差距。为了进一步提高苏淮猪的竞争力, 有必要对苏淮猪产仔性能进行持续选育。然而, 猪的繁殖性状遗传力低, 且为限性性状, 用常规选择方法收效甚微, 因此, 研究并应用分子标记对多产性开展标记辅助选择以提高猪的繁殖性状具有重要的意义。
有关候选基因的筛选研究多集中在卵泡刺激素、促黄体生成素、促性腺激素释放激素、催乳素等激素及其受体基因[3-5], 而对卵泡分泌的抑制素及其受体基因方面的研究较少。抑制素INH主要由卵巢颗粒细胞或睾丸支持细胞分泌, 是由α和βA或βB 2个亚基通过二硫键形成的糖蛋白异二聚体, 属于TGFβ家族成员。抑制素A是由α和βA亚基构成, 而抑制素B是由α和βB构成[6]。先前的研究发现, 抑制素在卵泡选择以及优势卵泡的发育过程中起关键作用。抑制素与激活素和FSH构成的抑制素/激活素-FS系统能够调控卵泡的发育, 也在卵巢中调节类固醇激素合成[7-8]。因此, 抑制素基因(INHA)被选为繁殖性状的候选基因。Robertson等[9]首次从猪cDNA文库中筛选出猪抑制素亚基基因。在2012年, 已完成猪全基因组测序[10]。猪INHA基因位于第15号染色体, 包含1个内含子和2个外显子, 总长为4 046 bp。猪INHA基因5′UTR区的多态性位点是否影响猪的繁殖性能, 尚未见报道。本试验对INHA基因5′UTR区进行多态性检测, 并采用最小二乘法分析其与苏淮猪产仔数之间的关系, 为苏淮猪的选育提供理论依据。
1 材料与方法 1.1 试验动物及样品采集189头供试猪为纯种苏淮母猪, 来自江苏省淮安市淮阴种猪场。收集母猪的产仔数等繁殖性状数据。将供试猪耳尖部分经乙醇消毒后, 用耳号钳采集一小块耳尖, 放入已灭菌的1.5 mL EP管中, 干冰保存送回实验室。
1.2 苏淮猪基因组DNA的提取及检测采用常规的酚-氯仿提取法提取苏淮猪耳组织样基因组DNA, 提取后的DNA用双蒸水溶解, 用紫外分光光度计测定DNA浓度, 然后-20 ℃保存备用。
1.3 引物设计与合成根据GenBank的数据资源, 下载猪INHA基因序列(登录号NC_010457.4), 应用Primer Premier 5.0软件对INHA基因5′UTR区设计引物1对, 预期扩增长度为293 bp, 由上海英骏生物技术有限公司合成。引物对序列为:5′-GGGCAGACCCTGACAGAAG-3′/5′-CTCATTACCTGTAGCCGGGA-3′。
1.4 INHA基因的PCR反应PCR反应体系(总体积20 μL):2×Mix 10 μL, 上、下游引物各1 μL(10 pmol·L-1), DNA模板1 μL(100 ng·μL-1), 加双蒸水至20 μL。反应程序:96 ℃预变性2 min; 96 ℃变性20 s, 55 ℃复性30 s, 72 ℃延伸30 s, 共35个循环; 72 ℃后延伸5 min, 最后4 ℃保存。
1.5 PCR产物回收及测序PCR产物经胶回收试剂盒回收, 纯化后送样品到南京金斯瑞生物科技有限公司进行PCR产物测序。胶回收试剂盒由日本东洋纺公司提供。
1.6 苏淮猪基因5′UTR区生物信息学分析利用NCBI上的GenBank数据库查找猪INHA基因5′UTR区序列, 同时利用软件DNAMAN 6.0进行多物种之间的序列比对(猪、大鼠、牛、人、山羊)和同源树分析; 使用在线软件Methprimer(http://www.urogene.org)对猪INHA基因5′UTR区序列预测分析CpG岛(CpG island); 使用在线软件genomatic(www.genomatic.de.com)对猪INHA基因5′UTR区序列进行转录因子预测分析。
1.7 数据的统计分析核苷酸序列采用DNAMAN 6.0软件进行对比, 经Popgenev1.32软件计算基因型频率、等位基因频率、杂合度和多态信息含量(PIC)、遗传杂合度(He)和有效等位基因数(Ne), 并进行Hardy-Weinberg平衡适应性检验。同时, 采用SPSS 19.0软件的一般线性模型(GLM)程序分析基因型对猪产仔数的影响, 模型如下:
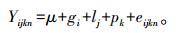
|
式中:Yijkn为苏淮猪第n个个体的产仔数表型值, μ为群体均值, gi为基因型的效应, lj为年度效应, pk为胎次效应, eijkn为随机误差效应。
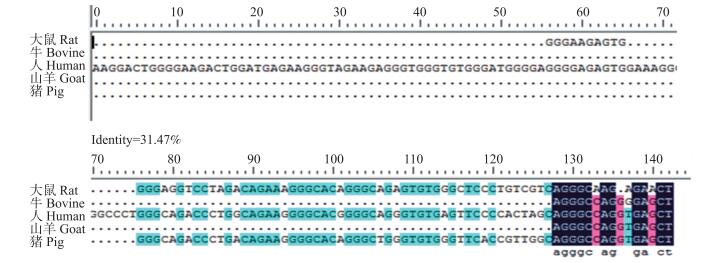
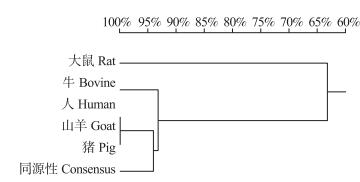
2 结果与分析 2.1 苏淮猪INHA基因5′UTR区序列特征苏淮猪INHA基因5′UTR区序列全长为67 bp, 其序列中A、T、C和G的含量分别是17.9%、14.9%、22.4%和44.8%, 其中G+C的含量(67.2%)大于A+T的含量(32.8%)。通过同源比对发现猪INHA基因5′UTR区序列与大鼠、牛、人、山羊之间同源性为31.47%(图 1)。说明猪INHA基因5′UTR核苷酸序列在哺乳动物中不保守。对猪INHA基因5′UTR区序列与大鼠、牛、人、山羊的进行同源树分析, 显示人、山羊、猪在该区的序列同源较高(图 2)。
|
图 1 猪与大鼠、牛、人、山羊的INHA 5′UTR区序列比对 Figure 1 Sequence comparison of 5′UTR region of INHA in the rat, bovine, human, goat and pig |
|
图 2 大鼠、牛、人、山羊、猪的INHA基因5′UTR区同源树分析 Figure 2 The analysis homologies of 5′UTR region of INHA gene in rat, bovine, human, goat and pig |
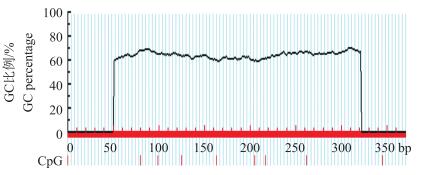
基因5′调控区普遍存在CpG岛(CpG island), 特别是5′UTR区甲基化与DNA转录密切相关。使用在线软件Methprimer(http://www.urogene.org)对猪INHA基因5′UTR区序列进行预测发现, 在INHA基因5′UTR序列没有CpG岛(图 3)。
|
图 3 苏淮猪INHA基因5′UTR区CpG岛预测 Figure 3 The prediction of the 5′UIR region CpG island in INHA gene of Suhuai pigs |
对于顺式作用元件方面, 通过使用在线软件genomatic(www.genomatic.de.com)对猪INHA基因5′UTR区序列进行转录因子预测分析, 结果表明INHA基因5′UTR区存在多个转录因子, 如多形性腺瘤基因1(PLAG1)、正性调节区锌指蛋白5(PRDM5)、红系特异转录活化因子(EKLF)、T-box转录因子21(TBX21)、Ca/H反向转运蛋白6(CAX6)等(图 4)。

|
图 4 苏淮猪INHA基因5′UTR区转录因子预测
Figure 4 The prediction of transcription factor binding sites of INHA gene 5′UTR in Suhuai pig
PLAG1:多形性腺瘤基因1 Pleomorphic adenoma gene 1; PRDM5:正性调节区锌指蛋白The PR domain zine finger protein; EKLF:红系特异转录活化因子Erythoid krüpel 2 like factor; TBX21:T-box转录因子T-box transcription; CAX6:Ca/H反向转运蛋白6 Ca/H antiporter 6 |
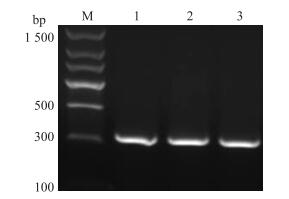
序列扩增后, 检测到1条明亮的单一条带位于300 bp处(图 5), 与试验结果一致。可以用于后续的试验。
|
图 5 苏淮猪INHA基因5′UTR区PCR扩增产物 Figure 5 PCR products of the 5′UTR region at the INHA gene in Suhuai pig M.DNA相对分子质量标准DNA marker; 1~3.苏淮猪INHA基因5′UTR区PCR products of INHA gene. |
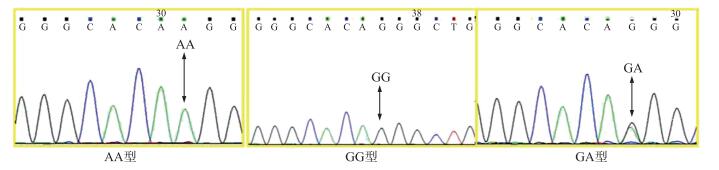
猪INHA基因位于第15号染色体, 基因全长4 046 bp, 含2个外显子和1个内含子。通过测序分析发现在INHA基因翻译起始位点前42 bp处(-42G>A)存在一个多态性位点。这个位点存在GG、AA、GA 3种基因型(图 6)。
|
图 6 苏淮猪INHA基因5′UTR区SNP位点(-42G>A位点) Figure 6 SNP site of 5′UTR region at the INHA gene in Suhuai pigs(-42G > A) |
从群体遗传学角度分析了这个突变位点(-42G>A)的基因型频率、等位基因频率(表 1)及杂合度(He)、有效等位基因数(Ne)和多肽信息含量(PIC)的遗传指标, 并进行卡方检验检测了Hardy-Weinberg平衡性状态。结果显示:在苏淮猪中GA基因型频率最高, 为0.831。G为优势等位基因, 等位基因频率为0.553。苏淮猪的Ne为1.978;PIC为0.372, 属于中度多态性(0.25<PIC<0.5);He为0.494。卡方检验表明该位点基因型不处在Hardy-Weinberg平衡性状态(P < 0.01)。
| 基因型Genotype frequency | 等位基因Allele frequency | ||||||
| AA | GG | GA | A | G | |||
| 频率P | 0.032 | 0.137 | 0.831 | 0.447 | 0.553 | ||
| 样本数n | 6 | 26 | 157 | ||||
对189头健康苏淮猪的2个繁殖性状与INHA基因5′UTR区突变位点基因型进行关联分析。GG基因型个体苏淮猪总产仔数显著高于AA基因型个体(P < 0.05), 总产仔数提高了0.63头, GG基因型个体和AA基因型个体总产仔数差异不显著(P>0.05)。而苏淮猪GG基因型与GA基因型个体在总产仔数和产活仔数上差异均不显著, GG基因型产活仔数略高于AA型(表 2)。
| 基因型 Genotype | 个体数 Number of animals | 总产仔数 Total litter size | 产活仔数 Alive litter |
| AA | 6 | 10.20±2.10a | 9.10±2.53a |
| GG | 26 | 10.83±2.24b | 9.32±2.28a |
| GA | 157 | 10.42±2.39a | 9.04±2.44a |
| 注:同列不同小写字母表示在0.05水平差异显著。 Note:The differences were significant in the same column with different lowercases at 0.05 level. | |||
抑制素(INH)与激活素(ACT)和卵泡抑素(FS)构成INH-ACT-FS系统, 并通过内分泌机制调控垂体卵泡刺激素(FSH)的分泌影响卵泡发育及排卵。抑制素A水平在卵泡早期最低, 随优势卵泡的发育直至卵泡发育晚期明显升高, 反馈抑制垂体FSH的合成与分泌, 使FSH水平下降, 有助于优势卵泡的选择[11]。优势卵泡主要表达抑制素A, 而从属卵泡主要表达抑制素B[12]。INHA也能够通过旁分泌方式影响卵巢发育[13]。INHA水平能够直接影响卵巢的功能, 同时INHA的水平又受到INHA基因直接调控。而基因5′UTR调控区在该基因表达调控中发挥至关重要的作用。INHA基因5′UTR区能够影响INHA基因mRNA转录、脱腺苷和降解, 而INHA基因-42G>A位点突变可能影响INHA基因与转录因子的结合, 进而影响INHA mRNA的转录和稳定性[14]。本研究在INHA的5′UTR区预测到多个转录因子, 如PLAG1、PRDM5、EKLF、TBX21、CAX6等, 这些转录因子能够影响INHA基因的转录, 进而调控INHA的合成和分泌。INHA是一个多功能因子, 并在其他物种上进行了广泛的研究与应用。抑制素α亚基具有免疫原性, 利用免疫方法可降低体内具有活性的抑制素浓度。抑制素免疫可以提高动物的排卵率。利用抑制素主动免疫可以提高黄牛发情率[15]。姜庆林等[16]采用PCR-SSCP技术检测在高繁殖力绵羊品种(小尾寒羊和湖羊)和低繁殖力绵羊品种(多赛特羊、特克塞尔羊和德国肉用美利奴羊)的抑制素A基因第一外显子, 发现INHA基因外显子1中第877位发生T→C的碱基突变, 不同基因型在高繁殖力绵羊品种和低繁殖力绵羊品种之间差异显著; 滑国华等[17]、方宇瑜等[18]对山羊抑制素亚基基因Ⅱ酶切多态性与其产羔数性状进行关联分析时, 发现该基因可能是影响山羊产羔数性状的一个主效基因, G等位基因可能与高产性状呈正相关。另外, 抑制素基因的多态性也与卵巢早衰有关[19]; Li等[20]发现抑制素A亚基基因多态性与母猪卵泡囊肿发病率存在联系, -42GG和c.3222GG基因型母猪患卵泡囊肿的风险较低。
本试验中, 我们在苏淮猪INHA基因5′UTR区同样检测到一个位于-42G>A处的多态位点, 数据分析表明INHA基因5′UTR区-42G>A处位点对苏淮猪产仔数有显著影响, 在苏淮猪中各基因型对总产仔数的影响从大到小是GG基因型、GA基因型、AA基因型, GG基因型为优势基因型。总产仔数GG基因型比AA基因型多0.63头, 产活仔数GG基因型比AA基因型多0.22头。由此可见, 该基因位点与苏淮猪繁殖性能有一定关系, 对产仔数和产活仔数都有提高的作用。本研究发现INHA基因5′UTR区的多态性对部分繁殖性状有显著影响, 因此可以尝试将INHA基因作为影响繁殖性状的候选基因用于苏淮猪的标记辅助选择, 为苏淮猪的选育工作提供科学依据。
| [1] |
赵建军, 吴建海, 张新国, 等. 苏淮猪培育历程及市场化推广现状[J].
中国畜禽种业, 2015, 11(5): 71–73.
Zhao J J, Wu J H, Zhang X G, et al. Current situation of breeding and market promotion of Suhuai pig[J]. Chinese Journal of Animal Science and Veterinary Medicine, 2015, 11(5): 71–73. (in Chinese with English abstract) |
| [2] |
曲亮, 李开桢, 汪秀星, 等. FSHβ基因多态性对苏淮猪繁殖性能的影响[J].
畜牧与兽医, 2008, 40(2): 24–28.
Qu L, Li K Z, Wang X X, et al. Effects of FSHβ gene polymorphism on reproductive performance of Suhuai pig[J]. Journal of Animal Husbandry and Veterinary Medicine, 2008, 40(2): 24–28. (in Chinese with English abstract) |
| [3] | Nonneman D J, Rohrer G A. Comparative mapping of a region on chromosome 10 containing QTL for reproduction in swine1[J]. Animal Genetics, 2003, 34(1): 42–46. DOI: 10.1046/j.1365-2052.2003.00928.x |
| [4] |
吴金生, 王金玉. FSHR基因第10外显子多态性及其与小梅山猪产仔数的相关性[J].
中国农业科学, 2012, 4(13): 2728–2736.
Wu J S, Wang J Y. The polymorphism of exon 10 of FSHR gene and its correlation with litter size in Xiaomeishan pig[J]. Chinese Journal of Agricultural Science, 2012, 4(13): 2728–2736. (in Chinese with English abstract) |
| [5] |
陈从英, 朱万成, 李平华, 等. 白色杜洛克×二花脸F2资源群体中催乳素(PRL)和催乳素受体(PRLR)基因与母猪杀婴行为和产仔数关联性研究[J].
中国农业科学, 2010, 43(11): 2347–2354.
Chen C Y, Zhu W C, Li P H, et al. The relationship between prolactin(PRL)and prolactin receptor(PRLR)gene and sow infestation and litter size in white Duroc×Erhualian F2 population[J]. Chinese Journal of Agricultural Sciences, 2010, 43(11): 2347–2354. DOI: 10.3864/j.issn.0578-1752.2010.11.019 (in Chinese with English abstract) |
| [6] | Kempisty B, Jackowska M, Wo Az'1 na M, et al. Expression and cellular distribution of INHA and INHB before and after in vitro cultivation of porcine oocytes isolated from follicles of different size[J]. Journal of Biomedicine and Biotechnology, 2012, 2012: 742829. |
| [7] | Hengevoss J, Piechotta M, Müller D, et al. Combined effects of androgen anabolic steroids and physical activity on the hypothalamic-pituitary-gonadal axis[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2015, 150: 86–96. DOI: 10.1016/j.jsbmb.2015.03.003 |
| [8] | Muttukrishna S, Knight P G. Inverse effects of activin and inhibin on the synthesis and secretion of FSH and LH by ovine pituitary cells in vitro[J]. Journal of Molecular Endocrinology, 1991, 6(2): 171–178. DOI: 10.1677/jme.0.0060171 |
| [9] | Robertson D M, Foulds L M, Leversha L, et al. Isolation of inhibin from bovine follicular fluid[J]. Biochemical and Biophysical Research Communications, 1985, 126(1): 220–226. DOI: 10.1016/0006-291X(85)90594-7 |
| [10] | Choi J W, Chung W H, Lee K T, et al. Whole-genome resequencing analyses of five pig breeds, including Korean wild and native, and three European origin breeds[J]. DNA Research, 2015: dsv011. |
| [11] | Glister C, Groome N P, Knight P G. Bovine follicle development is associated with divergent changes in activin-A, inhibin-A and follistatin and the relative abundance of different follistatin isoforms in follicular fluid[J]. Journal of Endocrinology, 2006, 188(2): 215–225. DOI: 10.1677/joe.1.06485 |
| [12] | Matzuk M M, Burns K H, Viveiros M M, et al. Intercellular communication in the mammalian ovary:oocytes carry the conversation[J]. Science, 2002, 296(5576): 2178–2180. DOI: 10.1126/science.1071965 |
| [13] | Lovell T M, Gladwell R T, Groome N P, et al. Ovarian follicle development in the laying hen is accompanied by divergent changes in inhibin A, inhibin B, activin A and follistatin production in granulosa and theca layers[J]. Journal of Endocrinology, 2003, 177(1): 45–55. DOI: 10.1677/joe.0.1770045 |
| [14] | Suresh P S, Venkatesh T. Computational interrogation of cis-regulatory elements of genes that are common targets of luteotropin and luteolysin in the primate corpus luteum[J]. Gene, 2013, 515(2): 403–409. DOI: 10.1016/j.gene.2012.12.050 |
| [15] |
杨利国, 张居农, 王进荣, 等. 应用猪精液抑制素主动免疫法诱导黄牛孪生[J].
中国农业科学, 2002, 35(2): 207–212.
Yang L G, Zhang J N, Wang J R, et al. Application of porcine sperm inhibin active immunization to induce cattle twin[J]. Chinese Journal of Agricultural Sciences, 2002, 35(2): 207–212. (in Chinese with English abstract) |
| [16] |
姜庆林, 储明星, 陈国宏, 等. 绵羊抑制素A基因外显子1多态性及其与高繁殖力关系的研究[J].
安徽农业大学学报, 2013, 40(6): 945–949.
Jiang Q L, Chu M X, Chen G H, et al. Studies on exon 1 polymorphism of sheep inhibin A gene and its relationship with high fecundity[J]. Journal of Anhui Agricultural University, 2013, 40(6): 945–949. (in Chinese with English abstract) |
| [17] |
滑国华, 陈世林, 姚红卫, 等. 山羊抑制素α亚基基因HaeⅡ酶切多态性及其与产羔数性状的关联分析[J].
遗传, 2007, 29(8): 972–976.
Hua G H, Chen S L, Yao H W, et al. Correlation analysis of Hae Ⅱ gene polymorphism of goat inhibin α subunit gene and its association with litter size[J]. Hereditas, 2007, 29(8): 972–976. (in Chinese with English abstract) |
| [18] |
方宇瑜, 吴艳, 高硕, 等. 苏淮猪群体抗腹泻基因MUC13和FUT1多态性分析及其抗腹泻选育方案研究[J].
畜牧与兽医, 2015, 47(12): 12–17.
Fang Y Y, Wu Y, Gao S, et al. Polymorphism analysis of anti-diarrhea genes MUC13 and FUT1 in Suhuai pigs and its selective breeding on anti-diarrhea traits[J]. Animal Husbandry and Veterinary Medicine, 2015, 47(12): 12–17. (in Chinese with English abstract) |
| [19] | Yoon S H, Choi Y M, Hong M A, et al. Inhibin α gene promoter polymorphisms in Korean women with idiopathic premature ovarian failure[J]. Human Reproduction, 2012, 27(6): 1870–1873. DOI: 10.1093/humrep/des107 |
| [20] | Li W, Sun L, Chen S, et al. Association of inhibin-α gene polymorphisms with follicular cysts in large white sows[J]. Theriogenology, 2015, 84(6): 839–845. DOI: 10.1016/j.theriogenology.2014.06.028 |




