文章信息
- 罗小清, 张珍瑞, 郭凡溪, 郭洋洋, 吴峰, 余祖功
- LUO Xiaoqing, ZHANG Zhenrui, GUO Fanxi, GUO Yangyang, WU Feng, YU Zugong
- 猪可食性组织中氟尼辛残留量的UPLC-MS/MS检测方法的建立
- Development of an ultra-performance liquid chromatography-tandem mass spectrometry method for the determination of flunixin in edible swine tissues
- 南京农业大学学报, 2017, 40(6): 1105-1110
- Journal of Nanjing Agricultural University, 2017, 40(6): 1105-1110.
- http://dx.doi.org/10.7685/jnau.201606019
-
文章历史
- 收稿日期: 2016-06-15
氟尼辛(flunixin)是一种新型的非甾体抗炎药(NSAID), 与增溶剂葡甲胺等比例结合形成稳定的葡甲胺盐——氟尼辛葡甲胺(FM)[1]。FM是一种动物专用的NSAID, 由于其具有较好的解热、镇痛、抗炎疗效[2-3], 在兽医临床使用上有逐渐增加的趋势。国内外相关文献报道表明氟尼辛具有潜在的胃肠道毒副作用[4-7], 如可引起犬、猫和兔的呕吐、腹泻和胃肠溃疡等。因此出于对食品安全以及人类健康的考虑, 欧盟、美国等相继规定了氟尼辛在猪和牛的可食性组织中最大残留限量[5, 8], 氟尼辛在我国亦批准可用于猪等家畜, 但目前尚未对相关动物源性食品中氟尼辛的残留限量做出具体规定, 也未制定猪可食性组织中氟尼辛残留量的检测方法。我国是一个生猪养殖、消费大国, 为了更好地监管氟尼辛在养猪业的应用, 以降低其在猪可食性组织中的残留, 建立猪可食性组织中氟尼辛残留检测方法十分必要。
目前, 国内外报道的动物源性食品中氟尼辛残留量的检测方法有气相色谱法[9]、高效液相色谱法[10]、气相色谱串联质谱法[11]和液相色谱串联质谱法(LC-MS/MS)[12-13]等, 其中液相色谱串联质谱法具有灵敏度高、定量准确和重现性好等优点。本研究拟在文献基础上, 优化并建立一种适用于猪可食性组织中氟尼辛残留量的超高效液相色谱串联质谱(UPLC-MS/MS)检测方法, 以期为猪可食性组织中氟尼辛残留的监控提供参考。
1 材料与方法 1.1 仪器和设备Waters Acquity UPLC-Xevo TQ-D液相色谱-串联质谱仪(Waters公司), XP-205电子天平(METTLER公司); 12位水浴型氮吹仪(美国Organomation公司); 3-30K型冷冻离心机(Sigma公司); MS 3 basic旋涡混匀器(IKA公司); 12通道固相萃取装置(Waters公司)。
1.2 试剂氟尼辛葡甲胺(中国兽医药品监察所, 纯度99.0%); 乙腈、甲醇均为色谱纯; 乙酸乙酯、乙腈、正己烷、磷酸、氨水均为分析纯; MCX固相萃取柱(Waters公司, 规格为150 mg/6 mL)。
1.3 试液的配制氟尼辛标准储备液(200 μg·mL-1):精确称取已干燥好的氟尼辛葡甲胺对照品33.24 mg, 置于100 mL容量瓶中, 用80%(体积分数)甲醇水溶液定容至刻度, 混匀即得。
氟尼辛标准工作液(10 μg·mL-1):准确量取200 μg·mL-1氟尼辛的标准储备液5 mL, 置于100 mL容量瓶中, 用80%甲醇水溶液定容、混匀即得。
1.4 试料的来源及制备猪可食性组织:肌肉、皮脂(皮肤和脂肪组织)、肝脏、肾脏, 来源于南京市某农贸市场以及笔者饲养的猪。取一定量的组织样品, 进行组织匀浆后作为供试样品。取供试样品分成两部分, 一部分作为空白试样, 一部分添加适宜浓度的氟尼辛标准工作液, 作为添加试样。
1.5 样品前处理 1.5.1 提取称取试样(2±0.02)g于50 mL离心管中, 加无水硫酸钠2 g、乙酸乙酯-乙腈(体积比1:1)溶液15 mL, 涡漩1 min, 振荡15 min, 超声10 min, 5 000 r·min-1离心5 min。取上清液, 置于另一50 mL离心管中。残渣再加乙酸乙酯-乙腈(体积比1:1)溶液10 mL。重复提取一次, 合并2次提取液。加入乙腈饱和正己烷10 mL, 振荡3 min, 静置10 min, 收集下层液体于40 ℃氮气吹干。残余物用2 mL乙腈助溶并超声5 min后, 加2%(体积分数)磷酸溶液8 mL, 涡旋2 min, 8 000 r·min-1离心5 min, 作为提取样液。
1.5.2 净化MCX柱依次用甲醇5 mL、水5 mL和2%(体积分数)磷酸溶液5 mL活化, 取提取样液过柱, 控制流速小于1 mL·min-1, 用甲醇5 mL淋洗, 抽干, 用5%(体积分数)的氨化甲醇5 mL洗脱, 于40 ℃氮气吹干, 用乙腈1 mL和0.1%(体积分数)甲酸水溶液1 mL溶解残余物, 涡旋混匀, 滤膜过滤, 供液相色谱-串联质谱测定。
1.6 液相色谱条件色谱柱Acquity UPLC BEH C18(50 mm×2.1 mm, 粒径1.7 μm), 流速0.2 mL·min-1, 进样量5 μL, 柱温35 ℃, 流动相为乙腈(A)和0.1%甲酸溶液(含0.5 mmol·L-1乙酸铵)(B)。梯度洗脱程序:0~1.5 min, 10% A; 1.5~1.6 min, 10%~30% A; 1.6~3.5 min, 30%~90% A; 3.5~5.5 min, 90%~100% A。
1.7 质谱条件电喷雾离子源(ESI), 正离子扫描, 多反应监测, 电离电压3 600 V, 源温150 ℃; 雾化温度450 ℃, 锥孔气流速50 L·h-1, 雾化气流速900 L·h-1, 锥孔电压48 V; 定性离子对分别为297.2>279.2(22 eV)、297.2>264.2(33 eV), 其中297.2>279.2(22 eV)作为定量离子对。
1.8 方法学验证 1.8.1 专属性为验证待测物在出峰时间处无其他物质干扰, 收集不同来源的试料(南京某超市及自己饲养猪的可食性组织), 釆用1.5节样品前处理方法处理后检测, 通过与标准溶液色谱图以及空白试料添加色谱图进行比较, 观察待测物在保留时间处有无干扰, 由此来判定方法的专属性。
1.8.2 基质匹配标准曲线的制备精密量取10 μg·mL-1氟尼辛标准工作液适量, 用乙腈-0.1%甲酸溶液(体积比1:1)稀释, 配制成氟尼辛质量浓度分别为0.5、1、5、10、25、50、100、200和500 μg·L-1的标准工作液。各取2 mL标准工作液, 分别溶解经提取、净化及吹干后的若干份空白试料残余物, 0.22 μm微孔滤膜过滤上清液, 供超高效液相色谱-串联质谱仪(UPLC-MS/MS)测定。以测得的氟尼辛的特征离子质量色谱峰面积为纵坐标, 对应的药含量为横坐标, 绘制标准曲线, 求回归方程和相关系数。
1.8.3 检测限(LOD)与定量限(LOQ)配制系列浓度的氟尼辛标准工作液添加于2 g均质空白试料(肌肉、皮脂、肝脏、肾脏)中, 制得相应的试样添加水平(0.2~2 μg·kg-1), 按1.3.2节方法提取、净化后供UPLC-MS/MS检测, 测定药物保留时间的定性离子色谱峰信噪比(S/N)(按PtP算)。重复5次, 求平均值。取信噪比(S/N)不小于3时的添加浓度为LOD; 取信噪比(S/N)不小于10时的添加浓度为LOQ。
1.8.4 回收率试验(精密度和准确度)采用标准工作液添加法进行方法的回收率测定。准确称取空白猪肌肉样品若干份, 分别添加标准工作液使试料中药物水平分别为1、25、50和100 μg·kg-1; 称取空白猪皮脂样品若干份, 分别添加标准工作液使试料中药物水平为1、5、10和20 μg·kg-1; 称取空白猪肝脏样品若干份, 分别添加标准工作液使试料中药物水平为1、100、200和400 μg·kg-1; 称取空白猪肾脏样品若干份, 分别添加标准工作液使试料中药物水平为1、15、30和60 μg·kg-1。每批次内每个浓度做5次平行试验, 连续考察3 d, 统计回收率及批内、批间相对标准偏差。
1.8.5 方法的稳定性试验本试验考察了加标样品的短期稳定性及冻/融循环稳定性, 具体方法如下[14]:
短期稳定性试验:称取空白试样2 g, 添加标准工作液使试样中氟尼辛水平为5和500 μg·kg-1, 每个浓度3个平行, 按1.5节方法提取, 提取样液在常温下(20 ℃)放置24 h后取5 μL进UPLC-MS/MS检测。
冻/融循环稳定性试验:向空白试样中添加标准工作液, 制得氟尼辛水平为5和500 μg·kg-1的试样, 每个浓度3个平行, 充分混匀后, -20 ℃冰箱放置24 h后取出, 室温放置解冻。待完全融解后再置-20 ℃ 24 h。经过3次冷冻-融解循环后, 试样按1.5节方法提取, 取5 μL提取液进UPLC-MS/MS检测。
1.9 实际样品测定应用本试验确定的检测方法对从南京某农贸市场不同摊点采集的6份猪可食性组织进行分析。
2 结果与分析 2.1 方法的专属性考察标准溶液色谱图、空白试料以及空白试料添加特征离子质量色谱图见图 1。由图 1可知:待测物在保留时间处无干扰, 方法专属性良好。
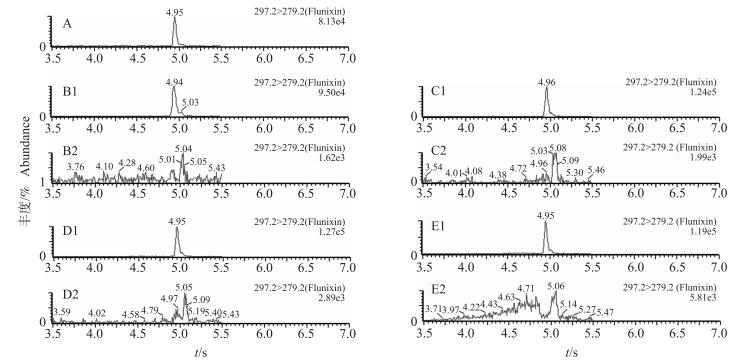
|
图 1 氟尼辛的标准工作液(A)、空白试样以及添加试样定量限(LOQ)水平(B、C、D、E)特征离子质量色谱图 Figure 1 Typical MRM chromatograms of standard solutions(A, spiked at 1 μg·L-1), blank samples and fortified samples(B, C, D, E, spiked at LOQ level) A.氟尼辛的标准工作液(1 μg·L-1)Flunixin standard solutions; B1.肌肉加标Muscle spiked; B2.肌肉空白Muscle blank; C1.皮脂加标Skin and fat spiked; C2.皮脂空白Skin and fat blank; D1.肝脏加标Liver spiked; D2.肝脏空白Liver blank; E1.肾脏加标Kidney spiked; E2.肾脏空白Kidney blank. |
氟尼辛在0.5~500 μg·L-1的质量浓度范围内呈现良好的线性关系, 回归方程为:y=815.66x+2 359.3, 相关系数(r)为0.999 6。
按信噪比(S/N)不小于3确定氟尼辛在猪可食性组织中的LOD均为0.5 μg·kg-1; 按信噪比(S/N)不小于10确定氟尼辛在猪可食性组织中的LOQ均为1 μg·kg-1。
2.3 方法的回收率(精密度和准确度)由回收率试验结果(表 1)可知:本方法在猪肌肉样品中添加1~100 μg·kg-1氟尼辛的回收率为78.6%~90.3%, 批内、批间RSD均不大于13.8%。在猪皮脂样品中添加1~20 μg·kg-1氟尼辛的回收率为75.1%~86.5%, 批内、批间RSD均不大于16.5%。在猪肝脏样品中添加1~400 μg·kg-1氟尼辛的回收率为75.9%~83.0%, 批内、批间RSD均不大于12.7%。在猪肾脏样品中添加1~60 μg·kg-1氟尼辛的回收率为74.8%~84.5%, 批内、批间RSD均不大于11.3%。表明该方法符合残留分析精密度和准确度要求。
| 样品 Samples | 添加量/(μg·kg-1) Spiked amount | 回收率/% Recovery rate | 标准差/% Standard deviation (SD) | 批内精密度/% Intra-day precision RSD(n=5) | 批间精密度/% Inter-day precision RSD(n=15) |
| 肌肉 Muscle | 1 | 90.3 | 12.4 | 13.8 | 13.8 |
| 25 | 79.0 | 6.5 | 8.5 | 8.2 | |
| 50 | 78.6 | 4.3 | 5.2 | 5.5 | |
| 100 | 79.5 | 4.8 | 6.5 | 6.1 | |
| 皮脂 Skin and fat | 1 | 86.5 | 14.3 | 13.9 | 16.5 |
| 5 | 78.2 | 4.3 | 5.4 | 5.5 | |
| 10 | 75.1 | 5.5 | 7.6 | 7.3 | |
| 20 | 77.3 | 3.8 | 4.8 | 5.0 | |
| 肝脏 Liver | 1 | 83.0 | 10.0 | 12.7 | 12.1 |
| 100 | 78.1 | 3.6 | 4.6 | 4.6 | |
| 200 | 77.2 | 4.5 | 5.8 | 5.8 | |
| 400 | 75.9 | 6.1 | 7.7 | 8.1 | |
| 肾脏 Kidney | 1 | 84.5 | 9.4 | 11.3 | 11.1 |
| 15 | 75.8 | 3.8 | 4.8 | 5.0 | |
| 30 | 74.9 | 3.5 | 4.4 | 4.7 | |
| 60 | 74.8 | 3.4 | 4.6 | 4.6 |
取高、低(500、5 μg·kg-1)2个水平氟尼辛的空白组织加标样品, 按1.5节方法提取, 在常温下(20 ℃)放置24 h后进行UPLC-MS/MS检测。结果(表 2)显示:样品短期稳定性良好, 加标回收率为71.7%~83.3%, RSD均不大于7.0%, 符合《兽药残留实验室质量控制规范:NY/T 1896—2010》[14]及欧盟2002/657/EC文件[15]的要求。
| 基质 Matrix | 添加量/ (μg·kg-1) Spiked | 放置24 h稳定性 Stability after 24 hours′ standing | 冻融循环稳定性 Stability after freeze-thaw cycles | |||||
| 平均回收率/% Mean recovery rate | 标准差/% Standard deviation | 相对标准 偏差/% RSD | 平均回收率/% Mean recovery rate | 标准差/% Standard deviation | 相对标准 偏差/% RSD | |||
| 肌肉 | 5 | 82.2 | 2.0 | 2.5 | 79.1 | 2.6 | 3.3 | |
| Muscle | 500 | 83.3 | 0.8 | 1.0 | 85.1 | 1.2 | 1.4 | |
| 皮脂 | 5 | 71.7 | 5.0 | 7.0 | 72.5 | 1.4 | 2.0 | |
| Skin and fat | 500 | 81.1 | 0.4 | 0.5 | 79.3 | 1.7 | 2.1 | |
| 肝脏 | 5 | 76.8 | 4.7 | 6.1 | 72.4 | 2.8 | 3.9 | |
| Liver | 500 | 76.2 | 1.6 | 2.1 | 75.1 | 0.4 | 0.6 | |
| 肾脏 | 5 | 73.6 | 0.7 | 0.9 | 70.8 | 0.5 | 0.7 | |
| Kidney | 500 | 77.3 | 0.9 | 1.2 | 76.6 | 1.8 | 2.3 | |
取高、低(500、5 μg·kg-1)2个水平氟尼辛的空白组织加标样品, 经过3次冷冻/融解循环后, 按1.5节方法提取并进行UPLC-MS/MS检测。结果(表 2)显示:样品冻/融循环稳定性良好, 加标回收率70.8%~85.1%, RSD均不大于3.9%, 符合《兽药残留实验室质量控制规范:NY/T 1896—2010》[14]及欧盟2002/657/EC文件[15]的要求。
2.5 实际样品的测定对从南京某农贸市场6个摊点采集的6份猪可食性组织进行了检测, 方法的定量限为1 μg·kg-1, 结果显示:2份皮脂样品中分别检出2.33和1.87 μg·kg-1氟尼辛; 1份肾脏样品检出1.52 μg·kg-1氟尼辛, 1份肾脏样品能检测到氟尼辛, 但不能定量; 1份肝脏样品能检测到氟尼辛, 但不能定量; 所有肌肉样品中都未检测到氟尼辛。因我国尚无猪可食性组织中氟尼辛的限量标准, 所以参照EMEA规定的在猪肌肉、皮脂、肝脏、肾脏的限量分别为50、10、200和30 μg·kg-1计算, 本次检出的氟尼辛含量远低于以上限量。
3 讨论 3.1 色谱条件的优化流动相的组成和配比、梯度洗脱条件不但影响待测物的色谱行为, 还影响着待测物的离子化效率和灵敏度。常用于液质分析的流动相体系可分为4种:甲醇和水、乙腈和水、甲醇和甲酸溶液、乙腈和甲酸溶液。本研究在Acquity UPLC BEH C18色谱柱上考察了上述流动相体系对氟尼辛出峰的影响, 结果表明:1)乙腈作为流动相优于甲醇; 2)流动相中含有0.1%甲酸能显著地增强氟尼辛的离子响应程度, 而加入适量的乙酸铵(0.5 mmol·L-1)能改善峰型。故选择乙腈和0.1%甲酸溶液(含0.5 mmol·L-1乙酸铵)作为流动相。相对于等度洗脱, 梯度洗脱能缩短样品运行时间。通过改变流动相中各溶剂组成的比例来改变流动相的极性, 从而使样品中的氟尼辛在较短时间内出峰, 最终的梯度洗脱程序见1.6节。
3.2 质谱条件的优化氟尼辛含有一个羧基, 易结合氢而带正电荷, 在ESI+模式下, 用针泵以流动注射的方式将质量浓度为500 μg·L-1的氟尼辛标准溶液按5 μL·min-1的流速注入离子源中, 进行一级质谱扫描, 得到待测物的分子离子峰, 再以待测物的离子为母离子, 对其子离子进行二级质谱扫描。选择2个特征子离子, 以信噪比高、峰形好、干扰小的离子对作为定量离子对, 然后再对其锥孔电压、碰撞能量、源温、雾化温度、锥孔气流速及雾化气流速等质谱参数进行优化, 最终得到的质谱条件如1.7节所述。该方法符合欧盟2002/657/EC[15]文件中利用质谱方法对药物残留进行确证必须满足4个识别点的要求(母离子1点, 特征子离子1.5点/个)。
3.3 提取和净化条件的优化文献报道的生物基质中氟尼辛的提取溶剂有乙腈[13]、2%磷酸-乙醚溶液(体积比1:10)[16]、1-氯丁烷[12]、乙腈和1 mol·L-1乙酸水溶液(体积比9:1)[17]、甲醇[18]、酸化乙腈(乙腈-磷酸, 体积比80:1)[7, 19-20]、乙腈/甲醇(体积比90:10)[21]等。本试验比较了乙腈(C)、1%磷酸乙腈溶液(D)、1%三氯乙酸乙腈溶液(E)、1%磷酸乙酸乙酯溶液(F)、乙酸乙酯(G)和乙腈-乙酸乙酯(体积比1:1)(H)等提取溶剂的提取效果后发现:酸化有机溶剂极性较强, 有较强的蛋白沉淀能力, 易将肝、肾样品中的色素类杂质提取出来, 使得提取液颜色较深, 净化难度大且不易浓缩处理; 在相同的操作步骤下, 以上提取溶剂C、G、H对氟尼辛的提取效率优于D、E、F; 氟尼辛属于中等极性化合物, 相比于提取溶剂C、G, H的极性适中, 对于组织样品中的杂质的提取介于两者之间; 此外, C在浓缩过程中很耗时, G的浸提能力较差, 因此选择H作为提取溶剂。
虽然乙腈-乙酸乙酯(体积比1:1)有较好的提取效果, 但仍然含有一些内源性干扰物, 如蛋白质、脂肪、色素类杂质等脂溶性物质, 为了得到干净的上样液, 本试验选用固相萃取柱(SPE)进行净化。文献报道使用的SPE柱有:SepPak Alumina amino(NH2)[13]、Oasis HLB[7]、C18 end-capped(EC)[20]、Oasis MCX[19]。本试验考察了MCX、HLB和Sep-Pak C18柱的净化效果。试验发现, 采用HLB和Sep-Pak C18固相萃取柱净化时效果并不理想, 添加回收率结果重复性不好, 过柱速度易受上样液状态的影响, 并且得到的上样液基质抑制较明显; 与HLB和Sep-Pak C18相比, MCX柱的净化效率较佳, 因此选用MCX固相萃取柱净化样品。
本试验建立的猪可食性组织中氟尼辛的UPLC-MS/MS检测方法, 线性范围广、样品处理简便、灵敏度高、成本较低, 适用于猪可食性组织中氟尼辛的残留监测。
| [1] | Yu Z G, Jiang C M, Guo Y G, et al. Pharmacokinetics of flunixin meglumine after intravenous and intramuscular administration in pigs[J]. Agricultural Sciences in China, 2007, 6(11): 1396–1401. DOI: 10.1016/S1671-2927(07)60189-8 |
| [2] |
蒋春茂, 余祖功, 郭永刚, 等. 氟尼辛葡甲胺在鸡体内的药物动力学研究[J].
南京农业大学学报, 2006, 29(4): 107–110.
Jiang C M, Yu Z G, Guo Y G, et al. Study on pharmacokinetics of flunixin meglum ine after intravenous intramuscular and oraladm inistration in broilers[J]. Journal of Nanjing Agricultural University, 2006, 29(4): 107–110. DOI: 10.7685/j.issn.1000-2030.2006.04.022 (in Chinese with English abstract) |
| [3] | Rantala M, Kaartinen L, Valimaki E, et al. Efficacy and pharmacokinetics of enrofloxacin and flunixin meglumine for treatment of cows with experimentally induced Escherichia coli mastitis[J]. Journal of Veterinary Pharmacology and Therapeutics, 2002, 25(4): 251–258. DOI: 10.1046/j.1365-2885.2002.00411.x |
| [4] | Macallister C G, Morgan S J, Borne A T, et al. Comparison of adverse-effects of phenylbutazone, flunixin meglumine, and ketoprofen in horses[J]. Journal of the American Veterinary Medical Association, 1993, 202(1): 71–77. |
| [5] | EMEA/CVMP. Committee for Veterinary Medicinal Products Flunixin Summary Report[R]. London:The European Agency for the Evaluation of Medicinal Products Veterinary Medicines Evaluation Unit, 1999. |
| [6] | Mozaffari A A, Derakhshanfar A, Alinejad A, et al. A comparative study on the adverse effects of flunixin, ketoprofen and Phenylbut azone in miniature donkeys:haematological, biochemical and pathological findings[J]. New Zealand Veterinary Journal, 2010, 58(5): 224–228. DOI: 10.1080/00480169.2010.69295 |
| [7] | Zhu A L, Peng T, Liu L, et al. Ultra-performance liquid chromatography-tandem mass spectrometry determination and depletion profile of flunixin residues in tissues after single oral administration in rabbits[J]. Journal of Chromatography B, 2013, 934: 8–15. DOI: 10.1016/j.jchromb.2013.07.002 |
| [8] | Brynes S D. Demystifying 21 CFR part 556-tolerances for residues of new animal drugs in food[J]. Regulatory Toxicology and Phyarmacology, 2005, 40(3): 324–327. |
| [9] | Johansson M, Anlér E L. Gas chromatographic analysis of flunixin in equine urine after extractive methylation[J]. Journal of Chromatography-B:Biomedical Sciences and Applications, 1988, 427: 55–66. DOI: 10.1016/0378-4347(88)80104-X |
| [10] | Belal F F, El-Razeq S A A, Fouad M M, et al. Micellar high performance liquid chromatographic determination of flunixin meglumine in bulk, pharmaceutical dosage forms, bovine liver and kidney[J]. Analytical Chemistry Research, 2015, 3: 63–69. DOI: 10.1016/j.ancr.2014.12.003 |
| [11] | Azzouz A, Souhail B, Ballesteros E. Determination of residual pharmaceuticals in edible animal tissues by continuous solid-phase extraction and gas chromatography-mass spectrometry[J]. Talanta, 2011, 84(3): 820–828. DOI: 10.1016/j.talanta.2011.02.016 |
| [12] | Luo Y, Rudy J A, Uboh C E, et al. Quantification and confirmation of flunixin in equine plasma by liquid chromatography quadrupole time-of-flight tandem mass spectrometry[J]. Journal of Chromatography B, 2004, 801: 173–184. DOI: 10.1016/j.jchromb.2003.11.002 |
| [13] | Jedziniak P, Szprengier-Juszkiewicz T, Olejnik M, et al. Determination of non-steroidal anti-inflammatory drugs residues in animal muscles by liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2010, 672: 85–92. DOI: 10.1016/j.aca.2010.04.031 |
| [14] |
中华人民共和国农业部. NY/T 1896-2010兽药残留实验室质量控制规范[S]. 北京: 中国标准出版社, 2010.
Ministry of Agriculture of the People's Republic of China. NY/T 1896-2010 criterion on quality control of laboratories for residue analysis of veterinary drugs[S]. Beijing:China Standard Publishing House, 2010(in Chinese). |
| [15] | European Commission(EC). Commission Decision 2002/657/EC of 12 August 2002 implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results, as amended by Decision 2003/181/EC[J]. Official Journal of the European Communitics, 2002, 3044: 8–36. |
| [16] | Lee C D, Maxwell L K. Effect of body weight on the pharmacokinetics of flunixin meglumine in miniature horses and quarter horses[J]. Journal of Veterinary Pharmacology and Therapeutics, 2014, 37(1): 35–42. DOI: 10.1111/jvp.2014.37.issue-1 |
| [17] | Hilton H G, Magdesian K G, Groth A D, et al. Distribution of flunixin meglumine and firocoxib into aqueous humor of horses[J]. Journal of Veterinary Internal Medicine, 2011, 25(5): 1127–1133. DOI: 10.1111/jvim.2011.25.issue-5 |
| [18] | Dubreil-Cheneau E, Pirotais Y, Bessiral M, et al. Development and validation of a confirmatory method for the determination of 12 non steroidal anti-inflammatory drugs in milk using liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2011, 1218: 6292–6301. DOI: 10.1016/j.chroma.2011.06.006 |
| [19] | Hu T, Peng T, Li X J, et al. Simultaneous determination of thirty non-steroidal anti-inflammatory drug residues in swine muscle by ultra-high-performance liquid chromatography with tandem mass spectrometry[J]. Journal of Chromatography A, 2012, 1219: 104–114. DOI: 10.1016/j.chroma.2011.11.009 |
| [20] |
彭麟, 郭大伟, 张伟, 等. UPLC-MS/MS法检测黄鳝中氯霉素类药物残留[J].
畜牧与兽医, 2016, 48(4): 30–35.
Peng L, Guo D W, Zhang W, et al. Determination of chloramphenicols in the eels by UPLC-MS/MS[J]. Animal Husbandry and Veterinary Medicine, 2016, 48(4): 30–35. (in Chinese with English abstract) |
| [21] | Gallo P, Fabbrocino S, Vinci F, et al. Confirmatory identification of sixteen non-steroidal anti-inflammatory drug residues in raw milk by liquid chromatography coupled with ion trap mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2008, 22(6): 841–854. DOI: 10.1002/(ISSN)1097-0231 |




