文章信息
- 张俞, 史兴娟
- ZHANG Yu, SHI Xingjuan
- Cep70的细胞定位分析及在微管聚合中的作用研究
- Study of cellular localization of Cep70 and its role in microtubule polymerization
- 南京农业大学学报, 2017, 40(6): 1094-1099
- Journal of Nanjing Agricultural University, 2017, 40(6): 1094-1099.
- http://dx.doi.org/10.7685/jnau.201707012
-
文章历史
- 收稿日期: 2017-07-06
微管是真核生物主要的细胞骨架之一, 在细胞内呈网状或束状分布。微管参与许多重要细胞活动如细胞形态的维持、细胞内物质运输、细胞分裂和细胞迁移等。中心体由1对互相垂直排列的中心粒(centriole)及围绕在中心粒周围的无定形基质(pericentriolar material, PCM)共同组成。中心体是动物细胞中主要的微管组织中心。通过γ-微管蛋白环状复合物(γ-tubulin ring complex, γTuRC)核化微管, 核化的微管延伸后锚定在中心体上, 从而形成放射状的网状结构[1-2]。中心体在有丝分裂期介导双极纺锤体的形成, 使染色体排列在赤道板上, 从而调控染色体的正确分离, 在细胞分裂中发挥重要功能[3]。中心体功能异常与许多疾病相关, 如肿瘤、神经疾病和纤毛疾病等[4-6]。
Cep70是最初通过质谱鉴定的一个中心体蛋白[7], 含597个氨基酸, 相对分子质量为70×103。Cep70在斑马鱼胚胎中与纤毛发生相关[8]; 在衣藻中, Cep70的同源基因编码蛋白CRC70在中心粒前体的组装中起到支架作用[9]; 在哺乳动物细胞中, Cep70通过与中心体蛋白γ-tubulin相互作用参与有丝分裂纺锤体的定向[10], 并在细胞极化及细胞迁移中发挥重要作用[11]。我们前期研究表明, Cep70在哺乳动物细胞内与中心体蛋白γ-tubulin共定位, 并促进细胞内微管的组织和再生[10]。但Cep70在细胞内与微管蛋白的共定位情况及其在体外微管聚合中所发挥的作用目前尚不清楚。
本试验用pMALp2T-Cep70重组质粒在大肠杆菌中表达并纯化Cep70融合蛋白, 通过抗体制备和免疫荧光显微分析对Cep70进行细胞内定位分析, 并进一步研究了Cep70在微管聚合中所发挥的功能, 为了解Cep70在微管参与的细胞活动中的作用提供理论和试验依据。
1 材料与方法 1.1 试验动物6周龄BALB/c雌鼠购自南京模式动物所。
1.2 主要试剂RPMI-1640培养液(Wisent公司); 胎牛血清(Gibco公司); 胰蛋白酶(南京生兴生物技术公司); 蛋白标准品(CWBIO公司); 异丙基硫代半乳糖苷(IPTG, 上海生工生物工程公司); 弗氏完全佐剂、弗氏不完全佐剂、4′, 6-diamidino-2-phenylindole(DAPI)、抗α-tubulin抗体(Sigma公司); 抗MBP抗体(Abcam公司); 辣根过氧化物酶标记的二抗(Santa Cruz公司); 荧光素或罗丹明标记的二抗(Jackson ImmunoResearch Laboratory); 化学发光检测试剂(Beyotime公司); 微管蛋白、体外微管组装试剂盒(Cytoskeleton公司)。pMALp2T载体质粒为本实验室保存, pMALp2T-Cep70原核表达质粒为笔者在前期研究中构建[10]。人脐静脉内皮细胞(HUVEC)株购自中国科学院上海细胞库。
1.3 细胞培养HUVEC细胞用RPMI-1640完全培养基(含有2 mmol·L-1 L-谷氨酰胺及10%胎牛血清)培养。细胞均置于含5% CO2的37 ℃细胞培养箱中培养。根据细胞生长状态, 用2.5 g·L-1胰蛋白酶进行消化, 每隔2~5 d传代1次。
1.4 融合蛋白MBP-Cep70的表达和纯化将原核表达质粒pMALp2T-Cep70或pMALp2T空载体转化入大肠杆菌(Escherichia coli)BL21(DE3)感受态表达菌株。37 ℃摇床培养至D600为0.6左右, 加入IPTG(终浓度0.1 mmol·L-1), 200 r·min-1、18 ℃诱导过夜。次日离心收集菌体, 重悬于1/20菌液体积的Column Buffer(200 mmol·L-1 NaCl、10 mmol·L-1 β-巯基乙醇、1 mmol·L-1 EDTA、20 mmol·L-1 Tris-HCl, pH7.5), 加入苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)后进行超声波破碎。用8倍体积的Column Buffer平衡麦芽糖-琼脂糖亲和层析柱(amylose resin, New England BioLabs), 用12倍体积的Column Buffer洗涤柱子。用5 mL的洗脱液(200 mmol·L-1NaCl、10 mmol·L-1 β-巯基乙醇、1 mmol·L-1 EDTA、20 mmol·L-1 Tris-HCl、10 mmol·L-1麦芽糖, pH7.5)洗脱。收集洗脱液超滤浓缩至最小体积, 即可得到带有麦芽糖结合蛋白(MBP)标签的融合蛋白。
1.5 抗体制备用200 μg纯化的MBP-Cep70融合蛋白和等体积的弗氏完全佐剂乳化后对6周龄的BALB/c小鼠进行首次皮下注射免疫。10 d后用100 μg纯化蛋白和等体积的弗氏不完全佐剂乳化后对小鼠进行第2次免疫。之后每隔1周进行免疫增强注射(注射量与第2次免疫相同), 至第5次免疫3 d后, 弯头镊子摘除小鼠眼球取血, 收集血清即为抗Cep70多克隆抗体, 进行Western blot鉴定[10]。
1.6 免疫印迹试验融合蛋白经SDS-PAGE电泳分离, 转移至聚偏二氟乙烯(PVDF)膜上[12], 于50 g·L-1脱脂奶粉(TBST配制)中封闭2 h, 加一抗后于4 ℃孵育过夜, TBST洗膜3次, 然后用辣根过氧化物酶标记的二抗结合1 h, TBST洗膜5次后用化学发光检测试剂显示目的蛋白条带。
1.7 免疫荧光显微试验检测内源性Cep70细胞内定位用抗Cep70和抗α-tubulin抗体对HUVEC细胞进行双重免疫荧光染色(对照组为IgG)。24孔板中放入无菌盖玻片, 铺上HUVEC细胞。24 h后用甲醇-20 ℃固定贴于盖玻片生长的细胞10 min, PBS清洗后用20 g·L-1 BSA室温封闭30 min。按照文献[13]中所描述的方法分别与一抗和二抗相结合, PBS洗去未结合的二抗后用DAPI对细胞核染色5 min, 封片后在荧光显微镜下检测。
1.8 体外微管聚合试验 1.8.1 荧光分析体外微管聚合试验将微管体外组装试剂盒中罗丹明(rhodamine)标记的微管蛋白与未标记的微管蛋白以体积比15:85混合。将微管蛋白与纯化的MBP-Cep70蛋白37 ℃孵育20 min, 加入含有Taxol的微管反应终止液。取少量反应物与防荧光淬灭剂混合涂片, 荧光显微镜下观察微管形态。用Image J软件(美国国家心理健康研究所National Institutes of Health)测量微管的长度。
1.8.2 微管混浊度试验向MBP-Cep70纯化蛋白中加入微管蛋白, 反应环境为PEMG Buffer[100 mmol·L-1哌嗪-1, 4-二乙磺酸(PIPES)、1 mmol·L-1 EGTA、1 mmol·L-1 MgSO4、1 mmol·L-1鸟嘌呤-5′-三磷酸(GTP), pH6.8][13]。将比色杯放入温控的分光光度计中, 检测反应体系在37 ℃、350 nm波长下的吸光值(A350)。
1.9 数据统计分析数据结果以平均数±标准误(x±SE)来表示。对照组和试验组之间的差异通过F检验和双侧t检测进行分析。
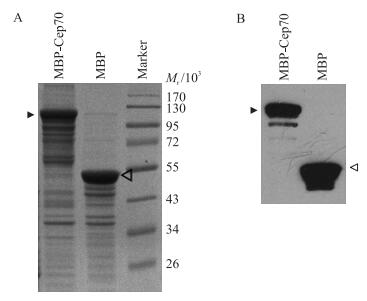
2 结果与分析 2.1 融合蛋白MBP-Cep70的纯化及Cep70抗体的制备将pMAL2T-Cep70或pMAL2T质粒转化大肠杆菌BL21表达菌株, 培养至D300值为0.6左右时, 加入0.1 mmol·L-1 IPTG, 在18 ℃下进行诱导。16 h后收集菌体进行超声波破碎, 菌液离心得到上清液, 进行SDS-PAGE。考马斯亮蓝染色显示MBP-Cep70融合蛋白和MBP标签蛋白均大量诱导表达(图 1-A)。将诱导表达的蛋白经麦芽糖-琼脂糖亲和层析柱进行纯化后, 用anti-MBP抗体进行蛋白印迹检测, 结果显示anti-MBP抗体可以同时识别MBP-Cep70融合蛋白和MBP标签蛋白, 证实了纯化蛋白的特异性(图 1-B)。我们用纯化的MBP-Cep70融合蛋白免疫小鼠, 得到了anti-Cep70的多克隆抗体。对抗体进行不同比例的稀释, 发现稀释比例为1:1 000时, Western blot分析结果显示其特异性强。
|
图 1 融合蛋白MBP-Cep70诱导表达的SDS-PAGE电泳检测(A)及纯化Cep70的Western blot检测(B) Figure 1 SDS-PAGE analysis of the expression of MBP-Cep70 fusion protein (A) and Western blot analysis (B) of the purified anti-Cep70 antibody 箭头和空心箭头分别标示的是MBP-Cep70和MBP。 Arrowhead and open arrowhead indicate MBP-Cep70 and MBP, respectively. |
我们之前研究发现Cep70是一个中心体蛋白, 其与中心体的分子标记γ-tubulin共表达定位[10]。中心体是动物细胞中主要的微管组织中心, 本试验进一步用anti-Cep70抗体检测Cep70蛋白与微管在细胞内的定位情况。用anti-Cep70和anti-α-tubulin抗体对HUVEC细胞进行双重免疫荧光染色(对照组为IgG), 结果显示在间期HUVEC细胞中, 微管呈放射状分布在细胞质中。与对照组IgG相比, Cep70在细胞内呈特异的点状分布, 定位在放射状微管的中心即微管组织中心(中心体)上(图 2)。而且, Cep70除了定位在微管组织中心上, 还以弥散的形式分布在细胞质中。

|
图 2 内源性Cep70在HUVEC细胞内的定位 Figure 2 The subcellular localization of endogenous Cep70 in HUVEC cells 用anti-Cep70抗体(IgG作为对照)、anti-α-tubulin抗体和DAPI进行免疫荧光显微分析Cep70的亚细胞定位。 Immunofluorescent images of HUVEC cells stained with anti-Cep70(IgG control), anti-α-tubulin antibodies and the DNA dye DAPI. |
微管蛋白在组装成微管的过程中, 在波长350 nm处的吸光度值会发生变化[14]。我们通过测量37 ℃下微管蛋白组装成微管过程中混浊度的变化, 进一步研究Cep70在体外微管组装中发挥的作用。向比色杯中加入微管蛋白和MBP-Cep70或MBP蛋白后置于温控的分光光度计中, 检测在37 ℃、350 nm波长下吸光度值变化。分别选取孵育5、10、15和20 min这4个时间点的吸光值(A350)进行分析, 发现在不同时段MBP-Cep70蛋白均促进微管蛋白的聚合(图 3)。

|
图 3 Cep70在体外促进微管聚合的变化 Figure 3 Effect of Cep70 on microtubule assembly in vitro examined by the light scattering assay *P < 0.05. The same as follws. |
体外微管混浊度试验结果表明:与加入了MBP蛋白的对照组相比, MBP-Cep70蛋白增加了体外聚合微管的长度(图 4-A)。通过用Image J软件随机对显微镜视野下的微管长度进行测量, 发现加入MBP-Cep70纯化蛋白后, 体外聚合的微管长度显著增加(P < 0.05)(图 4-B)。这些结果提示Cep70可在体外微管组装中起到正调控作用。

|
图 4 Cep70对微管组装形态调节的免疫荧光观察(A)和对微管长度的影响(B) Figure 4 Fluorescence microscopic analysis of the morphology of assembled microtubules (A) and the effect of the length of microtubules (B) |
本试验通过对Cep70融合蛋白的表达和纯化, 有助于在体外研究该蛋白的一些分子生物学和生物化学功能[15-17]。在本研究中, 我们摸索了MBP-Cep70在细菌中的表达条件。在菌液D600达0.6左右时开始诱导表达目的蛋白, 此条件下, 菌体数量适中、活力强、表达蛋白量多。我们首先摸索了37 ℃或25 ℃的诱导条件, 发现目的蛋白的可溶性表达较少, 大都形成包涵体。可能是因为此诱导条件下蛋白质进行大量表达, 在短时间内来不及正确折叠, 从而形成无活性的包涵体。后来尝试低温18 ℃下过夜诱导蛋白表达, 得到了较多的可溶性融合蛋白。此外, 用IPTG对菌体有一定的毒性, 其浓度过高会造成菌体严重损害甚至死亡, 使目的蛋白表达量降低。而低IPTG浓度有助于缓解细菌的表达负荷, 能产生出更多的完全蛋白。综合上述情况, 本试验选取了MBP-Cep70的最佳诱导条件:0.1 mmol·L-1 IPTG, 200 r·min-1, 18 ℃诱导过夜。
蛋白质在细胞中定位对其功能的发挥起到关键性作用[18-23], 因此制备Cep70特异性的抗体对后期的研究非常重要。MBP标签蛋白相对分子质量大小约为42×103, 而目的蛋白大小为70×103。我们曾尝试用HRV 3C蛋白酶(human rhinovirus 3C protease)对纯化的融合蛋白进行切割, 但切割效果不好。故本试验用融合蛋白MBP-Cep70免疫小鼠, 制备了鼠源的多克隆抗体, 再对抗体的特异性进行检测, 发现该抗体能非常清晰地识别在细胞内中心体的Cep70。我们之前采用免疫印迹试验也表明, Cep70抗体可以正确识别GST-Cep70, 而不能识别GST标签蛋白[10]。而目前商业化的Cep70抗体在免疫荧光试验中不能特异地标识定位中心体的Cep70, 仅能用于免疫印迹分析。这些结果表明本研究制备的Cep70抗体特异性较好, 为进一步研究Cep70的细胞生物学功能提供了便利。
微管组装包括微管核化和微管延伸, 受细胞内许多蛋白质的精细调控[24-26]。微管是一种高度动态的细胞骨架分子, 其长度通过微管末端竞争性的聚合和解聚反应来协同调节[27]。在微管的体外聚合试验中, 微管延伸是微管正末端聚合和负末端解聚的共同结果[28-29]。本试验结果显示Cep70增加了体外微管的长度, 表明Cep70可能是促进微管的组装来调节微管延伸。微管核化是微管组装过程中的限速步骤, 它由中心体上的γTuRC介导[28]。我们推测Cep70可能通过与γ-tubulin或其他中心体蛋白相互作用调节微管核化, 也有可能Cep70通过与微管或微管相关蛋白(microtubule-associated proteins, MAPs)作用促进微管的聚合[13, 15, 30-31]。研究Cep70对微管组织的调节, 为进一步探究Cep70在微管参与的相关细胞活动及生命活动中的功能提供了理论和试验依据。
| [1] | Woodruff J B, Gomes B F, Widlund P O, et al. The centrosome is a selective condensate that nucleates microtubules by concentrating tubulin[J]. Cell, 2017, 169(6): 1066–1077. DOI: 10.1016/j.cell.2017.05.028 |
| [2] | Sulimenko V, Hájková Z, Klebanovych A, et al. Regulation of microtubule nucleation mediated by γ-tubulin complexes[J]. Protoplasma, 2017, 254(3): 1187–1199. DOI: 10.1007/s00709-016-1070-z |
| [3] | Meraldi P. Centrosomes in spindle organization and chromosome segregation:a mechanistic view[J]. Chromosome Research, 2016, 24(1): 19–34. DOI: 10.1007/s10577-015-9508-2 |
| [4] | Rivera-Rivera Y, Saavedra H. Centrosome-a promising anti-cancer target[J]. Biologics, 2016, 10: 167–176. |
| [5] | Chavali P L, Pütz M, Gergely F. Small organelle, big responsibility:the role of centrosomes in development and disease[J]. Philosophical Transactions of The Royal Society B-Biological Sciences, 2014, 369. DOI: 10.1098/rstb.20130468 |
| [6] | Shaheen R, Shamseldin H E, Loucks C M, et al. Mutations in CSPP1, encoding a core centrosomalp rotein, cause a range of ciliopathy phenotypes in humans[J]. The American Journal of Human Genetics, 2014, 94(1): 73–79. DOI: 10.1016/j.ajhg.2013.11.010 |
| [7] | Andersen J S, Wilkinson C J, Mayor T, et al. Proteomic characterization of the human centrosome by protein correlation profiling[J]. Nature, 2003, 426: 570–574. DOI: 10.1038/nature02166 |
| [8] | Wilkinson C J, Carl M, Harris W A. Cep70 and Cep131 contribute to ciliogenesis in zebrafish embryos[J]. BMC Cell Biology, 2009, 10: 17. DOI: 10.1186/1471-2121-10-17 |
| [9] | Shiratsuchi G, Kamiya R, Hirono M. Scaffolding function of the Chlamydomonas procentriole protein CRC70, a member of the conserved Cep70 family[J]. Journal of Cell Science, 2011, 124: 2964–2975. DOI: 10.1242/jcs.084715 |
| [10] | Shi X, Sun X, Liu M, et al. CEP70 protein interacts with γ-tubulin to localize at the centrosome and is critical for mitotic spindle assembly[J]. Journal of Biological Chemistry, 2011, 286(38): 33401–33408. DOI: 10.1074/jbc.M111.252262 |
| [11] | Shi X, Liu M, Li D, et al. Cep70 contributes to angiogenesis by modulating microtubule rearrangement and stimulating cell polarization and migration[J]. Cell Cycle, 2012, 11(8): 1554–1563. DOI: 10.4161/cc.19954 |
| [12] | Shi X, Li D, Wang Y, et al. Discovery of centrosomal protein 70 as an important player in the development and progression of breast cancer[J]. The American Journal of Pathology, 2017, 187(3): 679–688. DOI: 10.1016/j.ajpath.2016.11.005 |
| [13] | Shi X, Yao Y, Wang Y, et al. Cep70 regulates microtubule stability byinteracting with HDAC6[J]. FEBS Letters, 2015, 589(15): 1771–1777. DOI: 10.1016/j.febslet.2015.06.017 |
| [14] | Gao J, Huo L, Sun X, et al. The tumor suppressor CYLD regulates microtubule dynamics and plays a role in cell migration[J]. Journal of Biological Chemistry, 2008, 283(14): 8802–8809. DOI: 10.1074/jbc.M708470200 |
| [15] | Sun X, Shi X, Liu M, et al. Mdp3 is a novel microtubule-binding protein that regulates microtubule assembly and stability[J]. Cell Cycle, 2011, 10(22): 3929–3937. DOI: 10.4161/cc.10.22.18106 |
| [16] | Sun L, Gao J, Dong X, et al. EB1 promotes Aurora-B kinase activity through blocking its inactivation by protein phosphatase 2A[J]. Proc Natl Acad Sci USA, 2008, 105(20): 7153–7158. DOI: 10.1073/pnas.0710018105 |
| [17] | Huo L, Li D, Sun L, et al. Tat acetylation regulates its actions on microtubule dynamics and apoptosis in T lymphocytes[J]. Journal of Pathology, 2010, 223(1): 28–36. |
| [18] | Sun L, Gao J, Huo L, et al. Tumour suppressor CYLD is a negative regulator of the mitotic kinase Aurora-B[J]. Journal of Pathology, 2010, 221(4): 425–432. |
| [19] | Huo L, Li D, Sun X, et al. Regulation of Tat acetylation and transactivation activity by the microtubule-associated deacetylase HDAC6[J]. Journal of Biological Chemistry, 2011, 286(11): 9280–9286. DOI: 10.1074/jbc.M110.208884 |
| [20] | Delgehyr N, Sillibourne J, Bornens M. Microtubule nucleation and anchoring at the centrosome are independent processes linked by ninein function[J]. Journal of Cell Science, 2005, 118: 1565–1575. DOI: 10.1242/jcs.02302 |
| [21] | Yang Y, Ran J, Liu M, et al. CYLD mediates ciliogenesis in multiple organs by deubiquitinating Cep70 and inactivating HDAC6[J]. Cell Research, 2014, 24(11): 1342–1353. DOI: 10.1038/cr.2014.136 |
| [22] | Xie S, Qin J, Liu S, et al. Cep70 overexpression stimulates pancreatic cancer by inducing centrosome abnormality and microtubule disorganization[J]. Scientific Reports, 2016, 6: 21263. DOI: 10.1038/srep21263 |
| [23] | Ta la, Xie S, Sun X, et al. Microtubule-associated protein Mdp3 promotes breast cancer growth and metastasis[J]. Theranostics, 2014, 4(10): 1052–1061. DOI: 10.7150/thno.9727 |
| [24] | Delgehyr N, Sillibourne J, Bornens M. Microtubule nucleation and anchoring at the centrosome are independent processes linked by ninein function[J]. Journal of Cell Science, 2005, 118(8): 1565–1575. DOI: 10.1242/jcs.02302 |
| [25] | Wade R H. On and around microtubules:an overview[J]. Molecular Biotechnology, 2009, 43(2): 177–191. DOI: 10.1007/s12033-009-9193-5 |
| [26] | Ta la, Sun X, Chen J, et al. Microtubule stabilization by Mdp3 is partially attributed to its modulation of HDAC6 in addition to its association with tubulin and microtubules[J]. PLoS ONE, 2014, 9(3): e90932. DOI: 10.1371/journal.pone.0090932 |
| [27] |
杨笑柳, 剧世强, 崔盼盼, 等. Aurora-A抑制对猪卵母细胞MⅠ期纺锤体组装的影响[J].
南京农业大学学报, 2016, 39(4): 656–660.
Yang X L, Ju S Q, Cui P P, et al. Effects of Aurora-A inhibitor on MⅠ-stage spindle configuration of porcine oocytes[J]. Journal of Nanjing Argricultural University, 2016, 39(4): 656–660. DOI: 10.7685/jnau.201512009 (in Chinese with English abstract) |
| [28] | Schiebel E. γ-tubulin complexes:binding to the centrosome, regulation and microtubule nucleation[J]. Current Opinion in Cell Biology, 2000, 12(1): 113–118. DOI: 10.1016/S0955-0674(99)00064-2 |
| [29] | van der Vaart B, Akhmanova A, Straube A. Regulation of microtubule dynamic instability[J]. Biochemical Society Transactions, 2009, 37: 1007–1013. DOI: 10.1042/BST0371007 |
| [30] | Shi X, Wang Y, Sun X, et al. Centrosomal protein 70 is a mediator of paclitaxel sensitivity[J]. International Journal of Molecular Sciences, 2017, 18(6): 1267. DOI: 10.3390/ijms18061267 |
| [31] | Shi X, Wang J, Yang Y, et al. Cep70 promotes microtubule assembly in vitro by increasing microtubule elongation[J]. Acta Biochimica et Biophysica Sinica, 2012, 44(5): 450–454. DOI: 10.1093/abbs/gms017 |




