文章信息
- 朱怀森, 钱庄, 杨东风, 刘洪林, 鲍恩东
- ZHU Huaisen, QIAN Zhuang, YANG Dongfeng, LIU Honglin, BAO Endong
- 注射ACTH对断奶母猪卵泡促黄体素受体表达及卵泡液中类固醇激素合成的影响
- The effect of ACTH injection on follicular fluid concentrations of steroid hormones and expressions of luteinizing hormone receptors in weaned Suhuai sows
- 南京农业大学学报, 2017, 40(6): 1081-1087
- Journal of Nanjing Agricultural University, 2017, 40(6): 1081-1087.
- http://dx.doi.org/10.7685/jnau.201608010
-
文章历史
- 收稿日期: 2016-08-08
2. 宁夏农牧厅农业国际合作项目管理中心, 宁夏 银川 750002;
3. 南京农业大学动物科技学院, 江苏 南京 210095
2. International Agricultural Cooperation Project Management Center of Ningxia Department of Agricultural and Animal Husbandry, Yinchuan 750002, China;
3. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China
应激是机体应对应激源刺激时所呈现的一种全身性的非特异性应答反应[1]。应激在母猪的集约化生产中是不可避免的, 且影响母猪的生产性能, 例如环境、断奶、运输等都可造成母猪生产性能的降低[2]。对母猪生产力降低的原因进行分析, 约有10%的母猪生产力下降是由卵巢囊肿所造成的, 且囊肿的发生与内分泌稳态被破坏有关[3]。随着应激反应的发生, 下丘脑-垂体-肾上腺轴(HPA)被活化并引起体内激素分泌异常, 进而影响了卵巢的功能。例如, 促肾上腺皮质激素(ACTH)含量可随着HPA轴的活化而升高, ACTH含量的改变不仅造成机体激素分泌紊乱, 还影响卵巢功能的发挥[4]。类固醇激素的合成是分步完成的, 此过程中任何一步受到破坏都可影响激素最终的含量[5]。类固醇激素含量的改变与卵巢结构及功能有关, 且极易受到ACTH含量改变的影响。
集约化生产中所面临的应激源因素较多, 因此研究应激与繁殖性能的相关性存在较大的困难。外源性ACTH不仅影响肾上腺的功能, 还可直接或通过皮质醇的改变间接影响卵巢组织功能和其他激素的分泌, 因此ACTH注射可被用于应激模型的建立[2]。据文献报道, ACTH注射后卵泡的发育及发情周期等都会受到影响, 但对血浆中促黄体素、雌二醇及孕酮等激素的影响不大[6]。而ACTH注射后卵泡液中上述几种激素的含量是否也会发生相应的变化还鲜见报道。本试验中我们模拟利用ACTH注射处理以建立断奶母猪的应激模型, 通过观察人工应激处理后断奶母猪卵泡壁中促黄体素受体(LHR)的表达、卵泡液中类固醇激素含量及类固醇激素合成关键酶的表达等, 探究应激对母猪繁殖性能的影响及其作用。
1 材料与方法 1.1 试验材料 1.1.1 试验动物选取处于3~4胎次、体质量(185±25)kg的10头苏淮母猪, 随机将受试母猪均分为ACTH处理组(试验组)与对照组, 于第28天断奶, 并于断奶当天进行颈静脉插管手术。将手术当天作为试验开始的第1天, 自试验第2天开始, 分别于每天的08:00、16:00、24:00(间隔8 h)给试验组母猪分3次均注射1 IU·kg-1 ACTH(A6303, SIGMA), 同时给对照组母猪注射生理盐水。从试验第2天09:00开始到母猪发情结束的试验期间, 自静脉插管每隔3 h采取血液10 mL。所有血液样品在1 000 g转速下离心10 min, 处理后的血浆样品均保存于-20 ℃冰箱备用。
1.1.2 试验材料孕酮(P4)、雌二醇(E2)、皮质醇ELISA检测试剂盒(H089、H102、H094)购自南京建成生物工程研究所有限公司; 雄烯二酮(ASD)ELISA检测试剂盒(33-33720)购自北京天净沙公司; 快速反转录酶试剂盒(RR037A)购自日本TaKaRa公司; ACTH(A6303)购自美国SIGMA公司; CYP19A1(A1336)、CYP17A1(A1373)、LHR抗体(A6266)购自武汉ABclone公司; 3β-HSD(sc-30820)购自美国Santa Cruz公司; 山羊抗兔二抗(IH-0011)购自北京鼎国公司; DAB显色液(AR1022)购自武汉博士德公司。试验中所有引物均由上海英骏生物工程有限公司合成。
1.2 试验方法 1.2.1 卵泡液与卵泡壁的采集受试母猪于屠宰后的10 min内完整采取卵巢, 用无菌剪刀与镊子剥取直径约3~4 mm的卵泡, 用灭菌注射器采集卵泡液, 与卵泡壁一并保存于液氮中。另取部分受试母猪的卵巢组织浸入4%(体积分数)多聚甲醛溶液中进行固定, 以备组织学和免疫组织化学检测。
1.2.2 血浆中皮质醇及卵泡液中雌二醇、孕酮、雄烯二酮的测定根据ELISA检测试剂盒说明书, 绘制标准曲线, 计算血浆中皮质醇(检测范围5~1 500 ng·mL-1; 批内变异系数9%, 批间变异系数15%)及卵泡液中雌二醇(检测范围0.5~200 ng·L-1; 批内变异系数10%, 批间变异系数12%)、孕酮(检测范围0.5~200 ng·mL-1; 批内变异系数11%, 批间变异系数14%)、雄烯二酮(检测范围1.5~40 nmol·L-1; 批内变异系数9%, 批间变异系数11%;保存条件4 ℃)的含量。
1.2.3 卵泡壁总RNA提取与反转录使用Trizol(15596-026, Invitrogen公司)提取法提取卵泡壁组织中的总RNA, 用快速反转录酶试剂盒将总RNA进行反转录, 转录后获得的cDNA产物保存于-80 ℃冰箱中备用。
1.2.4 荧光定量PCR检测相关基因转录水平采用实时荧光定量PCR仪对受试母猪卵泡壁组织中CYP11A1、CYP17A1、CYP19A1、StAR、3β-HSD、LHR、β-actin mRNA转录水平分别进行检测。试验中所有引物序列均来源于NCBI(表 1), 通过软件Primer Premier 5.0设计引物。被检样品均重复3次, 取平均值, 按照2-ΔΔCT法计算各个基因表达量。
| 基因Gene | 引物对序列(5′→3′)Primer pairs sequence | 产物大小/bp Product size |
| LHR | GCTCACCCAAGACACTCC/CGGAGCAAAGGAGTACAC | 190 |
| StAR | GGCAAGGCTCTTCTAACT/ACTCGGGAAAGCACAGAT | 99 |
| CYP11A1 | CCAGCATTACCAGAAGCC/TGTGCCTCCATTACCGAG | 92 |
| CYP19A1 | AAGAAGGGTCACAACAAG/GACGAGTGACCGAAAGAA | 165 |
| CYP17A1 | ATGATCCAAGCCAAGACG/TTTACCACAGAGGCAGAAG | 140 |
| 3β-HSD | CCTGGCAAGTATTTCTCGG/TAGCAGGTGGTGAACAACGACC | 107 |
| β-actin | CTCCATCATGAAGTGCGACGT/CTGTCCTACGTCTTCCTCTAGTG | 114 |
将4%(体积分数)多聚甲醛溶液中固定的受试母猪卵巢组织取出, 常规法石蜡制片, 切片厚4 μm。切片经65 ℃烘干处理后依次脱蜡、水化, PBS洗涤3次。将切片放入柠檬酸钠缓冲液(pH6.0)中进行微波修复。37 ℃恒温箱中BSA封闭30 min, 分别滴加相应一抗(CYP19A1、CYP17A1、3β-HSD、LHR均1:200稀释), 4 ℃孵育过夜。第2天充分洗涤后, 分别滴加山羊抗兔二抗(1:150), 37 ℃孵育60 min, PBS洗涤3次。与DAB显色液反应, 苏木精复染, 中性树胶封片。显微镜下观察并拍照。每张切片在光镜下随机选取5个视野进行观察、拍照并进行图像分析。利用Image-Pro Plus 6.0软件进行卵巢组织切片染色强度的平均光密度(D)分析处理。
1.3 数据分析所有数据利用SPSS 20.0软件进行统计, 采用独立样本t检验分析ACTH处理组与对照组之间的差异。所有数据均用x±SD表示。
2 结果与分析 2.1 临床症状与对照组相比, ACTH处理组母猪的活动明显增多, 临床上表现为精神不安, 对公猪兴趣减弱, 发情推迟。ACTH处理组中, 受试断奶母猪出现排卵障碍, 卵泡直径变短, 卵泡发育明显受到抑制; 而同期对照组母猪则正常排卵(图 1)。

|
图 1 对照组母猪正常排卵卵巢(A)与促肾上腺皮质激素(ACTH)注射试验组母猪发育障碍卵巢(B) Figure 1 Representative photographes of ovaries in control group(A)and ovulation failure ovaries after adreno corticotropic hormone(ACTH)treatment in weaned sows(B) |
对所有母猪卵巢上的黄体或红体数目进行统计, 并将形成黄体或红体的数目作为受试母猪的排卵率。结果(表 2)显示, 与对照组相比, ACTH处理组中母猪的排卵率显著降低(P < 0.05)。
| 处理分组Treatment groups | 排卵率/% Ovulation rate |
| 对照组Control group | 23.40±2.94 |
| ACTH处理组ACTH treatment group | 19.10±1.04* |
| 注:*, **分别表示与对照组相比差异显著(P < 0.05)和差异极显著(P < 0.01)。下同。 Note:*, ** mean significant difference at 0.05 and 0.01 levels compared with control group. The same as follows. | |
ACTH处理组中, 与排卵母猪相比, 未排卵母猪卵泡液中激素含量下降, 但差异不显著(P>0.05)。与对照组相比, ACTH处理组排卵与未排卵母猪卵泡液中3种激素含量都出现了不同程度的下降, 其中以雌二醇含量下降最为明显(P<0.01), 其次是雄烯二酮含量的下降(P<0.05), 孕酮含量排卵母猪出现下降但差异不显著(P>0.05), 而未排卵母猪则明显下降(P<0.05)。作为评估卵泡发育是否受到抑制的一个参考指标, 对照组与ACTH处理组母猪的雌二醇与孕酮比值(E2/P4)均大于1, 但ACTH处理组排卵母猪与未排卵母猪的E2/P4值均显著降低(P < 0.05), 说明注射ACTH处理组母猪卵泡的发育受到了明显抑制。
| 激素 Hormone | 对照组 Control group | ACTH处理组ACTH treatment group | |
| 排卵母猪(ACTH-A) Sows of ovulation successful | 未排卵母猪(ACTH-B) Sows of ovulation failure | ||
| 雄烯二酮/(nmol·L-1) Androstenedione | 17.94±1.96 | 14.29±1.43* | 12.94±0.71* |
| 孕酮/(ng·mL-1) Progesterone(P4) | 80.67±5.69 | 78.82±3.67 | 74.13±3.47* |
| 雌二醇/(pg·mL-1) Estradiol(E2) | 178.04±4.78 | 93.61±7.73** | 86.72±8.03** |
| E2/P4 | 2.21±0.36 | 1.19±0.04* | 1.16±0.05* |
血浆中皮质醇含量升高是动物应激反应的一个标志。利用ELISA方法检测不同时间点母猪血浆中皮质醇的含量, 结果显示:ACTH处理组母猪血浆中的皮质醇含量均分别显著高于其相对应时间点的对照组母猪(P < 0.01)。其中ACTH处理组母猪血浆中皮质醇的含量在应激处理后的第3天达到最高水平。虽然试验第6天和第9天时其皮质醇含量出现了明显的下降, 但依然高于相应的对照组母猪(表 4)。
| 处理分组 Treatment groups | 注射后不同时间皮质醇含量/(ng·mL-1) The cortisol content after different injection time | |||
| 3 d | 6 d | 9 d | ||
| 对照组Control group | 62.91±6.44 | 56.84±20.43 | 43.82±24.11 | |
| ACTH处理组 ACTH treatment group | 排卵母猪(ACTH-A) Sows of ovulation successful | 190.84±4.32** | 97.00±15.73** | 90.10±24.03** |
| 未排卵母猪(ACTH-B) Sows of ovulation failure | 212.97±91.66** | 113.16±15.62** | 99.66±15.06** | |
类固醇激素合成过程中, 激素合成酶基因转录水平的高低可影响卵泡液中激素的含量。利用荧光定量PCR技术对类固醇合成酶基因转录水平进行检测。结果表明(图 2):与对照组相比, ACTH处理组未排卵母猪(ACTH-B)与排卵母猪(ACTH-A)卵泡壁中CYP17A1、CYP19A1、LHR和3β-HSD的转录水平均显著降低(P<0.05), CYP11A1和StAR的转录水平也出现了降低的趋势(P>0.05)。与ACTH处理组排卵母猪(ACTH-A)相比, 未排卵母猪(ACTH-B)卵泡壁中类固醇激素合成酶基因转录水平有所降低(P>0.05)。
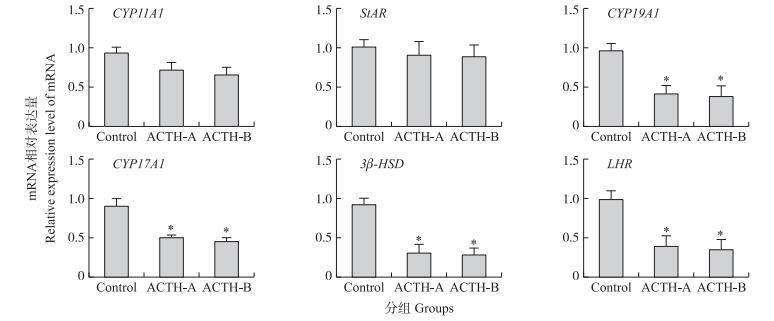
|
图 2 试验组与对照组母猪类固醇合成酶基因的转录水平 Figure 2 The levels of steroid synthesase genes in ACTH treated and control weaned sows Control:对照组Control group; ACTH-A:试验组排卵母猪Sows of ovulation succeeful in experimental group; ACTH-B:试验组未排卵母猪Sows of ovulation failure in experimental group.下同。The same as follows. |
从免疫组化结果(图 3)可以看出:CYP17A1、LHR、3β-HSD和CYP19A1这4种蛋白的阳性信号均为棕褐色, 其中CYP17A1、LHR和3β-HSD 3种蛋白主要表达在卵泡壁膜细胞的细胞浆中; 而CYP19A则主要分布于卵泡壁颗粒细胞的细胞浆中。ACTH应激处理7 d后, 上述4种蛋白的表达量均出现明显的下降。CYP17A1、LHR和3β-HSD在膜细胞上的阳性信号明显减弱, 同时CYP19A1在颗粒细胞上的阳性信号也明显减弱, 蛋白表达显著降低。试验组排卵母猪和未排卵母猪卵泡壁中CYP17A1、3β-HSD、CYP19A1及LHR的表达差异不大。
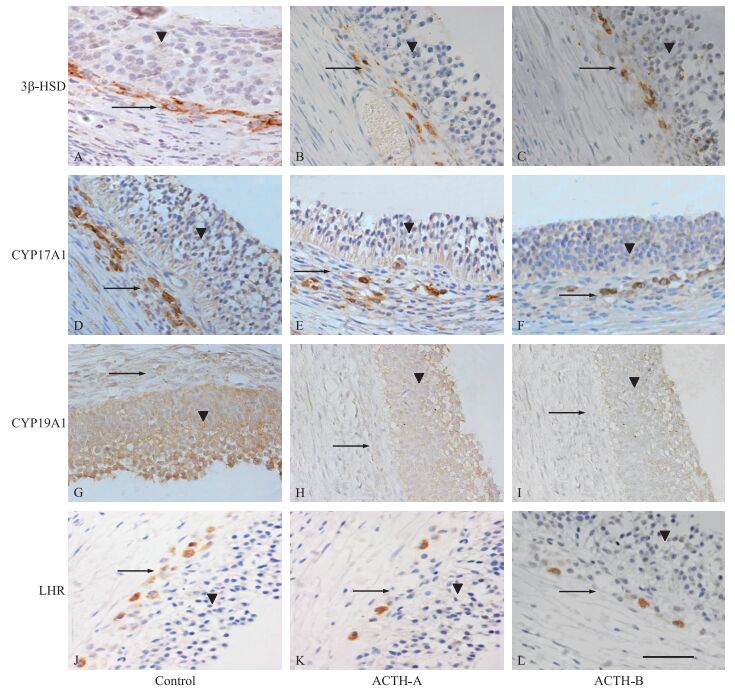
|
图 3 试验组与对照组断奶母猪卵泡壁中类固醇合成酶及LHR表达的免疫组化结果(标尺=50 μm) Figure 3 Immunohistochemistric results of steroid synthesases and LHR in ACTH treated and control weaned sows(bar=50 μm) A、D、J分别表示3β-HSD、CYP17A1、LHR在对照组母猪卵泡壁膜细胞胞浆中的表达; B、E、K分别表示3β-HSD、CYP17A1、LHR在ACTH-A组卵泡壁膜细胞胞浆中的表达; C、F、L分别表示3β-HSD、CYP17A1、LHR在ACTH-B组卵泡壁膜细胞胞浆中的表达; G、H、I分别表示CYP19A1在对照组、ACTH-A组、ACTH-B组卵泡壁颗粒细胞胞浆中的表达。→:膜细胞层; ▼:颗粒细胞层。 A, D, J mean the expression of 3β-HSD, CYP17A1 and LHR in cytoplasm of theca cells of follicular wall in the sows of control group respectively; B, E, K mean the expression of 3β-HSD, CYP17A1 and LHR in cytoplasm of theca cells of follicular wall in the ACTH-A group; C, F, L mean the expression of 3β-HSD, CYP17A1 and LHR in cytoplasm of theca cells of follicular wall in the ACTH-B group; G, H, L mean the expression of CYP19A1 in cytoplasm of granule cells of follicular wall in sows of control, ACTH-A and ACTH-B group. →:Theca cell layer; ▼:Granulose cell layer. |
从表 5可以看出:CYP17A1、LHR和3β-HSD主要表达在卵泡的膜细胞上, 而CYP19A1主要在颗粒细胞上表达。ACTH应激处理7 d后, 上述4种蛋白的D值均出现了显著下降(P < 0.05)。试验组排卵母猪(ACTH-A)与未排卵母猪(ACTH-B)卵泡壁中4种蛋白的表达差异不显著(P>0.05)。
| 分组处理Treatment group | 蛋白Protein | 表达位置Express location | D | |
| 对照组 Control group | CYP17A1 | 膜细胞Theca cell | 0.43±0.05 | |
| 3β-HSD | 膜细胞Theca cell | 0.53±0.08 | ||
| CYP19A1 | 颗粒细胞Granular cell | 0.50±0.05 | ||
| LHR | 膜细胞Theca cell | 0.32±0.03 | ||
| ACTH处理组 ACTH treatment group | 排卵母猪(ACTH-A) Sows of ovulation successful | CYP17A1 | 膜细胞Theca cell | 0.29±0.03** |
| 3β-HSD | 膜细胞Theca cell | 0.42±0.14* | ||
| CYP19A1 | 颗粒细胞Granular cell | 0.33±0.09** | ||
| LHR | 膜细胞Theca cell | 0.25±0.05** | ||
| 未排卵母猪(ACTH-B) Sows of ovulation failure | CYP17A1 | 膜细胞Theca cell | 0.26±0.06** | |
| 3β-HSD | 膜细胞Theca cell | 0.36±0.17* | ||
| CYP19A1 | 颗粒细胞Granular cell | 0.27±0.11** | ||
| LHR | 膜细胞Theca cell | 0.18±0.06** | ||
猪的集约化生产中, 应激因素不可避免地影响母猪的繁殖性能[2]。应激可导致机体HPA轴的过度活化及血浆中皮质醇的含量明显升高, 在此过程中类固醇激素的合成及卵巢生殖功能的发挥都因此而受到一定影响[1]。雌二醇在卵泡发育及颗粒细胞存活的过程中发挥着重要的作用, 当雌二醇分泌不足时腔卵泡闭锁增加、卵泡成熟受到抑制[7]。由于卵巢中类固醇激素的合成是一系列过程, 因此合成过程中几种关键酶(CYP11A1、CYP17A1、CYP19A1、StAR和3β-HSD)的表达会直接影响到类固醇激素在卵泡液中的含量。
应激过程中机体HPA轴的过度活化造成血浆中皮质醇浓度升高, 而过高的皮质醇浓度则在下丘脑-垂体水平影响促性腺激素的释放, 进而影响卵泡排卵及卵泡囊肿的形成[8]。血浆中过高的皮质醇浓度还可抑制类固醇激素的合成、释放及排卵前LH峰的形成[9]。类固醇激素合成过程包括:StAR将胆固醇分子转移到线粒体内膜; 在CYP11A1的作用下胆固醇分子转化为孕烯醇酮; 孕烯醇酮在3β-HSD的作用下转化为孕酮; 孕酮在羟基化作用下通过CYP17A1转化为雄烯二酮; 当雄烯二酮转到颗粒细胞后通过CYP19A1的作用转化为雌二醇[10]。在我们的试验中, StAR和CYP11A1基因转录水平出现下降(P>0.05), 与此相对应的是卵泡液中孕酮激素水平也出现了下降趋势(P>0.05)。CYP17A1、CYP19A1以及LHR等基因的表达出现显著降低(P<0.05), 与卵泡液中雌二醇及雄烯二酮的低蛋白表达相对应。由此可见, ACTH人工应激处理通过影响类固醇合成酶基因的转录水平而影响了类固醇激素的合成, 进而影响卵泡发育及排卵的发生。
文献报道, 类固醇激素合成酶的基因表达与E2/P4值的高低存在显著的关系。E2/P4比值变化在一定程度上可作为类固醇激素合成酶基因转录水平的指示器, LHR、CYP17A1、CYP19A1基因的转录水平受到抑制时, 可见卵泡液中E2/P4值降低[11]。在ACTH诱导的应激反应中血浆皮质醇含量升高, 类固醇激素合成受到影响而导致E2/P4比值降低[9]。而E2/P4比值的降低也表明LHR、CYP17A1、CYP19A1基因的转录水平受到影响[12]。对卵泡壁中LHR的表达进行基因水平及蛋白水平的检测, 发现LHR的表达在ACTH应激处理过程中明显被抑制, 这可能与血浆中皮质醇的含量显著升高有关[13]。据报道, 促性腺激素必须通过与受体结合才能发挥其作用, 而卵泡壁中LHR表达量降低将会影响促黄体素对卵泡的作用[14]。LH及LHR都受皮质醇的影响, 血浆皮质醇含量升高可抑制LH的释放、排卵前LH峰的形成及LHR在卵泡壁的表达[11]。LHR的表达量降低, 影响了LH功能发挥, 进而影响了卵泡的发育及排卵, 这可能是试验组中应激处理的母猪发情不排卵的主要原因。
综上所述, 本试验中注射ACTH能够引起母猪出现应激反应, 而经这种处理后的断奶母猪, 其发情不排卵现象可能与外源ACTH导致的皮质醇水平过高, 进而引起类固醇激素合成水平下降, 以及卵泡壁LHR表达减少有关。
| [1] | Einarsson S, Brandt Y, Lundeheim N, et al. Stress and its influence on reproduction in pigs:a review[J]. Acta Vet Scand, 2008, 50: 48. DOI: 10.1186/1751-0147-50-48 |
| [2] | Dobson H, Smith R F. What is stress, and how does it affect reproduction?[J]. Animal Reproduction Science, 2000, 60/6: 743–752. |
| [3] | Vargas A J, Bernardi M L, Paranhos T F, et al. Reproductive performance of swine females re-serviced after return to estrus or abortion[J]. Anim Reprod Sci, 2009, 113(1/2/3/4): 305–310. |
| [4] | Hennessy D P, Williamson P. The effects of stress and of ACTH administration in hormone profiles, oestrus and ovulation in pigs[J]. Theriogenology, 1983, 20(1): 13–26. DOI: 10.1016/0093-691X(83)90019-5 |
| [5] | Szulanczyk-Mencel K, Rzasa A, Bielas W. Relationships between ovarian cysts and morphological and hormonal state of ovarian cortex in sows[J]. Anim Reprod Sci, 2010, 121(3/4): 273–278. |
| [6] | Madej A, Lang A, Brandt Y, et al. Factors regulating ovarian function in pigs[J]. Domestic Animal Endocrinology, 2005, 29(2): 347–361. DOI: 10.1016/j.domaniend.2005.02.030 |
| [7] |
林鹏飞, 剧世强, 罗碧平, 等. 猪有腔卵泡发育和闭锁中颗粒细胞凋亡与卵泡液类固醇激素的变化[J].
西北农林科技大学学报(自然科学版), 2011, 39(3): 28–33, 39.
Lin P F, Ju S Q, Luo B P, et al. Analysis of the granulosa cells apoptosis and the changes of hormone during porcine follicular development and atresia[J]. Journal of Northwest A&F University(Natural Science Edition), 2011, 39(3): 28–33, 39. (in Chinese with English abstract) |
| [8] | Scholten J A, Liptrap R M. A role for the adrenal cortex in the onset of cystic ovarian follicles in the sow[J]. Can J Comp Med, 1978, 42(4): 525–533. |
| [9] | Barb C R, Kraeling R R, Rampacek G B, et al. Inhibition of ovulation and LH secretion in the gilt after treatment with ACTH or hydrocortisone[J]. J Reprod Fertil, 1982, 64(1): 85–92. DOI: 10.1530/jrf.0.0640085 |
| [10] |
孙嘉瑞, 曹轶男, 张新晨, 等. 三聚氰胺与三聚氰酸混合物对小鼠睾酮生成和调控的影响[J].
南京农业大学学报, 2016, 39(4): 650–655.
Sun J R, Cao Y N, Zhang X C, et al. Effect of mixture of melamine and cyanuric acid on production and synthesis regulation of testosterone in mice[J]. Journal of Nanjing Agricultural University, 2016, 39(4): 650–655. DOI: 10.7685/jnau.201510037 (in Chinese with English abstract) |
| [11] | Nimz M, Spitschak M, Schneider F, et al. Down-regulation of genes encoding steroidogenic enzymes and hormone receptors in late preovulatory follicles of the cow coincides with an accumulation of intrafollicular steroids[J]. Domestic Animal Endocrinology, 2009, 37(1): 45–54. DOI: 10.1016/j.domaniend.2009.02.002 |
| [12] |
张金璧, 林飞, 潘增祥, 等. 猪不同程度闭锁卵泡判定方法的比较研究[J].
南京农业大学学报, 2013, 36(1): 115–119.
Zhang J B, Lin F, Pan Z X, et al. Comparative study of methods to determine the follicular atresia extent in pigs[J]. Journal of Nanjing Agricultural University, 2013, 36(1): 115–119. DOI: 10.7685/j.issn.1000-2030.2013.01.020 (in Chinese with English abstract) |
| [13] | Sapolsky R M. How do glucocorticoids influence stress responses?Integrating permissive, suppressive, stimulatory, and preparative actions[J]. Endocrine Reviews, 2000, 21(1): 55–89. |
| [14] |
付灵梅, 谭朝阳, 王丽君, 等. 紫石英对排卵障碍大鼠卵巢局部卵泡刺激素受体、黄体生成素受体表达的影响[J].
中国实验方剂学杂志, 2011, 19(5): 184–186.
Fu L M, Tan C Y, Wang L J, et al. Influence of fluoritum on rats with ovarian failure and level of FSHR and LHR[J]. Chinese Journal of Experimental Traditional Medical Formulate, 2011, 19(5): 184–186. (in Chinese with English abstract) |




