文章信息
- 李舒清, 张镜丹, 纪程, 顾文文, 李荣, 邹建文
- LI Shuqing, ZHANG Jingdan, JI Cheng, GU Wenwen, LI Rong, ZOU Jianwen
- 接种复合菌剂对牛粪好氧堆肥进程及温室气体(CH4和N2O)排放的影响
- Effects of inoculation of complex microbial inoculants on the process and greenhouse gas(CH4and N2O) emissions of cattle manure aerobic composting
- 南京农业大学学报, 2017, 40(6): 1041-1050
- Journal of Nanjing Agricultural University, 2017, 40(6): 1041-1050.
- http://dx.doi.org/10.7685/jnau.201707004
-
文章历史
- 收稿日期: 2017-07-03
2. 江苏峻德生态农业科技有限公司, 江苏 淮安 223300
2. Jiangsu Junde Ecological Agriculture Technology Co. Ltd., Huai'an 223300, China
随着我国农业的不断发展, 畜禽粪便和作物秸秆等固体废弃物的产生量也不断增多。据估计我国农业生产中每年产生的畜禽粪便及作物秸秆的产生量约为51 t[1-2], 其中废弃物的利用率仅为50%。不当的农业固体废弃物处理方式会造成严重的环境污染(如秸秆焚烧污染大气, 畜禽粪便排入水体污染水体等); 同时也是对有机质等宝贵养分资源的极大浪费。高温好氧堆肥是处理农业固体废弃物的有效途径之一, 其通过好氧微生物的作用在一定条件下将复杂的有机固体废弃物分解并形成腐殖质, 同时灭活废弃物中的病原微生物和寄生虫, 是畜禽粪便稳定化、无害化和资源化的一种经济高效技术, 具有广阔的应用前景[3]。
传统的好氧堆肥过程主要是由自然微生物参与实现废弃物分解腐熟的过程, 往往耗时较长(升温缓慢), 处理不彻底(后熟时间长), 而且在堆制过程中经常伴有恶臭、蚊蝇等, 不利于工业化生产。接种外源微生物是加速高温好氧堆肥进程的有效途径。外源微生物可加速堆肥初期基质的分解, 从而快速提高堆体温度; 另一方面也能加快木质纤维素的降解, 从而促进堆体后熟, 缩短堆肥周期[4-5]。如Zhao等[6]发现外源接种放线菌可加速鸡粪堆肥中的木质纤维素降解, 促进堆肥腐熟; 而接种包含白腐真菌、链霉菌及多种芽孢杆菌的复合菌剂可有效加快牛粪堆肥的升温, 延长其高温期时间, 加快堆体中有机物尤其是木质纤维素的降解, 最终加速堆体腐熟[7]。竹江良等[8]也报道在烟草废弃物高温堆肥过程中, 在添加合适猪粪比例的基础上加入外源微生物菌剂有利于堆体迅速进入高温分解阶段, 延长高温分解持续时间, 缩短发酵堆肥时间, 促进C/N降低, 加速烟草废弃物堆肥腐熟进程。
高温好氧堆肥也是CH4和N2O等温室气体的重要排放源[9]。近年来, 学者们逐渐认识到微生物在好氧堆肥过程中对温室气体排放(主要是CH4和N2O)的重要贡献。CH4是有机质厌氧降解过程的终产物, 主要在好氧堆肥的开始阶段由产甲烷菌(methanogens)分解有机物时释放[10]; 同时, 堆肥中的甲烷氧化菌(methanotrophs)可以在好氧条件下将CH4氧化。N2O的形成是硝化与反硝化共同作用的结果。硝化作用指NH4+在微生物作用下逐步形成NO3-的过程, 反硝化作用则指堆肥中微生物催化的由NO3-→NO2-→NO→N2O→N2的过程。其中由NO还原产生的N2O一部分会直接散发到大气中, 引起温室效应[11]; 另一部分会被转化为N2并释放[12]。已有研究表明在堆肥过程中施用固氮菌剂能有效减少N2O排放和氮损失, 显著提高成品中的氮素含量[13-14]。
畜禽粪便好氧堆肥是实现废弃物稳定化、无害化和资源化的重要途径, 但在实施过程中往往进度较慢, 同时会产生大量温室气体造成环境污染。本试验拟将实验室前期分离到的解淀粉芽孢杆菌SQR9和灰绿曲霉Z5制成复合菌剂, 并研究在牛粪堆肥中接种该复合菌剂后对堆肥进程及温室气体产生的影响, 为优化高温好氧堆肥处理牛粪等固体废弃物提供理论依据与技术支持。
1 材料与方法 1.1 供试材料牛粪及稻草来源于江苏峻德生态农业科技有限公司。
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)SQR9保藏于中国普通微生物菌种保藏管理中心(CGMCC), CGMCC菌株编号5808, 筛选自黄瓜根际, 生长迅速, 具有良好的拮抗多种病原真菌的能力和分解纤维素、木聚糖等多种底物的能力[15]。
灰绿曲霉(Aspergillus fumigatus)Z5分离自中药渣高温堆肥, 具有很强的木质纤维降解能力[16]。
1.2 堆肥试验设计与样品采集条垛式好氧堆肥试验于江苏峻德生态农业科技有限公司堆肥场进行。堆肥原料为新鲜牛粪与秸秆(质量比为4:1), 堆体体积约为125 m3(65 m×2.8 m×1.1 m)。共设置2个处理。对照处理(CK):不加菌剂进行自然堆置; 处理组(T):接种含解淀粉芽孢杆菌SQR9和灰绿曲霉Z5的混合菌剂, 其中SQR9菌体密度为2×109 CFU·g-1, Z5的孢子浓度为2×108 g-1。菌剂接种量为0.5%(质量分数), 在堆肥初始阶段与堆料混合均匀。堆肥自2015年5月22日开始至7月1日结束, 历时41 d。堆肥前24 d为曝氧期, 堆体每2 d翻堆1次; 后17 d为后熟期, 不进行翻堆。本试验堆体的初始含水率、pH和C/N均在合理的范围内。
根据堆体的长度将其平均分成三等分, 各设1个采样点。在每个采样点选择合适的采样剖面, 在堆体的30 cm深度处分别采集堆肥样品, 并将3个采样点处采集的等量样品充分混匀后采用四分法取样品3次。采样时间为堆肥开始后1、3、5、7、9、13、22、28、32和41 d。取样后选取1袋新鲜样品保存于4 ℃冰箱, 用于测定不同堆肥时期样品的含水率, 铵态氮(NH4+-N)、硝态氮(NO3--N)和亚硝态氮(NO2--N)含量; 1袋新鲜样品冷藏于-20 ℃冰箱, 用于进行微生物功能基因丰度测定; 另外一部分样品自然风干后过20目和100目筛, 用于测定其他理化指标。
1.3 堆肥相关指标的测定 1.3.1 温度通过水银温度计测定堆体30 cm深处的温度, 每个堆体测定3个点, 其平均温度即为堆体温度。同时测定采样箱箱体温度, 即为环境温度。测定时间为堆肥开始后1、3、5、7、9、11、13、15、17、19、22、24、28、32、37和41 d。
1.3.2 含水率采用烘干称重法测量堆肥样品含水率:将用双蒸水洗干净的铝盒放于50 ℃电热鼓风恒温干燥箱中, 烘干至恒质量。冷却后的空铝盒质量记为W1。天平去皮归零后称取5 g保存于4 ℃冰箱的新鲜堆肥样品, 将堆肥样品均匀平铺于空铝盒的底部, 每个样品称取3次, 设3个重复, 标好编号后将其放入已经开启预热至65 ℃的电热鼓风恒温干燥箱中, 烘至恒质量后关闭干燥箱, 使铝盒在干燥箱内冷却30 min, 再将铝盒从干燥箱内移出, 称质量(W2), 按照如下公式计算含水率:含水率=[5-(W2-W1)]/5×100%。
1.3.3 pH与电导率称取3 g风干堆肥样品于150 mL锥形瓶中, 加入30 mL超纯水, 搅拌混匀后将其放入200 r·min-1的水平摇床上, 振荡2 h, 取出锥形瓶, 水平静置30 min后分别通过pH计(PHS-3C)和电导率仪(FE-30)测定样品的pH值和电导率, 每个堆肥样品设置3个重复。
1.3.4 铵态氮(NH4+-N)和硝态氮(NO3--N)含量测定称取5 g新鲜堆肥样品于150 mL锥形瓶中, 加50 mL超纯水, 搅拌混匀后将其放入200 r·min-1的水平摇床上, 振荡30 min, 取出锥形瓶, 水平静置30 min后过滤, 收集的滤液采用流动分析仪测定铵态氮和硝态氮含量, 每个堆肥样品设置3个重复。
1.3.5 碳氮比(C/N)用天平准确称取20~30 mg过100目筛的堆肥样品, 用锡箔纸包裹住样品, 记录称取样品的质量(精确到0.001 mg)。通过元素分析仪测定堆肥总有机碳和全氮含量, 计算各样品的碳氮比, 每个样品设置3个重复。
1.4 温室气体(CH4与N2O)采集与测定采用静态暗箱法采集试验气体样品[17]。采样箱箱体材质是聚氯乙烯, 箱体为圆柱体, 圆柱直径为0.45 m, 高为0.5 m。采样时间为堆肥开始后的1、3、5、7、9、11、13、15、17、19、22、24、28、32、37和41 d。每次采集样品时间为当天的12:00—14:00。在采样箱通气阀关闭后的0、5、10、15和20 min采集气体样品, 每个时间段分别采集1 000 mL的气体样品, 气袋的容量为1 500 mL。采集的气体样品需要在最短时间内使用Agilent 7890A气相色谱仪进行检测分析[18]。
1.5 堆肥样品CH4与N2O产生相关功能基因丰度的测定采用Power Soil® DNA Isolation Kit强力土壤DNA提取试剂盒提取新鲜堆肥样品的DNA, 通过实时荧光定量PCR检测样品中与CH4与N2O产生相关功能基因的拷贝数。所选功能基因包括mcrA、pmoA、amoA、narG、nirS、nirK和nosZ, 具体引物序列及产物信息见表 1, 由南京金斯瑞生物科技有限公司合成。
| 基因 Gene | 名称 Name | 序列 Sequence | 片段大小/bp Fragment size | 参考文献 Refrences |
| 16S总细菌 Bacteria | 515F 907R | GTGCCAGCMGCCGCGG CCGTCAATTCMTTTRAGTTT | 392 | [19] |
| 16S产甲烷古菌 Methanogenus | 1106F 1378R | TTWAGTCAGGCAACGAGC TGTGCAAGGAGCAGGGAC | 273 | [20] |
| mcrA | mlas mcr-rev | GGTGGTGTMGGDTTCACMCARTA CGTTCATBGCGTAGTTVGGRTAGT | 509 | [21] |
| pmoA | 189-f mb661-r | GGNGACTGGGACTTCTGG CCGGMGCAACGTCYTTACC | 472 | [21] |
| amoA | amoA-1F amoA-2R | GGGGTTTCTACTGGTGGT CCCCTCKGSAAAGCCTTCTTC | 491 | [22] |
| narG | narG-1960m2f narG-2050m2r | TAYGTSGGGCAGGARAAACTG CGTAGAAGAAGCTGGTGCTGTT | 110 | [23] |
| nirK | nirKF1aCu nirKR3Cu | ATCATGGTSCTGCCGCG GCCTCGATCAGRTTGTGGTT | 473 | [24] |
| nosZ | nosLb nosRb | AGAACGACCAGCTGATCGACA TCCATGGTGACGCCGTGGTTG | 300 | [25] |
| Note:M=A/C; D=A/G/T; R=A/G; B=C/G/T; V=G/A/C; N=A/C/G/T; Y=C/T; K=G/T; S=G/C; W=A/T. | ||||
定量PCR反应采用SYBR® Premix Ex TaqTM(宝生物工程有限公司)试剂盒于ABI(Applied BIO systems)PRISM® 7500 Real-time PCR System扩增仪上对土壤DNA样品进行定量分析。扩增反应在96-well Fast Thermal Cycling plate中进行。反应体系为20 μL:SYBR Premix Ex TaqTM(2×)混合液10 μL, ROX dye Ⅱ(50×)0.4 μL, 上、下游引物(10 pmol·mL-1)各0.4 μL, DNA模板2 μL, ddH2O 6.8 μL。反应程序:95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 34 s, 40个循环, 最后进行熔解曲线反应(95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s)。在每一个循环的退火阶段收集荧光, 实时监测反应并且记录荧光信号的变化, 得出扩增曲线。
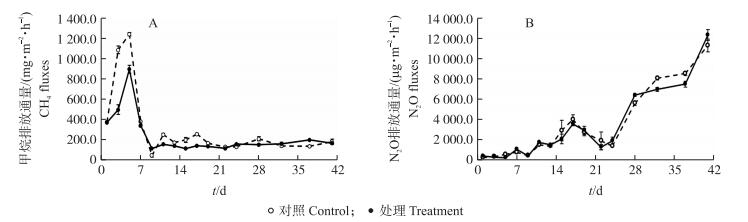
质粒标准样品的制备:以堆肥样品DNA为模板, 通过PCR扩增各靶标基因片段(引物序列见表 1), 产物纯化后连接到pMD19-T载体(宝生物工程有限公司), 转化大肠杆菌DH5α感受态细胞, 经菌液PCR或提取质粒验证后挑取阳性克隆送南京金斯瑞生物技术有限公司测序。同时将提取的质粒利用核酸定量仪Thermo scientific NANODROP 1000(NanoDrop Technologies, Wilmington, DE, USA)定量, 按以下公式将质粒DNA的量转化为拷贝数。
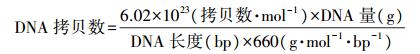
|
将定量后的质粒以10倍系列稀释, 观察不同质粒浓度下的扩增效率及对应的CT值, 确定合适的DNA模板浓度。在合适的浓度范围内选择5~6个稀释梯度进行扩增反应, 绘制出标准曲线。用作定量PCR反应的标准品, 以荧光强度为纵坐标制作标准曲线。将测得的CT值代入标准曲线方程, 即可计算出待测样品的各靶标基因拷贝数(基因丰度)。
1.6 数据统计与分析本试验数据统计分析采用JMP 11.0(SASinsititue, USA)完成, 对照与处理组之间数据使用t检验进行统计分析。使用Microsoft Excel 2010进行图表制作。
2 结果与分析 2.1 不同处理堆肥过程中物理指标的动态变化 2.1.1 堆肥过程中温度的变化牛粪堆肥的温度变化趋势与一般好氧堆肥的温度变化特征相似(图 1)。接种菌剂的堆肥温度迅速上升, 3 d时即超过60.0 ℃并维持至32 d, 最高温度达到74.0 ℃(15 d)。自然堆肥升温较慢, 至9 d达到60.0 ℃以上, 随后持续至32 d, 但最高温度仅为69.7 ℃(13 d)。由此可见, 接种功能菌剂可加速堆体升温, 提高堆体最高温度, 从而促进堆肥腐熟, 并更有效地杀死堆肥中的寄生虫和病原微生物, 达到无害化的目的。
|
图 1 堆体温度和环境温度的变化 Figure 1 Changes in composting temperature and ambient temperature |
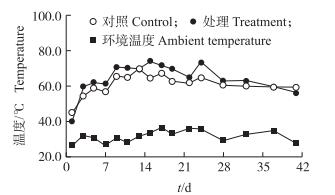
不同处理堆肥的pH值均呈先下降后稳定的趋势(图 2-A)。其中接种菌剂的堆体其pH值在堆肥初始的7 d内迅速由7.70降至7.50, 而对照的pH值在前7 d变化不大, 至9 d时迅速下降至7.54。随后两者的pH值都稳定在7.5左右。一般好氧堆肥初期pH值的下降可能是由于微生物分解有机物产生的有机酸类物质积累所致。接种菌剂后堆体初期pH值较对照低, 有利于降低发酵过程中的氨挥发。
|
图 2 堆肥过程中pH值、含水率和电导率的变化 Figure 2 Changes of pH value, moisture and electrical conductivity(EC)during the composting process |
2个处理的含水率均随堆肥进程迅速下降, 28 d后逐渐保持稳定(图 2-B)。接种菌剂处理的堆肥含水率下降速度高于自然堆肥, 其原因是接菌处理相比于对照升温更快, 温度更高, 高温期更长。堆肥结束时处理与对照的含水率分别为34.1%和36.8%(图 2-B)。
堆肥过程中2个处理堆体的电导率相差不大, 整体呈逐渐上升趋势。堆肥结束时接菌处理与对照堆肥的电导率分别为14.52和14.04 mS·cm-1(图 2-C)。
2.2 不同处理堆肥过程中C/N、铵态氮(NH4+-N)和硝态氮(NO3--N)的变化由表 2可见:堆体的初始物料C/N较低, 约为18, 堆肥进程中C/N不断下降, 其中接菌处理C/N下降更快, 在22 d时已下降至12.8;对照处理至32 d时C/N下降至12.5。堆肥结束时处理与对照的C/N相差不大, 分别为12.1和12.3。这说明接菌后加速了堆体有机物的降解和C/N的迅速下降, 有利于堆肥的腐熟。
| 指标 Item | 处理 Treatment | 堆肥时间/d Composting time | |||||||||
| 1 | 3 | 5 | 7 | 9 | 13 | 22 | 28 | 32 | 41 | ||
| C/N | 自然堆肥 Control | 17.9±0.1 | 17.5±0.8 | 16.9±0.2 | 16.4±0.3 | 15.7±0.1 | 14.6±0.3 | 14.2±0.0 | 13.7±0.2 | 12.5±0.0 | 12.3±0.2 |
| 菌剂处理 Treatment | 18.2±0.2 | 17.1±0.1 | 16.7±0.1 | 15.7±0.1 | 14.1±0.3 | 14.2±0.6 | 12.8±0.2 | 12.4±0.2 | 11.8±0.5 | 12.1±0.2 | |
| NH4+-N含量/ (g·kg-1) | 自然堆肥 Control | 1.53±0.06 | 2.09±0.01 | 2.06±0.08 | 2.12±0.01 | 1.98±0.05 | 1.61±0.05 | 0.99±0.05 | 0.89±0.03 | 0.71±0.03 | 0.53±0.03 |
| NH4+-N content | 菌剂处理 Treatment | 1.53±0.02 | 1.73±0.01 | 2.02±0.01 | 1.93±0.08 | 2.15±0.02 | 1.49±0.04 | 1.08±0.12 | 1.03±0.04 | 0.64±0.01 | 0.58±0.02 |
| NO3--N含量/ (g·kg-1) | 自然堆肥 Control | 0.25±0.02 | 0.39±0.03 | 0.79±0.03 | 0.71±0.04 | 0.72±0.03 | 0.74±0.03 | 0.95±0.02 | 1.04±0.04 | 0.97±0.00 | 1.04±0.02 |
| NO3--N content | 菌剂处理 Treatment | 0.29±0.05 | 0.49±0.03 | 0.71±0.01 | 0.69±0.04 | 0.77±0.01 | 0.86±0.02 | 0.95±0.05 | 0.81±0.02 | 1.06±0.02 | 0.97±0.06 |
不同处理堆体NH4+-N含量的动态变化趋势相似且相差不大。初始物料NH4+-N含量为1.53 g·kg-1, 堆肥5 d时上升至2.02~2.06 g·kg-1并保持稳定。堆肥9 d后NH4+-N含量迅速下降, 可能是由于此时高温状态下堆体中的NH4+-N转变为NH3而大量挥发。堆肥结束时NH4+-N含量降至0.53~0.58 g·kg-1。
NO3--N含量的变化趋势与NH4+-N相反, 呈上升趋势, 且不同处理间差异不大。堆体开始时NO3--N含量为0.25~0.29 g·kg-1, 在堆肥开始阶段迅速上升, 在5 d时即达到0.71~0.79 g·kg-1。随后NO3--N含量逐渐上升, 至堆肥结束时达到0.97~1.04 g·kg-1。2个处理间NH4+-N与NO3--N含量变化整体比较接近, 说明接种堆肥微生物对堆体的氮循环影响不大。
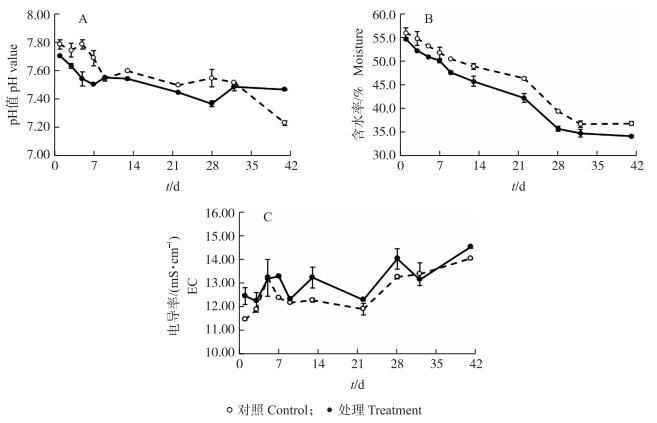
2.3 不同处理堆肥过程中CH4与N2O排放通量不同处理堆肥过程中温室气体CH4与N2O的排放通量均呈现明显的此消彼长的趋势(图 3)。CH4排放主要集中在堆肥升温期的前期(7 d之前), 其排放通量在堆肥开始后迅速增加, 堆肥3 d时对照与接菌处理排放通量分别为1 086.9和496.4 mg·m-2·h-1(P < 0.05);在5 d时达到峰值, 对照与处理组分别为1 241.4和894.9 mg·m-2·h-1(P < 0.05);7 d时堆体进入高温期后, 2个处理CH4排放通量迅速下降至400 mg·m-2·h-1以下, 并平缓下降, 对照组排放通量略高但两者相差不大。整体来看, 与对照相比, 接菌处理主要在CH4集中排放的堆肥前期显著降低了排放通量(图 3-A)。
|
图 3 堆肥过程中CH4(A)与N2O(B)的排放通量 Figure 3 Fluxes of CH4(A)and N2O(B) during the composting process |
与CH4的排放趋势相反, 堆体N2O排放通量呈不断增长的趋势, 从整体上看2个处理排放通量差异不大:堆肥前10 d 2个处理N2O排放通量均低于1 000 μg·m-2·h-1, 随后从11~17 d排放通量小幅增长至3 521.8~3 972.4 μg·m-2·h-1(图 3-B)。堆肥22 d时2个处理N2O排放通量急剧增加, 至41 d堆肥结束时对照与接菌处理N2O排放通量分别为11 273.4和12 304.5 μg·m-2·h-1。
2.4 不同处理堆肥中总细菌及与CH4和N2O排放相关功能基因丰度变化 2.4.1 16S rRNA总细菌丰度变化由图 4-A可见:2个处理16S rRNA总细菌的丰度在整个堆肥过程中略有下降, 且相差不大:堆肥初始细菌16S rRNA丰度为12.29~12.58 lg(copies·g-1); 堆肥过程中稳定在12.2 lg(copies·g-1)左右; 结束时对照与接菌处理细菌16S rRNA丰度分别为12.13和11.94 lg(copies·g-1)。
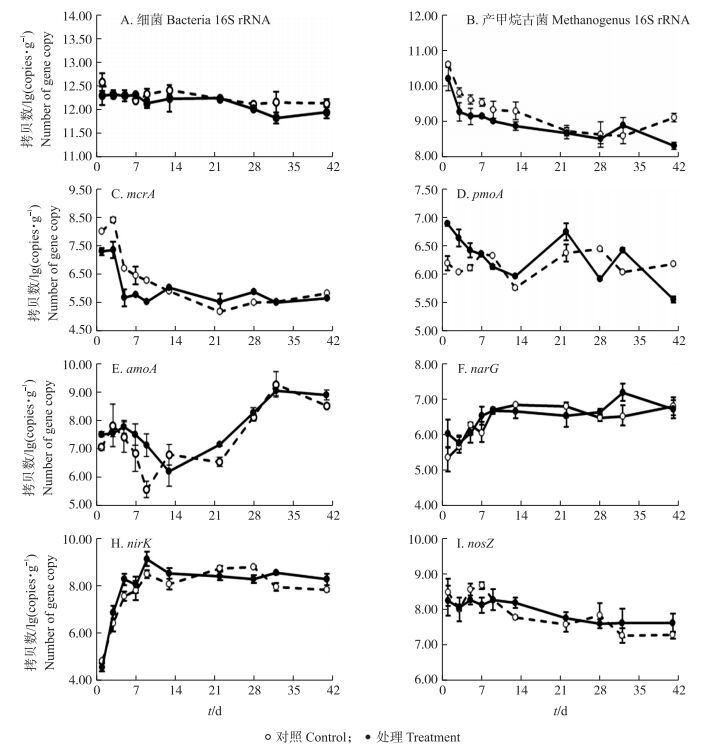
|
图 4 堆肥过程中总细菌及与CH4和N2O排放相关功能基因丰度变化 Figure 4 Changes in gene copy numbers of 16S rRNA and functional genes associated with CH4 and N2O emissions during the composting process |
由图 4-B可见:2个处理产甲烷古菌16S rRNA的丰度在堆肥过程中的变化趋势与CH4排放通量相似, 均在初期迅速下降随后保持稳定, 且堆肥前期接菌处理堆体的产甲烷菌丰度显著低于对照(4~13 d)。堆肥1 d对照与接菌处理产甲烷菌16S rRNA丰度分别为10.61和10.20 lg(copies·g-1); 随后甲烷菌丰度迅速下降, 至13 d对照与接菌处理分别下降至9.29和8.86 lg(copies·g-1), 在该过程中每个取样点处理组的产甲烷菌丰度均比对照低0.4 lg(copies·g-1)左右。堆肥22 d后2个处理堆体中产甲烷菌丰度均下降至8.7 lg(copies·g-1)左右, 并保持稳定直至堆肥结束。
通常选择编码产甲烷菌的甲基辅酶M还原酶的mcrA作为目的基因分析产甲烷菌。mcrA丰度的整体变化趋势与CH4排放通量及产甲烷古菌16S rRNA类似:在堆肥前3 d较高, 对照组丰度为8.00~8.41 lg(copies·g-1), 接菌处理组为7.28~7.34 lg(copies·g-1), 随后迅速下降至9 d时, 对照组为6.27~6.69 lg(copies·g-1), 接菌处理为5.50~5.65 lg(copies·g-1), 之后均稳定在5.6 lg(copies·g-1)左右。接菌处理显著降低了堆肥前期的mcrA丰度(1~9 d)(图 4-C)。
pmoA是编码甲烷单加氧酶α亚基的基因, 采用pmoA作为标记基因分析甲烷氧化菌。接菌处理与对照相比显著增加了堆体前期(5 d)的pmoA丰度, 分别为6.43~6.89 lg(copies·g-1)和6.04~6.11 lg(copies·g-1)(图 4-D)。随后pmoA的丰度在2个处理间均出现波动, 但整体相差不大。
2.4.3 N2O排放相关功能基因丰度变化amoA是反映硝化过程(氨氧化)的一个重要功能基因。从图 4-E可知:2个处理中amoA的丰度均呈先降低后增加的趋势。除少数取样点存在显著差异外(如9 d), 整体上2个处理间amoA的丰度比较接近。
编码硝酸还原酶的narG是反硝化过程相关的功能基因, 2个处理堆体中其丰度差别不大:在1~9 d(升温期)逐渐从5.36~6.04 lg(copies·g-1)增加至6.67~6.70 lg(copies·g-1); 随后稳定在6.80 lg(copies·g-1)左右直至堆肥结束(图 4-F)。
nirS与nirK均是编码亚硝酸还原酶(nitrite reductase)的功能基因。在堆肥过程中相比于nirS, nirK对于N2O排放的贡献更大, 本研究选择对其进行定量。结果表明:nirK丰度变化趋势与narG相似, 且在2个处理间差别不大(图 4-G)。
编码氧化亚氮还原酶的nosZ也是环境中重要的反硝化基因。由图 4-H可见:nosZ丰度在2个处理堆肥过程中整体呈下降趋势, 由堆肥初期的8.00~8.67 lg(copies·g-1)逐渐下降至后期的7.26~7.62 lg(copies·g-1), 且2个处理之间nosZ丰度差异不大。
3 讨论好氧堆肥是实现大量畜禽粪便废弃物无害化和资源化的重要途径, 但在实际生产中往往面临周期较长和效率较低等问题; 同时堆肥中产生的大量废气会造成环境污染(包括气体异味以及温室气体造成的环境效应等)。外源接种微生物菌剂是促进堆肥进程或减少有害气体排放的有效途径[26-28]。本研究在牛粪堆肥中接种包含解淀粉芽孢杆菌和灰绿曲霉的复合菌剂, 以探究其对堆肥进程及温室气体产生的影响。
本试验结果表明堆肥加入复合菌剂可加速堆体升温, 延长堆肥高温期时间, 促进有机质降解, 提高堆肥pH值, 最终使堆肥提前进入腐熟(22 d)。可见外源接种复合菌剂能明显加速牛粪堆肥腐熟进程, 有利于堆肥腐熟及无害化。在堆肥的初始阶段, 堆体中的糖类、蛋白质和氨基酸等易被分解的底物将首先被微生物分解利用[29]。本试验所用复合菌剂中的解淀粉芽孢杆菌可产生活性较高的蛋白酶、淀粉酶和蔗糖酶等, 因此其可在堆肥初期快速分解堆体中的易分解底物, 从而加速了堆体升温, 这与Xi等[4]的研究结果类似。待堆肥进入高温期后, 易降解碳、氮源已基本被分解完全, 此时堆体中的微生物开始分解利用纤维素、半纤维素和木质素等底物, 同时分解代谢过程中产生的热量可保持或进一步提高堆体的温度[7]。本试验接种外源菌剂后与对照相比提高了堆体的最高温度, 延长了高温期时间, 推测与接种的灰绿曲霉快速剧烈分解牛粪堆肥中的木质纤维素从而产生大量热量有关[30]。Xu等[7]报道牛粪堆肥接种外源复合菌剂后升温加速, 高温期延长, 堆体中有机物尤其是木质纤维素降解加快, 腐熟时间缩短。由此可知, 本试验中所用复合菌剂中的不同功能微生物分别在堆肥的不同阶段发挥作用, 最终加速了牛粪堆肥中有机质降解和腐熟进程。肖礼等[31]发现猪粪秸秆混合堆肥中接种白腐真菌、氨化和硝化菌剂对堆肥腐熟影响不大, 但可有效促进有机碳降解。高云航等[32]报道在牛粪堆肥中接种含酵母菌、枯草芽孢杆菌、青霉菌、花斑曲霉和短波假单胞菌的低温复合菌剂可在低温条件下促进堆体迅速升温, 并改善堆肥的腐熟质量。刘东海等[33]也发现接种含芽孢杆菌、乳酸菌和酵母菌的复合发酵菌剂可有效提高堆肥进度、促进堆肥腐熟并提高堆肥质量。由此可知, 接种合适的复合菌剂(酵母菌、芽孢杆菌、丝状真菌等)有助于加快不同类型畜禽粪便堆肥的进程。
农业废弃物好氧堆肥中有害气体的产生, 包括温室气体的产生, 是实际生产中有待解决的另一个重要问题。CH4和N2O是畜禽粪便堆肥产生的主要温室气体, 其中CH4的排放是其产生(甲烷产生菌贡献, 标记基因为mcrA, 编码甲基辅酶M还原酶)与消耗(即甲烷氧化, 甲烷氧化菌贡献, 标记基因为pmoA, 编码甲烷单加氧酶α亚基)的平衡结果[10]。N2O的形成是硝化与反硝化共同作用的结果, 主要由产生过程(NH4+→NO3-→NO2-→NO→N2O, 标记基因为amoA、narG和nirK, 分别编码氨单加氧酶、硝酸还原酶和亚硝酸还原酶)和消耗过程(N2O→N2, 标记基因nosZ, 编码一氧化氮还原酶)的相对强度决定[12]。本试验中对照与处理的CH4和N2O呈现此消彼长的排放趋势(CH4主要在堆肥初期排放随后迅速下降; N2O初期排放通量很低之后在堆肥中后期逐渐增加), 均与已报道的畜禽粪便好氧堆肥温室气体的排放规律[29, 34]相似, 而添加复合菌剂后堆肥的CH4排放通量与对照相比显著下降, 但N2O排放通量相差不大。定量PCR结果表明:在CH4大量产生的堆肥前期, 与对照相比, 接种复合菌剂后降低了堆体中甲烷产生相关的mcrA基因丰度, 而增加了与甲烷消耗有关的pmoA基因丰度, 该现象与Sonoki等[21]报道的添加生物黑炭导致牛粪堆肥CH4排放通量下降时堆体中相关功能基因的变化趋势相似, 推测这是其降低CH4排放的微生物学机制, 接种的外源菌剂如何影响上述2个功能基因丰度还有待进一步研究。另一方面, 添加复合菌剂后堆体中氮循环相关功能基因(amoA、narG、nirK和nosZ)和对照相比差异不大, 该现象与二者N2O的排放通量趋势吻合。Fukumoto等[26]的研究表明接种硝化细菌能将猪粪堆肥过程中的N2O排放通量降低到对照的20%以下。后续研究可考虑接种固氮菌剂、硝化菌剂或其他调控堆体氮循环的功能微生物以期减少堆肥N2O排放[14]。同时, 配合合适的通风方式优化堆体的整体供氧, 克服局部厌氧区域的产生, 更有利于控制温室气体的产生[35]。
本研究结果表明, 在牛粪好氧堆肥中接种复合菌剂, 可有效加速堆体升温, 延长堆肥高温期时间, 加速堆肥腐熟进程, 同时减少温室气体CH4的排放, 有利于实现堆肥快速腐熟及无害化。该技术可为优化高温好氧堆肥处理牛粪等固体废弃物提供理论依据与技术支持, 具体的参数优化和机制研究仍有待进一步深入。
| [1] |
朱启红. 畜禽粪便的综合利用[J].
农机化研究, 2007(8): 236–238.
Zhu Q H. Comprehensive utilization of livestock manure[J]. Agricultural Mechanization Research, 2007(8): 236–238. (in Chinese with English abstract) |
| [2] |
崔蜜蜜, 蒋琳莉, 颜廷武. 基于资源密度的作物秸秆资源化利用潜力测算与市场评估[J].
中国农业大学学报, 2016, 21(6): 117–131.
Cui M M, Jiang L L, Yan T W. Potential evaluation and market assessment on crop straw resource utilization based on resource density[J]. Journal of China Agricultural University, 2016, 21(6): 117–131. (in Chinese with English abstract) |
| [3] | Wei Y S, Fan Y B, Wang M J, et al. Composting and compost application in China[J]. Resources, Conservation and Recycling, 2000, 30(4): 277–300. DOI: 10.1016/S0921-3449(00)00066-5 |
| [4] | Xi B, He X, Dang Q, et al. Effect of multi-stage inoculation on the bacterial and fungal community structure during organic municipal solid wastes composting[J]. Bioresource Technology, 2015, 196: 399–405. DOI: 10.1016/j.biortech.2015.07.069 |
| [5] |
冯宏, 李华兴. 菌剂对堆肥的作用及其应用[J].
生态环境, 2004, 13(3): 439–441.
Feng H, Li H X. The functions of microbial inoculum and its application in composting[J]. Ecology and Environment, 2004, 13(3): 439–441. (in Chinese with English abstract) |
| [6] | Zhao H M, Du H, Feng N X, et al. Biodegradation of di-n-butylphthalate and phthalic acid by a novel Providencia sp.2D and its stimulation in a compost-amended soil[J]. Biology and Fertility of Soils, 2016, 52: 65. DOI: 10.1007/s00374-015-1054-8 |
| [7] | Xu J, Xu X, Liu Y, et al. Effect of microbiological inoculants DN-1 on lignocellulose degradation during co-composting of cattle manure with rice straw monitored by FTIR and SEM[J]. Environmental Progress and Sustainable Energy, 2016, 35(2): 345–351. DOI: 10.1002/ep.v35.2 |
| [8] |
竹江良, 刘晓琳, 李少明, 等. 两种微生物菌剂对烟草废弃物高温堆肥腐熟进程的影响[J].
农业环境科学学报, 2010, 29(1): 194–199.
Zhu J L, Liu X L, Li S M, et al. Effect of two microbial agents on tobacco fine waste high-temperature compost maturity[J]. Journal of Agro-Environmental Science, 2010, 29(1): 194–199. (in Chinese with English abstract) |
| [9] | Chadwick D, Sommer S, Thorman R, et al. Manure management:implications for greenhouse gas emissions[J]. Animal Feed Science and Technology, 2011, 166: 514–531. |
| [10] | Brown S, Kruger C, Subler S. Greenhouse gas balance for composting operations[J]. Journal of Environmental Quality, 2008, 37(4): 1396–1410. DOI: 10.2134/jeq2007.0453 |
| [11] |
单德鑫, 李淑芹, 许景钢. 固体有机废物堆肥过程中氮的转化[J].
东北农业大学学报, 2007, 38(2): 265–269.
Shan D X, Li S Q, Xu J G. Nitrogen transformations in solid organic waste composting[J]. Journal of Northeast Agricultural University, 2007, 38(2): 265–269. (in Chinese with English abstract) |
| [12] | Maeda K, Hanajima D, Toyoda S, et al. Microbiology of nitrogen cycle in animal manure compost[J]. Microbial Biotechnology, 2011, 4(6): 700–709. DOI: 10.1111/mbt.2011.4.issue-6 |
| [13] | McCrory D F, Hobbs P J. Additives to reduce ammonia and odor emissions from livestock wastes[J]. Journal of Environmental Quality, 2001, 30(2): 345–355. DOI: 10.2134/jeq2001.302345x |
| [14] | Pepe O, Ventorino V, Blaiotta G. Dynamic of functional microbial groups during mesophilic composting of agro-industrial wastes and free-living(N2)-fixing bacteria application[J]. Waste Management, 2013, 33(7): 1616–1625. DOI: 10.1016/j.wasman.2013.03.025 |
| [15] | Zhang N, Yang D, Wang D, et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates[J]. BMC Genomics, 2015, 16(1): 685. DOI: 10.1186/s12864-015-1825-5 |
| [16] | Liu D, Li J, Zhao S, et al. Secretome diversity and quantitative analysis of cellulolytic Aspergillus fumigatus Z5 in the presence of different carbon sources[J]. Biotechnology for Biofuels, 2013, 6(1): 149. DOI: 10.1186/1754-6834-6-149 |
| [17] | ou J, Huang Y, Jiang J, et al. A 3-year field measurement of methane and nitrous oxide emissions from rice paddies in China:effects of water regime, crop residue, and fertilizer application[J]. Global Biogeochemical Cycles, 2005, 19(2): 153–174. |
| [18] | Liu S, Q in, Y, Zou J, et al. Effects of water regime during rice-growing season on annual direct N2O emission in a paddy rice-winter wheat roation system in southeast China[J]. Science of the Total Environment, 2010, 408: 906–913. DOI: 10.1016/j.scitotenv.2009.11.002 |
| [19] | Zhou J, Wu L, Deng Y, et al. Reproducibility and quantitation of amplicon sequencing-based detection[J]. ISME Journal, 2011, 5: 1303–1313. DOI: 10.1038/ismej.2011.11 |
| [20] | Watanabe T, Kimura M, Asakawa S. Community structure of methanogenic archaea in paddy field soil under double cropping(rice-wheat)[J]. Soil Biology and Biochemistry, 2006, 38: 1264–1274. DOI: 10.1016/j.soilbio.2005.09.020 |
| [21] | Sonoki T, Furukawa T, Jindo K, et al. Influence of biochar addition on methane metabolism during thermophilic phase of composting[J]. Journal of Basic Microbiology, 2013, 53(7): 617–621. DOI: 10.1002/jobm.v53.7 |
| [22] | Rotthauwe J H, Witzel K P, Liesack W. The ammonia monooxygenase structural gene amoA as a functional marker:molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied and Environmental Microbiology, 1997, 63: 4704–4712. |
| [23] | López-Gutiérrez J C, Henry S, Hallet S, et al. Quantification of a novel group of nitrate-reducing bacteria in the environment by real-time PCR[J]. Journal of Microbiological Methods, 2004, 57: 399–407. DOI: 10.1016/j.mimet.2004.02.009 |
| [24] | Henry S, Baudoin E, López-Gutiérrez J C, et al. Quantification of denitrifying bacteria in soils by nirK gene targeted real-time PCR[J]. Journal of Microbiological Methods, 2004, 59: 327–335. DOI: 10.1016/j.mimet.2004.07.002 |
| [25] | Scala D J, Kerkhof L J. Nitrous oxide reductase(nosZ)gene-specific PCR primers for detection of denitrifiers and three nosZ genes from marine sediments[J]. FEMS Microbiology Letters, 1998, 162: 61–68. DOI: 10.1111/fml.1998.162.issue-1 |
| [26] | Fukumoto Y, Suzuki K, Osada T, et al. Reduction of nitrous oxide emission from pig manure composting by addition of nitrite-oxidizing bacteria[J]. Environmental Science and Technology, 2006, 40(21): 6787–6791. DOI: 10.1021/es0611801 |
| [27] | Tran Q N M, Mimoto H, Nakasaki K. Inoculation of lactic acid bacterium accelerates organic matter degradation during composting[J]. International Biodeterioration and Biodegradation, 2015, 104: 377–383. DOI: 10.1016/j.ibiod.2015.07.007 |
| [28] |
沈根祥, 尉良, 钱晓雍, 等. 微生物菌剂对农牧业废弃物堆肥快速腐熟的效果及其经济性评价[J].
农业环境科学学报, 2009, 28(5): 1048–1052.
Shen G X, Wei L, Qian X Y, et al. Effect of microbial inoculation on quick composting of animal manure with crop straws and economic analysis[J]. Journal of Agro-Environmental Science, 2009, 28(5): 1048–1052. (in Chinese with English abstract) |
| [29] | Wang C, Lu H, Dong D, et al. Insight into the effects of biochar on manure composting:evidence supporting the relationship between N2O emission and denitrifying community[J]. Environmental Science and Technology, 2013, 47: 7341–7349. DOI: 10.1021/es305293h |
| [30] |
刘东阳, 王蒙蒙, 马磊, 等. 高效纤维素分解菌的分离筛选及其分解纤维素研究[J].
南京农业大学学报, 2014, 37(6): 49–58.
Liu D Y, Wang M M, Ma L, et al. Isolation of the efficient lignocelluloses degrading microbes and decomposition of cellulose[J]. Journal of Nanjing Agricultural University, 2014, 37(6): 49–58. DOI: 10.7685/j.issn.1000-2030.2014.06.008 (in Chinese with English abstract) |
| [31] |
肖礼, 黄懿梅, 赵俊峰, 等. 外源菌剂对猪粪堆肥质量及四环素类抗生素降解的影响[J].
农业环境科学学报, 2016, 35(1): 172–178.
Xiao L, Huang Y M, Zhao J F, et al. Effects of exogenous microbial agents on pig manure compost quality and tetracycline antibiotic degradation[J]. Journal of Agro-Environment Science, 2016, 35(1): 172–178. DOI: 10.11654/jaes.2016.01.023 (in Chinese with English abstract) |
| [32] |
高云航, 勾长龙, 王雨琼, 等. 低温复合菌剂对牛粪堆肥发酵影响的研究[J].
环境科学学报, 2014, 34(12): 3166–3170.
Gao Y H, Gou C L, Wang Y Q, et al. Effects of the cold-adapted complex microbial agents on cattle manure composting[J]. Acta Scientiae Circumstantiae, 2014, 34(12): 3166–3170. (in Chinese with English abstract) |
| [33] |
刘东海, 李双来, 乔艳, 等. 不同菌剂在鸡粪堆肥中的应用效果[J].
中国土壤与肥料, 2015(2): 111–116.
Liu D H, Li S L, Qiao Y, et al. Effects of inoculating different microorganism agents on composting of chicken manure[J]. Soil and Fertilizer Sciences in China, 2015(2): 111–116. DOI: 10.11838/sfsc.20150220 (in Chinese with English abstract) |
| [34] | Chen R, Wang Y, Wei S, et al. Windrow composting mitigated CH4 emissions:characterization of methanogenic and methanotrophic communities in manure management[J]. FEMS Microbiology Ecology, 2014, 90: 575–586. DOI: 10.1111/fem.2014.90.issue-3 |
| [35] |
倪海娣, 陈志银, 程绍明, 等. 不通通风量下猪粪好氧堆肥中氧气浓度的变化[J].
浙江大学学报(农业与生命科学版), 2005, 31(5): 603–607.
Ni H D, Chen Z Y, Cheng S M, et al. Variation of oxygen concentration in pig manure composting piles under different aeration flowrates[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2005, 31(5): 603–607. (in Chinese with English abstract) |




