文章信息
- 周晨, 韩召军
- ZHOU Chen, HAN Zhaojun
- 灰飞虱水通道蛋白基因克隆及其与杀虫剂代谢的关系
- Aquaporin gene cloning and its possible contribution to insecticide metabolism in Laodelphax striatellus
- 南京农业大学学报, 2017, 40(6): 1014-1022
- Journal of Nanjing Agricultural University, 2017, 40(6): 1014-1022.
- http://dx.doi.org/10.7685/jnau.201703003
-
文章历史
- 收稿日期: 2017-03-02
水通道蛋白(aquaporin, AQP)是细胞膜内嵌蛋白(major intrinsic protein, MIP)超家族的主要成员, 它主要传输水分子, 也能传输甘油、尿素、氨等水溶性小分子化合物, 主要调节生物体内渗透压平衡。水通道蛋白是一个多亚型的蛋白家族, 在昆虫中已鉴定出3种亚家族:萤火虫内嵌蛋白(Pyrocoelia rufa integral protein, PRIP)、果蝇内嵌蛋白(Drosophila integral protein, DRIP)和黑腹果蝇大脑蛋白(D. melanogaster big brain protein, BIB)[1]。不同生物的水通道蛋白的种类不同, 多少不一。已有研究发现果蝇有8种水通道蛋白, 家蚕有6种[2]。目前的功能研究表明, 水通道蛋白在昆虫中主要参与了食物中的水分再吸收, 多余水分的排出, 抗冻、抗寒、抗干燥等生理过程[1]。在原生动物与蠕虫类寄生虫水通道蛋白研究中, 发现其水通道蛋白参与了众多的生理活动, 并且与抗寄生虫药物(含锑药剂、美拉胂醇和喷他脒)的吸收有着直接或间接的关系, 水通道蛋白的表达量决定了药物的吸收量[3], 基因突变导致的功能缺失也对药物吸收造成影响[4]。
目前害虫防治的主要方法是化学防治, 这也是导致抗药性产生的重要原因。害虫抗药性产生机制有多种, 并且常常是几种机制共同作用的结果。害虫抗药性机制主要有行为抗性、生理抗性、代谢抗性3个类型[5]。行为抗性主要指昆虫能够识别并远离杀虫剂从而减少与杀虫剂的接触。生理抗性主要指昆虫体外表皮和体内神经膜对杀虫剂的吸收透过能力降低, 体内靶标位点对杀虫剂的结合能力降低, 体内脂肪体等惰性部位对杀虫剂的贮存作用加强, 排泄功能增强使杀虫剂能快速排出。代谢抗性主要指昆虫体内对杀虫剂的解毒能力增强, 代谢速度加快, 昆虫通过提高体内解毒酶活力以及增强解毒酶与杀虫剂亲和性等方式将杀虫剂快速分解为低毒性、强水溶性的中间产物并排出体外, 从而表现出抗药性[6-7]。
在昆虫抗药性研究中, 代谢抗性和生理抗性中的靶标抗性研究较多, 而生理抗性中的穿透抗性研究较少。目前已有研究发现水通道蛋白在原生动物与蠕虫类寄生虫的抗药性中起重要作用[1], 但在昆虫抗药性中的作用尚未有研究。本文通过克隆获得灰飞虱水通道蛋白的cDNA全长序列, 并进行表达分析和功能验证。研究结果为进一步开展昆虫水通道蛋白功能的研究和灰飞虱对小分子化合物农药抗性机制的研究奠定了基础, 同时对于灰飞虱的抗性检测、治理以及新药开发也具有重要意义。
1 材料与方法 1.1 材料与试剂供试昆虫:供试灰飞虱采自江苏省建湖县的大田水稻植株上。采回的灰飞虱用水稻秧苗于养虫室内饲养, 采用室内筛选获得不同药剂的抗性品系, 其中吡虫啉抗性品系抗性倍数为14.2倍, 毒死蜱抗性品系抗性倍数为158.5倍, 乙虫腈抗性品系抗性倍数为1 000倍以上, 并通过单家系分离获得敏感品系。室内饲养温度为26 ℃, 相对湿度70%, 光周期(光/暗)为16 h/8 h。
供试药剂:97%毒死蜱原粉(湖北先隆化工有限公司); 97%吡虫啉原粉(南京红太阳股份有限公司); 94%乙虫腈原粉(拜耳作物科学有限公司); 杀虫双分析标准品和灭多威分析标准品(阿拉丁试剂有限公司)。测序及引物合成由南京金斯瑞生物科技有限公司完成。
1.2 灰飞虱总RNA提取和PCR模板合成总RNA按Trizol提取试剂盒(Invitrogen, USA)说明书提取。AQP片段克隆所需模板按反转录试剂盒(TaKaRa, Japan)说明书合成。AQP全长克隆所需5′和3′ RACE模板按Clontech SMARTer试剂盒(TaKaRa, Japan)说明书合成。
1.3 引物设计和灰飞虱AQP基因片段的获得利用生物信息学方法对已测得的灰飞虱转录组数据进行BLAST搜索, 获取可能的灰飞虱AQP基因序列, 并利用Primer Premier 5.0设计引物(表 1), 对搜索获得的序列片段进行PCR克隆验证。具体采用25 μL的PCR反应体系和降落PCR技术进行, 试验条件设置和产物回收参照本实验室乙酰胆碱受体基因的研究报道[8]。
| 基因 Genes |
正向引物或RACE特异性引物 Primer forward or gene specific primer for RACE |
反向引物或RACE巢氏第2轮特异性引物 Primer reverse or nested gene specific primer for RACE |
| 片段验证引物Primers used for fragments | ||
| LsAQP1 | AACTTCGCCACATTTCCAC | GCAACACCGTCATCATTCTT |
| LsAQP2 | GGAGGCTGGCATCACATT | GTGAGAACAGCAGGTCCAAA |
| LsAQP3 | TGACAACGGAGCTATCTCGT | TCTACTTGCCATTGGTGGG |
| LsAQP4 | GCTCCGAAATGAGTCTGAAA | AAATGGTTCCTACCGCTGA |
| LsAQP5 | GGACATGGACGTGGACAAG | GCAGTTTCGCTGAACTTGG |
| LsAQP6 | CGAAAGCCATCCAGTCTCC | AGCCCAATACACCCAGAGG |
| 5′-RACE引物Primers used in 5′-RACE | ||
| LsAQP1 | CATGATGGCGAGTCCGAATGAGA | CGACAGGCAGCCGAAGAAGTTGA |
| LsAQP2 | CGAACCAAGGTTTCCTCGCACTG | CCACTGCACCAATACACTGGACGAT |
| LsAQP3 | CCAGGCACTGTCACTCCGTAGAGTAGA | CGAACATCAGTCCACGCAGCAGA |
| LsAQP4 | AAGCGACGACCAAGCCAAATCC | GCAAGCCGTGCCCACCGTCTCA |
| LsAQP5 | CCAATGCTATTACACTGGCACCGA | GCCTTCGCCTATGCTGCCTTCC |
| LsAQP6 | GCTGGGTTCAAGCTACAGCCTGTTAT | GCTGGTGAATATCGCTTCAACAGC |
| 3′-RACE引物Primers used in 3′-RACE | ||
| LsAQP1 | GTGAGTACAGCCCCGTTCAGGTCG | TGATGACGGTGTTGCCTGATTGC |
| LsAQP2 | GCATGAACCCTGCACGAACTTTTG | GGGCGAATCACTGGATCTACTGGG |
| LsAQP3 | GCTGGAGGACTGACACCCGCATCT | AACCCGTACTGCCCAAGCCTAGC |
| LsAQP4 | CCCGTACACTGGAGCCAGTATGAA | GCAAGCCGTGCCCACCGTCTCA |
| LsAQP5 | TTCGGCACGGCCATGTTCGTTG | GCACCCGCCAACAATGCACTTC |
| LsAQP6 | CGCCCGGAGTGCATCCTTTGAA | TGTAGCTCCTTCGACCACAGAAATGC |
| End to end引物Primers used in end to end | ||
| LsAQP1 | ATGGTGGGTGGCGGTGTGAA | TCAGGCAACACCGTCATCAT |
| LsAQP2 | ATGGGTGCCAAACAGATAAT | TTAGAAATCATAGGAGCTAG |
| LsAQP3 | ATGACAACGGAGCTATCTCG | TTAGATTAAATCCAATTTGC |
| LsAQP4 | ATGAGTCTGAAAGTGTCAGT | TCATGTCGGTCTAAGTGGCA |
| LsAQP5 | ATGTTTGTGATGCCTCCGTC | CTAAGCTTCAGCAGTTTCGC |
| LsAQP6 | ATGTCTTTTGGAAAATACTG | TCATTCTCCAGCTTTCGCGT |
| 定量PCR引物Primers used in qRT-PCR | ||
| LsAQP1 | CTGGTTCTGGTTGTGTTTGG | TCCCAGAGCAACAGTCAGTC |
| LsAQP2 | GACTGGCCATCACTACATGC | GTGAGAACAGCAGGTCCAAA |
| LsAQP3 | ACACCAGGAGATCGAAGGAC | TTGGCTTCTCCAATTCATCA |
| LsAQP4 | GGTCGTCGCTTCTGTTGTTA | GCACACAGTGTTACCGAAGG |
| LsAQP5 | GTATGAATCCAGCCCGAAGT | CGATGAAAGAGACCAGCAAA |
| LsAQP6 | TCGACCACAGAAATGCAAAT | TCCCAAACAATAATGCTGGA |
| β-actin | TCCGAGACATCAAGGTGAAACTG | TGCTTCCATACCCAAGAAAGACG |
cDNA全长克隆采用25 μL的PCR反应体系和巢氏PCR技术进行RACE扩增, 然后进行产物回收、测序和end to end验证, 具体条件同文献[8]。
1.5 灰飞虱AQP基因进化分析利用BLAST搜索获得灰飞虱AQP的同源基因序列。将灰飞虱AQP各氨基酸序列及搜索得到的同源基因的氨基酸序列进行比对分析, 并通过MEGA 5.0软件构建系统发育树(Neighbor joining法, 1 000次重复检验)。
1.6 灰飞虱6个AQP基因的表达水平分析以灰飞虱3种抗性和敏感品系雌成虫的cDNA为模板, 利用定量PCR技术测定AQP基因在灰飞虱4种抗、感品系中的相对表达水平。定量PCR试验条件同文献[9]。采用2-ΔΔCT方法, 以持家基因β-actin作为内参基因进行相对定量[10]。
1.7 数据统计方法采用单因素方差分析和Tukey显著性检验来比较灰飞虱AQP mRNA相对表达量。统计分析软件为SPSS 17.0。
1.8 灰飞虱吡虫啉抗性品系中AQP基因的突变位点检测对吡虫啉抗性品系灰飞虱雌成虫用LD80剂量药剂进行处理, 出现中毒反应后, 取10头中毒症状不明显的成虫提取总RNA。对吡虫啉敏感品系雌成虫用LD20剂量药剂进行处理, 注意观察, 取10头中毒快且严重的成虫提取总RNA。将总RNA反转录成cDNA模板。利用end to end引物对AQP基因进行编码区全长克隆。每个基因在抗、感品系中分别挑取10个阳性克隆进行测序, 对比检测可能的突变位点。全长基因的克隆方法同1.3节, 引物见表 1。
1.9 LsAQP1、LsAQP6在爪蟾卵母细胞中的表达和功能分析 1.9.1 非洲爪蟾卵母细胞的获得从成熟雌性爪蟾卵巢中取得卵叶组织, 进行剥膜处理并挑出发育良好的卵母细胞[11]。
1.9.2 质粒的构建以及体外cRNA合成将端部含有EcoRⅠ和XbaⅠ酶切位点的AQP编码区序列连接到PGH19载体上, 纯化后按体外转录试剂盒(Ambion, USA)说明书合成cRNA。
1.9.3 卵母细胞显微注射将处理好的卵母细胞放入装有培养液(200 mmol·L-1)的培养皿中, 用显微镜调整针的位置和角度, 刺入动物极和植物极的交界处(黑白交界处), 注入46 ng RNA或等体积的无菌水。将注射后的卵母细胞置于18 ℃的恒温培养箱中, 培养3 d备用。
1.9.4 水吸收能力检测将注射后培养备用的卵母细胞转移至18 ℃、60 mmol·L-1的营养液中, 通过显微照相记录不同时间点细胞体积的变化。每30 s拍摄1次照片, 持续4 min。利用水导度公式[12-13]计算水导度:Pf=V0[d(V/V0)/dt]/[SVw(Osmin-Osmout)]。其中:Pf为水导度或吸水膨胀系数, 单位为μm·s-1; V为不同时间点的细胞体积; V0为初始细胞体积; Vw为水的偏摩尔体积; S为细胞表面积; Osmout为细胞外渗透压; Osmin为细胞内渗透压。
1.9.5 物质吸收能力检测将注射后培养备用的卵母细胞转移至18 ℃的营养液中, 营养液中的NaCl(96 mmol·L-1)由测试物质(杀虫双64 mmol·L-1或灭多威200 mmol·L-1)替代, 渗透压保持不变[12-13]。在这个试验中, 物质的吸收会形成一个向内的渗透压梯度从而导致水分的吸收和细胞的膨胀。通过显微照相来记录细胞变化。每30 s拍摄1次照片, 持续4 min。物质吸收能力通过细胞体积的膨胀速率[d(V/V0)/dt]来表示[12-13]。
2 结果与分析 2.1 灰飞虱AQP基因的克隆及序列分析根据灰飞虱转录组数据分析得到的AQP基因片段, 设计特异性引物进行克隆验证, 并通过RACE技术扩增和end to end验证, 获得了6个基因全长序列, 分别命名为LsAQP1、LsAQP2、LsAQP3、LsAQP4、LsAQP5和LsAQP6。其中LsAQP1编码341个氨基酸, 相对分子质量为35.4×103; LsAQP2编码248个氨基酸, 相对分子质量为26.3×103; LsAQP3编码346个氨基酸, 相对分子质量为37.1×103; LsAQP4编码247个氨基酸, 相对分子质量为25.9×103; LsAQP5编码274个氨基酸, 相对分子质量为29.2×103; LsAQP6编码273个氨基酸, 相对分子质量为29.3×103。BLAST分析发现所克隆的基因与其他昆虫的AQP基因氨基酸序列相似性最高, 而且都具有6个跨膜区、NPA三联体位点和Ar/R残基(aromatic/arginine)等功能保守区[14-16], 表明克隆得到的是灰飞虱AQP基因。结果见图 1。

|
图 1 灰飞虱水通道蛋白基因氨基酸序列的比对 Figure 1 Alignment of the deduced amino acid sequences of the aquaporin genes cloned from Laodelphax striatellus 下划线指示跨膜区; 灰色背景表示NPA保守位点; 加粗字体表示Ar/R残基, 对应于人体水通道蛋白基因AQP1的Phe56、His180、Cys189和Arg195。Trans-membrane domains are underlined, NPA motifs are shown with grey highlight and residues that correspond to the Ar/R constriction site(Phe56, His180, Cys189, and Arg195 from Homo sapiens AQP1, EAL24446.1)are shown in bold. |
将灰飞虱AQP基因氨基酸序列和之前已经验证过的其他22种昆虫的78个AQP基因一起进行进化分析。结果(图 2)显示:昆虫AQP至少存在4个亚家族, 包括萤火虫内嵌蛋白(PRIP)、黑腹果蝇大脑蛋白(BIB)、果蝇内嵌蛋白(DRIP)和第4个未能分类的亚家族。LsAQP1属于PRIP亚家族, LsAQP2属于DRIP亚家族, LsAQP3属于BIB亚家族, LsAQP4、LsAQP5、LsAQP6属于未能分类的亚家族[14-16]。
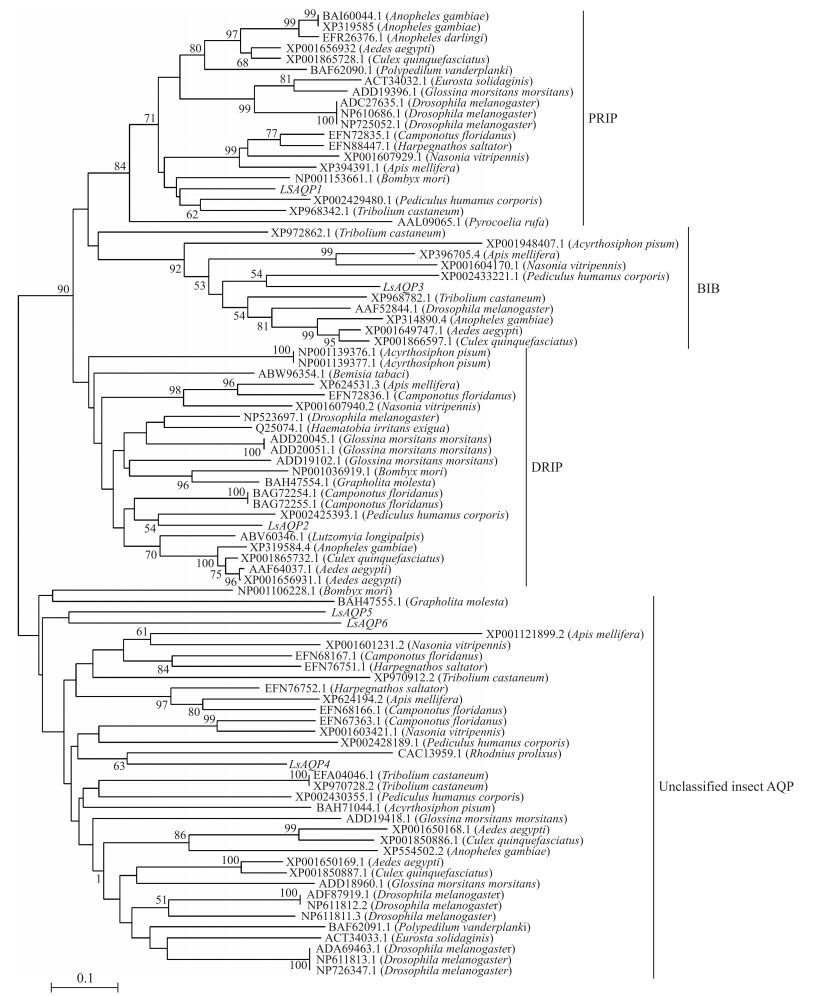
|
图 2 灰飞虱和其他昆虫AQP基因的系统发育树 Figure 2 Phylogenetic tree of aquaporin genes from L. striatellus and other insects |
定量PCR检测发现, LsAQP1、LsAQP2、LsAQP3、LsAQP4和LsAQP5在抗性和敏感品系中的表达量无显著差异。但LsAQP6在抗吡虫啉、毒死蜱和乙虫腈的3种抗性品系中均高表达, 且与敏感品系表达量差异显著, 其中在吡虫啉抗性品系中的相对表达水平最高(图 3)。由此可见, LsAQP6与灰飞虱抗性相关, 可能在抗性形成中起到一定作用。
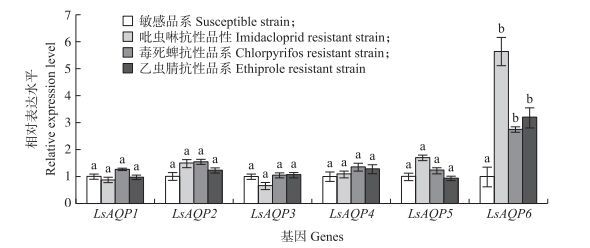
|
图 3 灰飞虱6个AQP基因在4种抗、感品系中的相对表达量(n=3) Figure 3 The relative expression levels of six AQP genes in adults of the susceptible strain and three resistant strains of L. striatellus 字母不同代表差异显著(P<0.05)。下同。Different letters indicate significant difference at 0.05 level. The same as follows. |
选择表达差异较大的吡虫啉抗、感品系, 对克隆得到的AQP基因序列进行比对分析, 发现LsAQP1、LsAQP2、LsAQP3、LsAQP4、LsAQP5和LsAQP6基因虽然存在一些多态性位点(表 2), 但来自抗、感品系的序列之间没有固定的差异, 说明这些基因均没有抗药性相关的突变位点。
| LsAQP1 | LsAQP2 | LsAQP3 | LsAQP4 | LsAQP5 | LsAQP6 | |||||||||||||||||
| 位点 Site |
频率 Frequency |
位点 Site |
频率 Frequency |
位点 Site |
频率 Frequency |
位点 Site |
频率 Frequency |
位点 Site |
频率 Frequency |
位点 Site |
频率 Frequency |
|||||||||||
| R | S | R | S | R | S | R | S | R | S | R | S | |||||||||||
| G132A | 3 | 2 | A114C | 1 | 4 | A84T | 8 | 0 | A84C | 5 | 0 | T108C | 2 | 3 | T123C | 4 | 3 | |||||
| C138T | 6 | 3 | C132T | 2 | 6 | G223T | 8 | 0 | G120T | 5 | 0 | C333A | 6 | 2 | C150T | 2 | 3 | |||||
| G180C | 6 | 3 | A154G | 1 | 7 | C225T | 8 | 0 | C214T | 5 | 0 | G372A | 6 | 2 | C183A | 4 | 3 | |||||
| A348G | 6 | 1 | C231T | 0 | 5 | C268T | 0 | 6 | G256A | 1 | 5 | G458C | 6 | 2 | G222A | 3 | 4 | |||||
| T399C | 3 | 3 | T255C | 5 | 0 | T370A | 2 | 6 | T268C | 6 | 1 | G546A | 4 | 1 | A336T | 4 | 3 | |||||
| A513T | 6 | 2 | C309T | 0 | 5 | T418G | 1 | 6 | C382G | 6 | 0 | T585A | 4 | 1 | A510G | 2 | 3 | |||||
| A648G | 5 | 2 | T315C | 2 | 5 | C473T | 2 | 8 | T442C | 6 | 0 | C744T | 4 | 1 | C735T | 2 | 3 | |||||
| T819C | 5 | 2 | C357T | 5 | 0 | T496G | 0 | 9 | T450C | 1 | 6 | G738A | 2 | 3 | ||||||||
| G873T | 3 | 2 | T516C | 4 | 3 | A508G | 1 | 7 | T453C | 5 | 0 | |||||||||||
| G1005A | 3 | 2 | A519C | 4 | 3 | A679G | 0 | 7 | T477C | 5 | 2 | |||||||||||
| T522A | 4 | 3 | C685T | 2 | 6 | |||||||||||||||||
| A791C | 0 | 8 | ||||||||||||||||||||
| C805G | 9 | 0 | ||||||||||||||||||||
| C847T | 8 | 0 | ||||||||||||||||||||
| 注:R表示抗性品系R means resistance strain; S表示敏感品系S means susceptible strain. | ||||||||||||||||||||||
为了分析在抗性品系中高表达基因LsAQP6在灰飞虱体内的功能, 本研究将该基因注射入非洲爪蟾卵母细胞中表达, 并以未进行注射转化处理的, 以及注射水和无差异表达基因LsAQP1进行转化处理的卵母细胞为对照, 进行了水、甘油和农药的转运试验。鉴于多数杀虫剂的分子质量大, 水溶性差, 本研究仅选用了灭多威和杀虫双作为代表。结果(图 4)发现:LsAQP6对水具有较高的转运能力, 对灭多威也具有显著的转运能力, 但对甘油和杀虫双则没有表现出显著的转运能力。而在抗、感品系没有表达差异的LsAQP1, 对测定的4种物质均没有表现出明显的转运能力。
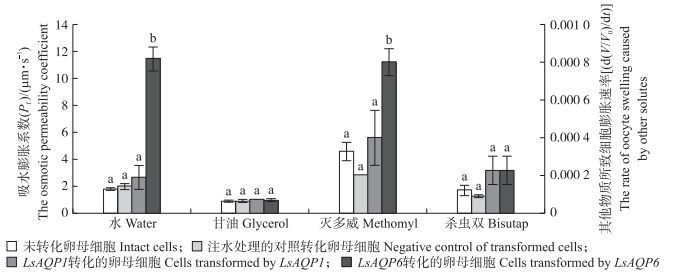
|
图 4 非洲爪蟾卵母细胞中表达LsAQP1和LsAQP6对水、甘油、灭多威、杀虫双的转运能力(n=4) Figure 4 Transport capabilities of LsAQP1 and LsAQP6 expressed in Xenopus laevis oocytes for water, glycerol, methomyl and bisutap |
近年来, 脊椎动物和植物水通道蛋白已经被广泛研究, 主要涉及它们的结构, 底物特异性, 调节代谢和作为各种疾病潜在药物靶标的作用等[17-21]。与这些较为丰富的研究相比, 关于昆虫水通道蛋白的研究相对较少。目前来自各种基因组数据的分析表明, 不同昆虫物种中的AQP基因数目在6到10之间变化[22-23]。有关昆虫AQP的研究已经显示出其对于水平衡调节、抗干性和一般渗透调节具有重要作用[24-28]。在原生动物与蠕虫类寄生虫的研究中发现, AQP对其抗药性起重要作用[2, 29]。而AQP对于昆虫抗药性是否起作用则未见相关报道。本文在分析已获得转录组数据的基础上, 通过PCR验证获得了灰飞虱不同AQP基因片段序列, 同时利用RACE技术进一步克隆获得了6个AQP cDNA全长序列, 分别命名为LsAQP1、LsAQP2、LsAQP3、LsAQP4、LsAQP5和LsAQP6。通过与GenBank上已知的同源基因序列进行比对分析, 发现它们都具有AQP基因典型的结构特征:NPA保守位点和6个典型的跨膜区域, 除LsAQP3缺失1个外, 所有其他基因也都具有4个Ar/R残基[1]。进化树分析也进一步证明它们与已报道的昆虫AQP的亲缘关系密切, 也分属于4个亚家族, 其中LsAQP1属于PRIP亚家族, LsAQP2属于DRIP亚家族, LsAQP3属于BIB亚家族, LsAQP4、LsAQP5、LsAQP6属于未能分类的亚家族。这些结果表明, 这6个基因是灰飞虱的AQP基因, 但由于序列差异, 尤其是LsAQP3缺失1个Ar/R残基, 其功能或功能变异尚需进一步研究证实。
为了揭示AQP在灰飞虱抗药性中的作用, 本研究比对分析了灰飞虱对吡虫啉的抗性品系与敏感品系6个AQP基因的序列多态性, 但没有发现抗性相关突变位点, 表明AQP基因不是通过突变导致功能变化引起抗药性。而利用定量PCR检测不同AQP基因在灰飞虱不同抗、感品系中的表达水平, 结果发现LsAQP6基因在灰飞虱3种抗性品系中均高表达, 且与敏感品系相比差异显著, 但LsAQP1、LsAQP2、LsAQP3、LsAQP4和LsAQP5在抗、感品系中则没有显著差异, 表明灰飞虱可能通过LsAQP6的高表达提高解毒代谢能力并产生抗药性。
进一步对LsAQP6的物质转运能力分析证实, 与抗药性相关的LsAQP6对水分具有很高的转运能力, 对于灭多威也具有显著的转运能力, 但对甘油和杀虫双的转运能力不显著, 这表明LsAQP6具有明显的底物选择性, 在昆虫体内对水和某些小分子农药具有显著的转运作用。因此, 抗性品系中LsAQP6的表达量升高, 可能通过快速转运农药或农药代谢中间体, 从而加速非靶标组织细胞对农药的降解作用, 提高虫体对药剂的耐受能力。值得注意的是, 同样表达测定LsAQP1却没有发现其物质转运活性, 可能是因为其底物专一性, 对测定的4种物质没有转运能力。已有研究表明, 不同AQP具有不同的转运底物谱[17-18]。另一方面, 也可能是该基因功能蛋白的表达需要特定的修饰或辅助因子, 这在蛋白基因功能表达中经常出现。但所有推测均需进一步研究确定。此外, 利用蛙卵表达系统进行物质转运能力测试, 检测蛋白表达水平较为困难, 本研究参照Li等[30]的方法直接分析基因的功能。但直接分析表达基因的功能会因为未表达而出现假阴性, 所以对于阴性结果, 尤其是可以电离的杀虫双, 尚需要利用不同系统进行进一步验证。
综上所述, 本研究根据转录组数据克隆获得了灰飞虱6个全长AQP基因, 通过检测不同基因在抗、感品系中的多态性位点和表达量以及差异表达基因对4种物质的转运试验, 证实其中LsAQP6基因不仅在抗性灰飞虱中高表达, 而且具有转运水分和一些小分子农药的功能。本研究结果为继续开展昆虫AQP基因功能和抗药性的相关研究提供了重要依据。
| [1] | Campbell E M, Ball A, Hoppler S, et al. Invertebrate aquaporins:a review[J]. J Comp Physiol B, 2008, 178(8): 935–955. DOI: 10.1007/s00360-008-0288-2 |
| [2] |
刘海远, 舒本水, 姜春来, 等. 斜纹夜蛾水通道蛋白1(AQP1)基因的克隆、分子特性和表达分析[J].
昆虫学报, 2013, 56(4): 339–349.
Liu H Y, Shu B S, Jiang C L, et al. Molecular cloning, characterization and expression analysis of aquaporin 1(AQP1)gene in Spodoptera litura(Lepidoptera:Noctuidae)[J]. Acta Entomologica Sinica, 2013, 56(4): 339–349. (in Chinese with English abstract) |
| [3] | Song J, Mak E, Wu B, et al. Parasite aquaporins:current developments in drug facilitation and resistance[J]. Biochim Biophys Acta, 2014, 1840(5): 1566–1573. DOI: 10.1016/j.bbagen.2013.10.014 |
| [4] | Graf F E, Ludin P, Wenzler T, et al. Aquaporin 2 mutations in Trypanosoma brucei gambiense field isolates correlate with decreased susceptibility to pentamidine and melarsoprol[J]. PLoS Negl Trop Dis, 2013, 7(10). |
| [5] |
胡兴强. 家蝇抗药性机理研究综述[J].
安徽预防医学杂志, 2003, 9(5): 336–339.
Hu X Q. A review of studies on resistance mechanism of musca domestica[J]. Anhui Journal of Preventive Medicine, 2003, 9(5): 336–339. (in Chinese with English abstract) |
| [6] |
胡小邦, 朱昌亮. 昆虫抗药性机制研究进展[J].
国外医学:寄生虫病分册, 2004, 31(1): 18–23.
Hu X B, Zhu C L. Advances in insect resistance mechanism[J]. Foreign Med Sci:Parasit Dis, 2004, 31(1): 18–23. (in Chinese with English abstract) |
| [7] |
曲明静, 许新军, 韩召军, 等. 昆虫乙酰胆碱酯酶基因变异抗药性机制研究[J].
昆虫知识, 2007, 44(2): 191–194.
Qu M J, Xu X J, Han Z J, et al. Advances in studies of acetylcholinesterase gene variation assoiated with insect resistance[J]. Chinese Bulletin of Entomology, 2007, 44(2): 191–194. DOI: 10.7679/j.issn.2095-1353.2007.040 (in Chinese with English abstract) |
| [8] |
李晨歌, 琚阳, 韩召军, 等. 马铃薯甲虫3个烟碱型乙酰胆碱受体α亚基基因的克隆及表达分析[J].
南京农业大学学报, 2014, 37(3): 65–71.
Li C G, Ju Y, Han Z J, et al. Cloning and expression analysis of three genes encoding nicotinic acetylcholine receptor α subunit in Leptinotarsa decemlineata[J]. Journal of Nanjing Agricultural University, 2014, 37(3): 65–71. DOI: 10.7685/j.issn.1000-2030.2014.03.009 (in Chinese with English abstract) |
| [9] |
王芮, 符蓉, 杨倩文, 等. 抗药性灰飞虱稳定内参基因的筛选[J].
南京农业大学学报, 2016, 39(5): 763–770.
Wang R, Fu R, Yang Q W, et al. Identification of reference genes in resistant small brown plant hopper, Laodelphax striatellus[J]. Journal of Nanjing Agricultural University, 2016, 39(5): 763–770. DOI: 10.7685/jnau.201511031 (in Chinese with English abstract) |
| [10] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [11] |
李仁. 番茄水通道蛋白在干旱胁迫及果实成熟过程中的功能分析[D]. 北京: 中国农业大学, 2015.
Li R. Characterization of aquaporin genes in tomato during drought stress and fruit development process[D]. Beijing:China Agricultural University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10019-1015584306.htm |
| [12] | Wallace I S, Roberts D M. Distinct transport selectivity of two structural subclasses of the nodulin-like intrinsic protein family of plant aquaglyceroporin channels[J]. Biochemistry, 2005, 44: 16826–16834. DOI: 10.1021/bi0511888 |
| [13] | Wallace I S, Shakesby A J, Hwang J H, et al. Acyrthosiphon pisum AQP2:a multifunctional insect aquaglyceroporin[J]. Biochim Biophys Acta, 2012, 1818(3): 627–635. DOI: 10.1016/j.bbamem.2011.11.032 |
| [14] | Staniscuaski F, Paluzzi J P, Real-Guerra R, et al. Expression analysis and molecular characterization of aquaporins in Rhodnius prolixus[J]. J Insect Physiol, 2013, 59(11): 1140–1150. DOI: 10.1016/j.jinsphys.2013.08.013 |
| [15] | van Ekert E, Chauvigné F, Finn R N, et al. Molecular and functional characterization of Bemisia tabaci aquaporins reveals the water channel diversity of hemipteran insects[J]. Insect Biochem Mol Biol, 2016, 77: 39–51. DOI: 10.1016/j.ibmb.2016.07.010 |
| [16] |
王勋. 水稻二化螟CsAQP1基因的克隆与表达[D]. 扬州: 扬州大学, 2011.
Wang X. Cloning and experession of CSAQP1 genes in rice stem borer, Chilo suppressalis Walker(Lepidoptera:Pyralidae)[D]. Yangzhou:Yangzhou University, 2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-11117-1013181001.htm |
| [17] | Verkman A S. Aquaporins in clinical medicine[J]. Annu Rev Med, 2012, 63: 303–316. DOI: 10.1146/annurev-med-043010-193843 |
| [18] | Verkman A S, Anderson M O, Papadopoulos M C. Aquaporins:important but elusive drug targets[J]. Nat Rev Drug Discov, 2014, 13(4): 259–277. DOI: 10.1038/nrd4226 |
| [19] | Li G, Santoni V, Maurel C. Plant aquaporins:roles in plant physiology[J]. Biochim Biophys Acta, 2014, 1840(5): 1574–1582. DOI: 10.1016/j.bbagen.2013.11.004 |
| [20] | Tornroth-Horsefield S, Hedfalk K, Fischer G, et al. Structural insights into eukaryotic aquaporin regulation[J]. FEBS Lett, 2010, 584(12): 2580–2588. DOI: 10.1016/j.febslet.2010.04.037 |
| [21] | Agre P, King L S, Yasui M, et al. Aquaporin water channels-from atomic structure to clinical medicine[J]. The Journal of Physiology, 2002, 542(1): 3–16. DOI: 10.1113/jphysiol.2002.020818 |
| [22] | Benoit J B, Hansen I A, Attardo G M, et al. Aquaporins are critical for provision of water during lactation and intrauterine progeny hydration to maintain tsetse fly reproductive success[J]. PLoS Negl Trop Dis, 2014, 8(4): e2517. DOI: 10.1371/journal.pntd.0002517 |
| [23] | Drake L L, Boudko D Y, Marinotti O, et al. The aquaporin gene family of the yellow fever mosquito, Aedes aegypti[J]. PLoS ONE, 2010, 5(12): e15578. DOI: 10.1371/journal.pone.0015578 |
| [24] | Liu K, Tsujimoto H, Cha S J, et al. Aquaporin water channel AgAQP1 in the malaria vector mosquito Anopheles gambiae during blood feeding and humidity adaptation[J]. Proc Natl Acad Sci USA, 2011, 108(15): 6062–6066. DOI: 10.1073/pnas.1102629108 |
| [25] | Pietrantonio P V, Jagge C, Keeley L L, et al. Cloning of an aquaporin-like cDNA and in situ hybridization in adults of the mosquito Aedes aegypti(Diptera:Culicidae)[J]. Insect Mol Biol, 2000, 9(4): 407–418. DOI: 10.1046/j.1365-2583.2000.00201.x |
| [26] | Duchesne L, Hubert J F, Verbavatz J M, et al. Mosquito(Aedes aegypti)aquaporin, present in tracheolar cells, transports water, not glycerol, and forms orthogonal arrays in Xenopus oocyte membranes[J]. Eur J Biochem, 2003, 270(3): 422–429. DOI: 10.1046/j.1432-1033.2003.03389.x |
| [27] | Cohen E. Roles of aquaporins in osmoregulation, desiccation and cold hardiness in insects[J]. Entomology, Ornithology and Herpetology, 2012, S1: 001. |
| [28] | Drake L L, Rodriguez S D, Hansen I A. Functional characterization of aquaporins and aquaglyceroporins of the yellow fever mosquito, Aedes aegypti[J]. Sci Rep, 2015, 5: 7795. DOI: 10.1038/srep07795 |
| [29] | Baker N, Glover L, Munday J C, et al. Aquaglyceroporin 2 controls susceptibility to melarsoprol and pentamidine in African trypanosomes[J]. Proc Natl Acad Sci USA, 2012, 109(27): 10996–11001. DOI: 10.1073/pnas.1202885109 |
| [30] | Li R, Wang J, Li S, et al. Plasma membrane intrinsic proteins SlPIP2;1, SlPIP2;7 and SlPIP2;5 conferring enhanced drought stress tolerance in tomato[J]. Sci Rep, 2016, 6: 31814. DOI: 10.1038/srep31814 |




