文章信息
- 孙荣华, 李融梅, 何翔, 宋从凤
- SUN Ronghua, LI Rongmei, HE Xiang, SONG Congfeng
- 水稻白叶枯病菌毒力基因tal17.5病理学功能的研究
- Functional characterization of tal17.5 gene from Xanthomonas oryzae pv. oryzae strain JXOV
- 南京农业大学学报, 2017, 40(6): 1007-1013
- Journal of Nanjing Agricultural University, 2017, 40(6): 1007-1013.
- http://dx.doi.org/10.7685/jnau.201703008
-
文章历史
- 收稿日期: 2017-03-06
稻黄单胞菌水稻致病变种(Xanthomonas oryzae pv.oryzae, Xoo)引起的水稻白叶枯病是水稻上发现最早的细菌性病害。研究表明水稻白叶枯病菌主要依赖于由Ⅲ型泌出系统(type Ⅲ secretion system, T3SS)泌出的效应蛋白发挥毒力作用[1]。类转录激活蛋白(transcription activator-like effectors, TALE)是一类重要的T3SS效应蛋白, 由tal基因编码, 能特异性地结合在寄主DNA碱基序列, 即EBE(effector binding element)元件上, 来激活下游感病S(susceptibility)基因或抗病R(resistance)基因的转录表达, 从而导致寄主表现感病或抗病表型[2-3]。
根据TALE在Xoo入侵寄主时发挥的毒力作用将其划分为3种类型, 分别为主效毒力因子、温和毒力因子与无毒力因子[4]。TALE发挥主效毒力作用时决定了病原菌在寄主上的致病性, 比如Xoo菌株PXO99A中作为主效毒力因子的PthXo1能特异性地诱导水稻上感病基因OsSWEET11的表达, 在水稻品种‘IR24’上表现强致病力; 当主效毒力因子PthXo1的编码基因pthXo1缺失时, 该突变体菌株ME2在‘IR24’上丧失了致病性, 互作关系由亲和变为不亲和[5]; TALE发挥无毒作用时引起水稻的抗病反应, 如AvrXa27为无毒效应蛋白, 进入寄主水稻后会诱导水稻上抗病基因Xa27的表达, 引起水稻的抗病反应[6-7]; 另外与水稻互作的tal基因家族在基因组中大多呈冗余状态, 在互作过程中某个或某些tal基因对寄主的贡献会被掩盖, 致使某些TALE的功能表现为温和作用。朱引引等[8]从中国弱毒力菌株OS198中克隆了talR26.5基因, 将talR26.5导入PXO99A后能够在部分水稻品种上减弱PXO99A的毒力, 但并没有完全抑制PXO99A的毒力至OS198的水平, 这表明talR26.5基因在PXO99A中贡献了部分弱毒力, talR26.5基因的作用比较温和。目前研究表明Xoo菌株中编码毒力因子的tal基因有pthXo1(PXO99A)、pthXo2(JXOI)、pthXo3(PXO61)、pthXo6(PXO99A)、pthXo7(PXO99A)[1, 5, 9-10], 无毒功能的tal基因有avrXa7(PXO86)、avrXa10(PXO86)、avrXa23(PXO99A)和avrXa27(PXO99A)[6-7, 11-14], 其中avrXa7同时也具有毒力因子的功能[11], 所以是一个具有毒力和无毒力双重功能的基因。
JXOV是稻黄单胞菌水稻致病变种Xoo日本5号小种菌株, 前期本实验室通过菌落原位杂交, 从JXOV的基因文库(黏粒pHMⅠ为载体构建)筛选得到29个阳性克隆。根据这29个阳性克隆的BamHⅠ酶切后的Southern杂交图谱, 发现基于EcoRⅠ片段构建的JXOV基因文库克隆大多由2~6个直接或间接串联的avrXa3同源片段组成, 其中JXOV中tal基因数目约为20个。目前对于JXOV菌株的致病性分子遗传机制研究还较少, 了解JXOV基因文库中基因的具体功能, 挖掘新的tal基因, 研究tal基因与寄主水稻互作时的分子遗传机制, 有利于增加我们在分子水平上对水稻白叶枯病菌的认知, 为水稻白叶枯病害的防治提供理论基础和技术支持, 对揭示水稻白叶枯病菌的致病机制具有重要意义。本研究报道了JXOV菌株中的1个tal17.5基因的克隆及其病理学功能。
1 材料与方法 1.1 供试水稻品种本研究中用于毒力测试的水稻品种共有22个, 它们都至少含有1个水稻白叶枯病菌的抗性基因。这些品种和所含的抗病基因分别是‘IRBB1’(Xa1)、‘IRBB2’(Xa2)、‘IRBB3’(Xa3)、‘IRBB4’(Xa4)、‘IRBB5’(Xa5)、‘IRBB7’(Xa7)、‘IRBB8’(Xa8)、‘IRBB10’(Xa10)、‘IRBB11’(Xa11)、‘IRBB13’(Xa13)、‘IRBB14’(Xa14)、‘IR24’(Xa18)、‘IRBB50’(Xa4+xa5)、‘IRBB51’(Xa4)、‘IRBB52’(Xa4)、‘IRBB203’(Xa3)、‘IRBB204’(Xa4)、‘IRBB205’(Xa5)、‘IRBB208’(Xa8)、‘IRBB210’(Xa10)、‘IRBB211’(Xa11)、‘IRBB214’(Xa14)。
1.2 供试菌株与抗生素本研究中所涉及的供试菌株为菲律宾系统的6号小种代表菌株PXO99A, ME2为PXO99A中缺失了pthXo1基因的突变体。抗生素的终质量浓度:壮观霉素(Sp)为25 μg·mL-1, 氨苄青霉素(Ap)为100 μg·mL-1, 卡那霉素(Km)为50 μg·mL-1。
1.3 tal基因的电转化将2 μL目的质粒与100 μL的感受态菌液在冰上混匀30 min后转入电击杯中, 将电击杯放入电机槽中电击; 向电击杯中加入液体培养基, 28 ℃培养2 h后涂布在含有相应抗生素的平板上培养得到重组菌。
1.4 在水稻上的致病力测定接种用菌悬液D600为0.5。采用剪叶接种法接种1个月大小的水稻苗, 每株水稻选取心叶下方的2张完全展开叶片进行接种, 每个菌株在相同的水稻品种上接种6株水稻。接种15 d后测量病斑长度。采用注射法接种15 d左右的水稻苗, 每个菌株注射6张叶片, 注射5 d后取接种的叶片组织研磨后测定叶片中的菌量。每处理取3张叶片, 用酒精棉球表面消毒后, 将叶片剪碎, 置于3 mL灭菌水中研磨, 含菌组织液经10倍系列稀释后取10 μL涂布在含相应抗生素的NA平板上, 28 ℃培养3~5 d后计数菌落形成单位(CFU)[15]。每处理设置3个重复, 试验重复3次。数据采用SPSS 19.0软件在0.05水平上进行差异显著性检验。
1.5 胼胝质沉积烟草叶片注射接种12 h后, 切取接种部位1 cm×1 cm叶片放入12孔组织培养板中; 加入2 mL 95%的乙醇在37 ℃漂洗至无色; 70%的乙醇洗2次后再经过3次ddH2O洗涤; 用1%苯胺溶液(用150 mmol·L-1 K2HPO4配制而成)在黑暗下处理1 h; 水洗干净后放入60%甘油中, 在显微镜下观察并拍照[16]。每处理设置3个重复, 试验重复3次。
1.6 实时荧光定量PCR本研究使用的试剂盒为SYBR Premix Ex TaqTM(TaKaRa生物公司), 在荧光定量PCR仪ABI PRISM 7500 Real-Time PCR System(Applied Biosystems公司, USA)上对目标基因的表达量进行测定。以actin为内参基因, 使用各OsSWEET基因的特异性引物进行扩增, 每个处理重复3次。引物序列见表 1。
| 基因Gene | 引物对序列(5′→3′)Primer pairs sequence(5′→ 3′) |
| actin | TGTATGCCAGTGGTCGTACCA/CCAGCAAGGTCGAGACGAA |
| OsSWEET2 | GTTTCACATGCGAGCGTCTTT/AACGGAGAAGCGAACATGGA |
| OsSWEET3b | GGGCTTGGCATACTGCTTGA/AGAACGGGTAGCACCATTCG |
| OsSWEET4 | CGCTCCATGATCGTCGGTAT/TCCACGCTCTTAGTCTGGATCAC |
| OsSWEET7a | GAAGAAGATGGAAGTGGTGCTA/CGCCAAGACCATTAGGGA |
| OsSWEET7c | GCTATCGGTGGTGAGCTTCCT/AGAGCACGCCAAGACCATTG |
| OsSWEET7d | CATCGTTCACCCCAACAGCATTCTC/TCGTCTCTGATGGGTGTGCGCGTCT |
| OsSWEET7e | ATCAGCACATGCCCTTAA/TTCTTCCCTGTCTGGTTG |
| OsSWEET11 | AGTCGACGGGAGGGTACAG/GACGAGGTAGAGGGTGGTGA |
| OsSWEET13 | CTACGCGCTGATCAAGTCCAA/GGGCGTAGGCGAGGTACAT |
| OsSWEET14 | GGCGACCGCCGCATCGTGGTT/GCCCAGCACGTTGGGAAGAGCG |
| OsSWEET15 | CCGTACGTGGTGACGCTCTT/ACGCACCCCACACCATTG |
| OsSWEET16 | TCGTAGGGAACGTAATCTCAATACTG/CGGCAGCCACCTGAATTC |
前期试验通过Southern杂交和酶切鉴定从JXOV的基因文库中筛选了29个含tal基因的黏粒克隆, 将其转化PXO99A, 在水稻上测定转化子的毒力。JV-7是筛选获得的导致表型变化明显的1个克隆, 它在一些水稻品种上具有增强PXO99A毒力的作用。PXO99A与PXO99A/pHMⅠ剪叶接种水稻时, 在相同的水稻品种之间两者病斑长度无差异; 故本研究以PXO99A作为阳性对照。由图 1可见:与PXO99A相比, 剪叶接种PXO99A/JV-7后在‘IRBB2’‘IRBB4’‘IRBB7’‘IRBB8’‘IRBB10’‘IRBB13’‘IR24’‘IRBB50’‘IRBB208’‘IRBB210’‘IRBB211’‘IRBB214’共12个水稻品种上PXO99A/JV-7的病斑长度增加3.0~9.3 cm(P<0.05);在其余的10个水稻品种上未发现病斑长度有显著性变化(P≥0.05)。对JV-7进行亚克隆分析, 我们克隆了1个3 345 bp BamHⅠ之间的基因片段。经测序分析发现, 该基因为1个tal基因, 编码的TALE蛋白的中间串联重复区含17.5个重复单元, 据此将该编码基因命名为tal17.5。tal17.5编码典型的TALE, 结构高度保守, 在N端具有Ⅲ型泌出系统T3SS分泌和转运信号; C端含有核定位信号(nuclear localization signals, NLS)、酸性转录激活域(acidic activation domain, AD)和亮氨酸拉链结构(leucine zipper, LZ); 在中间的串联重复区, 除第8个重复单元含有33个氨基酸外, 其余的每个重复单元均含有34个氨基酸。第12、13位可变氨基酸残基顺序为NI NS HD NG NS NN HD N*NN NN NI NN HD HG HD HD NN NG。应用GenBank(http://www.ncbi.nlm.nih.gov)中的BLAST程序进行核苷酸和氨基酸序列同源性比较, 结果发现, Tal17.5与Xoo菌株K74中K74-14蛋白(基因登录号为AKH66007.1)有99%的一致性, 它们有完全相同的重复单元数目, 第12、13位的可变氨基酸残基也完全相同, 但K74-14蛋白的功能尚且未知。

|
图 1 PXO99A/JV-7在不同水稻品种上致病力的测定 Figure 1 Virulence of PXO99A/JV-7 on rice *表示与对照PXO99A相比, 在0.05水平上有显著性差异。下同。 The asterisk(*)indicates that a significant difference between the same type of plants was detected at 0.05 level, compared with the PXO99A. The same as follows. |
为了检测tal17.5在寄主水稻上的毒力功能, 我们在水稻上剪叶接种PXO99A和PXO99A/tal17.5。结果显示:在22个水稻品种中, 与PXO99A相比, PXO99A/tal17.5在‘IRBB2’‘IRBB4’‘IRBB7’‘IRBB8’‘IRBB10’‘IR24’‘IRBB50’‘IRBB208’‘IRBB210’‘IRBB211’‘IRBB214’共11个水稻品种上的剪叶病斑长度增加5~10 cm(P<0.05)(图 2-A); 而在其余的11个水稻品种上PXO99A和PXO99A/tal17.5间的致病力差异不显著。剪叶结果表明, tal17.5的导入能增强PXO99A在部分水稻上的毒力。为了进一步了解病菌在水稻中的生长繁殖情况, 检测了PXO99A、PXO99A/tal17.5注射接种上述病斑长度显著增长的几种水稻品种5 d后的细菌含菌量。结果(图 2-B)显示, 与PXO99A相比, PXO99A/tal17.5的细菌含菌量显著增加(P<0.05)。以上结果表明:tal17.5可能是通过促进细菌在寄主中的增殖来发挥毒力作用的。

|
图 2 PXO99A/tal17.5在水稻上致病力的测定 Figure 2 Virulence of PXO99A/tal17.5 on rice A.剪叶接种的病斑长度; B.细菌在水稻上的含菌量。 A. Lesion length after leaf-clip inoculation; B. Bacterial population in rice leaves. |
一些OsSWEET基因被发现能够被Xoo诱导, 作为感病因子为病原菌提供营养。为了解tal17.5在部分水稻上引起的毒力提高是否也影响水稻的OsSWEET基因表达, 我们用实时荧光定量PCR检测了接种PXO99A/tal17.5后水稻中不同OsSWEET基因的相对表达水平。PXO99A中含有的主效毒力因子PthXo1能特异性地诱导OsSWEET11的表达, 所以本研究采用PXO99A缺失了PthXo1后的突变菌株ME2为受体菌株, 分析了tal17.5基因的导入诱导OsSWEET基因的表达情况。选用的水稻品种为接种PXO99A/tal17.5后病斑长度比接种PXO99A增长幅度最大的‘IRBB10’。在苗期水稻上分别注射接种ddH2O、ME2、ME2/tal17.5, 24 h后通过实时荧光定量PCR检测相关OsSWEET基因的表达情况。设置接种水后水稻中的OsSWEET基因表达量为1。结果如图 3所示:与接种ME2相比, 接种ME2/tal17.5后, 发现已知的3个感病基因OsSWEET11、OsSWEET13和OsSWEET14中只有OsSWEET11被诱导表达, 表达水平上升了4.6倍; 而OsSWEET13和OsSWEET14表达量差异不明显。另外发现OsSWEET2、OsSWEET7a、OsSWEET7c、OsSWEET15、OsSWEET16基因的相对表达量提高了3~6倍(P<0.05)。以上结果说明tal17.5提高毒力可能与OsSWEET11表达水平提高有关, 但与OsSWEET2、OsSWEET7a、OsSWEET7c、OsSWEET15和OsSWEET16的表达提高是否有关尚不能确定。
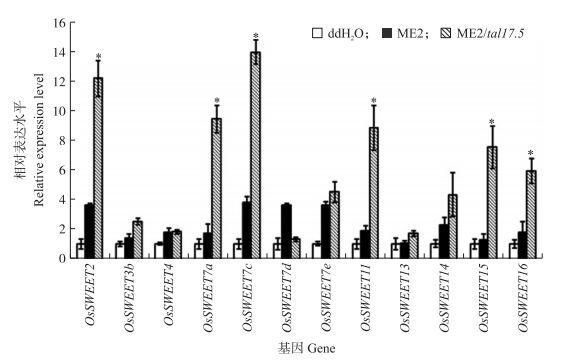
|
图 3 ME2/tal17.5诱导OsSWEET基因的表达 Figure 3 ME2/tal17.5 induce the OsSWEET gene expression |
在烟草叶片上注射接种PXO99A和PXO99A/tal17.5检测胼胝质沉积。结果如图 4所示:注射接种PXO99A和PXO99A/tal17.5的部位都检测到有胼胝质的沉积(图 4-A, 白点部分), 但是接种PXO99A/tal17.5的部位胼胝质沉积数量要远远少于接种PXO99A的处理。表明tal17.5的导入减弱了PXO99A在烟草叶片上引起的胼胝质沉积。

|
图 4 PXO99A/tal17.5诱导烟草上的胼胝质沉积 Figure 4 Callose deposition in tobacco epidermis induced by PXO99A/tal17.5 A.胼胝质沉积(1.ddH2O; 2.PXO99A/tal17.5; 3.PXO99A); B.胼胝质沉积数。 A.Callose deposition in tobacco epidermis(1.ddH2O; 2.PXO99A/tal17.5; 3.PXO99A); B.Quantitation of callose deposits. |
在水稻白叶枯病菌中通常有多个tal基因, 由于tal基因结构上存在数量不等、但序列上又高度相似的重复区, 所以跟一般常规基因的研究比较起来, tal基因的新功能研究有一定的困难[4]。在本试验中我们利用基因文库互补的方法, 研究了Xoo JXOV菌株中的tal基因的功能。在JXOV菌株中有近20个的tal基因, 对于这些基因在细菌毒力中的功能研究却没有报道。为了从这么多的tal基因中快速找出有功能的基因, 我们将实验室筛选出来的含有tal基因的黏粒文库克隆转化PXO99A后在水稻上筛选毒力表型发生了变化的转化子, 然后分析导致该表型变化的黏粒克隆。结果发现:编号为JV-7的黏粒可以导致PXO99A在一些水稻品种上毒力增强, 所以我们认为JV-7中可能含有对水稻具有毒力作用的tal基因存在。
在已研究的tal基因中, 部分tal基因是作为主效毒力因子发挥作用的, 如具有主效毒力功能的PthXo1、PthXo2、PthXo3以及具有主效无毒功能的avrXa23和avrXa10, 还有同时具有毒力和无毒功能的avrXa7[1, 5, 9, 11-14]。当这些主效的毒力因子存在的时候, 病菌与特定寄主的互作表现为感病或抗病反应; 而当主效基因缺失的时候, 互作表型则由感病转为抗病, 或由抗病转为感病[1]。除主效毒力因子外, 也发现一些tal基因对病原菌的毒力有一定的贡献, 但却不表现为主效毒力, 如菲律宾菌株PXO99A的pthXo6、pthXo7和中国菌株OS198的talR26.5[8, 10]。PthXo6、PthXo7功能的发现源自对PXO99A与水稻品种‘日本晴’互作后转录组基因表达的研究, 该研究发现接种‘日本晴’后, PXO99A不仅诱导主效的感病基因OsSWEET11的表达, 同时也诱导另外2个转录因子OsTFX1和OsTFIIAγ1的表达[9]; 进一步研究发现这2个基因的诱导表达是由依赖于Ⅲ型泌出系统的效应蛋白PthXo6、PthXo7决定的; PthXo6的缺失降低了病菌的毒力, 而pthXo7的突变体ME10在‘IR24’上的毒力与野生菌PXO99A没有明显差异, 但是当PthXo7在PXO86中表达的时候却能使PXO86在含有xa5基因水稻上具有一定的毒力[10, 17]。talR26.5是克隆自中国菌株OS198中的1个tal基因, 能够使PXO99A的毒力在测定的22个品种中的3个品种上毒力降低约50%。OS198是一个广谱的弱毒力菌株, 推测talR26.5具有一定的无毒力功能, 但不是主效的无毒基因[8]。我们从日本菌株JXOV中克隆获得tal17.5基因, 在水稻上测定致病力的时候, 发现tal17.5在11个水稻品种上引起PXO99A的毒力增加, 病菌在这些水稻叶片中的繁殖力也提高了。在寄主上检测相关OsSWEET基因的表达, 发现tal17.5基因的导入促进了感病基因OsSWEET11和另外5个目前尚不了解功能的OsSWEET2、OsSWEET7a、OsSWEET7c、OsSWEET15、OsSWEET16基因的表达。但是有研究表明当TALE作为主效因子时, 诱导相关SWEET基因的相对表达量与对照相比增加少则几十倍, 多则几百甚至上千倍[5, 9]; 如Antony等[5]发现pthXo1导入ME2后在水稻品种‘IR24’上OsSWEET11的表达量比ME2增加了100多倍, PthXo3导入ME2后在水稻品种‘日本晴’上OsSWEET14的表达量比ME2增加了70倍左右。但本研究中tal17.5诱导感病基因OsSWEET11基因的相对表达量提高较低。已知OsSWEET11可以促进水稻中的营养物质向细胞间隙的输导, 为细菌提供更多的营养, 本研究中tal17.5基因导入PXO99A后引起的OsSWEET11基因低水平的表达量提高可能与接种后表现出的毒力在一定程度上的提高有关。水稻的SWEET基因有21个, 但是目前报道作为感病基因的SWEET基因只有OsSWEET11、OsSWEET13和OsSWEET14, 其他的SWEET基因与黄单胞菌的互作关系尚未见报道[1, 5, 9]。在本研究中呈现了OsSWEET2、OsSWEET7a、OsSWEET7c、OsSWEET15、OsSWEET16基因的表达受Tal17.5的诱导, 但它们在病原致病力中是否有贡献目前尚不能确定, 需要借助于更深入的关于Tal17.5与这些SWEET基因的互作靶标位置的研究。
病原菌与植物互作时, 病原菌需要克服植物的先天免疫系统(PTI)才能进入植物细胞发挥作用。PTI是由病原相关分子刺激诱导, 使植物产生非特异性的防卫反应, 包括过敏反应、活性氧爆发以及基于细胞壁的防卫反应, 接种点附近胼胝质的沉积等[18]。现在越来越多的试验证据表明:tal基因的毒性功能可能涉及抑制植物的基础防卫反应[19-21]; tal基因家族的2个成员avrXa7和avrXa10能够抑制烟草的HR反应[11, 13]。在本研究中tal17.5导入PXO99A后接种非寄主本氏烟后也抑制了PXO99A在烟草上的过敏反应(结果未列)。接种后烟草胼胝质测定结果也显示, PXO99A/tal17.5在接种点附近的胼胝质沉积减弱。由此我们推测, tal17.5的毒力是通过抑制寄主植物的基础防卫反应来实现的。对于tal17.5抑制防卫反应的分子机制还有待进一步的研究。
| [1] | Yang B, Sugio A, White F F. Os8N3 is a host disease-susceptibility gene for bacterial blight of rice[J]. Proc Natl Acad Sci USA, 2006, 103: 10503–10508. DOI: 10.1073/pnas.0604088103 |
| [2] | Boch J, Bonas U, Lahaye T. TAL effectors-pathogen strategies and plant resistance engineering[J]. New Phytologist, 2014, 204(4): 823–832. DOI: 10.1111/nph.13015 |
| [3] | Bogdanove A J. Principles and applications of TAL effectors for plant physiology and metabolism[J]. Current Opinion in Plant Biology, 2014, 19: 99–104. DOI: 10.1016/j.pbi.2014.05.007 |
| [4] | Boch J, Bonas U. Xanthomonas AvrBs3 family-type Ⅲ effectors:discovery and function[J]. Annu Rev Phytopathol, 2010, 48: 419–436. DOI: 10.1146/annurev-phyto-080508-081936 |
| [5] | Antony G, Zhou J H, Huang S, et al. Rice xa13 recessive resistance to bacterial blight is defeated by induction of the disease susceptibility gene Os-11N3[J]. Plant Cell, 2010, 22(11): 3864–3876. DOI: 10.1105/tpc.110.078964 |
| [6] | Hummel A W, Doyle E L, Bogdanove A J. Addition of transcription activator-like effector binding sites to a pathogen strain-specific rice bacterial blight resistance gene makes it effective against additional strains and against bacterial leaf streak[J]. New Phytologist, 2012, 195(4): 883–893. DOI: 10.1111/j.1469-8137.2012.04216.x |
| [7] | Gu K Y, Yang B, Tian D S, et al. R gene expression induced by a type-Ⅲ effector triggers disease resistance in rice[J]. Nature, 2005, 435(7045): 1122–1125. DOI: 10.1038/nature03630 |
| [8] |
朱引引, 刘永庭, 宋从凤, 等. 水稻白叶枯菌OS198中talR26.5基因的克隆及功能分析[J].
中国水稻科学, 2014, 28(4): 343–350.
Zhu Y Y, Liu Y T, Song C F, et al. Cloning and functional characterization of talR26.5 gene from Xanthomonas oryzae pv.oryzae OS198 strain[J]. Chin J Rice Sci, 2014, 28(4): 343–350. (in Chinese with English abstract) |
| [9] | Zhou J H, Long J Y, Yang B, et al. Gene targeting by the TAL effector PthXo2 reveals cryptic resistance gene for bacterial blight of rice[J]. The Plant Journal, 2015, 82(4): 632–643. DOI: 10.1111/tpj.12838 |
| [10] | Sugio A, Yang B, Zhu T, et al. Two type Ⅲ effector genes of Xanthomonas oryzae pv.oryzae control the induction of the host genes OsTFⅡAγ1 and OsTFX1 during bacterial blight of rice[J]. Proc Natl Acad Sci USA, 2007, 104: 10720–10725. DOI: 10.1073/pnas.0701742104 |
| [11] | Yang B, Sugio A, White F F. Avoidance of host recognition by alterations in the repetitive and C-terminal regions of AvrXa7, a type Ⅲ effector of Xanthomonas oryzae pv.oryzae[J]. Molecular Plant Microbe Interactions, 2005, 18(2): 142–149. DOI: 10.1094/MPMI-18-0142 |
| [12] | Tian D S, Wang J X, Zeng X, et al. The rice TAL effector-dependent resistance protein XA10 triggers cell death and calcium depletion in the endoplasmic reticulum[J]. Plant Cell, 2014, 26(1): 497–515. DOI: 10.1105/tpc.113.119255 |
| [13] | Wang C L, Qin T F, Zhao K J, et al. The broad bacterial blight resistance of rice line CBB23 is triggered by a novel transcription activator-like(TAL)effector of Xanthomonas oryzae pv.oryzae[J]. Molecular Plant Pathology, 2014, 15(4): 333–341. DOI: 10.1111/mpp.2014.15.issue-4 |
| [14] | Wang C L, Zhang X P, Zhao K J, et al. XA23 is an executor R protein and confers broad-spectrum disease resistance in rice[J]. Molecular Plant, 2015, 8: 290–302. DOI: 10.1016/j.molp.2014.10.010 |
| [15] |
张雅虹, 崔晓芳, 宋从凤, 等. tal4基因在水稻白叶枯菌PXO99A对噻枯唑抗性中的作用[J].
南京农业大学学报, 2014, 37(3): 57–64.
Zhang Y H, Cui X F, Song C F, et al. Functional analysis of tal4 of Xanthomonas oryzae pv.oryzae strain PXO99A in resistance to bismerthiazol[J]. Journal of Nanjing Agricultural University, 2014, 37(3): 57–64. DOI: 10.7685/j.issn.1000-2030.2014.03.008 (in Chinese with English abstract) |
| [16] | Song C F, Yang B. Mutagenesis of 18 type Ⅲ effectors reveals virulence function of XopZPXO99 in Xanthomonas oryzae pv.oryzae[J]. Molecular Plant Microbe Interactions, 2010, 23(7): 893–902. DOI: 10.1094/MPMI-23-7-0893 |
| [17] | Huang S, Antony G, Li T, et al. The broadly effective recessive resistance gene xa5 of rice is a virulence effector-dependent quantitative trait for bacterial blight[J]. The Plant Journal, 2016, 86: 186–194. DOI: 10.1111/tpj.2016.86.issue-2 |
| [18] |
张岩, 伍辉军, 周晓辉, 等. 丁香假单胞大豆致病变种harpin编码基因的克隆表达与功能研究[J].
南京农业大学学报, 2013, 36(1): 6–12.
Zhang Y, Wu H J, Zhou X H, et al. Cloning, expressing and function of a harpin-encoding gene from Pseudomonas syringae pv.glycinea[J]. Journal of Nanjing Agricultural University, 2013, 36(1): 6–12. DOI: 10.7685/j.issn.1000-2030.2013.01.002 (in Chinese with English abstract) |
| [19] | Chandran D. Co-option of developmentally regulated plant SWEET transporters for pathogen nutrition and abiotic stress tolerance[J]. IUBMB Life, 2015, 67(7): 461–471. DOI: 10.1002/iub.1394 |
| [20] | Deslandes L, Rivas S. Catch me if you can:bacterial effectors and plant targets[J]. Trends Plant Sci, 2012, 17(11): 644–655. DOI: 10.1016/j.tplants.2012.06.011 |
| [21] | Macho A P. Subversion of plant cellular functions by bacterial type-Ⅲ effectors:beyond suppression of immunity[J]. New Phytologist, 2016, 210: 51–57. DOI: 10.1111/nph.13605 |




