文章信息
- 张曼, 戴蓉, 张顺凯, 江海东
- ZHANG Man, DAI Rong, ZHANG Shunkai, JIANG Haidong
- H2O2浸种对油菜种子低温萌发的缓解效应
- Alleviation effects of seed soaking with H2O2on seed germination in rape under low temperature stress
- 南京农业大学学报, 2017, 40(6): 963-970
- Journal of Nanjing Agricultural University, 2017, 40(6): 963-970.
- http://dx.doi.org/10.7685/jnau.201702029
-
文章历史
- 收稿日期: 2017-02-23
油菜是我国唯一的冬季油料作物, 在种植业中占有较大比例。长江流域是我国最大的油菜产区, 低温冷害是该区域常见的气象灾害。近年来, 直播油菜面积不断增加, 播种期也不断被推迟, 致使晚直播油菜萌发期更易遭受低温胁迫。萌发是植物生活周期中最重要和最脆弱的阶段[1]。温度过低会抑制萌发过程中的物质代谢反应, 不利于种子萌发[2-3]。萌发期遭遇低温会导致种子发芽率降低、萌发时间延迟, 进而出现“小老苗”现象, 严重影响植株后期的生长及最终产量。
过氧化氢(H2O2)是细胞正常代谢的产物, 低温抑制种子萌发的生理机制之一在于活性氧(ROS)大量产生而导致的氧化损伤[4]。研究认为, 较低浓度的H2O2可作为信号分子诱导植物细胞内基因的表达及相关生理生化反应[5]。近年来, H2O2在提高植物抗逆性方面应用广泛, 研究表明, 适宜浓度H2O2处理可增加低温层积下花棒种子发芽率[6], 促进大豆低温萌发[7], 有效缓解低温对柑橘叶片细胞膜的伤害[8], 增强水稻幼苗的抗寒性[9], 也可提高绿豆幼苗[10]及直播油菜的低温耐受能力[11]。然而, H2O2浸种处理对低温胁迫下油菜种子萌发期间影响的研究未见报道。本试验以2个不同低温萌发特性的油菜品种为材料, 研究H2O2浸种对其低温萌发过程中发芽率、发芽势等萌发指标, SOD、POD、CAT等抗氧化防御能力和Cu/Zn-SOD、BnICE1抗寒基因表达变化的影响, 揭示H2O2浸种对不同抗寒性的油菜种子抗低温萌发的影响及其作用机制, 为油菜抗寒机制的研究及油菜抗寒途径的探索提供理论依据和技术指导。
1 材料与方法 1.1 试验材料供试油菜(Brassica napus)品种为‘南农油4号’(耐寒型)和‘中双11号’(敏感型)。供试药剂为南京化学试剂有限公司生产的30% H2O2(分析纯), 试验用0.05%(体积分数)的H2O2[11]。
1.2 试验设计与取样时期挑选大小一致、形态饱满的‘南农油4号’(N-4)和‘中双11号’(Z-11)油菜种子, 经0.5%次氯酸钠消毒15 min, 蒸馏水漂洗3次, 滤纸吸干水分后, 常温下分别用蒸馏水和0.05% H2O2浸种8 h, 黑暗条件下回干后, 置于铺有双层洁净滤纸、直径为9 cm的培养皿内, 每皿50粒种子。采用RZX型人工智能气候箱(宁波江南仪器厂)调控温度, 常温处理和低温处理分别设置为(22±1)℃(正常播种期间平均温度)和(10±1)℃(晚直播期间平均温度), 光照条件均设置为黑暗, 并根据干湿情况定时补充蒸馏水以保持充足水分。蒸馏水浸种后常温和低温处理分别设为(22±1)℃(CK)和(10±1)℃(LT), 0.05% H2O2浸种后低温处理设为H2O2, 在干燥种子(DS)以及处理后低温萌发6、12、24和48 h(常温下48 h的发芽状态已超出本试验范围, 所以只取到24 h)取样并测定生理指标, 3次重复, 每天统计并记录发芽情况。
1.3 测定项目与方法 1.3.1 萌发指标测定胚根长度不小于种子直径时视为萌发, 每天统计并记录发芽情况, 处理后3 d计算发芽势, 处理后7 d计算发芽率, 采用公式计算发芽指数[12]和平均发芽时间(d)[13]。
发芽指数=∑(逐日发芽数/发芽时间),
平均发芽时间(d)=∑(种子置床时的时间×相应各天的萌发粒数/∑(相应各时间的萌发粒数))。
1.3.2 生理生化指标测定H2O2含量按照南京建成生物公司提供的试剂盒说明书测定; MDA含量的测定参照Hodges等[14]的方法; SOD、POD和CAT的测定使用同一提取液, SOD和POD酶活性提取与测定参照Tan等[15]的方法; CAT活性测定按照Chance等[16]的方法并有所修改:0.1 mL酶液加3 mL CAT反应液(0.075% H2O2溶液1 mL, 0.05 mol·L-1 pH7.0的磷酸缓冲液1.9 mL), 240 nm下比色, 每隔15 s读取吸光度的下降值。称取0.3 g叶片放入预冷的研钵中, 加入5%(体积分数)磺基水杨酸3 mL在冰浴中研磨成匀浆, 冷冻离心机(4 ℃)20 000 g离心20 min取上清液, 然后参照Khanna-Chopra等[17]和Paradiso等[18]的方法分别测定抗坏血酸(AsA)和谷胱甘肽(GSH)含量。
1.3.3 抗寒基因的表达分析1) RNA的提取和反转录:在丁勇等[19]和孙海波等[20]提取种子内总RNA方法的基础上进行改良, 取萌发48 h(常温下24 h)时的油菜种子0.3 g, 液氮研磨充分后参照RNA提取试剂盒(北京百泰克公司)说明书, 结合改良后的方法分别提取低温萌发48 h(常温24 h)时种子的总RNA, 利用10 g·L-1琼脂糖凝胶电泳检测和超微量紫外分光光度计测定其完整性与浓度后, 置-80 ℃冰箱保存备用。选用反转录试剂盒(北京百泰克公司)进行cDNA合成反应。2)引物序列的合成:参照马骊等[21]所使用的引物序列(表 1), 委托南京金斯瑞生物科技有限公司进行合成, 电泳检测其特异性。3)实时荧光定量PCR:根据试剂盒(北京百泰克公司)说明书, 利用实时荧光定量PCR仪, 采用两步法进行Real-time PCR扩增。扩增程序为95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 40个循环; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。目的基因与内参基因对应各3次重复, 操作时避免强光照射。数据分析采用2-ΔΔCT方法计算。
| 基因Gene | 序列Sequence(5′→3′) |
| BnICE1-1 | CCCGCCGGAAAACAACAACACAG |
| BnICE1-2 | CGCCAGACGACGCCAAGACCTC |
| Cu/Zn-SOD-1 | GGCTGTTGTTGTCCATGCAG |
| Cu/Zn-SOD-2 | TAATGCCACAAGCAACACGG |
| Actin1-1 | GTGTCATGGTTGGGATGGGT |
| Actin1-2 | AAGAACCGGGTGCTCTTCAG |
采用SigmaPlot 12.5软件作图, 同时运用SPSS 18.0软件对数据进行差异显著性分析。
2 结果与分析 2.1 H2O2浸种对油菜种子低温萌发的影响由表 2可见:低温显著抑制2个油菜品种种子的萌发, N-4和Z-11的发芽势分别比常温下降低31.75%和41.23%, 且低温对N-4的抑制作用小于Z-11。与低温对照LT相比, H2O2浸种处理能够显著提高种子的发芽势和发芽指数, 并且缩短平均发芽时间。因此, H2O2浸种对油菜种子在低温下的发芽过程有明显促进作用, 然而与常温对照相比, 此预处理还不能完全缓解低温对种子萌发的影响, H2O2处理后种子的平均发芽时间仍比常温下增加1.0~1.4 d。
| 品种 Breeds |
处理 Treatment |
发芽势/% Germination potential |
发芽率/% Germination rate |
发芽指数 Germination index |
平均发芽时间/d Mean germination time |
| 南农油4号 | CK | 96.7a | 99.3a | 45.1a | 1.3c |
| Nannongyou 4(N-4) | LT | 66.0b | 90.7b | 14.2c | 3.3a |
| H2O2 | 90.0a | 99.3a | 26.1b | 2.3b | |
| 中双11号 | CK | 90.7a | 93.3a | 41.8a | 1.3c |
| Zhongshuang 11(Z-11) | LT | 53.3b | 89.7b | 13.5c | 3.6a |
| H2O2 | 80.0a | 92.7a | 19.6b | 2.7b | |
| 注:1)CK:(22±1)℃常温处理; LT:(10±1)℃低温处理; H2O2:(10±1)℃低温H2O2处理。 2)各列中不同小写字母表示处理间在0.05水平有显著差异。下同。 Note:1)CK:(22±1)℃ normal temperature treatment; LT:(10±1)℃ low temperature treatment; H2O2:(10±1)℃ low temperature with H2O2 treatment. 2)The different small letters in the same column indicate significant difference among treatment at 0.05 level. The same as follows. |
|||||
由图 1可以看出:2个品种油菜种子的MDA含量随萌发时间延长而逐渐升高, 整个萌发过程中, 各处理间MDA含量从大到小依次为LT、H2O2、CK。低温下MDA含量增加速率较快, 且Z-11的增加幅度大于N-4。与LT相比, H2O2浸种处理显著抑制了低温下种子萌发过程中MDA含量的增加, 萌发6 h开始, 低温下LT和H2O2处理在2个品种间都已表现出差异, 且Z-11中MDA含量要高于N-4。

|
图 1 H2O2浸种处理对油菜种子低温萌发过程中MDA含量的影响 Figure 1 Effects of seed soaking with H2O2 on MDA content in rape seed germination process under low temperature DS:干燥种子Dry seed. The same as follows. |
由图 2可知:随着油菜种子萌发时间的延长, H2O2含量呈现上升的趋势。与CK相比, 低温胁迫明显促进H2O2含量的增加。低温下H2O2浸种能够显著降低种子内的H2O2含量, 且LT和H2O2处理间的含量差异逐渐增大, N-4的LT和H2O2处理的H2O2含量在种子萌发12 h时已表现出显著差异, 而在敏感型品种Z-11中发生在萌发24 h。且在低温萌发24~48 h, N-4中的H2O2含量上升趋势减缓, 在Z-11中H2O2含量仍处于上升阶段。
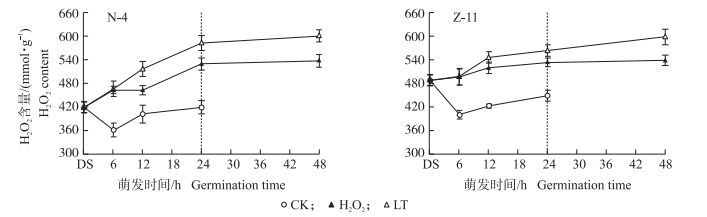
|
图 2 H2O2浸种对油菜种子低温萌发过程中H2O2含量的影响 Figure 2 Effects of seed soaking with H2O2 on H2O2 content in rape seed germination process under low temperature |
从图 3可以看出:随着萌发时间的延长, 2个品种SOD活性均呈升高趋势。相对于N-4, Z-11的上升趋势较平缓, 上升幅度较小。与CK相比, 低温处理和H2O2浸种处理2个品种的SOD活性均增加。N-4的种子在低温萌发48 h时, H2O2和LT处理间的SOD活性呈显著差异; Z-11的种子SOD活性较LT增加, 但差异不显著。

|
图 3 H2O2浸种对油菜种子低温萌发过程中SOD、POD、CAT活性的影响 Figure 3 Effects of seed soaking with H2O2 on SOD, POD, CAT activities in rape seed germination process under low temperature |
N-4的POD活性增加幅度也大于Z-11, 常温萌发12 h时, N-4中POD活性显著提高, Z-11品种则在萌发24 h时迅速增加。2个品种POD活性均呈先平缓后急剧增加的变化趋势。低温条件下, H2O2与LT处理组, N-4在萌发6 h时有差异, Z-11在萌发后期才表现差异。萌发48 h时, H2O2浸种后, N-4和Z-11的POD活性比LT分别提高31.22%和19.37%, 且显著差异。
常温下2个品种的CAT活性变化趋势与POD一致, 低温胁迫可促使CAT活性的增加, 在萌发24 h前CAT的活性平缓增加, 24~48 h之间急剧增加。H2O2浸种可提高低温萌发种子的CAT活性, 且在N-4品种中的增加幅度大于Z-11。N-4在萌发48 h时H2O2与LT处理之间差异最显著, 而Z-11中发生于萌发24 h。
2.5 H2O2浸种对油菜种子低温萌发过程中AsA和GSH含量的影响由图 4可以看出:常温下随萌发进程AsA含量逐渐升高。低温条件下, 随着萌发时间的延长, N-4种子中AsA含量总体呈先急剧升高后变缓的趋势, Z-11则呈先急剧上升后变缓再上升趋势; H2O2处理促进了2个油菜品种种子在低温萌发过程中AsA含量的增加, 在24~48 h之间, Z-11的增加幅度要高于N-4。
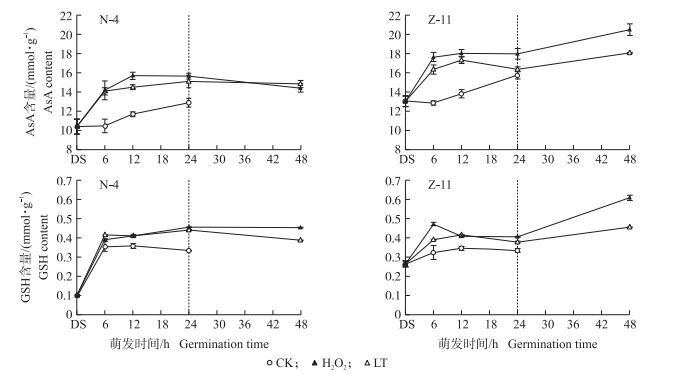
|
图 4 H2O2浸种对油菜种子低温萌发过程中AsA和GSH含量影响 Figure 4 Effects of seed soaking with H2O2 on AsA and GSH contents in rape seed germination process under low temperature |
整个萌发期间, 常温下种子中的GSH含量呈整体升高的趋势, 低温下N-4中的GSH含量先上升后略有降低, Z-11中呈先上升后下降再上升趋势。低温萌发24 h时, N-4和Z-11的GSH含量比CK分别增加30.85%和24.03%。H2O2处理也促进了不同品种种子在低温萌发过程中GSH含量的增加。在萌发24 h后, Z-11的增加幅度要高于N-4;在低温萌发48 h时, 在Z-11中H2O2处理相较LT的增加幅度约为N-4的2倍。
2.6 H2O2浸种对低温下油菜种子Cu/Zn-SOD和BnICE1表达量的影响 2.6.1 总RNA和引物电泳检测各处理提取的总RNA经超微量紫外分光光度计检测浓度正常, D260/D280均在1.8~2.0之间。琼脂糖凝胶电泳结果显示, 引物特异性良好(图 5)。
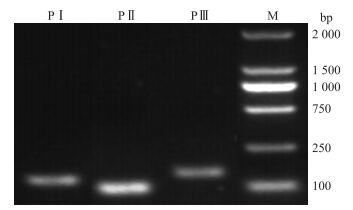
|
图 5 引物特异性检测电泳图 Figure 5 Specific amplification of 3 primer pairs M.Marker; PⅠ、PⅡ、PⅢ分别为Actin、Cu/Zn-SOD和BnICE1。 M.Marker; PⅠ, PⅡ, PⅢ were Actin, Cu/Zn-SOD and BnICE1, respectively. |
从图 6可见:低温下萌发48 h时, 2个品种中Cu/Zn-SOD的表达量均比常温下萌发24 h时显著上升, 且在抗寒性强的品种中, Cu/Zn-SOD基因的表达量相对较高。N-4中经H2O2处理后的种子在低温下的表达量较LT显著增加, 在Z-11中无显著差异。
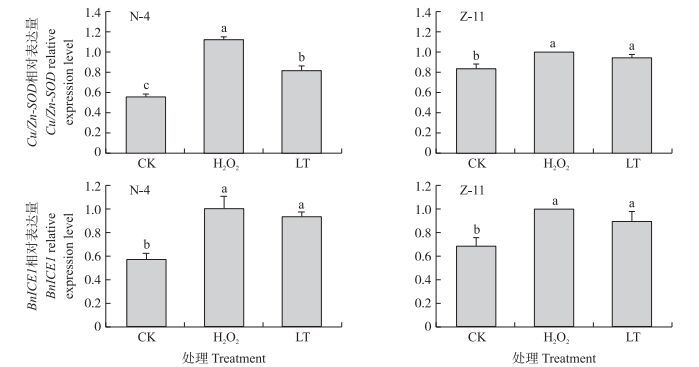
|
图 6 H2O2浸种处理对低温下油菜种子内Cu/Zn-SOD和BnICE1表达量的影响 Figure 6 Effects of seed soaking with H2O2 on the expression of Cu/Zn-SOD and BnICE1 in rape seeds under low temperature |
低温胁迫可促进抗寒基因BnICE1的表达。低温萌发48 h时不同油菜品种种子中抗寒基因BnICE1的表达量较常温条件均显著增加, 其中, N-4较常温对照增加了63.32%, Z-11增加了32.62%。H2O2浸种处理在一定程度上提高了BnICE1在低温萌发48 h时的表达量, 但在2个品种中的促进作用都不明显。
3 讨论种子萌发是植物生活史的关键环节, 对温度条件要求严格, 温度过高或者过低都会造成种子萌发不正常, 降低出苗率, 最终影响作物的产量。较低的温度不仅引起种子萌发率降低, 萌发时间延迟, 而且易导致幼苗畸形发育甚至死亡[22]。本研究中, 10 ℃下的低温处理显著降低了油菜种子的发芽率和发芽指数, 延长了发芽时间, 且低温胁迫下不同品种间的萌发能力存在差异; H2O2浸种处理能明显提高油菜种子低温萌发的发芽势, 提高发芽指数和萌发速度, 在2个品种中表现出不同程度的促进作用。表明外源H2O2浸种能有效缓解低温对油菜种子萌发的抑制, 增强萌发期间对低温胁迫的抗性, 为油菜后期生长打下坚实基础。
植物在低温胁迫下, 体内活性氧水平升高, 膜脂过氧化程度加剧, 会对植物造成氧化损伤, 严重影响植物生长[23]。低温胁迫可提高叶片中SOD、POD和CAT活性, 以清除过量的活性氧, 维持细胞正常代谢[11]。同时, 逆境条件下的高浓度内源AsA和GSH能够维持叶片中较高的抗氧化能力, 减轻ROS对叶片的氧化损伤程度[24-25]。本试验结果显示:低温萌发条件下MDA和H2O2含量增加, 油菜种子内SOD活性增加, CAT和POD活性先平缓后急剧升高, AsA和GSH含量变化相似。这可能是由于种子萌发期间遭遇低温促使ROS水平升高, 导致种子内膜脂过氧化程度加剧, 而过高的ROS水平可通过诱导抗氧化酶活性和非酶抗氧化物质含量的提高来清除, 以减轻低温逆境的伤害。低温萌发后期种子内的抗氧化酶活性低于常温对照, 可能与低温影响酶的数量和活性, 降低各项生理生化反应, 减缓代谢速率有关[26]。
低浓度H2O2作为一种逆境信号分子, 可诱导植物体内抗氧化酶活性的增强, 缓解不利条件引起的氧化胁迫, 提高对后续逆境胁迫的抵抗能力[27]。本研究发现, H2O2浸种处理促进了低温下油菜种子中POD和CAT活性的提高, 尤其在低温萌发24 h后活性迅速升高, 有利于清除此期间种子内过多的H2O2, 从而降低MDA的含量, 维持低温胁迫下细胞膜的稳定, 从而促进低温萌发。而且, 在整个抗氧化酶系中, N-4在萌发过程中的SOD、POD和CAT活性的增幅均高于Z-11, 表明N-4与Z-11相比有较强的抗氧化能力和耐寒性。
BnICE1和Cu/Zn-SOD是典型的与抗寒相关的功能基因和调控基因, 直接或间接地参与抵御低温的过程[28]。研究表明, 低温胁迫增加BnICE1和Cu/Zn-SOD基因表达量[29-30], H2O2参与植物的抗逆境胁迫调控[31-32]。本试验中, 低温下萌发48 h与常温萌发24 h相比, 2个品种种子的BnICE1和Cu/Zn-SOD基因表达量均显著增加, H2O2处理不同程度地促进了2个品种种子抗寒基因的表达。Z-11的Cu/Zn-SOD表达水平整体低于N-4, 表明在Z-11中其表达调控作用难以像N-4那样对低温胁迫作出高效的应答, 这与2个品种萌发过程中SOD活性的差异相一致; H2O2预处理对于促进低温下BnICE1基因表达的作用不明显, 可能原因是H2O2处理在诱导BnICE1的表达方面没有发挥重要作用。
0.05% H2O2浸种处理能有效提高2个品种种子萌发过程中SOD、POD和CAT的活性, 促进AsA和GSH含量的提高, 增强ROS清除能力, 降低H2O2和MDA的含量; 同时在一定程度上诱导Cu/Zn-SOD和BnICE1基因在低温下的表达, 且在抗寒品种中的表达高于敏感品种。说明H2O2浸种处理能通过提高种子中抗氧化酶活性和非酶抗氧化物质含量, 快速清除过多的H2O2, 抑制MDA含量的增加, 并且通过促进抗寒基因的表达, 提高种子的低温耐受能力, 从而使油菜种子在低温下较快萌发。
| [1] | Rajjou L, Duval M, Gallardo K, et al. Seed germination and vigor[J]. Annual Review of Plant Biology, 2012, 63: 507–533. DOI: 10.1146/annurev-arplant-042811-105550 |
| [2] |
宋兆伟, 郝丽珍, 黄振英, 等. 光照和温度对沙芥和斧翅沙芥植物种子萌发的影响[J].
生态学报, 2010, 30(10): 2562–2568.
Song Z W, Hao L Z, Huang Z Y, et al. Effects of light and temperature on the germination of Pugionium cornutum(L.)Gaertn. and Pugionium dolabratum Maxim. seeds[J]. Acta Ecologica Sinica, 2010, 30(10): 2562–2568. (in Chinese with English abstract) |
| [3] |
盛海燕, 葛滢, 常杰, 等. 环境因素对伞形科两种植物种子萌发的影响[J].
生态学报, 2004, 24(2): 221–226.
Sheng H Y, Ge Y, Chang J, et al. Influence of environmental factors on seed germination of two species in Umbellaceae[J]. Acta Ecologica Sinica, 2004, 24(2): 221–226. (in Chinese with English abstract) |
| [4] | Wang W Q, Møller I M, Song S Q. Proteomic analysis of embryonic axis of Pisum sativum seeds during germination and identification of proteins associated with loss of desiccation tolerance[J]. Journal of Proteomics, 2012, 77: 68–86. DOI: 10.1016/j.jprot.2012.07.005 |
| [5] | Jiang J L, Su M, Wang LY, et al. Exogenous hydrogen peroxide reversibly inhibits root gravitropism and induces horizontal curvature of primary root during grass pea germination[J]. Plant Physiology and Biochemistry, 2012, 53: 84–93. DOI: 10.1016/j.plaphy.2012.01.017 |
| [6] | Su L Q, Lan Q Y, Pritchard H W, et al. Reactive oxygen species induced by cold stratification promote germination of Hedysarum scoparium seeds[J]. Plant Physiology and Biochemistry, 2016, 109: 406–415. DOI: 10.1016/j.plaphy.2016.10.025 |
| [7] |
张立军, 宋广周, 白霜, 等. H2O2对不同大豆品种低温萌发及主要抗氧化酶活性的影响[J].
大豆科学, 2008, 27(1): 97–100, 105.
Zhang L J, Song G Z, Bai S, et al. Effect of exogenous H2O2 on germination rate and activities of main antioxidase in soybean(Glycine max L.)seedlings under low temperature[J]. Soybean Science, 2008, 27(1): 97–100, 105. (in Chinese with English abstract) |
| [8] |
蒋景龙. 外源H2O2对低温胁迫下柑橘叶片抗寒性的影响[J].
西北植物学报, 2016, 36(3): 499–505.
Jiang J L. Effect of exogenous H2O2 treatment on cold resistance of Citrus reticulata leaves under low temperature stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(3): 499–505. (in Chinese with English abstract) |
| [9] |
韩娜, 冯汉青, 李燕鸿, 等. 外源H2O2对水稻幼苗抗寒性的调节作用[J].
西北植物学报, 2009, 29(6): 1214–1219.
Han N, Feng H Q, Li Y H, et al. Regulation of exogenous H2O2 on rice seedlings chilling tolerance[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(6): 1214–1219. (in Chinese with English abstract) |
| [10] | Yu C W, Murphy T M, Sung W W, et al. H2O2treatment induces glutathione accumulation and chilling tolerance in mung bean[J]. Functional Plant Biology, 2002, 29: 1081–1087. DOI: 10.1071/PP01264 |
| [11] |
万林, 张曼, 钟飞燕, 等. H2O2浸种处理对晚直播油菜苗期耐寒性的影响[J].
中国油料作物学报, 2015, 37(6): 811–819.
Wan L, Zhang M, Zhong F Y, et al. Effects of seed soaking with hydrogen peroxide on seedling cold tolerance of late direct-sowing rape[J]. Chinese Journal of Oil Crop Sciences, 2015, 37(6): 811–819. DOI: 10.7505/j.issn.1007-9084.2015.06.011 (in Chinese with English abstract) |
| [12] | Wang Y R, Yu L, Nan Z B, et al. Vigor tests used to rank seed lot quality and predict field emergence in four forage species[J]. Crop Science, 2004, 44: 535–541. DOI: 10.2135/cropsci2004.5350 |
| [13] |
刘克彪, 姜生秀. 干旱和钠盐胁迫对罗布麻种子萌发的影响[J].
草业学报, 2016, 25(5): 214–221.
Liu K B, Jiang S X. Responses of Apoceynum venetum seed germination to drought and salt stress[J]. Acta Prataculturae Sinica, 2016, 25(5): 214–221. DOI: 10.11686/cyxb2015318 (in Chinese with English abstract) |
| [14] | Hodges D M, de Long J M, Forney C F, et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta, 1999, 207: 604–611. DOI: 10.1007/s004250050524 |
| [15] | Tan W, Liu J, Dai T, et al. Alterations in photosynthesis and antioxidant enzyme activity in winter wheat subjected to post-anthesis water-logging[J]. Photosynthetica, 2008, 46(1): 21–27. DOI: 10.1007/s11099-008-0005-0 |
| [16] | Chance B, Maehly A C. Assay of catalases and peroxidases[J]. Methods in Enzymology, 1955, 2(55): 764–775. |
| [17] | Khanna-Chopra R, Selote D S. Acclimation to drought stress generates oxidative stress tolerance in drought-resistant than-susceptible wheat cultivar under field conditions[J]. Environmental and Experimental Botany, 2007, 60: 276–283. DOI: 10.1016/j.envexpbot.2006.11.004 |
| [18] | Paradiso A, Berardino R, de Pinto M C, et al. Increase in ascorbate-glutathione metabolism as local and precocious systemic responses induced by cadmium in durum wheat plants[J]. Plant Cell Physiol, 2008, 49(3): 362–374. DOI: 10.1093/pcp/pcn013 |
| [19] |
丁勇, 刘英, 杨鸯鸯, 等. 油菜种子高质量总RNA提取的一种有效方法[J].
华中农业大学学报, 2006, 25(5): 465–468.
Ding Y, Liu Y, Yang Y Y, et al. An efficient method for extraction of high quality RNA from rapeseeds[J]. Journal of Huazhong Agricultural University, 2006, 25(5): 465–468. (in Chinese with English abstract) |
| [20] |
孙海波, 王智慧, 刘学群, 等. 一种适用于油菜、大豆、花生、芝麻四种油料作物种子的RNA提取方法[J].
中国油料作物学报, 2012, 34(4): 353–358.
Sun H B, Wang Z H, Liu X Q, et al. Modified RNA extraction method for seeds of rapeseed, soybean, peanut and sesame[J]. Chinese Journal of Oil Crop Sciences, 2012, 34(4): 353–358. (in Chinese with English abstract) |
| [21] |
马骊, 孙万仓, 刘自刚, 等. 低温胁迫下白菜型与甘蓝型冬油菜抗寒基因表达差异[J].
中国油料作物学报, 2016, 38(2): 135–141.
Ma L, Sun W C, Liu Z G, et al. Expression of cold resistance genes from winter rapeseed of Brassica rapa and B.napus under chilling stress[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(2): 135–141. DOI: 10.7505/j.issn.1007-9084.2016.02.001 (in Chinese with English abstract) |
| [22] |
丁琼, 王华, 贾桂霞, 等. 沙冬青种子萌发及幼苗生长特性[J].
植物生态学报, 2006, 30(4): 633–639.
Ding Q, Wang H, Jia G X, et al. Seed germination and seedling performance of Ammopiptanthus mongolicus[J]. Journal of Plant Ecology, 2006, 30(4): 633–639. (in Chinese with English abstract) |
| [23] |
王俊力, 王岩, 赵天宏, 等. 臭氧胁迫对大豆叶片抗坏血酸-谷胱甘肽循环的影响[J].
生态学报, 2011, 31(8): 2068–2075.
Wang J L, Wang Y, Zhao T H, et al. Effects of ozone on AsA-GSH cycle in soybean leave[J]. Acta Ecologica Sinica, 2011, 31(8): 2068–2075. (in Chinese with English abstract) |
| [24] | Jubany-Marí T, Munné-Bosch S, Alegre L, et al. Redox regulation of water stress responses in field-grown plants. Role of hydrogen peroxide and ascorbate[J]. Plant Physiology and Biochemistry, 2010, 48: 351–358. DOI: 10.1016/j.plaphy.2010.01.021 |
| [25] | Mou Z L, Fan W H, Dong X N. Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes[J]. Cell, 2003, 113: 935–944. DOI: 10.1016/S0092-8674(03)00429-X |
| [26] |
周艳虹, 喻景权, 钱琼秋, 等. 低温弱光对黄瓜幼苗生长及抗氧化酶活性的影响[J].
应用生态学报, 2003, 14(6): 921–924.
Zhou Y H, Yu J Q, Qian Q Q, et al. Effects of chilling and low light on cucumber seedlings growth and their antioxidative enzyme activities[J]. Chinese Journal of Applied Ecology, 2003, 14(6): 921–924. (in Chinese with English abstract) |
| [27] | Hu Y L, Ge Y, Zhang C H, et al. Cadmium toxicity and translocation in rice seedlings are reduced by hydrogen peroxide pretreatment[J]. Plant Growth Regulation, 2009, 59: 51–61. DOI: 10.1007/s10725-009-9387-7 |
| [28] |
姚晓华. 植物抗寒相关功能与调控基因研究进展[J].
中国农学通报, 2013, 29(27): 141–147.
Yao X H. Research advance in the cold-resistance function genes and regulatory genes in plants[J]. Chinese Agricultural Science Bulletin, 2013, 29(27): 141–147. DOI: 10.3969/j.issn.1000-6850.2013.27.025 (in Chinese with English abstract) |
| [29] | Hodges D M, Andrews C J, Johnson D A, et al. Antioxidant enzyme responses to chilling stress in differentially sensitive inbred maize lines[J]. Journal of Experimental Botany, 1997, 48(310): 1105–1113. |
| [30] |
张腾国, 常燕, 王娟, 等. 油菜BnICE1的克隆及表达分析[J].
中国农业科学, 2013, 46(1): 205–214.
Zhang T G, Chang Y, Wang J, et al. Cloning and expression analysis of a BnICE1 from Brassica napus L[J]. Scientia Agricultura Sinica, 2013, 46(1): 205–214. (in Chinese with English abstract) |
| [31] | Dat J, Vandenabeele S, Vranová E, et al. Dual action of the active oxygen species during plant stress responses[J]. Cell Mol Life Sci, 2000, 57: 779–795. DOI: 10.1007/s000180050041 |
| [32] | Orozco-Cárdenas M L, Narváez-Vásquez J, Ryan C A. Hydrogen peroxide acts as a second messenger for the induction of defense genes in tomato plants in response to wounding, systemin, and methyl jasmonate[J]. Plant Cell, 2001, 13: 179–191. DOI: 10.1105/tpc.13.1.179 |




