文章信息
- 沈子杰, 范德佳, 何俊, 黄捷, 江玲, 程遐年, 刘裕强, 万建民
- SHEN Zijie, FAN Dejia, HE Jun, HUANG Jie, JIANG Ling, CHENG Xianian, LIU Yuqiang, WAN Jianmin
- 籼稻品种‘IR13427-45-2-1-2-2-2’抗白背飞虱QTL定位
- Mapping of the quantitative trait locus conferring white-backed planthopper resistance in indica cultivar 'IR13427-45-2-1-2-2-2'
- 南京农业大学学报, 2017, 40(6): 957-962
- Journal of Nanjing Agricultural University, 2017, 40(6): 957-962.
- http://dx.doi.org/10.7685/jnau.201704027
-
文章历史
- 收稿日期: 2017-04-17
2. 中国农业科学院作物科学研究所, 北京 100081
2. Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
水稻是世界主要粮食作物之一, 水稻生产常年遭受各类病虫的危害, 其中白背飞虱(Sogatella furcifera Horváth)是危害水稻生产的主要害虫之一[1-2], 其通过刺吸取食水稻汁液, 影响水稻产量及品质, 严重时导致水稻完全枯死, 俗称“虱烧”[3]。此外, 白背飞虱还是水稻南方黑条矮缩病(southern rice black-streaked dwarf virus disease, SRBSDVD)的传播介体, 自2000年左右首次发现以来, 其危害面积逐年扩大, 2010年我国南方稻区, SRBSDVD危害面积达36万hm2[4-5]。目前, 防治白背飞虱及其传播的病毒病最常用的手段是喷施化学农药, 农药的长期过量使用不仅增加了生产成本, 污染环境, 杀死稻飞虱的天敌, 而且也会促使昆虫抗药性的产生。利用抗性品种, 被认为是防治白背飞虱最经济、有效、环保的途径。此外, 由于SRBSDVD不经卵传毒, 进行SRBSDVD抗性鉴定, 不仅需要大量的白背飞虱虫源, 而且每一代白背飞虱还需重新带毒, 鉴定较为复杂, 导致水稻抗SRBSDVD研究进展缓慢, 尚未发现SRBSDVD有效抗源[6]。因此, 抗白背飞虱基因的发掘, 不仅对白背飞虱防治, 同时对其传播的SRBSDVD的防治也将具有重要意义。
迄今, 已报道8个水稻抗白背飞虱主基因, 仅完成了1个基因的精细定位, 尚未有基因被克隆。Sidhu等[7]和黄得润等[8]将水稻品种‘N22’中的抗白背飞虱基因Wbph1定位于第7染色体短臂RFLP标记RG146和RG445附近。刘志岩等[9]利用水稻品种‘ARC10239’将抗白背飞虱基因Wbph2定位于第6染色体。Wbph3、Wbph4和Wbph5在染色体上的位置尚不明确[8, 10]。李西明等[11]将水稻品种‘鬼衣谷’中的抗白背飞虱基因Wbph6定位在第11条染色体短臂。此外, 从药用野生稻衍生系B5中鉴定了2个抗白背飞虱基因Wbph7(t)和Wbph8(t), 分别定位于第3染色体和第4染色体[12-14]。利用春江06/TN1群体, 将qWL6精细定位在第6染色体短臂标记M3和M5之间约122 kb区间[15]。
前人研究发现, 稻飞虱对抗性基因往往具有较强的适应性, 常导致品种抗性丧失, 因此需不断发掘新的抗性基因[16-18]。本研究利用高抗白背飞虱的籼稻品种‘IR13427-45-2-1-2-2-2’(‘IR13427’)与感虫粳稻品种‘宁粳3号’构建F2群体, 进行抗白背飞虱基因的遗传分析和定位, 旨在发掘新的抗性基因, 为抗白背飞虱基因的精细定位、克隆及育种利用提供新抗源。
1 材料与方法 1.1 材料供试水稻品种‘IR13427’为来源于国际水稻研究所的籼稻品种, 高抗白背飞虱[19]; ‘宁粳3号’是早熟晚粳品种, 高感白背飞虱。以‘IR13427’为母本、‘宁粳3号’为父本构建了一个包含92个单株的F2分离群体, 并自交, 分单株收种, 获得相应的F2:3家系。感虫品种‘越光’作为鉴定时的保护行。
1.2 虫源白背飞虱虫源于2014年6月采集于广西防城港市, 在南京农业大学人工气候室饲养于耐虫籼稻品种‘93-11’, 作为鉴定虫源。人工气候室相对湿度为60%, 黑暗时(23:00—08:00)温度为26 ℃, 光照时(08:00—23:00)温度为28 ℃。
1.3 白背飞虱抗性鉴定水稻抗白背飞虱表型的鉴定采用改进苗期集团鉴定法[20]。每个家系2个重复, 每个重复30~35粒种子, 浸泡2 d, 催芽1 d后将露白的种子播于直径为10 cm且装有营养土的塑料圆钵内, 各家系随机分布于周转箱中, 周转箱外侧播种‘越光’作为保护行, 防止人为因素影响白背飞虱的活动。待苗长至1叶1心期(约播种后4~5 d), 淘汰弱苗和小苗, 以保证幼苗一致, 每钵保留2~30株幼苗。每株接种20头左右2~3龄的白背飞虱若虫, 待感虫亲本‘宁粳3号’完全死亡后, 开始统计各个家系死苗率。抗性级别划分参照IRRI的分级标准(表 1)。
| 死苗率/% Mortality rate | 为害级别Damage rating | 抗性水平Resistance level |
| <1.0 | 0 | 高抗High resistance |
| 1.1~10.0 | 1 | 抗Resistance |
| 10.1~30.0 | 3 | 中抗Moderate resistance |
| 30.1~50.0 | 5 | 中感Moderate susceptable |
| 50.1~70.0 | 7 | 感Susceptable |
| >70.1 | 9 | 高感High susceptable |
亲本及F2单株剪取适量叶片于2.0 mL EP管中, 加入直径为5 mm的钢珠, 盖紧EP管放入液氮速冻1 min左右, 取出置于磨样机, 将叶片打碎后倒出钢珠; 加入600 μL CTAB提取液, 65 ℃水浴30 min, 水浴期间每5 min振荡1次; 加入400 μL(CTAB溶液的0.6~1.0倍)氯仿异戊醇(体积比为24:1), 上下颠倒4~5次; 将EP管放入离心机, 12 000 r·min-1离心5 min; 吸取200~300 μL上清液至1.5 mL EP管中, 加入0.6倍异丙醇后轻轻颠倒混匀, 放置-20 ℃冰箱30 min; 12 000 r·min-1离心5 min, 去除上清液, 收集沉淀物; 加入300 μL 70%乙醇, 洗涤5 min, 12 000 r·min-1离心5 min, 去除上清液; 将沉淀置于超净工作台吹干, 加入200 μL TE溶液, -20 ℃保存。
1.5 PCR反应反应体系为:模板DNA(10 ng·μL-1)2.0 μL, 引物(2 pmol·μL-1)1.5 μL, 10×Buffer(Mg2+)2.0 μL, dNTP(2.5 mmol·L-1)0.2 μL, rTaq 0.1 μL, ddH2O 4.2 μL。PCR反应程序为:95 ℃预变性5 min; 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸40 s, 循环33次; 72 ℃延伸10 min; 4 ℃保存10 min。PCR扩增产物通过80 g·L-1非变性PAGE胶检测, 银染显色后, 于灯箱上读取数据。
1.6 连锁分析及QTL检测利用亲本间具有多态的DNA标记, 选取12个极抗和10个极感家系用于初步连锁分析。发现连锁迹象后, 构建相应染色体的连锁图谱, 进行QTL检测。抗虫亲本‘IR13427’带型的个体赋值为1, 具有感虫亲本‘宁粳3号’带型的个体赋值为2, 同时具有双亲带型(杂合性)的个体赋值为3, 数据缺失赋值为0。利用MAPMAKER/EXP Version 3.0软件进行抗白背飞虱QTL检测, 以LOD≥2.0判断阈值QTL是否存在, 利用MapMaker 3.0绘制遗传图谱[21]。
2 结果与分析 2.1 ‘IR13427’与‘宁粳3号’对白背飞虱抗性比较利用苗期集团鉴定法对亲本‘IR13427’和‘宁粳3号’进行抗白背飞虱鉴定, 结果如图 1所示, 感虫亲本‘宁粳3号’在接种白背飞虱7 d左右, 死苗率达89%, 而抗虫亲本死苗率不到10%, 与前人报道相一致[19]。以上结果表明, ‘IR13427’高抗白背飞虱, 而‘宁粳3号’高感白背飞虱。
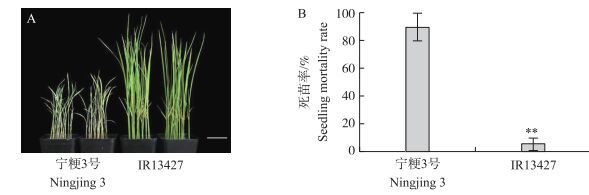
|
图 1 接种白背飞虱7 d后‘宁粳3号’与‘IR13427’对白背飞虱的抗性对比 Figure 1 Comparison of white-backed plant hopper(WBPH)resistance in'Ningjing 3' and'IR13427'at 7 days post infestation with WBPH **P<0.01;标尺(Bar)=3 cm。 |
对92个F2:3家系进行白背飞虱抗性鉴定, 参照IRRI分级标准, 将抗性等级分为0~9级(图 2), 其中0~2级为纯合抗虫(RR); 3~6级属于杂合性(Rr); 7~9级为纯合感虫(rr)[22]。结果发现:92个F2:3家系中RR、Rr、rr的分离比例为45:14:33, 适合性测验表明RR、Rr和rr的分离不符合1:2:1的孟德尔遗传分离比例(χ2=47.65), 表示‘IR13427’对白背飞虱的抗性应该是由数量遗传基因位点(QTL)所控制。
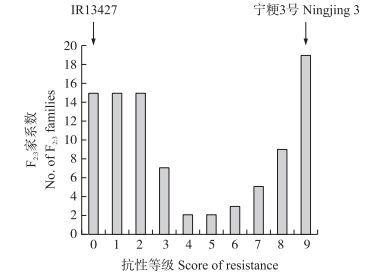
|
图 2 IR13427/宁粳3号F2:3群体白背飞虱抗性等级次数分布 Figure 2 Frequency distribution of the WBPH-resistance score in IR13427/Ningjing 3 F2:3 population |
根据表型鉴定统计结果, 选取12个极抗白背飞虱和10个极感白背飞虱的家系, 利用约180个均匀分布于12条染色体的多态性分子标记, 进行抗白背飞虱基因的初步连锁分析。结果表明:在第5、6和9染色体发现连锁迹象, 利用92个F2单株和40对SSR标记构建这3条染色体的连锁图谱, 结合各F2单株后代的抗白背飞虱表型数据, 利用MAPMAKER/EXP Version 3.0软件, 在第5和第6染色体检测到2个抗白背飞虱位点(图 3), 分别位于标记RM305~RM26(25.10 cM)和RM3414~M6(14.30 cM), LOD值分别为2.42和3.28, 贡献率分别为11.90%和18.30%(表 2), 但在第9染色体并没有检测到抗性位点。2个QTL抗性基因均来自于抗虫亲本‘IR13427’, 分别命名为qWBPH5和qWBPH6。
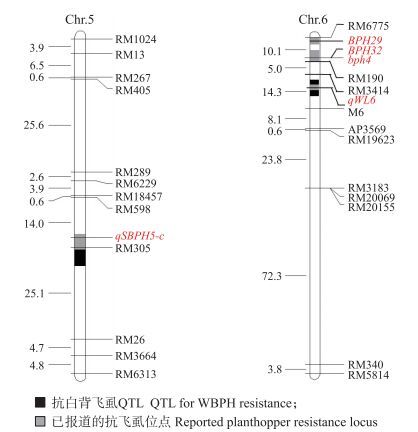
|
图 3 IR13427/宁粳3号F2群体检测到的抗白背飞虱QTL位点在染色体上的分布 Figure 3 Chromosomal location of QTL for WBPH resistance detected in IR13427/Ningjing 3 F2 population |
| QTL | 染色体 Chromosome |
标记区间 Marker interval |
遗传距离/cM Genetic distance |
LOD值 LOD score |
贡献率/% Variance explained |
加性效应 Additive effect |
| qWBPH5 | 5 | RM305~RM26 | 25.10 | 2.42 | 11.90 | -0.166 0 |
| qWBPH6 | 6 | RM3414~M6 | 14.30 | 3.28 | 18.30 | -0.181 5 |
| 注:“-”表示抗性等位基因来自于‘IR13427’。“-”indicates resistance alleles came from‘IR13427’. | ||||||
利用品种抗性是防治白背飞虱及其传播病毒病最经济且有效的手段。依赖表型选择的传统育种方式, 培育抗虫品种, 工作量大、盲目性强、周期长, 难以满足生产需求。通过分子标记辅助选择(molecular assisted selection, MAS)技术, 可显著提高抗虫育种的效率, 缩短育种年限。而抗白背飞虱基因的发掘及其紧密连锁标记的开发, 是利用MAS培育抗性品种的前提与基础。然而受到虫源繁殖、接种鉴定等因素的制约, 水稻抗白背飞虱研究相对较为滞后。此外, 稻飞虱对抗性品种具有较强的适应性, 常常在较短时间内导致品种抗性丧失, 又大大加剧了抗白背飞虱育种的难度。为此, 需不断发掘新的抗性基因, 以应对稻飞虱新种群的产生。
为解析籼稻品种‘IR13427’抗白背飞虱的遗传基础, 发掘抗白背飞虱新基因, 本研究构建了‘IR13427’与感虫品种‘宁粳3号’遗传群体, 利用该群体分别在水稻第5和第6染色体检测到2个抗性QTL(qWBPH5和qWBPH6)。与前人发掘的抗白背飞虱QTL位点比较分析, 发现之前尚未在水稻第5染色体检测到抗白背飞虱QTL, 表明本研究在第5染色体标记RM305~RM26之间检测到的qWBPH5为一个新的抗白背飞虱QTL。同时, 与之前定位的抗褐飞虱和灰飞虱基因QTL进行比较, 发现qWBPH5与Tuyen等[23]利用Rathu Heenati/02428 F2及BC1群体检测到的抗灰飞虱QTL qSBPH5-c位于相同的染色体区间。‘IR13427’携带的qWBPH5是否兼抗灰飞虱, qWBPH5与qSBPH5-c是否为同一基因, 将有待进一步研究。
目前已在水稻第6染色体短臂检测到多个抗稻飞虱位点, 表明该染色体区段为抗稻飞虱基因热点区。通过比较发现, qWBPH6与已被精细定位的抗白背飞虱基因qWL6位于相同的染色体区间, 表明qWBPH6可能与qWL6等位, 也进一步证实了在该区间存在一个稳定的抗白背飞虱位点。研究发现, ‘IR13427’不仅高抗白背飞虱, 同时还兼抗褐飞虱[19]。目前已在水稻第6染色体短臂检测到多个水稻抗褐飞虱基因[24-27]。qWBPH6是否兼抗褐飞虱, 也有待进一步研究证明。除第5和第6染色体外, 利用抗、感极端个体还在水稻第9染色体发现有连锁迹象, 然而并未在该染色体检测到抗白背飞虱QTL。分析原因有可能是第9染色体上的位点效应较小, 另外本研究所用的遗传群体相对较小, 只是一次的鉴定结果, 从而导致一些微小位点没有被检测到。今后将扩大群体, 多点多次鉴定, 验证qWBPH5和qWBPH6的稳定存在, 并检测其他染色体的微效位点, 进一步进行该群体抗白背飞虱QTL的检测。
本研究解析了籼稻品种‘IR13427’抗白背飞虱的遗传基础, 同时发掘的2个抗白背飞虱QTL及其连锁标记的鉴定, 将为利用分子标记辅助选择培育抗白背飞虱水稻新品种提供有用的基因资源和技术支撑。
| [1] |
徐安隆, 陈曙, 贺文爱, 等. 水稻抗褐飞虱与白背飞虱研究进展[J].
南方农业学报, 2015, 46(9): 1628–1635.
Xu A L, Chen S, He W A, et al. Progress on rice resistance to brown planthopper and white-backed planthopper[J]. Journal of Southern Agriculture, 2015, 46(9): 1628–1635. (in Chinese with English abstract) |
| [2] |
邓伟, 胡兰香, 陈红萍, 等. 水稻抗白背飞虱研究进展[J].
江西农业学报, 2012, 24(1): 91–97, 105.
Deng W, Hu L X, Chen H P, et al. Research progress in resistance of rice to Sogatella furcifera[J]. Acta Agriculturae Jiangxi, 2012, 24(1): 91–97, 105. (in Chinese with English abstract) |
| [3] | Yamasaki M, Yoshimura A, Yasui H. Genetic basis of ovicidal response to white-backed planthopper(Sogatella furcifera Horváth)in rice(Oryza sativa L.)[J]. Molecular Breeding, 2003, 12(2): 133–143. DOI: 10.1023/A:1026018821472 |
| [4] |
周国辉, 张曙光, 邹寿发, 等. 水稻新病害南方水稻黑条矮缩病发生特点及危害趋势分析[J].
植物保护, 2010, 36(2): 144–146.
Zhou G H, Zhang S G, Zou S F, et al. Occurrence and damage analysis of a new rice dwarf disease caused by Southern rice black-streaked dwarf virus[J]. Plant Protection, 2010, 36(2): 144–146. (in Chinese with English abstract) |
| [5] | Zhang H M, Yang J, Chen J P, et al. A black-streaked dwarf disease on rice in China is caused by a novel fijivirus[J]. Archives of Virology, 2008, 153(10): 1893–1898. DOI: 10.1007/s00705-008-0209-4 |
| [6] |
郭荣, 周国辉, 张曙光. 水稻南方黑条矮缩病发生规律及防控对策初探[J].
中国植保导刊, 2010, 30(8): 17–20.
Guo R, Zhou G H, Zhang S G. Study on the occurrence and control of Southern rice black-streaked dwarf virus disease[J]. China Plant Protection, 2010, 30(8): 17–20. (in Chinese with English abstract) |
| [7] | Sidhu G S, Khush G S, Medrano F G. A dominant gene in rice for resistance to white-backed planthopper and its relationship to other plant characteristics[J]. Euphytica, 1979, 28(2): 227–232. DOI: 10.1007/BF00056579 |
| [8] |
黄得润, 龚俊义. 水稻抗褐飞虱与白背飞虱基因定位研究进展[J].
科技通报, 2009, 25(4): 412–418.
Huang D R, Gong J Y. Advances in molecular mapping of resistance genes to brown planthopper and whitebacked planthopper in rice[J]. Bulletin of Science and Technology, 2009, 25(4): 412–418. (in Chinese with English abstract) |
| [9] |
刘志岩, 刘光杰, 寒川一成, 等. 水稻抗白背飞虱基因Wbph2的初步定位[J].
中国水稻科学, 2002, 16(4): 311–314.
Liu Z Y, Liu G J, Han C Y C, et al. Mapping the gene Wbph2 in ARC10239 resistant to the whitebacked planthopper, Sogatella furcifera in rice[J]. Chinese Journal of Rice Science, 2002, 16(4): 311–314. (in Chinese with English abstract) |
| [10] | Wu C F, Khush G S. A new dominant gene for resistance to whitebacked planthopper in rice[J]. Crop Science, 1985, 25(3): 505–509. DOI: 10.2135/cropsci1985.0011183X002500030017x |
| [11] |
李西明, 闵绍楷, 熊振民, 等. 水稻品种对白背飞虱的抗源筛选及其抗性遗传分析[J].
遗传学报, 1987, 14(6): 413–418.
Li X M, Min S K, Xiong Z M, et al. Screening of rice germplasms resistant to white-backed planthopper and their genetic analysis[J]. Acta Genetica Sinica, 1987, 14(6): 413–418. (in Chinese with English abstract) |
| [12] | Tan G X, Weng Q M, Ren X, et al. Two white-backed planthopper resistance genes in rice share the same loci with those for brown planthopper resistance[J]. Heredity, 2004, 92(3): 212–217. DOI: 10.1038/sj.hdy.6800398 |
| [13] | Buna W, Zhen H, Li H S, et al. Mapping of two new brown planthopper resistance genes from wild rice[J]. Chinese Science Bulletin, 2001, 46(13): 1092–1095. DOI: 10.1007/BF02900685 |
| [14] | Huang Z, He G, Shu L, et al. Identification and mapping of two brown planthopper resistance genes in rice[J]. Theoretical and Applied Genetics, 2001, 102(6/7): 929–934. |
| [15] | Yang Y L, Xu J, Leng Y J, et al. Quantitative trait loci identification, fine mapping and gene expression profiling for ovicidal response to whitebacked planthopper(Sogatella furcifera Horvath)in rice(Oryza sativa L.)[J]. BMC Plant Biology, 2014, 14(1): 1–16. DOI: 10.1186/1471-2229-14-1 |
| [16] |
朱麟, 古德祥, 张古忍. 水稻抗性品种对褐飞虱和白背飞虱羧酸酯酶活力影响的比较研究[J].
中山大学学报(自然科学版), 2003, 39(Suppl 2): 67–71.
Zhu L, Gu D X, Zhang G R. Comparative study on the effects of rice resistance on the activity of acetic acid and vinegar in brown planthopper and white-backed planthopper[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2003, 39(Suppl 2): 67–71. (in Chinese with English abstract) |
| [17] |
朱麟, 张古忍, 古德祥. 抗性水稻品种对褐飞虱和白背飞虱种群参数的影响[J].
昆虫知识, 2002, 39(4): 265–268.
Zhu L, Zhang G R, Gu D X. Effects of resistance rice varieties on population parameters of brown planthopper and white-backed planthopper[J]. Entomological Knowledge, 2002, 39(4): 265–268. DOI: 10.7679/j.issn.2095-1353.2002.076 (in Chinese with English abstract) |
| [18] |
张富铁, 庄延, 杨之帆, 等. 药用野生稻应答稻飞虱取食过程中基因表达的研究[J].
武汉植物学研究, 2005, 23(1): 1–6.
Zhang F T, Zhuang Y, Yang Z F, et al. Wild rice gene expression in response to brown planthopper(Nilaparvata lugens Stål)feeding and white-backed planthopper(Sogatella furcifera Horváth)feeding[J]. Journal of Wuhan Botanical Research, 2005, 23(1): 1–6. (in Chinese with English abstract) |
| [19] |
黄凤宽, 黄所生, 吴碧球, 等. 抗褐飞虱兼抗白背飞虱水稻种质资源发掘[J].
植物保护, 2012, 38(4): 152–155.
Huang F K, Huang S S, Wu B Q, et al. Screening of rice germplasms resistant to brown planthopper(BPH)and white-backed planthopper(WBPH)[J]. Plant Protection, 2012, 38(4): 152–155. (in Chinese with English abstract) |
| [20] |
俞晓平, 巫国瑞, 胡萃. 水稻品种对白背飞虱的抗性及其与稻株营养成分的关系[J].
中国水稻科学, 1989, 3(2): 56–61.
Yu X P, Wu G R, Hu C. The rice varietal resistance to white-backed planthopper(Sogatella furcifera)and the relationship between the nutrients in rice plants and varietal resistance[J]. Chinese Journal of Rice Science, 1989, 3(2): 56–61. (in Chinese with English abstract) |
| [21] |
刘仁虎, 孟金陵. MapDraw, 在Excel中绘制遗传连锁图的宏[J].
遗传, 2003, 25(3): 317–321.
Liu R H, Meng J L. MapDraw:amicrosoft excel macro for drawing genetic linkage maps based on given genetic linkage data[J]. Genetics, 2003, 25(3): 317–321. (in Chinese with English abstract) |
| [22] |
刘光杰, 付志红, 沈君辉, 等. 水稻品种对稻飞虱抗性鉴定方法的比较研究[J].
中国水稻科学, 2002, 16(1): 52–56.
Liu G J, Fu Z H, Shen J H, et al. Comparative study on evaluation methods for resistance to rice planthoppers(Homoptera:Delphacidae)in rice[J]. Chinese Journal of Rice Science, 2002, 16(1): 52–56. (in Chinese with English abstract) |
| [23] | Tuyen L Q, Liu Y, Jiang L, et al. Identification of quantitative trait loci associated with small brown planthopper(Laodelphax striatellus Fallen)resistance in rice(Oryza sativa L.)[J]. Hereditas, 2012, 149(1): 16–23. DOI: 10.1111/more.2012.149.issue-1 |
| [24] | Sun L, Liu Y, Jiang L, et al. Identification of quantitative trait loci associated with resistance to brown planthopper in the indica rice cultivar Col.5 Thailand[J]. Hereditas, 2007, 144(2): 48–52. DOI: 10.1111/j.2006.0018-0661.01932.x |
| [25] | Kawaguchi M, Murata K, Ishii T, et al. Assignment of a brown planthopper(Nilaparvata lugens Stål)resistance gene bph4 to the rice chromosome 6[J]. Breeding Science, 2001, 51(1): 13–18. DOI: 10.1270/jsbbs.51.13 |
| [26] | Wang Y, Cao L, Zhang Y, et al. Map-based cloning and characterization of BPH29, a B3 domain-containing recessive gene conferring brown planthopper resistance in rice[J]. Journal of Experimental Botany, 2015, 66(19): 6035–6045. DOI: 10.1093/jxb/erv318 |
| [27] | Ren J, Gao F, Wu X, et al. Bph32, a novel gene encoding an unknown SCR domain-containing protein, confers resistance against the brown planthopper in rice[J]. Scientific Reports, 2016, 6: 37645. DOI: 10.1038/srep37645 |




