文章信息
- 杨松青, 安立昆, 严远鑫
- YANG Songqing, AN Likun, YAN Yuanxin
- 玉米性别决定基因TS2的表达模式分析
- The gene expression analysis of tasselseed2 in maize organs/tissues
- 南京农业大学学报, 2017, 40(5): 936-940
- Journal of Nanjing Agricultural University, 2017, 40(5): 936-940.
- http://dx.doi.org/10.7685/jnau.201612019
-
文章历史
- 收稿日期: 2016-12-11
玉米(Zea mays L.)是雌雄同株异花植物, 其雌、雄花序的大小和发育的同步性是其产量形成的基础条件, 研究玉米雌、雄花序发育的机制对于培育高产优质品种具有重要的指导意义。而玉米的雌、雄花序发育起始于玉米的侧芽分生组织、(茎)顶端分生组织的两性原基, 通过性别决定过程和花发育过程来实现。
玉米茎尖(侧芽)的两性原基演化为单性花的过程就是玉米的性别决定过程。玉米缺乏性染色体, 其性别决定是通过调控一系列决定雌、雄花发育基因的表达来实现的。玉米是研究雌雄同株异花的模式植物, 对其性别决定机制已有研究[1]。分离玉米雌、雄花序性别转换或花序结构变异的突变体, 对于认识玉米性别决定的分子机制极其重要。目前已经分离到的重要突变体有ts 1、ts2、Ts3、ts4、Ts5、Ts6、sk1、d1、d2、d3、d5、D8、D9、an1等[2]。从这些突变体中已克隆到多个性状控制基因, 对这些基因的功能分析发现激素调控在玉米性别决定中起关键作用[2-4]。目前已发表的资料表明赤霉素(gibberellin, GA)、茉莉酸(jasmonic acid, JA)和油菜属内酯(brassinolide, BR)直接参与玉米性别决定过程[2-4]。其中关于GA和JA的作用研究最多、证据也最充足。Nickerson等[5]报道, 连续多次滴加一定浓度的GA3溶液至玉米植株喇叭口, 引起玉米雄穗长出花丝, 表现出雄穗雌性化。an 1、d1、D8等赤霉素合成或信号传递突变体的雌穗都长出雄性的单性小穗, 表现出雌穗雄性化[2], 即在雌穗上长出雄性小穗。这些证据说明赤霉素是玉米雌穗性别决定的关键因素。另一类突变体如ts 1、ts2、Ts3等表现雄穗雌性化, 即在雄穗上长出花丝, 如果授粉可以结实, 称为雄穗结实(tasselseed)。TS 1、TS2是玉米雄穗发育的关键基因, 缺失其中任何一个, 雄穗性别决定失败, 形成雄穗结实:ts 1(tasselseed1)或ts2(tasselseed2 )[6]。Delong等[7]通过Ac转座子标签克隆法从ts 2突变体中克隆到了TS 2基因, 它编码一个短链乙醇脱氢酶(short-chain alcohol dehydrogenase/reductase, SDR)。Wu等[8]利用蛋白质的体外表达和纯化技术, 从大肠杆菌中分离得到了TS2重组蛋白, 用此蛋白进行了一系列的体外酶活性试验, 结果表明TS2蛋白对类固醇的3位、17位羰基有脱氢酶活性, 推测TS2在植物体内起3β-或17β-羟基类固醇脱氢酶或羰基/醌还原酶的作用。但这一结果及其以后的研究都未能说明TS2在植物体内的生理功能和在玉米性别决定中的作用。Acosta等[9]克隆到了TS 1 基因, 它编码一个脂氧合酶(lipoxygenase), 是茉莉酸合成途径中的一个关键酶, 首次证明JA是玉米雄穗性别决定的关键激素, 认为TS 1 在JA合成途径中的功能涉及TS 2基因, 因为JA连续处理ts 2突变体, ts2的雌性化雄穗也能被恢复成接近正常的雄穗。Acosta等[9]推测TS2蛋白可能参与了JA合成途径的β-氧化步骤。虽然在1993年就已经克隆到TS 2基因, 但至今其生理功能仍然未知。研究TS 2的生理功能对于深入研究玉米性别决定的分子机制十分重要。本文通过分析TS 2在各时期器官/组织和受激素诱导的表达模式, 有利于揭示TS 2在植物性别决定中的生理功能。
1 材料与方法 1.1 植物材料以玉米自交系B73为试验植物材料。
1.2 主要试剂与仪器植物激素赤霉素(G7645-1G)、水杨酸(SA, salicylic acid:S5922-100G)、萘乙酸(NAA, naphtaleneacetic acid:317918-100G)、脱落酸(ABA, abscisic acid:A1049-100MG)、茉莉酸(392707-5ML)、乙烯合成前体1-氨基环丙烷羧酸(ACC, l-aminocyclopropane-l-carboxylic acid:P201735-1G), 购自Sigma公司。Trizol(ET111)、DNaseⅠ(GD201-01) 和反转录试剂盒(EasyScript First-Strand cDNA Synthesis SuperMix, AE301-03) 购自全式金公司。用荧光定量PCR试剂盒(THUNDERBIRD SYBR qPCR Mix, TOYOBO公司, QPS-201) 进行cDNA第1链合成。Oligo dT18为cDNA合成引物。使用实时定量PCR仪(Bio-Rad CFX96, Bio-Rad公司)进行TS 2 实时定量扩增。
1.3 试验方法 1.3.1 材料处理选取饱满的玉米自交系B73种子, 播种于人工混合营养土(蛭石、有机基质、泥土体积比为1:1:1) 中, 在温度26~32 ℃, 相对湿度70%~85%, 自然光照12~14 h的条件下培养。取V1~V11期叶片中段、V1~V8期植株的茎尖、V3期的叶片和根(玉米生长发育时期:V1指1叶1心期, V2指2叶1心期, 依次类推。V1~Vn详见https://extension.entm.purdue.edu/fieldcropsipm/corn-stages.php)作为RNA提取样本。V8期取穗位叶、雄穗, V11期取雌穗、气生根、节间、花丝为样本。
激素处理在V3期进行, 分别喷施100 μmol·L-1的GA、NAA、ABA、ACC、JA和2.5 mmol·L-1的SA溶液(含0.01%Tween-20), 喷施全部叶片表面至液滴滴落为止。激素处理后0、6、12、24、48、72 h剪取第3叶中段为样本, 将其用样品铝箔纸包裹迅速放于液氮中冷冻, -80 ℃保存以备后用。每个处理选取1株作为1个样本, 共3个样本(即3个生物学重复样本)。
1.3.2 总RNA的提取按Trizol试剂盒说明书提取总RNA。
1.3.3 cDNA第1链合成按反转录试剂盒EasyScript First-Strand cDNA Synthesis SuperMix说明书合成cDNA第1链。
1.3.4 实时荧光定量PCR(real-time quantitative PCR, qPCR)分析根据TS 2 基因序列[7]设计qPCR引物(表 1), 以cDNA为模板, 对TS 2 基因进行实时定量PCR扩增。每个反应设3次重复, 3个CT值取平均值计算。根据2-ΔΔCT计算基因的相对表达量。试验设3个生物学重复。反应体系为Primer F/R各1.0 μL(10 pmol·μL-1), cDNA 2.0 μL(相当于50 ng总RNA), THUNDERBIRD SYBR qPCR Mix 10 μL, ddH2O 6.0 μL, 共20 μL。内参基因为EIF 4 α。
| 基因名称Gene name | 引物序列(5′→3′) Primer sequence | 退火温度/℃ Annealing temperature |
| TS2-F | ACGCTCAGGTCCAGGGACAT | 58.0 |
| TS2-R | CGATCACTTCAAGTACAACTAATAGCAG | 56.0 |
| EIF4α-F | CGTCCAGAGGTTCTACAA | 59.7 |
| EIF4α-R | CATCCTTCGCCACAATAC | 59.7 |
荧光定量PCR分析了TS 2基因在玉米V1~V11的各个时期叶片(最长叶中段)和茎尖中的表达量。结果显示:TS 2在各个时期叶片中均有不同程度的表达, 以V8期叶片中的表达量为最高, 以后各时期表达量下降, 但生殖生长时期(V8~V11) 的表达量始终高于苗期(V1~V7)(图 1)。茎尖中TS 2 表达的趋势与叶片一致。苗期V1~V7茎尖中TS 2表达量一直很低, V5~V7茎尖TS 2 表达量显著低于叶片, 但到V8期茎尖中的表达量大幅度增加, 提高了20多倍, 这时茎尖中的表达量极显著高于叶片(图 1)。
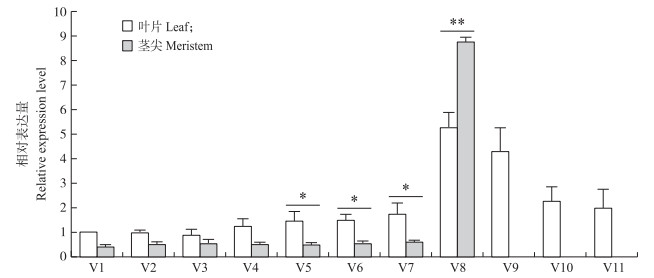
|
图 1 不同时期玉米叶片和茎尖中TS 2基因的表达特性
Figure 1 Expression profiling of TS 2 in leaves and meristem of maize at different development stages
1)*和* *表示在0.05和0.01水平上差异显著。* and * * indicate significant difference at 0.05 and 0.01 levels. 2) V1表示1叶1心期, V2表示2叶1心期, 依次类推。V1 indicates the stage of one fully expanded leaf with a short new leaf, V2 indicates the stage of two fully expanded leaves with a short new leaf, and so on. |
为了进一步了解TS 2基因在玉米植株各部位(器官或组织)的表达情况, 取V3期的叶片、根, V8期的穗位叶、雄穗(长度1~2 cm), 开花期(V11) 的雌穗、节间分生组织、花丝、气生根为RNA提取样本进行TS 2的表达量分析。同一时期的组织取自同一棵植株。结果如图 2所示:在选取的8个器官(组织)中TS 2 都有不同程度的表达。雄穗、雌穗、穗位叶和节间分生组织的表达量显著高于V3期叶片和根的表达量, 其中, 穗位叶与V3期的叶片比较, TS 2 的表达提高了5倍, 说明TS 2 的功能主要表现在玉米的生殖生长时期。营养器官中TS 2 的表达以节间分生组织为最高, 预示着TS 2 可能在花序发育过程中起重要作用。
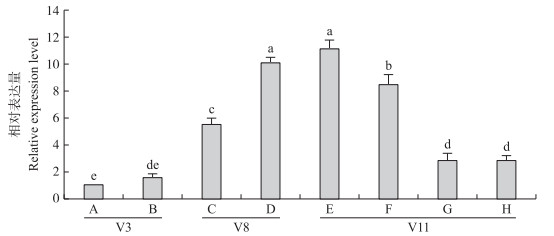
|
图 2 不同生长期玉米各组织中TS 2基因的表达特性
Figure 2 Expression profiling of TS 2 in different tissues of maize
1) A叶片Leaf; B根Root; C穗位叶Ear leaf; D雄穗Tassel; E雌穗Ear; F节间Internode; G花丝Silk; H气生根Brace root. 2) 不同小字字母代表在0.05水平上差异显著。Different small letters on the vertical bars indicate significant difference at 0.05 level. |
在V3期选用生长一致的幼苗分别喷施6种激素。结果如图 3所示:促进植物生长类激素GA、SA、NAA抑制TS 2的表达, 100 μmol·L-1 GA和2.5 mmol·L-1 SA喷施后6 h的抑制作用最强烈, 以后逐渐减弱, 处理后72 h抑制作用很小; 100 μmol·L-1 NAA处理后6~48 h TS 2的表达量不足处理前的20%, 处理后72 h恢复至处理前的60%。相反, 抑制植物生长的激素ABA、ACC和JA促进TS 2的表达, 100 μmol·L-1 ABA处理后48 h TS 2表达量提高了5倍; 100 μmol·L-1 ACC处理后12~24 h TS 2表达水平逐步提高, 处理后24 h表达量最高, 是对照的5倍, 此后表达量开始降低。与NAA相对应, 100 μmol·L-1 JA处理对TS 2表达的促进作用非常强烈, JA处理后6 h TS 2表达提高至7倍, 24 h时提高了84倍。说明TS 2的表达对茉莉酸相当敏感, 由此可认为TS 2是依赖于茉莉酸信号的植物性别决定基因。
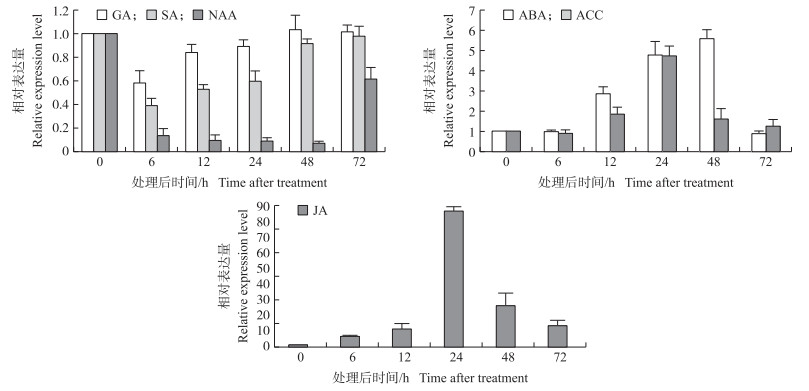
|
图 3 在V3期喷施外源植物激素对玉米TS 2 基因表达的影响 Figure 3 Effect of exogenous hormones treatment on expression level of TS 2 at V3 stage |
ts 1、ts2是典型的玉米雄穗雌性化突变体, 其雄穗的小穗雌性化率接近100%。Acosta等[9]研究发现ts 1突变体茎尖的JA水平低下, 外源茉莉酸滴加到6~7叶期的喇叭口可恢复ts 1、ts2的雄穗发育, 说明JA与ts 1、ts2突变关系密切, 推测TS1、TS2是JA合成途径中的酶类, 认为JA是玉米雄穗发育必需的信号分子。OPR(12-oxo-phytodienoic acid reductase)是JA合成途径中的另一个关键酶。Yan等[10]发现opr 7opr8双突变体的JA合成途径被阻断, 植株的各个器官的JA水平低下, opr 7opr8双突变体表现出同ts 1和ts2相似的表型, 即雄穗雌性化, 雄穗的小花雌性化率达100%, 结果再次证实JA是玉米雄穗性别决定的关键信号分子。TS 1和TS2是玉米性别决定过程的关键基因, 2个基因的突变表型相似, TS 1位于TS2上游[9], 暗示着TS 1和TS2在同一个信号转导途径中发挥作用。
Yamasaki等[6]基于赤霉素、TS 1、TS2和SK1的作用和预测功能, 建立了玉米雌、雄穗性别决定模型, 认为TS1、TS2共同产生了抑制雌蕊发育的“抑制因子”。该“抑制因子”就是JA或JA衍生物。但至今的研究结果都无法说明TS2是JA或JA衍生物合成的酶类。TS 2基因编码一个短链乙醇脱氢酶。而拟南芥的JA合成途径中却没有一个酶或酶的互作蛋白是SDR蛋白[11]。每种植物基因组都包含多个SDR蛋白质基因, 如拟南芥基因组含有178个SDR基因, 玉米和水稻各有200多个SDR基因[12]。多数植物SDR蛋白功能都未知, 只有少数SDR蛋白的生理功能明确。如拟南芥ABA2编码一个SDR蛋白, 它在ABA合成途径中催化黄质醛(xanthoxin)到ABA-醛(abscisic aldehyde)的反应, 称为黄质醛脱氢酶(xanthoxin dehydrogenase)[13]。
本文对TS 2基因的表达模式进行了分析, 试验结果表明, TS 2在营养器官(叶、根、茎)中有一定量的表达, 但在生殖器官(雄穗和雌穗)和茎尖中的表达量大大增加, 是叶片的9倍以上, 这说明TS 2参与了性别决定这个重要的生理过程。TS 2的表达水平受多种植物激素的影响, ABA、ACC、JA都可提高TS 2的表达量, 但以JA的诱导效应最大。JA处理后24 h TS 2的表达量提高了84倍, 说明TS 2是一个典型的JA依赖基因。试验结果暗示着植物在性别决定时期TS 2的表达水平势必受到体内茉莉酸信号的刺激而大量增加, 说明茉莉酸信号途径在植物的性别决定过程中起着重要的作用。但TS2蛋白作为一种在玉米性别决定中起关键作用的SDR蛋白质, 具有怎样的酶活性, 其产物是何种“抑制因子”[6], 有待进一步研究。
| [1] |
杨同文, 李潮海. 玉米性别决定的激素调控[J].
植物学报, 2012, 47(1): 65–73.
Yang T W, Li C H. Hormone regulation of sex determination in maize[J]. Chinese Bulletin of Botany, 2012, 47(1): 65–73. (in Chinese with English abstract) |
| [2] | Chuck G. Molecular mechanisms of sex determination in monoecious and dioecious plants[J]. Advances in Botanical Research, 2010, 54(10): 53–83. |
| [3] | Li Q, Liu B. Genetic regulation of maize flower development and sex determination[J]. Planta, 2017, 245(1): 1–14. DOI: 10.1007/s00425-016-2607-2 |
| [4] | Hartwig T, Chuck G S, Fujioka S, et al. Brassinosteroid control of sex determination in maize[J]. Proc Natl Acad Sci USA, 2011, 108(49): 19814–19819. DOI: 10.1073/pnas.1108359108 |
| [5] | Nickerson N H. Sustained treatment with gibberellic acid of five different kinds of maize[J]. Annals of the Missouri Botanical Garden, 1959, 46(1/2): 19–37. DOI: 10.2307/2394566 |
| [6] | Yamasaki S, Fujii N, Takahashi H. Hormonal regulation of sex expression in plants[J]. Vitamins and Hormones, 2005, 72: 79–110. DOI: 10.1016/S0083-6729(05)72003-3 |
| [7] | Delong A, Calderon-Urrea A, Dellaporta S L. Sex determination gene TASSELSEED2, of maize encodes a short-chain alcohol dehydrogenase required for stage-specific floral organ abortion[J]. Cell, 1993, 74(4): 757–768. DOI: 10.1016/0092-8674(93)90522-R |
| [8] | Wu X, Knapp S, Stamp A, et al. Biochemical characterization of TASSELSEED 2, an essential plant short-chain dehydrogenase/reductase with broad spectrum activities[J]. FEBS Journal, 2007, 274(5): 1172–1182. DOI: 10.1111/j.1742-4658.2007.05642.x |
| [9] | Acosta I F, Laparra H, Romero S P, et al. Tasselseed1 is a lipoxygenase affecting jasmonic acid signaling in sex determination of maize[J]. Science, 2009, 323(5911): 262–265. DOI: 10.1126/science.1164645 |
| [10] | Yan Y, Christensen S, Isakeit T, et al. Disruption of OPR7 and OPR8 reveals the versatile functions of jasmonic acid in maize development and defense[J]. Plant Cell, 2012, 24(4): 1420–1436. DOI: 10.1105/tpc.111.094151 |
| [11] | Wasternack C, Hause B. Jasmonates:biosynthesis, perception, signal transduction and action in plant stress response, growth and development. An update to the 2007 review in Annals of Botany[J]. Annals of Botany, 2013, 111(6): 1021–1058. DOI: 10.1093/aob/mct067 |
| [12] | Moummou H, Kallberg Y, Tonfack L B, et al. The Plant short-chain dehydrogenase(SDR)superfamily:genome-wide inventory and diversification patterns[J]. BMC Plant Biology, 2012, 12(1): 219. DOI: 10.1186/1471-2229-12-219 |
| [13] | González-Guzmán M, Apostolova N, Bellés J M, et al. The short-chain alcohol dehydrogenase ABA2 catalyzes the conversion of xanthoxin to abscisic aldehyde[J]. Plant Cell, 2002, 14(8): 1833–1846. DOI: 10.1105/tpc.002477 |




