文章信息
- 蒋雨鹤, 康大成, 周光宏, 张万刚
- JIANG Yuhe, KANG Dacheng, ZHOU Guanghong, ZHANG Wangang
- 两株发酵乳杆菌体外抗氧化活性研究
- Antioxidant activity in vitro of two strains of Lactobacillus fermentum
- 南京农业大学学报, 2017, 40(5): 915-920
- Journal of Nanjing Agricultural University, 2017, 40(5): 915-920.
- http://dx.doi.org/10.7685/jnau.201612050
-
文章历史
- 收稿日期: 2016-12-30
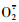 )清除率和氧自由基清除活性来评价2株发酵乳杆菌Y4、Y41的自由基清除能力,并通过测定抗氧化酶超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性探讨发酵乳杆菌的抗氧化机制。[结果]2株发酵乳杆菌的无细胞提取物具有较强的
)清除率和氧自由基清除活性来评价2株发酵乳杆菌Y4、Y41的自由基清除能力,并通过测定抗氧化酶超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性探讨发酵乳杆菌的抗氧化机制。[结果]2株发酵乳杆菌的无细胞提取物具有较强的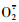 清除率和氧自由基清除能力,发酵上清液和菌悬液分别具有较强的DPPH自由基清除率和·OH清除率。菌株Y41的羟自由基及氧自由基清除能力均显著高于Y4(P < 0.05),其DPPH自由基清除率显著低于Y4;菌株Y41无细胞提取物
清除率和氧自由基清除能力,发酵上清液和菌悬液分别具有较强的DPPH自由基清除率和·OH清除率。菌株Y41的羟自由基及氧自由基清除能力均显著高于Y4(P < 0.05),其DPPH自由基清除率显著低于Y4;菌株Y41无细胞提取物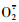 清除率显著高于Y4,但发酵上清液清除率显著低于Y4。此外,2株菌株无细胞提取物中均检测到具有SOD和GSH-Px活性。[结论]2株发酵乳杆菌都具有较高的抗氧化活性,其中菌株Y41的抗氧化能力更强,其中无细胞提取物具有更高的氧自由基清除能力和SOD活性。
清除率显著高于Y4,但发酵上清液清除率显著低于Y4。此外,2株菌株无细胞提取物中均检测到具有SOD和GSH-Px活性。[结论]2株发酵乳杆菌都具有较高的抗氧化活性,其中菌株Y41的抗氧化能力更强,其中无细胞提取物具有更高的氧自由基清除能力和SOD活性。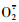 )and oxygen radical absorbance capacity were investigated to evaluate the antioxidant activities of two strains. The vitamin C was considered as the control. The activities of superoxide dismutase(SOD)and glutathione peroxidase(GSH-Px)were used to further explain the mechanism of antioxidant of two strains of L. fermentum.
[Results]
The cell-free extracts of two strains possessed the higher eliminating effects for
)and oxygen radical absorbance capacity were investigated to evaluate the antioxidant activities of two strains. The vitamin C was considered as the control. The activities of superoxide dismutase(SOD)and glutathione peroxidase(GSH-Px)were used to further explain the mechanism of antioxidant of two strains of L. fermentum.
[Results]
The cell-free extracts of two strains possessed the higher eliminating effects for 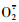 radicals and oxygen radical absorbance capacity, while the fermentation supernatants and the intact-cells fractions could be more efficient for clearing DPPH free radicals and
radicals and oxygen radical absorbance capacity, while the fermentation supernatants and the intact-cells fractions could be more efficient for clearing DPPH free radicals and 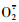 radicals. Each fraction of Y41 exhibited significantly higher scavenging rate on·OH and oxygen radical absorbance capacity while lower scavenging effects on DPPH free radicals than those of Y4(P < 0.05). As for the scavenging effect for
radicals. Each fraction of Y41 exhibited significantly higher scavenging rate on·OH and oxygen radical absorbance capacity while lower scavenging effects on DPPH free radicals than those of Y4(P < 0.05). As for the scavenging effect for 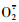 radicals, the cell-free extracts from strain Y41 showed higher ability to eliminate radicals compared to strain Y4 while the scavenging effects of fermentation supernatants was lower than Y4(P < 0.05). The cell-free extracts of two strains showed activities of SOD and GSH-Px.
[Conclusions]
Both of two strains had antioxidant ability and strain Y41 showed stronger antioxidant ability than strain Y4. The cell-free extracts of strain Y41 had higher oxygen radical absorbance capacity and SOD activity.
radicals, the cell-free extracts from strain Y41 showed higher ability to eliminate radicals compared to strain Y4 while the scavenging effects of fermentation supernatants was lower than Y4(P < 0.05). The cell-free extracts of two strains showed activities of SOD and GSH-Px.
[Conclusions]
Both of two strains had antioxidant ability and strain Y41 showed stronger antioxidant ability than strain Y4. The cell-free extracts of strain Y41 had higher oxygen radical absorbance capacity and SOD activity.
近年来, 越来越多的研究指出氧化应激与慢性疾病和人类的衰老之间有着密切的关联[1]。生命体氧化代谢过程中产生的过高水平的活性氧(ROS)会导致DNA、蛋白质和脂质的损伤, 对机体造成伤害[2], 而生命体自身会建立抗氧化防御体系, 然而这些体系无法一直保护机体免受氧化应激的作用[3]。因此, 如何增强机体的抗氧化屏障, 预防人类疾病与衰老, 成为当前领域的学术研究热点。
随着人们对健康饮食关注的日益增长, 相比于使用化学合成抗氧化剂, 安全、无毒的天然抗氧化剂逐渐成为业界更倾向的选择。研究表明, 乳酸菌是一种具有潜在健康效益的益生菌[4], 在抗氧化性方面已经得到许多体内、外试验的证实[5], 是一种良好的功能性天然抗氧化剂, 可以作为一种食源性抗氧化剂进行开发。
目前国内外对于乳酸菌抗氧化性能的评价主要有:自由基清除能力的测定、抗氧化酶活性检测、还原活性及脂质过氧化等。Kuda等[6]发现从鱼肠道中分离出的6株乳酸菌具有较强的DPPH自由基和羟自由基清除能力。在乳酸菌菌体及发酵产物中, SOD、CAT等抗氧化酶相继被发现[7]。Amanatidou等[8]发现乳酸菌可以通过调节SOD活性起到抗氧化作用。刘洋等[9]比较了4株乳酸菌的体外抗氧化能力, 发现发酵乳杆菌的无细胞提取物和发酵上清液均表现出最强的抗脂质过氧化能力。本试验选用DPPH自由基、羟自由基和超氧阴离子自由基来评价发酵乳杆菌的抗氧化特性, 这3种方法可产生与生物体系相似的自由基, 具有简便快速、易操作等优点。氧自由基清除能力的测定是根据自由基对荧光探针的破坏性而反映样品对氧自由基的抑制情况, 具有广谱适用性及较高的灵敏性。此外, 试验通过测定超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)这2种抗氧化酶的活性, 从酶活性的角度探究乳酸菌发挥抗氧化防御作用的机制。
目前用于研究乳酸菌抗氧化性的菌株主要来自于传统的发酵食品(如泡菜、酸奶)[10-12], 而较少对肉制品中的乳酸菌菌株进行研究。此外对于乳酸菌的抗氧化作用机制和各种存在形式的抗氧化活性比较的研究还不够透彻。因此本研究选用分离自金华火腿的2株发酵乳杆菌, 以自由基清除能力、氧自由基清除能力及抗氧化酶活性为指标, 对其菌悬液、无细胞提取物及发酵上清液的抗氧化活性进行检测, 以此来比较2株发酵乳杆菌的抗氧化性, 研究其抗氧化活性物质的分布情况, 为发酵乳杆菌天然抗氧化剂开发及应用提供参考。
1 材料与方法 1.1 材料与试剂2株供试菌株由本实验室分离自金华火腿。经生理生化试验和16S rDNA测序鉴定为发酵乳杆菌, 编号分别为Y4、Y41。
主要试剂:MRS肉汤购于北京陆桥有限公司; 1, 1-二苯基-2-三硝基苯肼(DPPH)购于美国Sigma公司; 四氮唑蓝(NBT)、还原型辅酶(NADH)和吩嗪甲酯硫酸盐(PMS)购于国药集团; 氧自由基清除力试剂盒购于Cell Biolabs公司; 超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购于南京建成科技有限公司; 其他试剂均为分析纯, 购于南京建成科技有限公司。
1.2 仪器与设备立式自动电热蒸汽灭菌锅LDX-50KBS购于上海申安医疗器械厂; 高速冷冻离心机Allegra 64R购于美国Beckman公司; 超声波破碎仪VCX 750, 购自美国SONICS & MATERIALS公司; Spectral Max M2e多功能酶标仪购于美国伯腾仪器有限公司; 水浴锅购于德国优莱博公司。
1.3 试验方法 1.3.1 发酵乳杆菌的培养及菌悬液、发酵上清液、无细胞提取物的制备发酵乳杆菌在MRS肉汤中37 ℃静置培养24 h, 培养2代后, 4 ℃ 6 000 r·min-1离心15 min, 收集上清液即为发酵上清液组。收集的菌体用无菌生理盐水洗涤3次, 并重悬至细胞浓度为1×109CFU·mL-1。将所得菌悬液分为两组, 一组作为菌悬液组, 另一组在250 W功率条件下冰浴超声波破碎, 超声处理5 s, 间隔5 s, 总超声时间为40 min, 10 000 g 4 ℃离心5 min, 保留上清液, 得到无细胞提取物组。
1.3.2 DPPH自由基清除能力测定参照杨英士等[13]的方法, 并略作改进。取1 mL样品和1 mL DPPH自由基溶液(0.2 mmol·L-1, 无水乙醇溶解), 充分混匀, 避光反应30 min, 于517 nm处测定其吸光值记为A样品; 对照组以1 mL无水乙醇代替DPPH自由基溶液, 吸光值记为A对照; 空白组以1 mL无水乙醇代替样品溶液, 吸光值记为A空白。DPPH自由基清除率=[1-(A样品-A对照)/A空白]×100%。
1.3.3 ·OH清除能力测定参考邢路娟等[14]的方法, 并作改进。取1 mL 0.02 mol·L-1 PBS(pH7.4) 于试管中, 依次加入1 mL 2.5 mmol·L-1邻二氮菲和1 mL去离子水, 充分混匀后, 加入1 mL 2.5 mmol·L-1 FeSO4溶液, 混匀(每管加入FeSO4后立即混匀)。然后加入1 mL样品溶液和1 mL 20 mmol·L-1 H2O2溶液, 37 ℃水浴1.5 h, 取出时立即冰浴。在536 nm处测定样品吸光值, 记为A样品; 以去离子水代替样品溶液, 吸光值记为A损伤; 以去离子水分别代替样品和H2O2溶液, 吸光值记为A未损伤。羟自由基清除率=(A样品-A损伤)/(A未损伤-A损伤)×100%。
1.3.4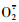
参考郑锦晓等[15]的方法, 并作适当改进。取样品1 mL, 依次加入0.5 mL 300 μmol·L-1四氮唑蓝(NBT)、0.3 mL 468 μmol·L-1还原型辅酶(NADH)以及0.5 mL 60 μmol·L-1吩嗪甲酯硫酸盐(PMS), 充分混匀后于25 ℃水浴, 5 min后在560 nm处测定吸光值, 记为A样品; 空白管用50 mmol·L-1的Tris-HCl缓冲溶液(pH8.0) 代替样品溶液, 于560 nm处测定吸光值, 记为A空白。以上试剂均使用Tris-HCl缓冲溶液配制。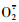
按照试剂盒说明操作。试剂盒中包含自由基引发剂偶氮二异丁脒盐酸盐(AAPH)、荧光素钠盐、水溶性维生素E和磷酸盐缓冲液等试剂。以每109个细胞的水溶性维生素E当量表示。
1.3.6 超氧化物歧化酶和谷胱甘肽过氧化物酶活性的测定按照试剂盒说明操作。
1.3.7 数据分析采用SAS 9.1统计软件分析。对两独立样本Y4及Y41测定的各指标先进行方差齐性检验, 再进行两均值双侧t检验。
2 结果与分析 2.1 发酵乳杆菌对DPPH自由基、羟自由基和超氧阴离子自由基的清除能力由表 1可知:菌株Y4和Y41均表现出一定的DPPH自由基清除能力, 但不同菌株不同形式之间差异较大。2株菌株的清除能力由大到小均依次表现为发酵上清液、菌悬液、无细胞提取物。菌株Y4菌悬液和无细胞提取物的清除能力均显著大于菌株Y41(P < 0.05), 而2株菌株发酵上清液的DPPH自由基清除能力无显著差异(P>0.05)。
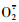
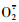
| % | ||||||||
| 存在形式 Existing form |
DPPH清除率 DPPH scavenging rate |
·OH清除率 ·OH scavenging rate |
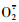 清除率 清除率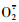 scavenging rate scavenging rate |
|||||
| Y4 | Y41 | Y4 | Y41 | Y4 | Y41 | |||
| 无细胞提取物Cell-free extracts | 19.29±0.47aC | 14.00±1.81bC | 27.52±0.51bC | 33.36±0.71aC | 62.92±0.76bA | 68.92±0.83aA | ||
| 发酵上清液Fermentation supernatants | 96.57±1.93aA | 95.85±1.04aA | 53.77±1.30bB | 58.98±0.93aB | 34.71±0.51aB | 29.19±0.61bB | ||
| 菌悬液Intact-cells | 26.50±2.63aB | 23.41±2.05bB | 78.56±0.54bA | 84.63±0.88aA | — | — | ||
| 注:同行中同一指标不同小写字母表示差异显著(P < 0.05);同列不同大写字母表示不同形式下同一指标差异显著(P < 0.05)。“—”未检测到。 Note: Values of the same index in the same row with different small letters are significantly different(P < 0.05). Values in the same column with different capital letters are significantly different(P < 0.05). “—”No detected. The same as follows. | ||||||||
菌株Y41的发酵上清液、菌悬液和无细胞提取物清除羟自由基(·OH)的能力均显著大于Y4, 且2株菌株不同形式之间清除能力差异较大, 菌悬液清除能力最强, 发酵上清液次之, 无细胞提取物清除能力最弱(表 1)。
2株菌株只有发酵上清液和无细胞提取物表现出清除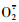
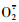
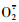
由表 2可知:无细胞提取物的氧自由基清除活性均显著高于菌悬液组, 且菌株Y41的2种形式都表现出比Y4更好的抗氧化活性。其中, 菌株Y41无细胞提取物的氧自由基清除活性最高, 为(682.59±9.6)×10-9μmol。
| 菌株 Strains |
细胞浓度/(CFU·mL-1) Cell concentration |
清除活性/(10-9μmol) Scavenging effect | |
| 菌悬液Intact-cells | 无细胞提取物Cell-free extracts | ||
| Y4 | 4×109 | 132.82±8.6bB | 409.76±8.2aB |
| Y41 | 2×109 | 185.17±10.2bA | 682.59±9.6aA |
| 注:细胞浓度为发酵乳杆菌在MRS肉汤中培养10 h的细胞浓度。The concentration of the cells cultured in MRS by 10 h. | |||
由图 1可见:反应体系中加入自由基引发剂以后, 荧光强度下降, 而加入样品菌株明显延缓了这种下降趋势, 表明样品菌株具有一定的氧自由基清除能力。
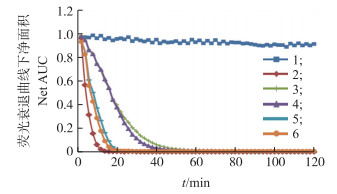
|
图 1 发酵乳杆菌的荧光强度随时间衰减曲线 Figure 1 The attenuation curve of fluorescence intensity of L. fermentum during different time 1:自然荧光衰减曲线; 2:体系中加入自由基引发剂以后的荧光衰减曲线; 3:稀释10倍的Y4菌悬液; 4:稀释10倍的Y41菌悬液; 5:稀释100倍的Y4无细胞提取物; 6:稀释100倍的Y41无细胞提取物。 1:The attenuation curve of fluorescence intensity without the reaction of the free radical initiator solution; 2:The attenuation curve of fluorescence intensity under the reaction of the free radical initiator solution; 3:The 10 times diluted intact-cells of Y4 strain; 4:The 10 times diluted intact-cells of Y41 strain; 5:The 100 times diluted cell-free extracts of Y4 strain; 6:The 100 times diluted cell-free extracts of Y41 strain. |
由表 3可知:菌株发酵上清液的SOD活性显著高于无细胞提取物, 且菌株Y41的SOD活性均显著高于Y4(P < 0.05)。另外, 2个菌株的发酵上清液中均未检测到GSH-Px活性, 但菌株Y4无细胞提取物中GSH-Px活性显著高于Y41(P < 0.05)。
| 存在形式 Existing form |
SOD活性/(U·mg-1)SOD activity | GSH-Px活性/(U·mg-1)GSH-Px activity | |||
| Y4 | Y41 | Y4 | Y41 | ||
| 无细胞提取物Cell-free extracts | 6.39±0.71bB | 8.40±0.48aB | 30.71±6.76a | 13.07±3.66b | |
| 发酵上清液Fermentation supernatants | 108.74±3.73bA | 118.46±6.34aA | — | — | |
本研究测定了分离自金华火腿的2株发酵乳杆菌不同存在形式的抗氧化能力, 结果表明不同形式对不同自由基的清除能力存在差异。刘少敏等[10]报道嗜酸乳酸菌和植物乳酸菌的不同形式抗氧化能力不同, 是因为其抗氧化机制不同且相对独立。本研究中, 菌株Y4和Y41的无细胞提取物具有较强的超氧阴离子自由基清除率及氧自由基清除活性, 表明发酵乳杆菌细胞内含有的抗氧化活性物质可高效地清除这两类活性氧自由基[16]。此外, 2株菌株的发酵上清液和菌悬液分别具有较强的清除DPPH自由基和羟自由基的能力, 表明发酵乳杆菌在生长代谢过程中, 分泌到胞外的代谢产物对DPPH类自由基具有较强的清除能力, 同时菌体表面具有可有效猝灭羟自由基的物质[17]。有研究指出, 乳酸菌细胞内外及其代谢产物可能会产生胞外多糖或能够螯合金属离子的天然物质, 从而减少自由基的数量[18-20]。因此乳酸菌发酵过程中不同形式对于各类活性氧自由基均可达到有效清除的目的, 可作为一种良好的天然抗氧化剂。
本研究中, 菌株Y41细胞内抗氧化物质对羟自由基、超氧阴离子自由基及氧自由基清除率显著高于Y4, 但菌株Y4在DPPH清除率上较Y41更具有优势, 因此不同菌株对不同来源的活性氧自由基抗氧化能力存在差异, 可能是细胞内外多种抗氧化物质综合作用的结果[21]。研究表明, 乳酸菌的抗氧化酶系统在清除活性氧过程中发挥重要作用, 大多数乳酸菌具有较高的SOD和GSH-Px活性, 从而产生清除活性氧自由基的能力[22-23]。本研究中Y41菌株的无细胞提取物的SOD活性显著高于Y4, 但GSH-Px活性显著低于Y4。SOD具有清除超氧阴离子的能力, 因此从酶活性方面来看, Y41应具有较强的超氧阴离子清除能力, 与前述超氧阴离子清除率测定结果一致。此外发酵上清液中SOD活性显著高于无细胞提取物, 而无细胞提取物对超氧阴离子清除率高于发酵上清液, 表明无细胞提取物中可能含有某些非酶类物质在发挥抗氧化作用[24]。GSH-Px具有清除过氧化物和羟自由基的能力, Y4菌株细胞内具有较高的酶活性, 而Y41胞内具有较高的羟自由基清除能力。因此Y41无细胞提取物中其他非酶类抗氧化物质可能起一定的抗氧化作用。
本研究从自由基清除率、氧自由基清除活性及抗氧化酶活性3个不同的角度评价了2株发酵乳杆菌的抗氧化能力, 结果表明2株菌株的3种形式均对DPPH自由基、羟自由基及超氧阴离子自由基有较好的清除效果。刘洋等[9]研究了发酵乳杆菌的无细胞提取物和发酵上清液对上述3种自由基的清除能力, 其清除效果显著低于本试验中的发酵乳杆菌。为了全面评价发酵乳杆菌的抗氧化能力, 本试验选取灵敏度较高的氧自由基清除能力的测定方法检测2株菌株的活性差异, 结果表明2株菌株的无细胞提取物的氧自由基清除活性显著高于完整细胞。与Saide等[25]的研究相比, 菌株Y41无细胞提取物测得的氧自由基清除活性为682.59×10-9μmol, 显著高于德式乳杆菌RM6-5(467×10-9μmol)、鼠李糖乳杆菌O16(212×10-9μmol)、鼠李糖乳杆菌NCFM(607×10-9μmol)及保加利亚乳杆菌(10 442×10-9μmol)。Kullisaar等[20]测得2株发酵乳杆菌E-3和E-18的无细胞提取SOD活性分别为0.859 U·mg-1和0.761 U·mg-1, 显著低于本试验结果中样品菌株同一存在形式的SOD值。基于以上研究结果可知, 发酵乳杆菌Y4和Y41在SOD活性及氧自由基清除活性方面具有较大的优势, 可以考虑将这2种测定方法作为评价抗氧化活性的主要指标。本试验在对这2种方法的考察中, 发现无细胞提取物具有更高的氧自由基清除活性及SOD和GSH-Px活性, 由此表明发酵乳杆菌的抗氧化活性物质主要分布在细胞内。
综上所述, 分离自中国传统干腌肉制品金华火腿的两株发酵乳杆菌Y4和Y41具有较好的清除DPPH、· OH、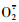
| [1] | Firuzi O, Miri R, Tavakkoli M, et al. Antioxidant therapy:current status and future prospects[J]. Current Medicinal Chemistry, 2011, 18(25): 3871–3888. DOI: 10.2174/092986711803414368 |
| [2] | Lü J, Lin P H, Yao Q, et al. Chemical and molecular mechanisms of antioxidants:experimental approaches and model systems[J]. Journal of Cellular and Molecular Medicine, 2010, 14(4): 840–860. DOI: 10.1111/j.1582-4934.2009.00897.x |
| [3] | Persichetti E, De Michele A, Codini M, et al. Antioxidative capacity of Lactobacillus fermentum LF31 evaluated in vitro by oxygen radical absorbance capacity assay[J]. Nutrition, 2014, 30(7/8): 936–938. |
| [4] | Gilliland S E. Health and nutritional benefits from lactic acid bacteria[J]. FEMS Microbiology Letters, 1990, 7(1/2): 175–188. |
| [5] |
彭新颜, 于海洋, 李杰, 等. 乳酸菌抗氧化作用研究进展[J].
食品科学, 2012, 23(2): 370–374.
Peng X Y, Yu H Y, Li J, et al. Development and prospect of antioxidant activity of lactic acid bacteria[J]. Food Science, 2012, 23(2): 370–374. (in Chinese with English abstract) |
| [6] | Kuda T, Kawahara M, Nemoto M, et al. In vitro antioxidant and anti-inflammation properties of lactic acid bacteria isolated from fish intestines and fermented fish from the Sanriku Satoumi region in Japan[J]. Food Research International, 2014, 64: 248–255. DOI: 10.1016/j.foodres.2014.06.028 |
| [7] | Zhang Y, Li Y. Engineering the antioxidative properties of lactic acid bacteria for improving its robustness[J]. Current Opinion In Biotechnology, 2013, 24(2): 142–147. DOI: 10.1016/j.copbio.2012.08.013 |
| [8] | Amanatidou A, Bennik M H, Gorris L G, et al. Superoxide dismutase plays an important role in the survival of Lactobacillus sake upon exposure to elevated oxygen[J]. Archives of Microbiology, 2001, 176(2): 79–88. |
| [9] |
刘洋, 郭宇星, 潘道东. 4种乳酸菌体外抗氧化能力的比较研究[J].
食品科学, 2012, 33(11): 25–29.
Liu Y, Guo Y X, Pan D D. Comparative antioxidant activity of four species of lactic acid bacteria in vitro[J]. Food Science, 2012, 33(11): 25–29. (in Chinese with English abstract) |
| [10] |
刘少敏, 周文琦, 李婷, 等. 不同乳酸菌抗氧化能力的比较与分析[J].
中国乳品工业, 2015, 43(8): 8–12.
Liu S M, Zhou W Q, Li T, et al. Research on antioxidant capacity of different lactic acid bacteria[J]. China Dairy Industry, 2015, 43(8): 8–12. (in Chinese with English abstract) |
| [11] |
王刚, 田丰伟, 刘小鸣, 等. 2株具有优良体外抗氧化能力乳酸菌的筛选与鉴定[J].
食品工业科技, 2013, 34(15): 149–153, 157.
Wang G, Tian F W, Liu X M, et al. Screening and identification of two lactic acid bacteria strains with excellent antioxidant activities in vitro[J]. Science and Technology of Food Industry, 2013, 34(15): 149–153, 157. (in Chinese with English abstract) |
| [12] |
顾品品, 邢家溧, 王刚, 等. 几种体外评价乳酸菌无细胞提取物抗氧化活性方法的比较研究[J].
食品工业科技, 2015, 36(23): 84–88.
Gu P P, Xing J L, Wang G, et al. A comparison of several in vitro evaluation methods of lactobacillus cell-free extract antioxidant activity[J]. Science and Technology of Food Industry, 2015, 36(23): 84–88. (in Chinese with English abstract) |
| [13] |
杨英士, 陈伟, 杨海燕, 等. 昆仑雪菊中2个黄酮类化合物的分离鉴定及其抗氧化活性评价[J].
南京农业大学学报, 2014, 37(4): 149–154.
Yang Y S, Chen W, Yang H Y, et al. Isolation and identification of two flavonoids compounds from Coreopsis tinctoria Nutt. and evaluation of their antioxidant activities[J]. Journal of Nanjing Agricultural University, 2014, 37(4): 149–154. DOI: 10.7685/j.issn.1000-2030.2014.04.022 (in Chinese with English abstract) |
| [14] |
邢路娟, 胡亚亚, 周光宏, 等. 宣威火腿中粗肽的提取与抗氧化活性鉴定[J].
南京农业大学学报, 2015, 38(4): 661–666.
Xing L J, Hu Y Y, Zhou G H, et al. The extraction and antioxidant activities of crude peptides from Xuanwei ham[J]. Journal of Nanjing Agricultural University, 2015, 38(4): 661–666. DOI: 10.7685/j.issn.1000-2030.2015.04.021 (in Chinese with English abstract) |
| [15] |
郑锦晓, 胡亚亚, 邢路娟, 等. 传统工艺和新工艺金华火腿中抗氧化肽的比较[J].
南京农业大学学报, 2016, 39(2): 312–317.
Zheng J X, Hu Y Y, Xing L J, et al. Research about peptides extracted from Jinhua ham under different processing technology[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 312–317. DOI: 10.7685/jnau.201508028 (in Chinese with English abstract) |
| [16] | Lin M Y, Chang F J. Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356[J]. Digestive Diseases and Sciences, 2000, 45(8): 1617–1622. DOI: 10.1023/A:1005577330695 |
| [17] |
黄玉军, 刘冬, 赵兰凤, 等. 6株人源乳酸菌体外抗氧化活性的比较[J].
现代食品科技, 2013(7): 1518–1522.
Huang Y J, Liu D, Zhao L F, et al. In vitro antioxidant activities of six lactic acid bacteria isolated from human intestinal tract[J]. Modern Food Science and Technology, 2013(7): 1518–1522. (in Chinese with English abstract) |
| [18] | Xu R, Shang N, Li P. In vitro and in vivo antioxidant activity of exopolysaccharide fractions from Bifidobacterium animalis RH[J]. Anaerobe, 2011, 17(5): 226–231. DOI: 10.1016/j.anaerobe.2011.07.010 |
| [19] |
梅秀明, 潘道东. 乳酸菌胞外多糖的纯化及对小鼠血清和肝组织抗氧化性的影响[J].
食品科学, 2009, 30(7): 220–224.
Mei X M, Pan D D. Study on separation and purification of extracellular polysaccharide in fermentation broth of Lactococcus lactis subsp. lactis and its effects on antioxidant functions of mouse serum and liver[J]. Food Science, 2009, 30(7): 220–224. (in Chinese with English abstract) |
| [20] | Kullisaar T, Zilmer M, Mikelsaar M, et al. Two antioxidative lactobacilli strains as promising probiotics[J]. International Journal of Food Microbiology, 2002, 72(3): 215–224. DOI: 10.1016/S0168-1605(01)00674-2 |
| [21] | Higuchi M, Yamamoto Y, Kamio Y. Molecular biology of oxygen tolerance in lactic acid bacteria:functions of NADH oxidases and Dpr in oxidative stress[J]. Journal of Bioscience and Bioengineering, 2000, 90(5): 484–493. DOI: 10.1016/S1389-1723(01)80028-1 |
| [22] | Kullisaar T, Songisepp E, Mikelsaar M, et al. Antioxidative probiotic fermented goats' milk decreases oxidative stress-mediated atherogenicity in human subjects[J]. British Journal of Nutrition, 2003, 90(2): 449–456. DOI: 10.1079/BJN2003896 |
| [23] | Ghanbari M, Jami M, Domig K J, et al. Seafood biopreservation by lactic acid bacteria:a review[J]. LWT-Food Science and Technology, 2013, 54(2): 315–324. DOI: 10.1016/j.lwt.2013.05.039 |
| [24] |
王玉华, 高晶, 陈萍, 等. 鼠李糖乳杆菌不同组分抗氧化活性的研究[J].
食品科技, 2011, 36(9): 27–31.
Wang Y H, Gao J, Chen P, et al. Antioxidant activity of Lactobacillus rhamnosus strains' constituents[J]. Food Science and Technology, 2011, 36(9): 27–31. (in Chinese with English abstract) |
| [25] | Saide J A, Gilliland S E. Antioxidative activity of Lactobacilli measured by oxygen radical absorbance capacity[J]. Journal of Dairy Science, 2005, 88(4): 1352–1357. DOI: 10.3168/jds.S0022-0302(05)72801-0 |




