文章信息
- 李佳宜, 陆应林, 刘小凡, 虞德兵
- LI Jiayi, LU Yinglin, LIU Xiaofan, YU Debing
- 高产与低产蛋鸡卵巢和卵泡及相关基因的表达差异
- Differentiation of follicle development and related genes expression between high and low-laying hens
- 南京农业大学学报, 2017, 40(5): 909-914
- Journal of Nanjing Agricultural University, 2017, 40(5): 909-914.
- http://dx.doi.org/10.7685/jnau.201611031
-
文章历史
- 收稿日期: 2016-11-27
动物卵泡发育需经历募集、选择和优势化, 最后排卵, 并通过下丘脑-垂体-卵巢生殖轴的作用和卵泡局部微环境的状态来调节其性腺的生理活动。家禽卵泡发育是一个多因素共同调控的过程[1], 不仅仅是生殖激素, 还包括许多卵巢内部的调控因子, 是一个多基因调控的过程。已有研究表明, 家禽卵巢在其发育的过程中, 受到促卵泡激素(FSH)及其受体的调控[2]。近年来对哺乳动物卵泡发育研究显示[3]:促卵泡激素(FSH)可通过直接或间接作用, 促进体外培养卵泡的增殖和发育。其直接作用是通过激活相关基因的表达, 而这些基因是促进细胞增殖和类固醇激素合成的关键基因。主要有与类固醇激素合成相关基因细胞色素P450家族成员19A1(CYP 19A1)、11A1(CYP11A1) [4-5]和类固醇激素合成关键酶(StAR)[6], 调控转录相关基因翼状螺旋/叉头转录因子2(FOXL 2 )[7]、骨形成蛋白15前体(BMP 15 )[8]、转录因子GATA家庭4(GATA 4)和6(GATA6)[9], 激素受体相关基因雄性激素受体(AR)[10]、雌激素受体1(ESR 1)、孕激素受体(PGR)、激活素受体1(ACVR 1)[11], 以及增殖与凋亡关键基因增殖细胞核抗原(PCNA)、天门冬氨酸酶(Caspase 3 )[12]、B淋巴细胞瘤2关联X蛋白(Bax)和Bcl 2 [13]; 其间接作用是调节卵泡发育重要物质的表达, 例如:Kit配体、生长分化因子9(GDF-9)和BMP-15 [14]。已有研究证实在6~8 mm的前卵泡(即小黄卵泡)颗粒层上次卵泡素受体(FSHR)表达量相对较高[15-16]。由此可见, FSH对鸡的卵泡发育及相关的调控基因有重要调控作用。内分泌激素可通过内分泌、自分泌、旁分泌的方式调控卵泡的发育和成熟, 从而影响动物的繁殖性能, 在禽类则表现为产蛋量的高低。
本研究结合前期的产蛋记录, 筛选出部分高产个体和低产个体, 对比高、低产蛋鸡激素水平, 卵巢及小黄卵泡形态学差异, 以及检测卵泡发育相关基因mRNA水平, 从形态学和分子水平上探究高产、低产蛋鸡卵泡发育的差异, 为进一步研究其在卵泡发育中的调控机制和卵泡微环境对动物生殖调控提供理论依据。
1 材料与方法 1.1 实验动物处理及样品采集实验动物为江苏省盐城市新曹农场草鸡选育场同一栋鸡舍内、个体笼养的240日龄东乡绿壳蛋鸡。定时饲喂, 自由饮水。通过产蛋记录筛选产蛋性能稳定、产蛋数最高的10只鸡为高产组, 产蛋数最低的10只鸡为低产组。屠宰后对卵巢组织拍照观察, 统计个体等级卵泡数量。采集卵巢组织, 分两部分:一部分立即置于液氮中保存, 用于繁殖相关基因实时荧光定量PCR检测; 另一部分置于体积分数为4%多聚甲醛中固定, 24 h后脱水、石蜡包埋组织, 制作石蜡切片, HE染色后显微镜拍照观察。
1.2 激素水平测定采用颈静脉采血法采集1 mL静脉血, 以12 000 r·min-1离心15 min, 吸取上层血清, -20 ℃保存。血清激素水平测定采用ELISA法, 分别按照促卵泡激素(FSH)、雌二醇(E2)、孕酮(P)定量测定试剂盒说明书操作。以上试剂盒均购自南京建成生物工程研究所。
1.3 实时荧光定量PCR卵巢组织样品采用传统Trizol法提取总RNA, 利用ABM的反转录试剂盒反转录成cDNA后-20 ℃保存备用。根据GenBank中收录的鸡相关基因mRNA序列, 用Primer Premier 5.0软件设计引物, 以β-actin基因为内参, 利用ABM荧光定量PCR试剂盒及ABI7500实时荧光定量PCR仪对卵巢相关基因进行实时荧光定量PCR, 测定各个基因的表达情况。荧光定量PCR的总反应体系20 μL(SYBR Premix Ex TaqTM 10 μL, 上、下游引物各0.5 μL, cDNA 2 μL, ddH2O 7 μL)。反应程序:95 ℃预变性5 min, 40个循环(95 ℃ 5 s, 退火30 s, 72 ℃延伸30 s); 每一循环在80 ℃读板测量荧光密度; 熔解曲线分析:60~95 ℃, 每隔0.3 ℃读板1次, 温度恒定1 s后读板。引物序列见表 1。
| 目的基因Target genes | GenBank登录号GenBank accession No. | 引物对序列(5′→3′)Primer pairs sequence | Tm/℃ |
| CYP11A1 | NM_001001756 | CAAAACGTTTACCGGGACAT/TTGCAGAGTCATGGAAGTCG | 59 |
| CYP19A1 | NM_001001761 | TGAGAGTTTGGATCAGCGGT/ACAAGACCAGGACCAGACAG | 59 |
| StAR | NM_204686 | CAACGGAGACAAAGTGCTGA/AGTGTCCTTCCCAACCCTCT | 60 |
| FOXL2 | NM_001012612 | CTACTCCTACGTGGCCCTGA/TGATGAAGCACTCGTTGAGG | 60 |
| BMP15 | NM_001006589 | TCCTCTTCCTCAACGACACC/TTACAGTAGCGCGGGTTGTA | 59 |
| GATA4 | NM_001293106 | AAACAGAACCAGGGCTCTCA/AGACTGGCTGATGGCTGACT | 60 |
| GATA6 | NM_205420 | CAGAGCTGCTGGAAGACCTC/GACGAGGGCACTCTCTTCTG | 59 |
| AR | NM_001040090 | CGATCGGATCATTGCTTGCA/GATCTCGGCCATCATTTCCG | 59 |
| ESR1 | NM_205183.2 | AATGAACAGGGCAGCTTTGG/CTCACAAGACCAGACCCCAT | 60 |
| PGR | NM_205262.1 | GCTTTGAATCGCTACCCCAG/GACACGCTGGACAGTTCTTC | 60 |
| ACVR1 | XM_015290134 | GCTGAAGGAAGACAGAGAAA/AGATGCAGTATACAGCCAAT | 60 |
| PCNA | NM_204170.2 | GGCGTCAACCTAAACAGCAT/GCTCCACATCGAGGTCCATA | 59 |
| Caspase3 | XM_015276123.1 | TATGTGGCGGCAGTGATGTA/CTGGACAGCAACGAAACCAA | 60 |
| Bax | XM_015274882 | GTACGTCAATGTGGTCACCC/TGGGATAATGCTGGGGTTGA | 59 |
| Bcl2 | NM_205339 | ACCATGAATGAAACCGTGCC/TTGTCGTAGCCTCTTCTCCC | 60 |
| β-actin | NM_001206359 | AGTACCCCATTGAACACGGT/ATACATGGCTGGGGTGTTGA | 60 |
| 注:Tm:退火温度Anealing temperature. | |||
各个试验均重复3次, 数据分析采用SPSS 18.0统计软件, 试验数据均用x±SD表示, 多组间差异分析采用单因素方差分析(One-Way ANOVA)。
2 结果与分析 2.1 高产与低产蛋鸡卵巢卵泡形态结构比较对比高产、低产蛋鸡卵巢(图 1)可见:高产蛋鸡卵巢体积大, 密布着3~6个排卵前优势卵泡(F1~F6级卵泡, 直径15~34 mm)和3~4个备选的小黄卵泡(直径6~8 mm), 而低产个体的卵巢体积相对较小, 而且卵巢上没有或者仅有1~2个排卵前等级卵泡, 卵巢上以小白卵泡居多。
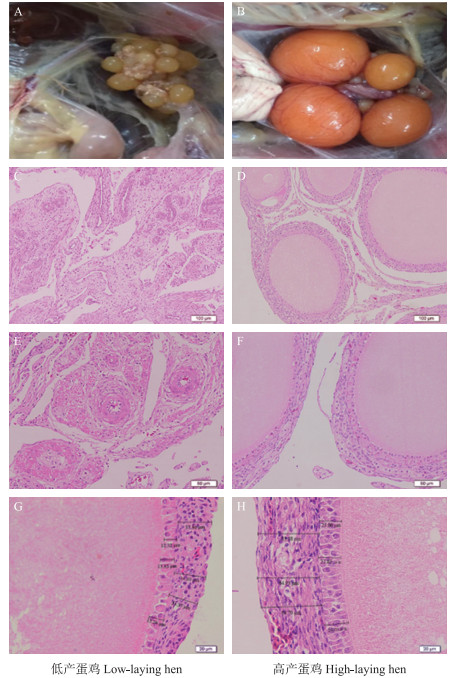
|
图 1 高产与低产蛋鸡卵巢外观形态学和卵巢及小黄卵泡组织学的比较 Figure 1 The comparison of ovarian morphology and histology of ovary and small yellow follicle between high-laying and low-laying hens A、B为低产与高产蛋鸡卵巢; C、E为低产蛋鸡卵巢切片; D、F为高产蛋鸡卵巢切片; G、H分别为低产和高产蛋鸡小黄卵泡切片。 A, B. The ovarian pictures of low-laying and high-laying hens; C, E. The ovarian tissue slices of low-laying hens; D, F. The ovarian tissue slices of high-laying hens; G, H. The small yellow follicle of low-laying and high-laying hens, respectively. |
对高产、低产蛋鸡卵巢和卵泡组织切片进行HE染色(图 1), 在同等倍数的显微镜下观察卵巢组织切片(图 1-C和D、E和F)可见:高产蛋鸡卵巢(图 1-B、D)上卵泡发育好, 卵巢上密布着小黄卵泡和大白卵泡(1~4 mm); 而低产蛋鸡卵巢(图 1-A、C)上卵泡闭锁较多。高倍镜下对高、低产小黄卵泡进行对比, 发现低产蛋鸡小黄卵泡(图 1-G)膜层和颗粒层较薄, 分别为13~15 μm和30~38 μm, 内外膜层分界不明显, 颗粒细胞松散, 颗粒层呈单层; 高产蛋鸡小黄卵泡(图 1-H)膜层较厚, 65 μm左右, 内外膜分界明显, 颗粒细胞呈多层紧密排列, 颗粒层厚度约22~24 μm。可见高产与低产蛋鸡卵巢和卵泡在组织形态上也存在明显差异。
2.2 高产与低产蛋鸡血液激素水平测定采用ELISA法测定鸡血清中促卵泡激素(FSH)、雌二醇(E2) 和孕酮(P)3种激素水平, 结果(图 2)显示:高产组血清中FSH、E2、P水平均极显著高于低产蛋鸡组(P < 0.01)。
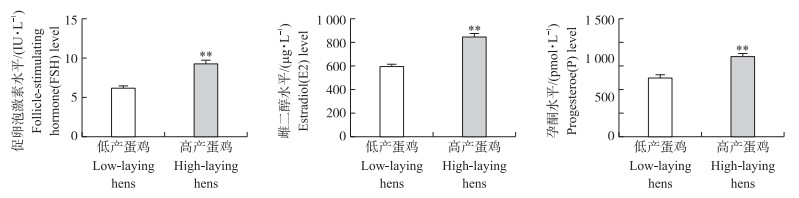
|
图 2 高产与低产蛋鸡血清激素水平比较 Figure 2 Comperision of hormonal level in serum of high-laying and low-laying hens *P < 0.05, * *P < 0.01. The same as follows. |
图 3为荧光定量PCR检测的4类与繁殖相关的关键基因在卵巢的表达水平。类固醇激素合成关键酶基因, 高产蛋鸡CYP 11A1 mRNA表达水平显著低于低产个体(P < 0.05);CYP 19A1和StAR在高产和低产蛋鸡卵巢中差异不显著。在卵巢上表达的4个关键转录因子基因, 高产蛋鸡FOXL 2和GATA4 mRNA表达水平显著高于低产蛋鸡(P < 0.05), 而BMP 15和GATA6则无显著性差异(P>0.05)。对激素受体表达检测发现, 高产蛋鸡卵巢ACVR 1极显著高于低产蛋鸡(P < 0.01), AR、ESR 1和PGR在高、低产蛋鸡间无明显差异。对卵泡细胞增殖和凋亡相关基因检测发现, 高产蛋鸡PCNA和Bcl 2极显著高于低产蛋鸡(P < 0.01), 但Caspase 3和Bax二者差异不显著。
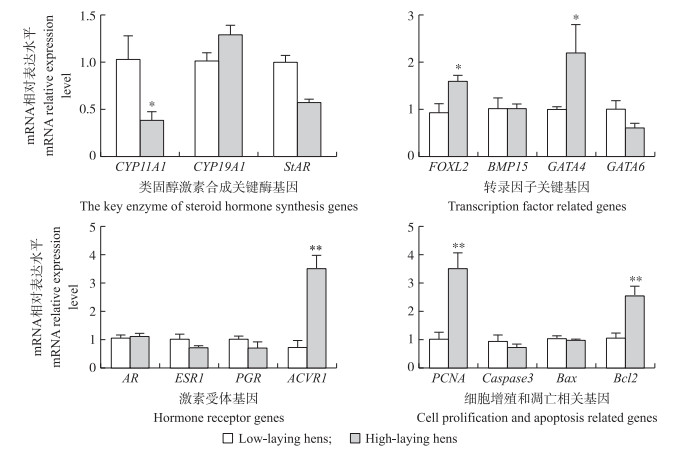
|
图 3 高产与低产蛋鸡卵巢相关基因的表达 Figure 3 Expression of relative genes of high-laying and low-laying hens ovary |
母鸡发育成熟后, 卵巢体积变大, 许多卵泡凸出。卵巢上含有大小不一的各个阶段的卵泡。发育状态良好的卵泡, 毛细血管丰富, 以提供充足的营养。卵泡表面光滑, 呈等级排列。而闭锁卵泡形态上发生了变化, 卵泡变形, 卵泡膜塌陷等[17]。本试验通过组织学和形态学观察, 比较高产与低产蛋鸡卵巢和卵泡, 发现二者存在明显差异, 高产蛋鸡卵泡丰富, 卵泡光滑, 无血斑、塌陷。而低产蛋鸡卵泡缺乏优势卵泡, 大量卵泡闭锁, 与王岩等[18]对乌鸡高、低产个体生殖器官的比较结果一致。
FSH是调控卵泡的主导激素, 多途径影响卵泡发育。雌激素主要是由大卵泡分泌, 可以通过反馈调节抑制其他小卵泡发育, 但是在高产蛋鸡中, 大卵泡数量多, 因此血清中雌激素水平也会相应升高。孕酮具有双向调节作用:低浓度孕酮有促排卵作用, 而高浓度则会反馈性抑制FSH和LH的分泌[19]。本试验中检测的3种激素(FSH、E2、P)水平, 高产蛋鸡均显著高于低产蛋鸡。高产个体中E2和P水平虽然相对较高, 但还没有达到双向调节的分界点, 3种激素间互相协同, 维持卵巢功能的完整性和卵泡发育。
家禽繁殖性能是一个微效多基因性状, 根据不同基因调控方向的不同, 很多学者进行了相关研究, 为高产家禽的选育提供分子理论基础。类固醇激素合成过程中关键酶基因的表达, 直接影响激素的合成。CYP 11A1最初在原始卵泡的膜细胞中表达, 随后在排卵前的成熟卵泡颗粒细胞中有表达[5], 在颗粒细胞中CYP 19A1 mRNA的高表达能更有效地介导FSH发挥作用, 促进卵泡发育[20]。在鸡等级前卵泡颗粒细胞中StAR mRNA表达水平很低, 相比较, F3和F2级卵泡表达量较高, F1级表达量最高, 可见StAR的表达与卵泡发育水平呈正相关[21]。在本试验中, CYP 19A1和StAR在高产与低产个体中差异并不显著, 但CYP 11A1却在低产个体中显著高于高产蛋鸡。低产蛋鸡CYP 11A1的高表达, 可能是鸡卵巢对较低水平激素的敏感性应答, 通过激活卵巢芳香化酶基因, 增加雌激素的合成。
调控卵泡发育的转录因子很多, 研究发现, FOXL 2 参与卵巢颗粒细胞的增殖分化调节[22]。FOXL 2 协同TGF-β超家族通过作用于FSH受体基因的mRNA表达促进鸡等级前卵泡颗粒细胞的增殖[23]。本试验中高产蛋鸡FOXL 2表达量显著高于低产蛋鸡, 可能是造成产蛋量差异的原因之一。BMP 15 不依赖FSH而发挥促颗粒细胞增生的作用, 抑制促性腺激素诱导的颗粒细胞孕酮的合成, 这一抑制作用也可能是通过抑制FSH受体(FSHR)、LH受体(LHR)的表达实现的[24], 但是本试验中高产与低产蛋鸡无显著差异。在卵泡颗粒细胞中GATA 4 的表达与细胞增殖活性同步增加, 可以调节Bcl2和细胞周期蛋白的表达[9]。在对高产与低产蛋鸡卵巢GATA 4 mRNA的比较中, 我们也发现高产蛋鸡中GATA 4表达量显著高于低产蛋鸡。高产蛋鸡卵巢上密布着发育状态良好的卵泡, 闭锁卵泡较少, 细胞增殖活性强。通过比较发现PCNA和Bcl 2 在高产蛋鸡中表达量较高。
本试验通过比较高产与低产蛋鸡卵巢卵泡形态、激素和相关基因差异, 为研究禽类卵巢卵泡发育和调控的分子机制提供一定的理论依据。而本文所研究的生殖激素水平与调控繁殖性状相关基因mRNA的表达水平之间可能存在一定联系, 这需要后续扩大群体数量以进行更加深入的研究。
| [1] |
宋宇轩, 曹斌云, 孙世铎. 影响家畜繁殖性状主基因的研究进展[J].
畜牧与兽医, 2005, 37(3): 53–55.
Song Y X, Cao B Y, Sun S D. The research progress of major genes in livestock reproductive traits[J]. Animal Husbandry and Veterinary Medicine, 2005, 37(3): 53–55. (in Chinese with English abstract) |
| [2] |
倪迎冬, 赵茹茜, 王亚菊, 等. 出雏至性成熟绍鸭卵巢FSH-R与LH-R mRNA表达的变化[J].
南京农业大学学报, 2004, 27(2): 64–67.
Ni Y D, Zhao R Q, Wang Y J, et al. Developmental changes of FSH-R and LH-R mRNA in the ovary of prepubertal Shaoxing ducks[J]. Journal of Nanjing Agricultural University, 2004, 27(2): 64–67. DOI: 10.7685/j.issn.1000-2030.2004.02.015 (in Chinese with English abstract) |
| [3] |
赵驻军, 张国磊. 雌性哺乳动物FSH及其受体[J].
黑龙江动物繁殖, 2008, 16(4): 4–6.
Zhao Z J, Zhang G L. Female mammals FSH and its receptor[J]. Animal Reproduction of Heilongjiang, 2008, 16(4): 4–6. (in Chinese with English abstract) |
| [4] |
甄鑫, 颜桂军, 孙海翔, 等. CYP19A1基因多态性与多囊卵巢综合征的相关性研究[J].
医学研究生学报, 2014(6): 596–599.
Zhen X, Yan G J, Sun H X, et al. CYP19A1 gene polymorphism and polycystic ovarian syndrome[J]. Journal of Medicine Postgraduate, 2014(6): 596–599. (in Chinese with English abstract) |
| [5] | Goldring N B, Durica J M, Lifka J, et al. Cholesterol side-chain cleavage P450 messenger ribonucleic acid:evidence for hormonal regulation in rat ovarian follicles and constitutive expression in corpora lutea[J]. Endocrinology, 1987, 120(5): 1942–1950. DOI: 10.1210/endo-120-5-1942 |
| [6] | Orly J, Stocco D M. The role of the steroidogenic acute regulatory(StAR)protein in female reproductive tissues[J]. Horm Metab Res, 1999, 31(7): 389–398. DOI: 10.1055/s-2007-978761 |
| [7] | Pisarska M D, Barlow G, Kuo F T. Minireview:roles of the forkhead transcription factor FOXL2 in granulosa cell biology and pathology[J]. Endocrinology, 2011, 152(4): 1199–1208. DOI: 10.1210/en.2010-1041 |
| [8] |
董传河, 杜立新. BMP15对卵巢功能的调节及对生殖的影响[J].
动物学杂志, 2008(4): 140–145.
Dong C H, Du L X. The regulation of BMP15 on ovarian functions and reproduction[J]. Chinese Journal of Zoology, 2008(4): 140–145. (in Chinese with English abstract) |
| [9] | Anttonen M, Parviainen H, Kyronlahti A, et al. GATA-4 is a granulosa cell factor employed in inhibin-alpha activation by the TGF-beta pathway[J]. J Mol Endocrinol, 2006, 36(3): 557–568. DOI: 10.1677/jme.1.01962 |
| [10] | Mendez C, Nunez-Vidales R, Mondragon-Huerta C, et al. Androgen receptor in the neural tube of the mouse and chicken embryo[J]. Neuroreport, 2009, 20(5): 513–516. DOI: 10.1097/WNR.0b013e3283294114 |
| [11] | Cooley J R, Yatskievych T A, Antin P B. Embryonic expression of the transforming growth factor beta ligand and receptor genes in chicken[J]. Dev Dyn, 2014, 243(3): 497–508. DOI: 10.1002/dvdy.24085 |
| [12] | Joseph E K, Levine J D. Caspase signalling in neuropathic and inflammatory pain in the rat[J]. Eur J Neurosci, 2004, 20(11): 2896–2902. DOI: 10.1111/j.1460-9568.2004.03750.x |
| [13] | Chittenden T, Harrington E A, O'Connor R, et al. Induction of apoptosis by the Bcl-2 homologue Bak[J]. Nature, 1995, 374(6524): 733–736. DOI: 10.1038/374733a0 |
| [14] | Aguiar F L, Lunardi F O, Lima L F, et al. FSH supplementation to culture medium is beneficial for activation and survival of preantral follicles enclosed in equine ovarian tissue[J]. Theriogenology, 2016, 85(6): 1106–1112. DOI: 10.1016/j.theriogenology.2015.11.022 |
| [15] | Woods D C, Johnson A L. Regulation of follicle-stimulating hormone-receptor messenger RNA in hen granulosa cells relative to follicle selection[J]. Biol Reprod, 2005, 72(3): 643–650. DOI: 10.1095/biolreprod.104.033902 |
| [16] | Ocon-Grove O M, Poole D H, Johnson A L. Bone morphogenetic protein 6 promotes FSH receptor and anti-Mullerian hormone mRNA expression in granulosa cells from hen prehierarchal follicles[J]. Reproduction, 2012, 143(6): 825–833. DOI: 10.1530/REP-11-0271 |
| [17] |
林金杏. 局部性促生长因子对鸡卵泡发育的调控及其机理的研究[D]. 杭州: 浙江大学, 2011.
Lin J X. Regulation of local growth-gromoting gactors on follicular development in the laying chickens[D]. Hangzhou:Zhejiang University, 2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10335-1012317284.htm |
| [18] |
王岩, 彭克美, 宋卉, 等. 高产与低产乌鸡主要生殖器官的比较形态学研究[J].
经济动物学报, 2006, 10(4): 206–210.
Wang Y, Peng K M, Song H, et al. Comparative morphological study on main reproductive organs between high and low yield silky fowl[J]. Journal of Economic Animal, 2006, 10(4): 206–210. (in Chinese with English abstract) |
| [19] |
杨淑华, 徐世文, 李金龙, 等. 生殖激素对禽类卵泡细胞凋亡的影响[J].
吉林畜牧兽医, 2005(10): 12–14.
Yang S H, Yu S W, Li J L, et al. The effect reproductive hormone on avian follicular cells apoptosis[J]. Jinlin Animal Husbandry and Veterinary, 2005(10): 12–14. DOI: 10.3969/j.issn.1672-2078.2005.10.006 (in Chinese with English abstract) |
| [20] |
刘大艳, 何珊, 朱文杰, 等. 超排卵周期中卵巢颗粒细胞CYP19A1 mRNA的表达与卵巢反应性关系的研究[J].
中国妇幼保健, 2015, 30(20): 3446–3449.
Liu D Y, He S, Zhu W J, et al. Study on the relationship between CYP19A1 mRNA expression in ovarian granular cells and ovarian response in controlled ovarian hyperstimulation cycles[J]. Maternity and Child Care of China, 2015, 30(20): 3446–3449. (in Chinese with English abstract) |
| [21] | Bauer M P, Bridgham J T, Langenau D M, et al. Conservation of steroidogenic acute regulatory(StAR)protein structure and expression in vertebrates[J]. Molecular and Cellular Endocrinology, 2000, 168(1/2): 119–125. |
| [22] | Schmidt D, Ovitt C E, Anlag K, et al. The murine winged-helix transcription factor Foxl2 is required for granulosa cell differentiation and ovary maintenance[J]. Development, 2004, 131(4): 933–942. DOI: 10.1242/dev.00969 |
| [23] | Qin N, Fan X C, Xu X X, et al. Cooperative effects of FOXL2 with the members of TGF-beta superfamily on FSH receptor mRNA expression and granulosa cell proliferation from hen prehierarchical follicles[J]. PLoS ONE, 2015, 10(10): e0141062. DOI: 10.1371/journal.pone.0141062 |
| [24] | Otsuka F, Yamamoto S, Erickson G F, et al. Bone morphogenetic protein-15 inhibits follicle-stimulating hormone(FSH)action by suppressing FSH receptor expression[J]. The Journal of Biological Chemistry, 2001, 276(14): 11387–11392. DOI: 10.1074/jbc.M010043200 |




