文章信息
- 翁梦薇, 计徐, 郑卫江, 姚文
- WENG Mengwei, JI Xu, ZHENG Weijiang, YAO Wen
- 去甲肾上腺素对大肠杆菌耐药质粒接合转移的影响
- Influence of norepinephrine on resistant plasmids conjugational transfer between Escherichia coli
- 南京农业大学学报, 2017, 40(5): 901-908
- Journal of Nanjing Agricultural University, 2017, 40(5): 901-908.
- http://dx.doi.org/10.7685/jnau.201701023
-
文章历史
- 收稿日期: 2017-01-11
抗生素自被发现以来拯救了无数人的生命, 并广泛应用于医(兽)药和动物促生长等方面, 但也使全球面临着细菌耐药性(antimicrobial resistance, AMR)的巨大挑战。AMR已被列为下一个流行性病因[1]和世界最紧迫的公共健康问题之一[2]。我们前期对苏淮乳仔猪粪便耐受头孢噻呋类大肠杆菌的6种抗生素耐药表型分析发现:多重耐药现象极为普遍, 达到90.80%, 可见AMR在畜牧生产中已呈现愈演愈烈的趋势[3]。细菌的耐药性可通过自身突变获得, 也可从其他微生物通过可移动遗传元件(质粒、转座子、噬菌体等)的转移——基因的水平转移(horizontal gene transfer, HGT)获得[4]。接合是最高效的HGT方法[5-6], 通过性菌毛的连接沟通使AMR基因从供体菌向受体菌高效转移, 从而严重威胁人类和动物的健康[7]。
畜禽养殖中应激普遍存在, 如热应激和幼龄动物的剪牙、断尾、断奶、混群等应激。肾上腺素(adrenaline, AD)和去甲肾上腺素(norepinepheine, NE)等儿茶酚胺类激素是宿主响应急性应激的主要激素。超过半数的NE在肠神经系统(enteric nervous system, ENS)合成和发挥功能[8]。胃肠道内去甲肾上腺素的浓度可高达50 μmol·L-1[9]。因此动物的胃肠道菌群除存在细菌间交互饲喂、细菌与宿主间共生的营养关系外, 环境因素(如日粮、疾病和管理等)也可能通过动物自主神经系统分泌的儿茶酚胺类激素改变肠道菌群结构和功能。Lyte等[10]使用添加了血清的铁贫乏培养基, 观察到了儿茶酚胺类激素对细菌的促生长作用, 这种促生长可能是通过儿茶酚胺特异性的铁运输能力增强了细菌对铁的摄取和利用实现的[11-12]。儿茶酚胺也能够影响细菌毒力因子的产生, 例如毒素、黏附素、生物膜的形成以及群体感应分子的生成[2]。暴露于儿茶酚胺环境下的大肠杆菌E.coli O157增加了志贺毒素的表达[13], 提高了对真核细胞的黏附力[14], 并加强了鞭毛的运动性[15]。儿茶酚胺也被证明刺激了沙门氏菌在猪胃肠道内的运动性, 并提高了其在肠道的定植能力[12]。这些现象为应激提高生物体传染性疾病的发病率提供了一个非免疫学的解释。
儿茶酚胺类激素对于细菌间耐药基因的水平转移是否也存在影响呢?Peterson等[16]报道, 体外5 μmol·L-1的NE即可提高接合性质粒从鼠伤寒沙门氏菌向大肠杆菌水平转移的效率, 上调了质粒编码的转移基因(tra)的表达水平, 并发现肾上腺素能α受体阻断剂酚妥拉明比β受体阻断剂普萘洛尔的抑制作用更强。这是急性应激可能影响病原菌进化与适应的首次报道, 但儿茶酚胺类激素对于细菌间耐药基因转移的影响目前未见报道。本研究旨在观察生理浓度去甲肾上腺素对大肠杆菌分离株耐药质粒体外接合转移率的影响, 并比较供体和受体菌及接合子的抗生素耐受水平, 以探讨生产中普遍存在的急性应激因素对细菌间耐药基因转移的可能影响。
1 材料与方法 1.1 菌株和培养基供体菌为南京农业大学动物科技学院消化道微生物实验室保存的7株断奶香猪粪便源大肠杆菌分离株; 受体菌为耐叠氮钠的大肠杆菌J53, 由香港理工大学深圳研究院惠赠; 药敏试验用质控大肠杆菌(ATCC25922), 购于广东微生物菌种保藏中心。
麦康凯琼脂(MacConkey agar, MAC), 伊红美蓝琼脂, 营养琼脂, 营养肉汤, 葡萄糖磷酸盐胨水(MR-VP), 蛋白胨水(色氨酸肉汤), 西蒙氏枸橼酸盐, 甲基红试剂, V-P试剂(甲、乙液), Kovacs氏靛基质试剂, 均购于北京奥博星生物技术有限责任公司。LB琼脂(Luria-Bertani agar)、LB肉汤(Luria-Bertani broth)、MH琼脂(Mueller-Hinton agar, MHA)、MH肉汤(MHB)均购于青岛海博生物技术有限公司。MEM培养液购于Life technologies公司。胎牛血清(FBS)购于杭州天杭生物科技有限公司。去甲肾上腺素标准品购于Sigma公司, 用超纯水配制成所需的储存浓度, 过滤除菌后备用。药敏纸片:氨苄西林(10 μg)、庆大霉素(10 μg)、四环素(30 μg)、恩诺沙星(5 μg)、氟苯尼考(30 μg)、环丙沙星(5 μg), 均购于Oxoid公司。氨苄西林、氟苯尼考购于南京龙斌生物科技有限公司。盐酸四环素、硫酸庆大霉素、恩诺沙星均购于生工生物(上海)股份有限公司。盐酸环丙沙星标准品购于大连美轮生物技术有限公司。0.45 μm滤膜购于Life technologies公司。质粒提取试剂盒(QIAGEN, 德国)。
1.2 去甲肾上腺素促大肠杆菌生长浓度的筛选去甲肾上腺素促进大肠杆菌生长最佳浓度的筛选试验在添加胎牛血清的MEM培养液中进行。使用2株喹诺酮类敏感型(ENR MIC=0.5 μg·mL-1)大肠杆菌作为试验菌株, 过夜复活的大肠杆菌按体积比1:100接种后, 37 ℃、200 r·min-1增菌培养6 h, 10 000 r·min-1离心5 min, 磷酸盐缓冲液(PBS)重悬并调整细菌的接种比例, 使得培养液中细菌终浓度为100 CFU·mL-1; 培养液中FBS的添加量为10%, NE的浓度设定为0、12.5、25、50和100 μmol·L-1; 通过测定D600值比较菌株在不同NE浓度培养液中的生长曲线, 以确定NE对于大肠杆菌的最佳促生长浓度。每个NE剂量组均设置3个重复, 试验重复3次。
1.3 大肠杆菌的接合转移试验 1.3.1 滤膜接合法以未添加NE的MEM培养液为对照组, 添加了最佳促生长浓度NE的MEM培养液为试验组, 进行大肠杆菌的接合转移试验, 接合成功的4株供体菌和受体菌对喹诺酮类药物的敏感性及质粒携带喹诺酮类耐药基因的情况见表 1。增菌后的供、受体LB肉汤菌液1 mL, 离心, 沉淀经洗涤后, 划线于LB平板, 37 ℃过夜培养; 分别挑取供、受体菌的单菌落接种于LB肉汤中, 200 r·min-1 37 ℃过夜培养; 各取上述肉汤60 μL接入6 mL LB肉汤中, 200 r·min-1振荡培养3~4 h, 使菌液D600值达到0.4~0.6, 用于后续接合转移试验。用镊子将0.45 μm滤膜置于LB平板(37 ℃, 预热1 h)中心; 将上述供、受体菌液按1:4的比例在5 mL离心管中混匀, 并加1 mL供、受体混合菌液至滤膜中心, 37 ℃静止孵育16 h, 为接合组; 另一滤膜中心仅加800 μL受体菌J53, 同样孵育, 作为质控组。用3 mL的灭菌生理盐水将接合组滤膜上的菌体洗下, 10倍梯度稀释, 分别涂布在含有ENR(4 μg·mL-1)、NaN3(100 μg·mL-1)的双抗平板上, 37 ℃过夜培养后计数菌落; 质控组滤膜上的菌体同样用灭菌生理盐水洗下, 梯度稀释后涂布在仅含有NaN3(100 μg·mL-1)的平板上, 37 ℃过夜培养后计数菌落。收集接合子, 置于-20 ℃保存备用。
| 菌株 Strains |
抗生素最小抑菌浓度/(μg·mL-1) MIC of antibiotic | 喹诺酮类耐药基因携带状况Plasmid-medicated quinolone resistant genes | ||||||||
| AMP | FLO | GEN | TET | ENR | CIP | aac(6′)-lb-cr | oqxAB | qnrS | ||
| J53 | 4 | 4 | 0.25 | 2 | 0.015 6 | 0.078 1 | - | - | - | |
| A | >64 | 128 | >64 | 32 | 16 | 4 | + | + | + | |
| B | 4 | 8 | 64 | >128 | 32 | 16 | + | + | + | |
| C | >64 | >128 | 64 | 32 | >32 | >32 | + | + | + | |
| D | >64 | 8 | 0.5 | >128 | >32 | 32 | + | + | + | |
| 注: 1) AMP:氨苄西林; FLO:氟苯尼考; GEN:庆大霉素; TET:四环素; ENR:恩诺沙星; CIP:环丙沙星。2)+:基因检测结果阳性; -:基因检测结果阴性。3) J53为受体菌, A、B、C、D均为供体菌。 Notes: 1) AMP:Ampicillin; FLO:Florfenicol; GEN:Gentamicin; TET:Tetracycline; ENR:Enrofloxacin; CIP:Ciprofloxacin. 2)+indicates positive test results; -indicates negative test results. 3) J53 indicates the donors recipient, A, B, C and D indicate the donors. The same as follows. | ||||||||||
接合转移效率=接合子菌落数/受体菌菌落数。接合子菌落数为在含有ENR(4 μg·mL-1)、NaN3(100 μg·mL-1)的双抗平板上生长的菌落数(CFU·mL-1); 受体菌菌落数为在含有NaN3(100 μg·mL-1)的平板上生长的菌落数(CFU·mL-1)。
1.3.3 接合子的鉴定与保存LB肉汤复活保存的接合子菌株, 于麦康凯琼脂平板划线并置于37 ℃培养24 h, 挑选砖红色、圆形隆起、光滑湿润、边缘整齐的单菌落进行吲哚试验、甲基红试验、V-P试验和枸橼酸盐利用试验。吲哚试验和甲基红试验结果为阳性, V-P试验和枸橼酸盐利用试验为阴性的菌株判定为大肠杆菌。将接合子菌株划线于含有NaN3(100 μg·mL-1)的麦康凯琼脂平板, 验证所获得接合子对NaN3耐受。用终含量为20%的甘油肉汤保存, 置于-20 ℃冰箱中备用。
1.4 大肠杆菌质粒耐药基因的检测 1.4.1 质粒的提取将供、受体和接合子菌株以体积比1:100比例接种于5 ml LB肉汤中, 37 ℃、200 r·min-1培养14~16 h后, 采用质粒提取试剂盒提取大肠杆菌的质粒, 用超微量分光光度计测定洗脱液中的质粒浓度及纯度后, 存放于-20 ℃备用。
1.4.2 喹诺酮类耐药基因的PCR检测表 2为本研究中用于检测质粒携带的喹诺酮类耐药基因的引物序列, 由Invitrogen(上海)公司合成。20 μL PCR反应体系如下:Premix Ex Taq 10 μL, 灭菌超纯水8.5 μL, 上、下游引物(10 μmol·L-1)各0.5 μL, DNA模板0.5 μL(约10 ng·μL-1)。PCR反应条件:95 ℃预变性10 min; 95 ℃变性1 min, 退火1 min(不同基因的Tm值如表 2所示), 72 ℃延伸1 min, 35个循环; 72 ℃延伸5 min。将PCR产物进行20 g·L-1琼脂糖凝胶电泳, 120 V电泳40 min。电泳结束后于凝胶成像系统下观察结果并拍照保存。
| 抗性基因 Resistent gene |
引物对序列(5′→3′) Primer pairs sequence |
退火温度/℃ Annealing temperature |
产物大小/bp Product length |
| aac(6′)-lb-cr | F:ACCAAGATCCAAACGGACCC/R:GAACCATGTACACGGCTGGA | 64 | 121 |
| oqxAB | F:CAAAACCGTTGCCATGACCT/R:ACATCCGGATATTCGCTCACC | 60 | 182 |
| qnrS | F:CGACGTGCTAACTTGCGTGA/R:GGCATTGTTGGAAACTTGCA | 52 | 118 |
| qepA | F:GCAGGTCCAGCAGCGGGTAG/R:CTTCCTGCCCGAGTATCGTG | 60 | 218 |
采用世界卫生组织(WHO)推荐的Kirby·Bauer氏(K-B)纸片扩散法, 即美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)[17]的药敏试验方法测定生化鉴定成功的接合子和供、受体菌对5类共6种抗菌药物的敏感性。首先通过3次独立重复试验, 测定6种抗菌药物纸片对质控菌株ATCC25922产生的抑菌圈大小。当质控菌株的抑菌圈直径在允许范围内, 则判定药敏纸片合格。用MH肉汤调整待测菌液浓度至0.5麦氏浊度后, 均匀涂布在MH营养琼脂平板上, 待平板略干燥时将6种药敏纸片分置在已接种细菌的琼脂表面, 每种药物贴2张纸片。37 ℃培养16~18 h后, 采用游标卡尺在培养板背面测量完全抑制区的直径, 计算平均值。每次试验时用标准的药敏试验质控菌ATCC25922与被测菌株平行测定。参照CLSI[17]公布的抑菌圈直径解释标准对结果进行判定。判定标准见表 3。
| 抗生素种类 Antimicrbial species |
纸片含药量/μg Disk content |
ATCC25922抑菌圈直径/mm ATCC25922 zone diameter |
抗药敏感度的抑菌圈直径解释标准/mm Description of inhibition zone diameter |
||
| 敏感Sensitive | 中介Intermediary | 耐药Resistent | |||
| 氨苄西林AMP | 10 | 16~22 | ≥17 | 14~16 | ≤13 |
| 氟苯尼考FLO | 30 | 22~28 | ≥22 | 19~21 | ≤18 |
| 庆大霉素GEN | 10 | 19~26 | ≥15 | 13~14 | ≤12 |
| 四环素TET | 30 | 18~25 | ≥15 | 12~14 | ≤11 |
| 恩诺沙星ENR | 5 | 32~40 | ≥23 | 17~22 | ≤16 |
| 环丙沙星CIP | 5 | 30~40 | ≥21 | 16~20 | ≤15 |
接合子及供、受体菌对6种抗生素的最小抑菌浓度(minimum inhibitory concentrations, MIC)采用CLSI推荐的琼脂稀释法[17-18]进行检测。参照CLSI的药敏标准, 当质控菌ATCC25922测定结果在规定的药敏范围内时, 对试验菌株的MIC值进行判读。大肠杆菌的MIC值分为敏感(包括中介)和耐药。抗生素的浓度范围和耐药折点见表 4。
| μg·mL-1 | |||
| 抗生素种类 Antimicrobial species |
浓度范围 Concentration ranges |
敏感折点 Sensitive break point |
耐药折点 Resistant break point |
| 氨苄西林AMP | 1~64 | ≤8 | ≥32 |
| 氟苯尼考FLO | 1~64 | ≤4 | ≥16 |
| 庆大霉素GEN | 0.125~64 | ≤4 | ≥16 |
| 四环素TET | 0.25~128 | ≤4 | ≥16 |
| 恩诺沙星ENR | 0.007 812 5~32 | ≤0.5 | ≥4 |
| 环丙沙星CIP | 0.001 950 0~32 | ≤1 | ≥4 |
采用IBM SPSS 19.0统计学软件分析, 进行两因素的析因方差分析和差异显著性比较。
2 结果与分析 2.1 去甲肾上腺素对大肠杆菌生长的影响如图 1所示, 与未添加NE的对照组相比, 培养28 h后, 12.5、25、50及100 μmol·L-1组均显著促进2株大肠杆菌菌株的生长(P < 0.05);在NE添加浓度12.5~100 μmol·L-1范围内, 随NE浓度升高, 其促生长效果增强。因此后面的试验中选用NE的添加浓度为100 μmol·L-1。
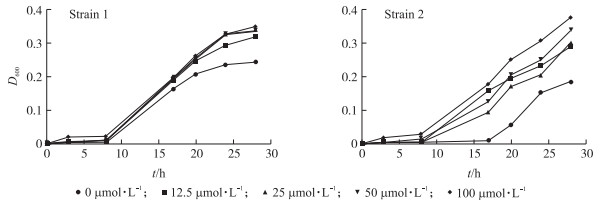
|
图 1 不同浓度去甲肾上腺素对大肠杆菌的促生长效果 Figure 1 Dose-response effects of norepinephrine(NE)on gowth promotion of E.coli |
以7株断奶香猪粪便源E.coli作为供体菌, J53作为受体菌, 用ENR和NaN3作为选择药物进行接合试验, 研究100 μmol·L-1的NE对E.coli分离株耐药质粒体外接合转移率的变化。其中4株供体菌经诱导后成功获得接合子(图 2)。与对照组相比, NE添加组耐药质粒的接合转移效率均有不同程度的提高, 其中A、B、C 3株菌NE诱导组的接合效率极显著高于对照组(P < 0.01)。
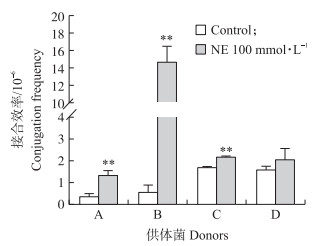
|
图 2 NE处理对供体菌接合效率的影响 Figure 2 The effects of NE on conjugation frequency of donors 与对照组相比, * *表示差异极显著。 Compared with control groups, * *means significant difference at 0.01 level. |
对接合子质粒喹诺酮类耐药基因进行PCR扩增并对其产物进行琼脂糖凝胶电泳检测, 比较接合子及供、受体菌质粒的喹诺酮类耐药基因。结果(表 5)显示:所有接合子均扩增到3种质粒携带的喹诺酮类耐药基因aac(6′)-lb-cr、oqxAB和qnrS, 而受体菌J53未检测到任何质粒携带的喹诺酮类耐药基因。说明接合子的这些耐药基因均从供体菌通过抗性质粒的水平转移获得。
| 菌株 Strains |
抗生素最小抑菌浓度/(μg·mL-1)MIC of antibiotic | 喹诺酮类耐药基因携带状况 Plasmid-medicated quinolone resistant genes |
||||||||
| AMP | FLO | GEN | TET | ENR | CIP | aac(6′)-lb-cr | oqxAB | qnrS | ||
| J53 | 4 | 4 | 0.25 | 2 | 0.015 6 | 0.078 1 | - | - | - | |
| A | >64 | 128 | >64 | 32 | 16 | 4 | + | + | + | |
| A0-1 | >64 | >128 | 64 | 32 | >32 | 32 | + | + | + | |
| A0-2 | >64 | >128 | 64 | 32 | >32 | 32 | + | + | + | |
| A100-1 | >64 | 128 | 64 | 64 | 16 | 4 | + | + | + | |
| A100-2 | >64 | 128 | >64 | 64 | 16 | 4 | + | + | + | |
| B | 4 | 8 | 64 | >128 | 32 | 16 | + | + | + | |
| B0-1 | >64 | >128 | 64 | 64 | >32 | >32 | + | + | + | |
| B0-2 | >64 | >128 | 64 | 64 | >32 | >32 | + | + | + | |
| B100-1 | 4 | 8 | 64 | 128 | 32 | 16 | + | + | + | |
| B100-2 | 4 | 8 | 64 | 128 | 32 | 16 | + | + | + | |
| C | >64 | >128 | 64 | 32 | >32 | >32 | + | + | + | |
| C0-1 | >64 | >128 | 64 | 64 | >32 | >32 | + | + | + | |
| C0-2 | >64 | >128 | 64 | 64 | >32 | >32 | + | + | + | |
| C100-1 | >64 | >128 | 64 | 1 | >32 | >32 | + | + | + | |
| C100-2 | >64 | >128 | 64 | 64 | >32 | >32 | + | + | + | |
| D | >64 | 8 | 0.5 | >128 | >32 | 32 | + | + | + | |
| D0-1 | >64 | 4 | 1 | 64 | >32 | 32 | + | + | + | |
| D0-2 | >64 | 4 | 1 | >128 | >32 | 32 | + | + | + | |
| D100-1 | >64 | 4 | 1 | >128 | >32 | 32 | + | + | + | |
| D100-2 | >64 | 4 | 0.5 | >128 | >32 | 32 | + | + | + | |
| 注:0表示未诱导组(接合子), 100表示去甲肾上腺素诱导组(接合子)。 Note: 0 indicates the control group(transconjugants), 100 indicates the NE treatment group(transconjugants). The same as follows. | ||||||||||
分别采用K-B纸片扩散法及琼脂稀释法对供、受体菌及接合子进行包括恩诺沙星在内的6种抗生素的敏感性检测, 结果见图 3和表 5。K-B纸片扩散法结果(图 3)显示:根据CLSI[17]公布的抑菌圈直径解释标准, 供体菌A对AMP、GEN、FLO的耐受程度较高, 其相应的接合子A100-2也呈现同样的耐受情况; 供体菌B对ENR、GEN、TET的耐受程度较高, 其相应的结合子B100-1对这3种抗生素也表现出耐受。琼脂稀释法结果(表 5)显示:对6种抗生素均敏感的受体菌J53在与供体菌发生成功接合转移后, 接合子均表现对喹诺酮类抗生素恩诺沙星耐受水平的显著提高, 与供体菌的MIC值无明显差异; 对其他5种抗生素的耐受水平也均显著升高, 大多接近供体菌的耐药水平。2种方法检测的药敏结果有较好的一致性。接合子的耐药基因检测和抗生素敏感性检测结果表明:大肠杆菌的耐药基因可通过接合方式传递给受体菌, 并在受体菌(接合子)中有效表达, 使其获得耐药表型。
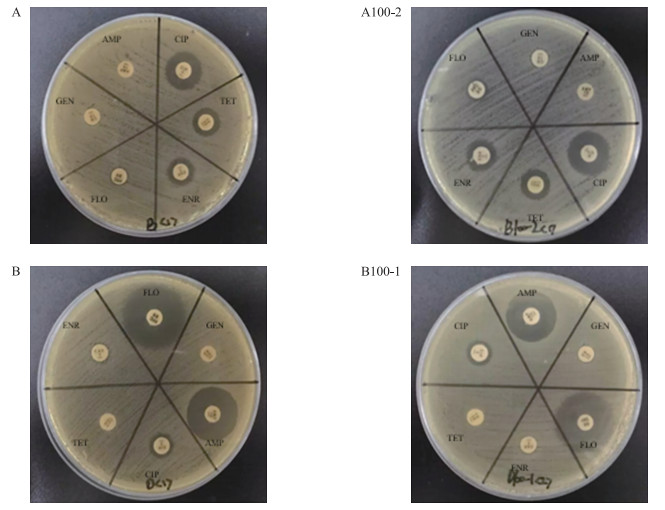
|
图 3 K-B纸片扩散法检测抗菌药物敏感性结果 Figure 3 The result of the susceptibilities against antimicrobial agents by Kirby.Bauer test |
处于应激状态的机体, 体内糖皮质激素和儿茶酚胺类激素的分泌量高于正常状态, 且免疫应答水平明显下降, 对细菌的易感性升高[19]。已有报道证实儿茶酚胺类激素能够促进细菌生长, 但是传统的细菌培养基(如LB肉汤)营养都比较丰富, 尤其是铁含量丰富(0.951 mg·L-1), 无法观察到显著的促生长效果[16, 20]。宿主体内游离的铁浓度极低, 本试验选择了贫铁的MEM培养液, 更好地模拟了在宿主体内铁限制的营养供应情况, FBS(铁离子含量0.218 mg·L-1)含有大量的转铁蛋白, NE可以摄取转铁蛋白中的铁离子形成稳定的螯合物, 然后与细菌外膜蛋白受体结合后转入铁为细菌生长所用[21]。细菌的接种剂量对于促生长试验也是一个至关重要的因素, 在去甲肾上腺素促进空肠弯曲菌生长的试验中, 细菌接种剂量与促生长效果呈显著负相关[20]。Freestone等[22]研究儿茶酚胺类激素刺激肠道共生大肠杆菌生长的过程中, 使用较低的细菌接种量(约100 CFU·mL-1)能够更好地接近哺乳动物宿主的体内条件。并且较低的细菌接种剂量可能更好地模拟宿主体内发生自然感染时的细菌数量[20], 因此本研究采用100 CFU·mL-1的细菌接种量。由于宿主在应激状态下胃肠道内去甲肾上腺素的浓度范围为2~50 μmol·L-1[16], 为了模拟细菌在应激状态下生长的体内环境, 本研究中NE的添加浓度设定为0、12.5、25、50、100 μmol·L-1。在NE体外促进E.coli生长的浓度筛选试验中, 随着NE浓度的增加, 其促生长效果增强, 即在接种后的不同时间点内, NE对E.coli的促生长效果具有浓度依赖性, 细菌浓度随NE浓度的升高而升高, 最终确定培养基中NE最佳添加浓度为100 μmol·L-1。
单个基因的突变和基因的获取是细菌在抗生素压力下耐药性产生的主要途径[23-24]。自发突变引起耐药的发生频率较低, 约为10-6~10-10, 而通过耐药基因转移引起细菌耐药的频率为10-4[25]。因此, 阴性细菌中DNA的接合转移是传播耐药的主要途径。Peterson等[16]首次报道NE可提高接合性质粒从鼠伤寒沙门氏菌向大肠杆菌水平转移的效率, 并发现肾上腺素能α受体阻断剂比β受体阻断剂的抑制作用更强。本研究发现在NE(100 μmol·L-1)存在的情况下, 携带耐药质粒的供体大肠杆菌向受体菌J53的接合转移率明显提高, 所有接合子均扩增到了来源于供体菌的3种喹诺酮类耐药基因:aac(6 ′)-lb-cr、oqxAB和qnrS。K-B纸片扩散法及琼脂稀释法药敏试验均显示, 接合子菌株在获得供体菌耐药基因的同时, 耐药表型也发生了传递, 表现出与供体菌接近的耐药表型。提示养猪生产中剪牙、断尾、混群、环境温度骤降等急性应激引起的体内儿茶酚胺类激素水平的上升, 在促进体内病原菌生长的同时, 也有可能促进病原菌耐药基因的获得, 从而使得细菌性疾病的预防与治疗难度加大。本试验中, 受体菌在与供体菌发生成功接合转移后, 接合子均表现出对喹诺酮类抗生素恩诺沙星的耐受水平显著升高, 且接合子对于庆大霉素、氟苯尼考等抗生素的耐受水平与受体菌相比有不同程度的升高, 耐药性发生了共转移。该现象说明接合性质粒在细菌耐药的传播过程中起到非常重要的作用。多种耐药基因可能位于同一质粒也从侧面加剧了日益严峻的耐药形式[9]。其中接合子A0-1、A0-2对CIP, B0-1、B0-2对AMP和FLO的耐受程度明显高于供体菌, 推测可能由于接合子中的基因表达环境改变, 使得原来未能表达的耐药基因能够正常甚至高表达。
宿主的生理应激和心理应激对于宿主疾病——特别是由感染引起的疾病的发病率、持续时间及严重程度有重要的影响。本研究结果提示宿主的应激激素有可能参与致病菌在宿主肠道环境中的适应以及进化, 通过接合转移的方式促进了耐药基因在肠道内的水平传播, 因此加强家畜养殖中各种应激因素的管理对于防止细菌感染引起的疾病具有重要意义。应激对于耐药基因水平传播的影响机制, 以及应激激素是否参与了病原菌耐药性的形成还需要进一步的研究。
| [1] | Bertolote J M, Fleischmann A, Butchart A, et al. Suicide, suicide attempts and pesticides:a major hidden public health problem[J]. Bull World Health Organ, 2006, 84(4): 260. |
| [2] | Reacher M H, Shah A, Livermore D M, et al. Bacteraemia and antibiotic resistance of its pathogens reported in England and Wales between 1990 and 1998:trend analysis[J]. British Medical Journal, 2000, 320(7229): 213–216. DOI: 10.1136/bmj.320.7229.213 |
| [3] |
郭蓉, 张峰, 郑卫江, 等. 撤除教槽料抗生素和无机铜对哺乳仔猪粪便大肠杆菌耐药性的影响[J].
南京农业大学学报, 2016, 39(3): 448–454.
Guo R, Zhang F, Zheng W J, et al. Effects of withdrawing antibiotic and copper in creep feed on the resistance of Escherichia coli isolated from feces of sucking piglets[J]. Journal of Nanjing Agricultural University, 2016, 39(3): 448–454. DOI: 10.7685/jnau.201601057 (in Chinese with English abstract) |
| [4] | Thomas C M. Paradigms of plasmid organization[J]. Molecular Microbiology, 2000, 37(3): 485–491. |
| [5] | Burrus V, Pavlovic G, Decaris B, et al. Conjugative transposons:the tip of the iceberg[J]. Molecular Microbiology, 2002, 46(3): 601–610. DOI: 10.1046/j.1365-2958.2002.03191.x |
| [6] | Nakamura Y, Itoh T, Matsuda H, et al. Biased biological functions of horizontally transferred genes in prokaryotic genomes[J]. Nat Genet, 2004, 36(7): 760–766. DOI: 10.1038/ng1381 |
| [7] | van den Eede G, Aarts H, Buhk H J, et al. The relevance of gene transfer to the safety of food and feed derived from genetically modified(GM)plants[J]. Food and Chemical Toxicology, 2004, 42(7): 1127–1156. DOI: 10.1016/j.fct.2004.02.001 |
| [8] | Furness J B. Types of neurons in the enteric nervous system[J]. J Auton Nerv Syst, 2000, 81(1/2/3): 87–96. |
| [9] | Thomas C M, Nielsen K M. Mechanisms of, and barriers to, horizontal gene transfer between bacteria[J]. Nat Rev Micro, 2005, 3(9): 711–721. DOI: 10.1038/nrmicro1234 |
| [10] | Lyte M, Ernst S. Catecholamine induced growth of gram negative bacteria[J]. Life Sci, 1992, 50(3): 203–212. DOI: 10.1016/0024-3205(92)90273-R |
| [11] | Freestone P P E, Lyte M, Neal C P, et al. The mammalian neuroendocrine hormone norepinephrine supplies iron for bacterial growth in the presence of transferrin or lactoferrin[J]. Journal of Bacteriology, 2000, 182(21): 6091–6098. DOI: 10.1128/JB.182.21.6091-6098.2000 |
| [12] | Bearson B L, Bearson S M D. The role of the QseC quorum-sensing sensor kinase in colonization and norepinephrine-enhanced motility of Salmonella enterica serovar Typhimurium[J]. Microbial Pathogenesis, 2008, 44(4): 271–278. DOI: 10.1016/j.micpath.2007.10.001 |
| [13] | Dowd S E. Escherichia coli O157:H7 gene expression in the presence of catecholamine norepinephrine[J]. FEMS Microbiology Letters, 2007, 273(2): 214–223. DOI: 10.1111/fml.2007.273.issue-2 |
| [14] | Chen C, Brown D R, Xie Y, et al. Catecholamines modulate Escherichia coli O157:H7 adherence to murine cecal mucosa[J]. Shock, 2003, 20(2): 183–188. DOI: 10.1097/01.shk.0000073867.66587.e0 |
| [15] | Clarke M B, Sperandio V. Events at the host-microbial interface of the gastrointestinal tract Ⅲ. Cell-to-cell signaling among microbial flora, host, and pathogens:there is a whole lot of talking going on[J]. American Journal of Physiology, 2005, 288(6): 1105–1109. |
| [16] | Peterson G, Kumar A, Gart E, et al. Catecholamines increase conjugative gene transfer between enteric bacteria[J]. Microbial Pathogenesis, 2011, 51(1/2): 1–8. |
| [17] | Watts J L. Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals[C]//Approved Standard, Third Edition. CLSI Document M31-A3. Wayne, PA:Clinical Laboratory Standards Institute, 2008. |
| [18] | Patel J B, Cockerill F R, Alder J, et al. Performance standards for antimicrobial susceptibility testing; twenty-fourth informational supplement[C]//CLSI Standards for Antimicrobial Susceptibility Testing. Wayne, PA:Clinical Laboratory Standards Institute, 2014:1-226. |
| [19] | Black P H. Central nervous system-immune system interactions:psychoneuroendocrinology of stress and its immune consequences[J]. Antimicrobial Agents and Chemotherapy, 1994, 38(1): 1–6. DOI: 10.1128/AAC.38.1.1 |
| [20] |
吴村. 去甲肾上腺素对空肠弯曲菌的促生长作用鉴定及表达谱分析[D]. 泰安: 山东农业大学, 2014.
Wu C. Effects of norepinephrine on growth promotion and gene expression profiling of Campylobacter jejuni[D]. Tai'an:Shandong Agricultural University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10434-1014341788.htm |
| [21] |
徐福洲, 吴村, 林军. 微生物内分泌学:揭示微生物与激素相互作用对感染的影响机制[J].
微生物学报, 2013, 53(9): 901–907.
Xu F Z, Wu C, Lin J. Microbial endocrinology:impact of interactions between microbes and neuroendocrine hormones on infection[J]. Acta Microbiologica Sinica, 2013, 53(9): 901–907. (in Chinese with English abstract) |
| [22] | Freestone P P, Williams P H, Haigh R D, et al. Growth stimulation of intestinal commensal Escherichia coli by catecholamines:a possible contributory factor in trauma-induced sepsis[J]. Shock, 2002, 18(5): 465–470. DOI: 10.1097/00024382-200211000-00014 |
| [23] | Martinez J L, Baquero F, Andersson D I. Predicting antibiotic resistance[J]. Nat Rev Micro, 2007, 5(12): 958–965. DOI: 10.1038/nrmicro1796 |
| [24] | Davies J. Inactivation of antibiotics and the dissemination of resistance genes[J]. Science, 1994, 264(5157): 375–382. DOI: 10.1126/science.8153624 |
| [25] | Halling-Sørensen B, Nors Nielsen S, Lanzky P F, et al. Occurrence, fate and effects of pharmaceutical substances in the environment:a review[J]. Chemosphere, 1998, 36(2): 357–393. DOI: 10.1016/S0045-6535(97)00354-8 |




