文章信息
- 李巧宁, 赵婕, 刘爱玲, 孟小宾, 鲍恩东
- LI Qiaoning, ZHAO Jie, LIU Ailing, MENG Xiaobin, BAO Endong
- 鸡组织中硫酸头孢喹肟的残留检测——高效液相色谱法
- Determination of cefquinome sulfate residues in broiler tissues by high performance liquid chromatography(HPLC)
- 南京农业大学学报, 2017, 40(5): 894-900
- Journal of Nanjing Agricultural University, 2017, 40(5): 894-900.
- http://dx.doi.org/10.7685/jnau.201701018
-
文章历史
- 收稿日期: 2017-01-18
2. 瑞普(天津)生物药业有限公司, 天津 300308
2. Ringpu(Tianjin) Bio-pharmacy Co. Ltd., Tianjin 300308, China
头孢喹肟又名头孢喹诺、头孢喹咪, 是第一个动物专用第4代头孢菌素, 20世纪80年代由德国赫司特公司研发。硫酸头孢喹肟于1993年首次被批准上市, 剂型为混悬液和软膏。2008年国产头孢喹肟原料及注射液被农业部批准为国家二类新兽药[1]。与第3代头孢类抗生素相比, 头孢喹肟抗菌谱更广, 抗菌活性更强, 并且对染色体和质粒介导的β-内酰胺酶稳定性也更高, 所以对细菌细胞膜的穿透性更强[2-4]。兽医临床上, 头孢喹肟主要用于治疗猪、牛的呼吸道疾病, 对乳房炎、子宫内膜炎也具有一定的治疗效果。目前也有将其用于治疗鸭传染性浆膜炎, 鸡、鹅的大肠杆菌、沙门氏菌、巴氏杆菌等病原菌以及支原体感染的报道[5]。头孢喹肟的药物动力学特点优良, 其在动物消化道内的吸收率较低, 但是皮下注射和肌肉注射时的吸收速度快、达峰时间短、生物利用度较高并且毒性较低, 在可食性组织中的残留量较少, 安全性较高[6-9]。有关头孢喹肟残留问题, 欧洲药物评价委员会将其在牛和猪可食性组织中的最大残留限量收录入欧盟理事会条例(EEC)2377/90号, 规定硫酸头孢喹肟的最大残余限量(MRL):肌肉0.05 mg·kg-1、肝脏0.1 mg·kg-1、肾脏0.2 mg·kg-1[10]。不过, 头孢喹肟残留检测的研究主要集中在牛奶和猪体内, 而有关其在鸡体内的研究则较少。为此, 本试验以头孢喹肟的原形药为残留标志物, 建立了鸡组织中头孢喹肟的固相萃取-高效液相色谱(SPE-HPLC)测定方法, 为了解头孢喹肟在鸡体内的残留消除规律及制定合理安全的休药期提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 试验动物28日齡的AA白羽肉鸡20只, 体质量(1.5±0.2) kg, 购自河北省廊坊市安次区康达种鸡养殖场。试验期间所有供试肉鸡按常规笼养, 饲喂不含抗菌药物的饲料, 自由饮水和采食。
1.1.2 药品和试剂硫酸头孢喹肟标准品(K0321406, 纯度82.6%, 以头孢喹肟计)由中国兽医药品监察所提供; 甲醇、乙腈(色谱级)购自天津市光复科技发展公司; 正己烷购自赛默飞世尔科技有限公司。
1.1.3 试验仪器及设备紫外分光光度计(CARY60)、高效液相色谱仪(安捷伦1260) 均为美国安捷伦科技有限公司产品; C18色谱柱(5C18-MS-Ⅱ 4.6 μm×250 mm)为COSMOSIL产品; C18固相萃取柱为苏州麦可旺志生物科技有限公司产品; 组织捣碎匀浆机(HJB660) 为美国WARING公司产品; 台式高速冷冻离心机(H1851R)为长沙湘仪离心机仪器有限公司产品; pH仪(PHS-3C)为上海雷磁仪器厂产品; 固相萃取仪(HSE-12B)为天津市恒奥科技发展有限公司产品; 水浴氮吹仪(CM-12) 为北京成萌伟业科技有限公司产品; 溶剂过滤器(GM-0.33A)、微孔滤膜(0.45 μm)为天津市津腾实验设备有限公司产品。
1.1.4 主要溶液配制硫酸头孢喹肟标准储备液(200 μg·mL-1):准确称取24.21 mg硫酸头孢喹肟标准品于100 mL容量瓶中, 用流动相溶解并定容, 密封, 4 ℃保存; HPLC流动相:准确量取90 mL乙腈, 与900 mL超纯水充分混匀, 用甲酸调pH至3.0, 0.45 μm微孔滤膜过滤, 超声脱气; 提取液:准确量取99 mL超纯水, 加入9 mL乙腈, 充分混匀, 制成体积比为1:11乙腈水溶液; 淋洗液:准确量取95 mL超纯水, 加入5 mL乙腈, 充分混匀, 制成5%(体积分数)的乙腈水; 洗脱液:准确量取50 mL乙腈及超纯水, 充分混匀, 制成50%的乙腈水。
1.2 试验方法 1.2.1 组织样品前处理将试验肉鸡处死, 快速取其皮肤和脂肪(以下简称皮脂)、胸肌、肝脏、肾脏组织剪碎, 于匀浆机中以10 000 r·min-1 4 ℃匀浆5 min, 将匀浆好的组织分装, 做标记, 置于-20 ℃冰箱保存备用。样品保存时间不超过1个月。
分别准确称取2.5 g已融化的鸡组织(包括皮脂、肌肉、肝和肾组织), 置于50 mL聚丙烯离心管中, 加入6 mL提取液, 涡旋2 min, 将其充分混匀, 300 r·min-1振荡15 min, 10 000 r·min-1 4 ℃离心10 min。取上清液于新的50 mL聚丙烯离心管中, 加入6 mL提取液, 涡旋2 min。将2次的上清液合并后加入6 mL正己烷, 涡旋, 放入摇床300 r·min-1振荡15 min, 然后10 000 r·min-1 4 ℃离心10 min, 取底部澄清液体, 过SPE柱, 向上层(正己烷层)中再加入6 mL提取液, 涡旋, 10 000 r·min-1 4 ℃离心10 min, 取底部澄清液体过SPE柱。
1.2.2 SPE柱净化用5 mL甲醇过柱, 用5 mL超纯水平衡SPE柱, 然后加入5 mL流动相润洗SPE柱, 控制溶液不要流干。将1.2.1节提取液过柱, 流速控制在每秒1滴左右。待提取液流干后, 加入2 mL超纯水、1 mL 5%乙腈水淋洗柱子。待淋洗液流干后将SPE柱真空抽干, 最后用6 mL 50%乙腈水洗脱, 再将SPE柱抽干, 收集洗脱液于10 mL刻度试管中, 用氮气50 ℃吹干, 最后用1 mL流动相复溶, 涡旋, 10 000 r·min-1 4 ℃离心10 min, 用0.22 μm针筒式滤膜过滤, 每次取20 μL进样分析。
1.2.3 药物残留检测条件C18色谱柱(4.6 μm×250 mm); 流动相为乙腈-水(体积比为1:10), 用甲酸调pH3.0左右, 以0.45 μm微孔滤膜过滤, 超声5 min后备用; 紫外检测器; 流速1.0 mL·min-1; 检测波长270 nm; 柱温30 ℃; 进样量20 μL。
1.2.4 方法的标准曲线制备精密称取各空白匀浆组织2.50 g, 准确加入头孢喹肟标准溶液, 使各组织匀浆中头孢喹肟含量(X)分别为0.02、0.05、0.10、0.20、0.50、1.00、2.00 μg·g-1, 按1.2.1节样品前处理方法分别处理, 依色谱测定方法进样, 记录色谱图, 得峰面积, 每个浓度重复5次, 以平均峰面积(Y)对头孢喹肟平均含量(X)回归, 分别得出不同组织样品药物浓度的标准曲线和回归方程。
1.2.5 方法的定量限和检测限测定取鸡组织样品2.50 g, 采用倍比稀释法对标准品进行稀释, 按照体积比20:1的比例将其准确加入到各组织中, 使硫酸头孢喹肟的含量分别为0.005、0.01、0.02、0.04 μg·g-1, 分别按上述样品处理方法进行处理, 每个含量5个重复, 测得基线噪音值, 计算每个含量极限噪音值的平均值, 将信噪比(S/N)不小于3定为检测限(LOD), S/N不小于10定为定量限(LOQ)。
1.2.6 方法的添加回收率测定分别取2.50 g空白肌肉、肝脏、肾脏、皮脂组织匀浆样, 按照要求添加一定体积的标准溶液, 使各组织中药物含量分别为0.02、0.20和2.00 μg·g-1, 按上述样品前处理方法分别处理后进行HPLC测定。同时用对应含量的头孢喹肟标准溶液作为对照进行HPLC测定, 每个含量5个重复。回收率的计算公式:回收率=(预处理后组织中头孢喹肟的实测峰面积/对应标准溶液中头孢喹肟的峰面积)×100%。
1.2.7 方法的精密度测定分别取2.50 g空白肌肉、肝脏、肾脏、皮脂组织匀浆样, 按照要求添加一定体积的标准溶液, 使各组织中药物含量分别为0.02、0.20和2.00 μg·g-1, 每个含量5个重复, 按上述样品前处理方法处理后进行HPLC测定, 连续测定5 d, 计算日内变异系数和日间变异系数。
1.2.8 方法的稳定性测定分别取2.50 g空白肌肉、肝脏、肾脏、皮脂组织匀浆样, 按照要求添加一定体积的标准溶液, 使各组织中药物含量均为0.20 μg·g-1, 在室温、4 ℃和-20 ℃条件下分别存放0、6、12、24、36和48 h后, 利用HPLC检测其响应值。用各组织对应的标准曲线方程分别计算样品中的药物含量, 以确定生物样品的存放条件, 保证检测结果的准确性和重现性。
1.2.9 方法的特异性检测选取了与硫酸头孢喹肟化学性质及结构相近的4种药物(阿莫西林、甲氧苄啶、氨苄西林、磺胺嘧啶), 将药物用流动相稀释制成2.00 μg·mL-1的标准工作液, 用硫酸头孢喹肟的检测方法进行检测, 以确定各种药物的出峰时间。将上述4种药物与头孢喹肟混合配制成质量浓度均为40.00 μg·mL-1的混合标准工作液。分别取2.50 g空白肌肉、肝脏、肾脏、脂肪和皮肤组织匀浆样, 按照要求添加一定体积的混合标准工作液, 使各组织中药物含量均为2.00 μg·g-1, 按照上述样品前处理法进行HPLC测定, 确定其他药物的存在不会影响硫酸头孢喹肟的测定。
2 结果与分析 2.1 色谱分析硫酸头孢喹肟标准品、空白皮脂样品和空白皮脂样品中添加硫酸头孢喹肟标准品的色谱图如图 1所示。由图 1可见:在所选用的分析条件下可较好地分离硫酸头孢喹肟。乙腈含量的多少对出峰时间影响较大, pH值的高低对峰型及出峰时间均有影响。当乙腈含量不变时, 流动相的pH值小于3时, 内源性杂质对测定的干扰较大; 当pH值等于3时, 目的峰与杂质峰彻底分离。硫酸头孢喹肟的保留时间为18 min左右, 分离度好。
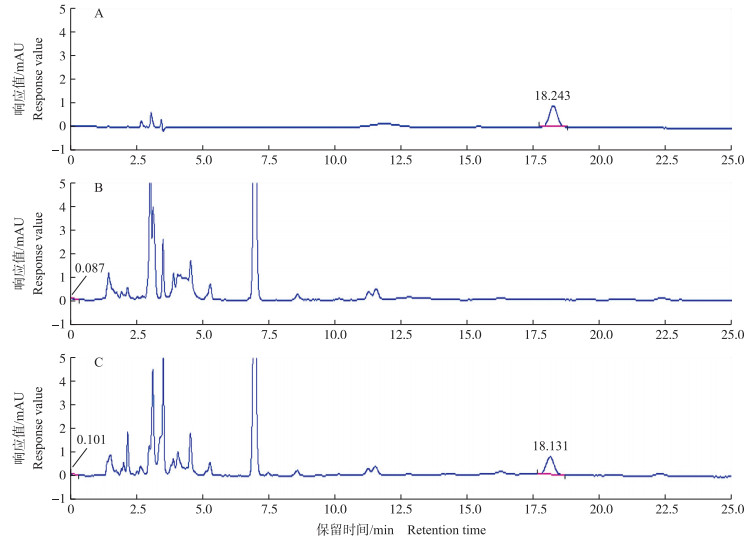
|
图 1 鸡皮肤和脂肪组织中硫酸头孢喹肟的高效液相色谱图 Figure 1 Chromatograms of cefquinome sulfate in the skin and fat tissues of broilers A:硫酸头孢喹肟标准品色谱图(0.20 μg·g-1)Chromatograms of cefquinome sulfate standard(0.20 μg·g-1); B:空白皮脂(皮肤和脂肪)色谱图Chromatograms of control skin and fat; C:添加标准品的皮脂色谱图(0.20 μg·g-1)Chromatograms of spiked fat and skin(0.20 μg·g-1). |
测定肌肉、肝脏、肾脏、皮脂等组织样品中硫酸头孢喹肟的浓度, 以峰面积(Y)对药物浓度(X)回归, 得线性回归方程(表 1)。肌肉、肝脏、肾脏、皮脂等组织中药物含量均在0.02~2.00 μg·g-1范围内, 线性关系良好。
| 组织样本Sample | 标准曲线方程Standard curve | 相关系数(R2) Correlation coefficients |
| 皮脂Skin and fat | Y=88.507X-0.780 4 | 0.999 8 |
| 肌肉Muscle | Y=87.334X+0.425 6 | 0.999 5 |
| 肝脏Liver | Y=83.905X+0.159 1 | 0.999 9 |
| 肾脏Kidney | Y=82.284X+0.125 7 | 0.999 2 |
硫酸头孢喹肟在受试鸡皮脂、肌肉、肝脏、肾脏样品中的的LOD和LOQ分别为0.01 μg·g-1和0.02 μg·g-1。
2.4 样品回收率测定由表 2可知:4种受试鸡组织样品在0.02~2.00 μg·g-1添加范围内, 药物平均回收率为85.98%~89.90%。
| 组织 Tissue |
添加量/(μg·g-1) Added content |
回收率/% Recovery rat |
相对标准差/% RSD |
| 皮脂 Skin and fat |
0.02 | 92.00±7.19 | 7.82 |
| 0.20 | 88.10±3.81 | 4.32 | |
| 2.00 | 88.27±4.18 | 4.74 | |
| 肌肉 Muscle |
0.02 | 84.76±7.27 | 8.58 |
| 0.20 | 94.79±3.67 | 3.87 | |
| 2.00 | 87.00±2.12 | 2.43 | |
| 肝脏 Liver |
0.02 | 93.56±11.42 | 12.20 |
| 0.20 | 90.03±5.33 | 5.92 | |
| 2.00 | 86.12±6.28 | 7.29 | |
| 肾脏 Kidney |
0.02 | 86.53±7.91 | 9.4 |
| 0.20 | 86.79±4.39 | 5.06 | |
| 2.00 | 84.63±4.93 | 5.82 |
分别取空白肌肉、肝脏、肾脏、皮脂组织样品各2.50 g, 添加一定体积的硫酸头孢喹肟标准品溶液, 使肌肉、肝脏、肾脏、皮脂组织样品中药物含量分别为0.02、0.20和2.00 μg·g-1, 每个含量5个重复, 连续测定5 d。结果(表 3)表明:4种组织中各药物含量测定的日内变异系数为0.86%~11.8%, 日间变异系数为2.44%~11.13%。
| 组织 Tissue |
添加量/(μg·g-1) Added content |
日内变异系数Intra-day coefficient | 日间变异系数Inter-day coefficient | |||
| 测定值Detemination value | RSD/% | 测定值Detemination value | RSD/% | |||
| 皮脂 Skin and fat |
0.02 | 0.027±0.001 0 | 3.72 | 0.027±0.001 5 | 5.34 | |
| 0.20 | 0.198±0.005 5 | 2.77 | 0.202±0.008 4 | 4.14 | ||
| 2.00 | 1.969±0.100 8 | 5.12 | 1.986±0.093 6 | 4.71 | ||
| 肌肉 Muscle |
0.02 | 0.016±0.001 9 | 11.80 | 0.015±0.001 7 | 11.30 | |
| 0.20 | 0.208±0.010 4 | 4.98 | 0.211±0.008 4 | 3.96 | ||
| 2.00 | 1.974±0.008 4 | 0.43 | 2.010±0.049 0 | 2.44 | ||
| 肝脏 Liver |
0.02 | 0.019±0.001 0 | 5.10 | 0.022±0.002 4 | 11.15 | |
| 0.20 | 0.211±0.009 4 | 4.42 | 0.216±0.013 7 | 6.33 | ||
| 2.00 | 2.197±0.164 8 | 7.49 | 2.054±0.149 7 | 7.28 | ||
| 肾脏 Kidney |
0.02 | 0.019±0.001 6 | 7.33 | 0.018±0.001 8 | 9.89 | |
| 0.20 | 0.188±0.008 1 | 4.31 | 0.196±0.010 0 | 5.10 | ||
| 2.00 | 1.819±0.015 6 | 0.86 | 1.929±0.420 0 | 6.39 | ||
在本试验条件下, 用HPLC法测定室温(25 ℃)、4 ℃及-20 ℃条件下含有0.20 μg·g-1药物组织样品的响应值, 用各个组织对应的标准曲线回归方程计算各样品中硫酸头孢喹肟的药物含量。由表 4可知:所有组织样品中的药物在48 h的观察期内均未发生降解, 说明样品在室温、4 ℃和-20 ℃条件下的稳定性好, 均适合样品的储存。
| 组织 Tissue |
储存温度/℃ Storage temperature |
不同储存时间的药物含量/(μg·g-1) Content of differment storage time |
相对标准偏差/% RSD |
|||||
| 0 h | 6 h | 12 h | 24 h | 36 h | 48 h | |||
| 皮脂 Skin and fat |
25(室温Room temperature) | 0.175 | 0.175 | 0.187 | 0.195 | 0.185 | 0.192 | 0.850 |
| 4 | 0.170 | 0.170 | 0.193 | 0.173 | 0.170 | 0.173 | 0.893 | |
| -20 | 0.178 | 0.175 | 0.178 | 0.182 | 0.169 | 0.167 | 0.572 | |
| 肌肉 Muscle |
25(室温Room temperature) | 0.165 | 0.163 | 0.159 | 0.157 | 0.155 | 0.168 | 0.496 |
| 4 | 0.167 | 0.175 | 0.185 | 0.173 | 0.165 | 0.163 | 0.827 | |
| -20 | 0.162 | 0.162 | 0.160 | 0.162 | 0.155 | 0.158 | 0.209 | |
| 肝脏 Liver |
25(室温Room temperature) | 0.179 | 0.183 | 0.183 | 0.191 | 0.202 | 0.205 | 1.062 |
| 4 | 0.175 | 0.176 | 0.175 | 0.178 | 0.179 | 0.176 | 0.196 | |
| -20 | 0.172 | 0.179 | 0.189 | 0.175 | 0.178 | 0.176 | 0.584 | |
| 肾脏 Kidney |
25(室温Room temperature) | 0.178 | 0.187 | 0.183 | 0.187 | 0.193 | 0.187 | 0.483 |
| 4 | 0.176 | 0.183 | 0.189 | 0.192 | 0.188 | 0.176 | 0.686 | |
| -20 | 0.183 | 0.197 | 0.197 | 0.192 | 0.194 | 0.173 | 0.919 | |
由图 2可知:阿莫西林、甲氧苄啶、氨苄西林、磺胺嘧啶的出峰时间分别在3.5、6.9、8.7和11.5 min。将药物加入到组织中经过样品前处理后阿莫西林及氨苄西林几乎未被保留下来, 甲氧苄啶和磺胺嘧啶的存在也未影响到硫酸头孢喹肟的测定。
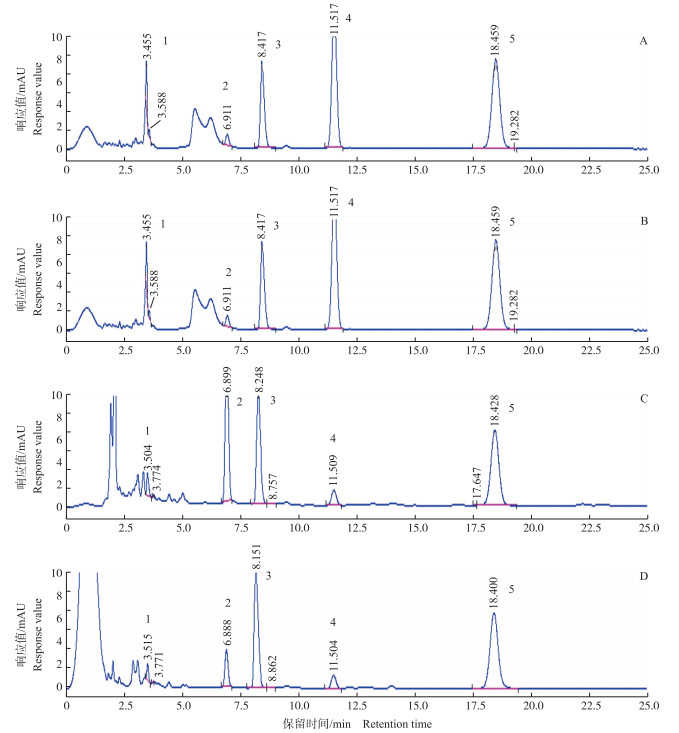
|
图 2 各种药物在受试鸡组织中的干扰色谱图 Figure 2 Interferential chromatograms of different antibiotics in tissues of the tested broilers A:皮脂Fat and skin; B:肌肉Muscle; C:肝脏Liver; D:肾脏Kidney. 1.阿莫西林Amoxicillin; 2.甲氧苄啶Methoxyl benzyl organism; 3.氨苄西林Ampicillin; 4.磺胺嘧啶Sulfadiazine; 5.硫酸头孢喹肟Cefquinome sulfate. |
在应用HPLC对动物组织、牛乳等样品进行检测时, 对于样品预处理的要求较高, 且预处理时必须仔细谨慎[11], 鸡的各脏器组织中成分相对复杂, 蛋白质、多肽和脂肪等大分子物质会对药物提取产生很大的干扰作用[10-12]。因此, 提取液应尽量选择对这些干扰物沉淀能力强, 同时又能溶解硫酸头孢喹肟的溶液。硫酸头孢喹肟属于β-内酰胺类抗生素, 试验中常用水或酸化的有机溶剂提取药物, 同时为了防止大分子物质与药物结合, 要进行蛋白沉淀, 常用的有机溶剂有甲醇、乙腈、异丙醇和无机盐等[13]。硫酸头孢喹肟具有一定的极性, 根据相似相溶的原理, 通常选择具有一定极性的溶剂, 根据文献报道, 对于头孢类药物常用乙腈来沉淀蛋白[8], 因此本研究中我们选择了乙腈、不同比例的乙腈-水、乙腈-甲酸水作为提取液, 比较了这几种提取液的提取效果。试验结果表明, 选择乙腈做提取液时, 杂质峰较多并且很难与目的峰分离; 选用乙腈-0.1%甲酸水作为提取液时, 提取液较混浊, 不利于过SPE柱净化浓缩; 不同比例的(如8:1、6:1、4:1、1:9、1:10、1:11) 乙腈-水作为提取液, 发现8:1、6:1、4:1比例的提取液中, 当乙腈含量较多时提取效果较差, 杂质峰多且与目的峰的分离效果差, 但当乙腈-水体积比为1:9、1:10、1:11时, 即当乙腈含量较少时的提取效果较好, 杂质峰相对较少且易于与目的峰分离, 并且回收率较高。由于提取后的液体要过SPE柱, 所以最终选择了乙腈含量最少的比例, 即乙腈-水(1:11) 作为提取液, 这样既能保证有乙腈沉淀蛋白, 又可获得较好的药物提取率。由于皮脂、肌肉、肝脏、肾脏等组织中含有一定量的脂肪, 所以在用提取液提取之后, 需要在提取液中加入适量的正己烷去除脂肪。研究发现, 加入正己烷属于液液萃取, 主要是根据药物在互不相溶的两相中的分配系数进行分布, 用正己烷萃取后会有10%左右的药物会滞留在正己烷中, 所以需要在正己烷中加入提取液, 重新提取一次以提高药物回收率。
药物提取的常用方法有振荡提取、超声提取和均质提取。振荡提取是利用液体流动而使待测组分溶出; 超声提取是利用机械效应、空化效应及热效应将待测组分快速溶出; 均质提取是通过高速搅拌或匀浆, 使提取溶剂与样品的微细颗粒充分接触、混合, 将待测组分从固体样品中快速溶出[10]。本试验对超声、振荡及先超声后振荡3种提取方法进行比较发现振荡提取的效果要比超声提取好, 振荡提取与先超声后振荡提取效果相差不大, 因此试验最终选择了振荡的提取方式。
根据药物的理化性质、酸碱性及水溶性等特点可以确定选用萃取柱的类型。净化头孢类抗生素常用的固相萃取柱有C18柱、离子交换柱和二乙烯基苯-N-乙烯基吡咯烷酮共聚物小柱[14]。本试验中, 分别比较了Wonda Sep C18柱、麦可旺志C18柱及Thermo HLB柱的保留及净化效果。结果发现, 前者对头孢喹肟的保留效果较差, 而后两者对头孢喹肟的保留效果无明显差别。对其净化效果和经济性的比较结果显示, 麦可旺志C18固相萃取柱在上样后用2 mL水淋洗, 未见有目标物被淋洗, 再用1 mL 10%乙腈水溶液淋洗会有少部分目标物被淋洗, 改选1 mL 5%乙腈水溶液作为淋洗液, 能更好保留药物。淋洗液选用纯乙腈时会将较多的杂质洗脱下来, 最终选用50%乙腈水溶液能将目标物完全洗脱下来, 同时尽可能少洗脱干扰物。
文献报道, 头孢菌素类抗生素可选用乙腈-甲酸水作为流动相[14], 乙腈及甲酸含量的不同会影响目的峰与杂质峰的出峰时间及峰型, 选用甲酸调节pH值`是由于头孢喹肟属于有机酸(pH值约1.5~2.5), 色谱柱中含有硅羟基, 会造成样品峰拖尾, 而低pH值能帮助抑制硅羟基的活性, 减小拖尾, 从而改善峰形, 提高分离度。本试验对不同pH值的流动相进行比较, 发现pH3.0左右时, 峰型较好, 与杂质峰的分离效果也较好。经过反复测试, 确定HPLC条件为流动相为乙腈-水(体积比为1:10), 用甲酸调至pH3.0左右, 保留时间在18 min左右, 鸡组织中硫酸头孢喹肟残留检测的精确度高, 准确性和重现性好, 符合残留检测的要求。
| [1] |
吴波, 段龙川, 罗厚强, 等. 头孢喹诺在黄羽肉鸡可食组织中残留消除规律研究[J].
上海畜牧兽医通讯, 2015(2): 13–17.
Wu B, Duan L C, Luo H Q, et al. Elimination regularity and residues of cefquinome in broiler tissues[J]. Shanghai Animal Husbandry and Veterinary Communications, 2015(2): 13–17. (in Chinese with English abstract) |
| [2] | CVMP(Committee for Veterinary Medical Products). Cefquinome Summary Report-2, EMEA/MRL/545/99[R]. London:EMEA, 1999. |
| [3] | Dolhan A, Jelinska A, Bebenek M. Stability of ceftiofur sodium and cefquinome sulphate in intravenous solutions[J]. The Scientific World Journal, 2014, 2014. DOI: 10.1155/2014/583461 |
| [4] |
刘美端, 赵地顺, 刘宝树, 等. 头孢喹肟研究进展[J].
中国畜牧兽医, 2013, 40(4): 216–220.
Liu M D, Zhao D S, Liu B S, et al. Reserch advance on cefquinome[J]. China Animal Husbandry and Veterinary Medicine, 2013, 40(4): 216–220. (in Chinese with English abstract) |
| [5] | Gulin V, Carret G, Houffschrnit P. In vitro activity of antimicrobial 10 antimicrohial agent against bacteria is olated from cows with clinical mastitis[J]. The Verterinary Record, 2003, 152: 466–471. DOI: 10.1136/vr.152.15.466 |
| [6] | Zhang X G, Li J C, Jiang H Y, et al. Residue depletion of cefquinome in swine tissue after intramuscular administration[J]. Journal of Agricultural and Food Chemistry, 2007, 55: 10493–10498. DOI: 10.1021/jf0719860 |
| [7] | Thomas E, Heuwieser W, Allan M J, et al. Pharmacokinetics of cefquinome in the bovine dry udder secretions used as basis for a dose titration of a new intramammary cefquinome formulation[J]. Journal of Veterinary Pharmacology and Therapeutics, 2003, 26(1): 282–307. |
| [8] |
蒋春茂, 陈晓兰, 陈毓. 硫酸头孢喹肟在鸡体内的药动学和生物利用度研究[J].
畜牧与兽医, 2014, 46(7): 73–76.
Jiang C M, Chen X L, Chen Y. The research of pharmacokinetics and bioavailability of cefquinome slufate in broiler[J]. Animal Husbandary and Veterinary Medicine, 2014, 46(7): 73–76. (in Chinese with English abstract) |
| [9] | Limbert M, Insert D, Klesel N, et al. Antibacterial activities in vitro and in vivo and pharmacokinetics of cefquinome, a new broad-spectrum cephalosorin[J]. Journal of Antimicrobial Chemotherapy, 1991, 35(1): 14–19. DOI: 10.1128/AAC.35.1.14 |
| [10] |
刘世娟. HPLC-MS/MS检测肌肉组织中多头孢菌素残留方法的建立[D]. 合肥: 安徽农业大学, 2012.
Liu S J. Establishment on HPLC-MS/MS detection methods for multi-cephalosporins in muscle tissue[D]. Hefei:Anhui Agricultural University, 2012(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10364-1013172964.htm |
| [11] |
胡佳丽, 刘小雷, 于东升. 动物源食品中β-内酰胺类抗生素残留的检测现状[J].
中国畜牧兽医, 2014, 41(1): 226–230.
Hu J L, Liu X L, Yu D S. The current status on the detection of-lactam antibiotics residues in animal-derived food[J]. China Animal Husbandry and Veterinary Medicine, 2014, 41(1): 226–230. (in Chinese with English abstract) |
| [12] |
晏苒, 曾明华, 苏婷婷, 等. 鸡组织中阿德呋啉药物残留的高效液相色谱-串联质谱法测定[J].
南京农业大学学报, 2014, 37(3): 112–118.
Yan R, Zeng H M, Su T T, et al. Determination of adprin in chicken tissues by high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Nanjing Agricultural University, 2014, 37(3): 112–118. DOI: 10.7685/j.issn.1000-2030.2014.03.017 (in Chinese with English abstract) |
| [13] |
刘创基. 动物性食品中β-内酰胺类药物及其代谢物检测方法的研究[D]. 北京: 北京化工大学, 2010.
Liu C J. Determination of beta-lactam antibiotics and their metabolites in food of animal origin[D]. Beijing:Beijing University of Chemical Technology, 2010(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10010-2010170330.htm |
| [14] |
白国涛, 储晓刚, 潘国卿, 等. 超高效液相色谱-串联质谱法测定牛肉中9种头孢菌素类药物残留[J].
色谱, 2009, 27(4): 417–420.
Bai G T, Chu X G, Pan G Q, et al. Determination of 9 cephalosporin drug residues in beef by ultraperformance liquid chromatographytandem mass spectrometry[J]. Chinese Journal of Chromatography, 2009, 27(4): 417–420. (in Chinese with English abstract) |




