文章信息
- 高雪, 朱立麒, 栗云云, 吴海琴, 朱怡蕾, 庾庆华
- GAO Xue, ZHU Liqi, LI Yunyun, WU Haiqin, ZHU Yilei, YU Qinghua
- 重组嗜酸乳杆菌S层蛋白拮抗H9N2禽流感病毒对树突状细胞侵袭的研究
- Inhibition of H9N2virus infection in dendritic cells by recombinant S-layer proteins of Lactobacillus acidophilus
- 南京农业大学学报, 2017, 40(5): 881-887
- Journal of Nanjing Agricultural University, 2017, 40(5): 881-887.
- http://dx.doi.org/10.7685/jnau.201609044
-
文章历史
- 收稿日期: 2016-09-28
禽流感(aivan influenza, AI)是由禽流感病毒(avian influenza virus, AIV)引起的禽类传染病, 严重危害我国养禽业的健康发展和人类安全。根据AIV感染鸡时致病性的强弱将其分为高致病性禽流感和低致病性禽流感[1], H9N2亚型禽流感病毒属于低致病性禽流感病毒。我国1994年首次报道该病毒感染鸡, 目前其已成为我国主要的禽流感流行毒株[2]。该病毒感染宿主后可能不致死或不发病, 但是, 可以通过粪-口途径由感染病毒的水禽进行传播[3]。此外, 有研究表明从高致病性H7N9流感病毒患者体内分离到的H7N9病毒有6个基因片段来源于H9N2病毒[4], 可见, H9N2禽流感病毒为新型高致病性流感病毒的重组变异提供了可能性, 对人类造成了潜在的威胁。
疫苗预防和在黏膜部分阻断病毒入侵是防治禽流感病毒的主要方式, 但目前我国禽流感疫苗接种后产生免疫应答的保护力难以防控禽流感的发生, 疫苗接种后禽流感在部分区域仍然呈流行态势, 这与禽流感病毒容易突变造成疫苗的失效密切相关。因此, 高效阻断禽流感病毒对呼吸道黏膜的侵袭是防治禽流感的重要措施。位于黏膜固有层中的树突状细胞作为机体功能最强的专职抗原递呈细胞(antigen presenting cells, APC), 可摄取、加工处理抗原并将其递呈给T细胞以启动免疫应答, 起着“哨兵”的作用[5]。虽然禽流感病毒通过黏膜上皮细胞唾液酸α-2, 3 Gal受体介导侵袭, 但树突状细胞对禽流感病毒的摄取和递呈是启动免疫应答的先决条件, 因此, 阻断禽流感对树突状细胞的侵袭对于防治禽流感具有重要意义。
S层蛋白是一种在古细菌和某些细菌表面能够自装配为规则晶格的单分子层蛋白, 相对分子质量为(40~200)×103[6], 占菌体总蛋白的10%~15%[7-8]。乳酸杆菌是一种常见的优势益生菌, 存在于人类和动物消化道、生殖道中。具有维持动物消化道内微生物区系平衡、加强黏膜屏障、增强机体免疫力等重要的生物学功能[9-11]。很多研究已经证实, S层蛋白存在于包括嗜酸乳杆菌ATCC4356在内的多种乳酸杆菌中[12-15]。近年来发现, 乳酸杆菌对病原菌的拮抗作用与S层蛋白密切相关[16]; 也有研究发现S层蛋白拮抗肠道致病菌侵袭肠上皮细胞的现象, 但它的大部分功能尚不清楚[17]。最近研究表明S层蛋白能够拮抗胡宁病毒(JUNV)对表达树突状细胞表面特异性非整联蛋白(DC-SIGN)3T3细胞的侵袭, 但试验中使用的提取于乳酸杆菌的S层蛋白纯度较低, 提取过程因涉及到变性剂等化学试剂而可能会影响S层蛋白结构, 并且乳酸杆菌的S层蛋白如何拮抗病毒的侵袭及其机制尚不清楚[18]。
研究证实乳酸杆菌的S层蛋白可以结合DC-SIGN受体从而诱导树突状细胞的活化[19], 禽流感病毒同样可以通过与DC-SIGN的结合促进病毒在人源树突状细胞内的复制[20]。因此, 为了解嗜酸乳杆菌S层蛋白的作用, 本试验利用大肠杆菌重组表达S层蛋白, 并通过亲和层析纯化重组S层蛋白, 探究其是否能够拮抗H9N2禽流感病毒对树突状细胞的侵袭, 从而在黏膜部位阻断禽流感病毒入侵机体, 为禽流感病毒的预防提供了新思路。
1 材料与方法 1.1 试验材料 1.1.1 菌株和质粒原核表达载体pGEX-4t-2、大肠杆菌JM109菌株和Rosetta-gami2(DE3) 菌株购自上海捷瑞生物工程有限公司。
1.1.2 病毒和动物禽流感病毒(A/Duck/Nanjing/01/1000, H9N2)由江苏省农业科学院兽医研究所惠赠。C57BL/6小鼠(4周龄, SPF级别)购自扬州大学动物研究中心。动物试验完全遵照南京农业大学实验动物护理和使用委员会对于动物实验的相关规定进行的。
1.2 试验方法 1.2.1 重组质粒的构建设计引物P1、P2(表 1)从乳酸杆菌ATCC4356的基因组中扩增出带有同源臂并且去除了信号肽的S层蛋白片段, 共1 279 bp。将pGEX-4t-2载体骨架用限制性内切酶BamHⅠ和XhoⅠ消化。将PCR产物与酶切消化产物经琼脂糖凝胶电泳后, 切下凝胶中S层蛋白基因片断和线性化的pGEX-4t-2。将切下的DNA片段用DNA回收试剂盒回收, 回收的线性化质粒pGEX-4t-2与带有同源臂的S层蛋白基因片段以1 : 3(物质的量比)混合, 加入T4连接酶(Thermo), 4 ℃过夜连接。连接产物转化大肠杆菌JM109菌株后, 将JM109涂布在含有氨苄青霉素(50 μg·mL-1)的LB平板, 37 ℃培养过夜。挑取单个转化子菌落, 在含有氨苄青霉素(50 μg·mL-1)的LB液体培养基中, 37 ℃振荡培养12 h。提取质粒作限制性酶切鉴定并测序, 命名为pGEX-4t-2-S。
| 目的基因 Target gene |
引物序列(5′→3′) Primer sequence(5′→3′) |
目的基因长度/bp Target gene length |
| 带有同源臂的S层蛋白 S-layer protein with homologous arms |
P1:GGTTCCGCGTGGATCCATGAAGAAAAATTTAAGAATCGTTAG P2:GGTTCCGCGTGGATCCGCTGTATCTACTGTTAGCGCTGCTACT |
1 279 |
| S层蛋白 S-layer protein |
P3:TGCTGCTTTACTTGCTGTTG P4:CTCTTGCTTACGCTGGCTAC |
927 |
| HA | F:AGACCATCGGCTGTTAATGG; R:TTGTGTATTGGGCGTCTTGA | 235 |
| NA | F:TTCAGGCAGAATGAATGCAG; R:TGCGGAAAGCCTAATTGAGT | 213 |
| NP | F:GAAATCCTGGGAATGCTGAA; R:AACACCTGGCTGTTTTGGAG | 202 |
| PB1 | F:TAACCCTCTGAACCCGTTTG; R:TTCCCCTTTGGCTAGTGTTG | 170 |
取1 μL(200 ng·μL-1)重组质粒pGEX-4t-2-S加入到50 μL E.coli Rosetta-gami2(DE3) 转化感受态细胞中, 冰上作用30 min后, 于水浴锅中42 ℃热激90 s, 立即取出, 在冰上孵育5 min后加入900 μL超级代谢抑制肉汤(super optimal broth with catabolite repression, SOC)培养基, 轻轻颠倒混匀, 放入37 ℃恒温培养箱中复苏10 min。将复苏的菌液放置于37 ℃摇床中, 150 r·min-1培养40 min, 取出菌液, 5 000 r·min-1离心5 min, 弃去上清液, 加入100 μL PBS重悬后涂布于氨苄青霉素抗性固体基础培养基(LB)平板。12~16 h后, 挑取转化子菌落, 使用引物P3、P4(表 1)进行PCR验证。
1.2.3 S层蛋白的提取和纯化挑取重组E.coli Rosetta-gami2(DE3) 的转化子菌落, 在含有氨苄青霉素(50 μg·mL-1)的LB培养基中培养过夜。将培养过夜的菌液以1 : 100(体积比)的比例接种于新的LB培养基中进行培养, 当菌液D600值达到0.5时, 加入IPTG 18 ℃诱导培养20 h以诱导重组大肠杆菌中S层蛋白的表达。8 000 r·min-1离心10 min, 收集菌体, 加入PBS重悬菌体后进行超声破碎, 14 000 r·min-1离心30 min; 收集上清液进行SDS-PAGE电泳验证, 结果表明上清液中有S层蛋白的表达。将收集的上清液过GST柱, SDS-PAGE鉴定得到的蛋白是否为纯化的S层蛋白, 使用Quantity One软件通过灰度值的统计计算S层蛋白的纯度。
1.2.4 小鼠骨髓源树突状细胞的分离培养颈椎脱臼处死4~6周龄的C57BL/6小鼠, 处死后立即浸入75%乙醇中浸泡5 min, 再转入含有2%双抗(青霉素200 U·mL-1, 链霉素0.2 mg·mL-1)的PBS浸泡5 min, 无菌条件下取出小鼠的股骨和胫骨, 用剪刀和镊子将骨头外面的肉剥干净; 用1 mL注射器吸取含有2%双抗的RPMI-1640培养基, 将骨髓冲洗至10 mL无菌离心管中, 收集离心管中的骨髓细胞悬液; 离心弃去上清液, 加入红细胞裂解液, 室温静置1 min后, 立即加入含有2%双抗的RPMI-1640培养基终止裂解反应, 离心后收集经红细胞裂解液作用后的细胞, 用含有2%双抗的RPMI-1640培养基重悬细胞, 离心5 min; 收集细胞, 用RPMI-1640完全培养基重悬后接种于6孔细胞培养板中; 37 ℃、5% CO2培养箱中培养60 h后, 全量换液, 再加入新鲜的RPMI-1640完全培养基继续培养至第6天; 收集悬浮以及半贴壁的细胞, 即为富集的小鼠骨髓来源的树突状细胞。
1.2.5 鸡骨髓源树突状细胞的分离培养15日龄左右的SPF小鸡经处死后立即放入75%的乙醇中浸泡5 min, 再转入含有2%双抗的PBS中浸泡5 min, 无菌条件下取出鸡的股骨和胫骨, 用剪刀和镊子将骨头外面的肉剥干净; 5 mL注射器吸取含有2%双抗的RPMI-1640培养基, 冲洗股骨和胫骨的骨髓至髓腔变白, 收集冲洗液, 1 000 r·min-1离心8 min; 收集沉淀细胞, 用含有2%青/链霉素的RPMI-1640培养基进行重悬得到细胞悬液, 然后按照等体积的比例将细胞悬液慢慢加入已备好的Histopaque-1119玻璃离心管中, 2 500 r·min-1离心30 min; 离心后出现3层, 小心收集中间白色雾状层细胞, 加入含有2%青/链霉素的RPMI-1640培养基进行重悬, 1 000 r·min-1离心8 min; 收集鸡骨髓细胞, 使用RPMI-1640完全培养基[含体积分数为10%的灭活胎牛血清, 100 U·mL-1青霉素, 0.1 mg·mL-1链霉素, 50 ng·mL-1鸡重组集落刺激因子(GM-CSF, 购自Abcam公司)和50 ng·mL-1鸡重组IL-4(购自Kingfisher公司)]重悬得到鸡骨髓细胞; 将细胞接种于Costar 6孔细胞培养板中, 每孔再加入2 mL RPMI-1640完全培养基, 使细胞终浓度为1×106 mL-1; 将得到的细胞置于37 ℃、5% CO2的培养箱中培养, 培养至第2天和第4天, 各半量换液1次; 诱导培养至第6天时, 收集细胞, 进行后续试验。
1.2.6 病毒拮抗试验将培养好的树突状细胞铺到12孔板中, 每孔1×106细胞。H9N2组:每孔加入RPMI-1640培养基200 μL; S+H9N2组:每孔加入400 μg·mL-1 S层蛋白200 μL, 于37 ℃作用1 h, 弃去S层蛋白。两组同时加入106 EID50 H9N2禽流感病毒200 μL(AIV流式试验中使用的病毒已经使用Dylight488标记过)后, 于4 ℃吸附1 h, 弃去上清液, 加入新的维持培养基(含有2%灭活胎牛血清, 100 U·mL-1青霉素, 0.1 mg·mL-1链霉素, 2 ng·mL-1重组GM-CSF), 病毒入侵1 h后, 2 000 r·min-1离心10 min, 收集树突状细胞, 用作提取RNA或进行流式检测。
流式细胞术检测表达S层蛋白对H9N2的拮抗作用:病毒拮抗试验后, 收集树突状细胞, 使用PBS洗涤3次, 最后加入200 μL PBS重悬, 通过细胞流式仪检测Dylight 488-H9N2的平均荧光强度(mean fluorescence intensity, MFI)。
RT-qPCR检测表达S层蛋白对H9N2的拮抗作用:病毒拮抗试验后, 向收集的树突状细胞加入RNAios Plus(TaKaRa)以提取RNA。将得到的RNA用PrimeScript RT Master Mix(TaKaRa)反转录为cDNA。将反转录得到的cDNA作为RT-qPCR的模板, 小鼠的GAPDH作为内参基因, 使用Taq-Man PCR Master Mix(TaKaRa)试剂盒检测H9N2禽流感病毒的血凝素蛋白(HA)、神经氨酸酶(NA)、核蛋白(NP)和基质蛋白1 (PB 1) 基因转录水平。反应体系:cDNA 2μL, 上、下游引物各0.4 μL, RoxⅡ 0.4 μL, SYBR 10 μL, 水6.8 μL。反应条件:95 ℃ 5 s; 95 ℃ 10 s; 60 ℃ 34 s, 40个循环。使用Applied Biosystems 7500系统进行分析。
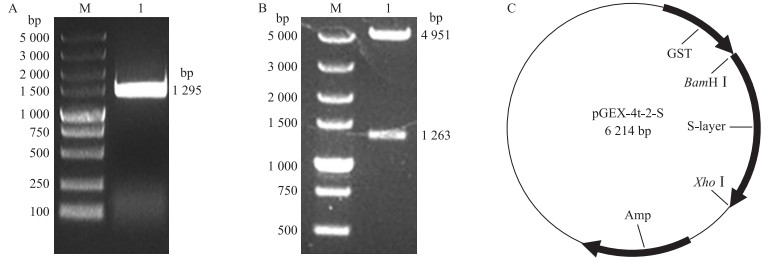
2 结果与分析 2.1 重组质粒的构建电泳结果表明, 使用引物P1、P2成功从嗜酸乳杆菌ATCC4356中扩增得到带有同源臂的S层蛋白基因片段(图 1-A), 大小为1 295 bp。此外, 从JM109转化子中提取质粒pGEX-4t-2-S, 限制性内切酶XhoⅠ和BamHⅠ双酶切消化, 电泳结果显示:从JM109提取的质粒中含有4 951 bp和1 263 bp的2个条带(图 1-B), 与目的基因和载体骨架大小完全符合。同时, 测序结果与嗜酸乳杆菌ATCC4356的S层蛋白基因序列完全一致。结果表明成功构建了质粒pGEX-4t-2-S(图 1-C), 并将其成功转入JM109中。
|
图 1 pGEX-4t-2-S重组质粒的构建和验证 Figure 1 The construction and identification of recombinant plasmid pGEX-4t-2-S A:带有同源臂目的基因的PCR产物电泳图The electrophoresis map of target gene with homologous arm; B:酶切验证图The results of enzyme digestion; C:重组质粒示意图The schematic diagram of recombinant plasmid. M:Maker; 1:目的条带Target bands. |
将重组质粒化学转化E.coli Rosetta-gami2(DE3), 将该重组菌涂布于LB平板12~16 h后, LB平板上可见菌落生成。挑取12个转化子, 使用P3、P4引物进行PCR验证。结果(图 2)显示, 选取的12个菌落均为阳性菌落。

|
图 2 重组大肠杆菌菌落的PCR产物验证图 Figure 2 The identification of recombinant E.coli Rosetta-gami2(DE3) by PCR M:DNA maker; 1~12:重组大肠杆菌菌落PCR产物The PCR results of recombinant E.coli Rosetta-gami2(DE3);13:阴性对照Negative control. |
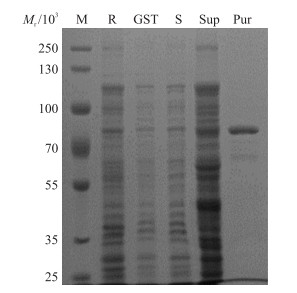
SDS-PAGE结果(图 3)显示:在相对分子质量为70×103处出现1条条带, 大小与预期表达的S层蛋白的大小相符, 且该泳道条带单一, 表明得到蛋白为纯化的S层蛋白。每1011 CFU的重组大肠杆菌S层蛋白产量为11.9 mg; 使用QuantityOne软件对纯化蛋白的泳道进行灰度分析, 结果表明, 纯化的S层蛋白纯度达到95%。
|
图 3 S层蛋白的纯化结果 Figure 3 The result of purified S-layer protein M:Maker; R:E.coli Rosetta-gami2(DE3) 菌体The cell of E.coli Rosetta-gami2(DE3);GST:化学转化入空质粒的DE3菌体DE3 transformated with blank plasmid; S:表达S层蛋白的DE3菌体DE3 expressed S-layer protein; Sup:表达S层蛋白的DE3菌体超声粉碎和离心后的上清液Supernatant of DE3 after ultrasonic fragmentation and centrifugation; Pur:亲和层析纯化后的S层蛋白S-layer protein obtained by affinity chromatography. |
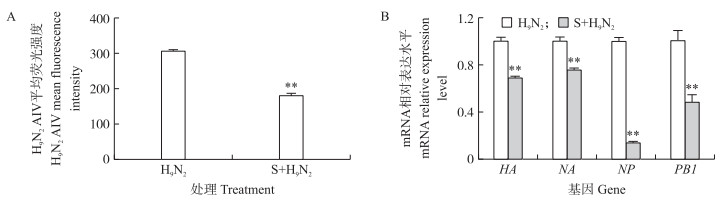
流式细胞术检测结果显示:S层蛋白提前处理组的小鼠树突状细胞中, AIV的平均荧光强度(MFI)极显著低于单独病毒组(图 4-A)。该结果表明, 从E.coli Rosetta-gami2(DE3) 中提取的重组S层蛋白提前作用于小鼠树突状细胞, 能够有效地拮抗H9N2 AIV对小鼠树突状细胞的侵袭。此外, RT-qPCR结果显示, 如果S层蛋白提前作用于小鼠树突状细胞, 那么血凝素蛋白基因(HA)、神经氨酸酶基因(NA)、核蛋白基因(NP)和基质蛋白1基因(PB 1) 的转录水平极显著低于相同处理时间的单独病毒组(图 4-B)。此结论与流式细胞检测结果相同, 因此推断:S层蛋白能够拮抗H9N2 AIV对小鼠树突状细胞的侵袭。
|
图 4 S层蛋白拮抗H9N2 AIV侵袭小鼠树突状细胞 Figure 4 S-layer protein inhibits H9N2 AIV infecting dendritic cells of mouse A:流式细胞术检测结果The results of cell flow cytometry; B:RT-qPCR检测4个基因表达The expression of four genes detected by RT-qPCR. HA:血凝素蛋白基因Hemagglutinin gene; NA:神经氨酸酶基因Neuraminidase gene; NP:核蛋白基因Nucleoprotein gene; PB 1 :基质蛋白1基因Matrix protein 1 gene. * * P<0.01. The same as follows. |
流式细胞检测结果显示:S层蛋白提前处理组的鸡树突状细胞中, AIV的平均荧光强度(MFI)极显著低于单独病毒组(图 5-A)。该结果表明, 重组E.coli Rosetta-gami2(DE3) 中提取的S层蛋白提前作用于鸡树突状细胞, 能够有效地拮抗H9N2禽流感病毒对鸡树突状细胞的侵袭。此外, RT-qPCR结果显示:如果S层蛋白提前作用于鸡树突状细胞, 那么HA和NA基因的转录水平极显著低于相同处理时间的单独病毒组(图 5-B)。此结论与流式细胞检测结果相同, 因此推断:S层蛋白也能够拮抗H9N2 AIV对鸡树突状细胞的侵袭。

|
图 5 S层蛋白拮抗H9N2 AIV侵袭鸡树突状细胞 Figure 5 S-layer protein inhibits H9N2infecting dendritic cells of chicken A:流式细胞术检测结果The results of cell flow cytometry; B:RT-qPCR检测2个基因表达The expression of two genes detected by RT-qPCR. |
目前, 菌体中S层蛋白的提取多涉及到变性剂的应用, 如使用盐酸胍、氯化锂、尿素、金属螯合剂及阳离子置换剂等将蛋白变性得到粗提蛋白, 再通过离子交换柱等方法进行蛋白纯化[21-22]。粗提蛋白样品的纯度较低, 杂蛋白多, 而进一步纯化的步骤往往比较繁琐, 并且只是在蛋白水平的纯化, 想要获得更纯、更利于试验的S层蛋白就需要从基因水平考虑。因此本研究从嗜酸乳杆菌ATCC4356中扩增出了S层蛋白的基因片段, 并构建能够表达S层蛋白的质粒pGEX-4t-2-S, 通过亲和层析得到纯化的S层蛋白, 物质纯度为95%、产率为每1011 CFU大肠杆菌11.9 mg, 这为后续试验的准确性和可靠性提供了保障。
H9N2亚型禽流感病毒作为一种低致病性流感病毒, 即使在长期接种疫苗的情况下, 依然会通过粪便进行病毒的传播, 威胁着养禽业的健康发展。而且, 最近研究发现, H9N2也可以感染人[23]。因此, 找到及时有效的H9N2防治措施显得尤为重要。树突状细胞在天然免疫系统和获得性免疫系统之间起到信使的作用, 而位于黏膜固有层中的树突状细胞对流感病的应答反应对于流感病毒的预防和清除起着至关重要作用。拮抗病毒对黏膜固有层处树突状细胞的侵袭, 能够在黏膜处阻断禽流感病毒对机体的侵袭, 这对于H9N2禽流感病毒的防控具有重要意义。
乳酸菌的S层蛋白具有维持细胞形态结构, 黏附或表面识别位点等功能[2, 24-25]。现已明确了某些乳酸菌对胃肠道黏膜的黏附作用及其对肠道致病菌黏附的抑制作用[21, 26]。本试验中, 我们构建了pGEX-4t-2-S这个能够表达S层蛋白的质粒, 提纯S层蛋白提前作用于小鼠和鸡树突状细胞能够有效拮抗H9N2禽流感病毒对细胞的侵袭, 表明重组的S层蛋白具有良好的抗病毒生物活性。
有研究表明, 乳酸杆菌的S层蛋白可以结合DC-SIGN受体, 调节树突状细胞的成熟和分化[19]。禽流感病毒同样可以通过与DC-SIGN的结合促进病毒在人源树突状细胞内的复制[27], 因此, 我们推断S层蛋白能够拮抗H9N2禽流感病毒侵袭树突状细胞可能是通过DC-SIGN受体这条通路。在后续试验中, 可通过免疫共沉淀技术和免疫荧光技术进一步探索S层蛋白与DC-SIGN是否通过蛋白互作拮抗禽流感病毒侵袭树突状细胞的具体机制。
本试验中, 我们成功构建了表达S层蛋白的载体, 并通过亲和层析成功提取到S层蛋白, 使用流式和实时荧光定量PCR证明了S层蛋白对于H9N2禽流感病毒的拮抗作用。S层蛋白具有成为一种新型生物抗病毒材料的潜力, 同时也为禽流感病毒的防治提供了新思路。
| [1] | Ueda M, Daidoji T, Du A, et al. Highly pathogenic H5N1 avian influenza virus induces extracellular Ca2+ influx, leading to apoptosis in avian cells[J]. Journal of Virology, 2010, 84(6): 3068–3078. DOI: 10.1128/JVI.01923-09 |
| [2] |
黄欣梅, 李银, 赵冬敏, 等. 11株H9N2亚型禽流感病毒神经氨酸酶基因遗传分析[J].
南京农业大学学报, 2016, 39(1): 150–155.
Huang X M, Li Y, Zhao D M, et al. The analysis of neuraminidase gene of 11 strains H9N2 avian influenza virus[J]. Journal of Nanjing Agricultural University, 2016, 39(1): 150–155. DOI: 10.7685/jnau.201503052 (in Chinese with English abstract) |
| [3] | Webster R G. Influenza virus:transmission between species and relevance to emergence of the next human pandemic[J]. Archives of Virology Supplementum, 1997, 13: 105–113. |
| [4] | Gao R, Cao B, Hu Y, et al. Human infection with a novel avian-origin influenza A(H7N9)virus[J]. The New England Journal of Medicine, 2013, 368(20): 1888–1897. DOI: 10.1056/NEJMoa1304459 |
| [5] | Howard C J, Charleston B, Stephens S A, et al. The role of dendritic cells in shaping the immune response[C]//Conference of Research Workers in Animal Diseases, 2004, 5(2):191-195. |
| [6] | Sara M, Sleytr U B. S-layer proteins[J]. Journal of Bacteriology, 2000, 182(4): 859–868. DOI: 10.1128/JB.182.4.859-868.2000 |
| [7] | Sleytr U B, Messner P, Pum D, et al. Crystalline bacterial cell surface layers(S layers):from supramolecular cell structure to biomimetics and nanotechnology[J]. Angewandte Chemie, 1999, 38(8): 1034–1054. DOI: 10.1002/(SICI)1521-3773(19990419)38:8<1034::AID-ANIE1034>3.0.CO;2-# |
| [8] | Sleytr U B, Messner P, Pum D, et al. Crystalline bacterial cell surface layers[J]. Molecular Microbiology, 1993, 10(5): 911–916. DOI: 10.1111/mmi.1993.10.issue-5 |
| [9] | Corthesy B, Gaskins H R, Mercenier A. Cross-talk between probiotic bacteria and the host immune system[J]. The Journal of Nutrition, 2007, 137(Suppl 2): 781–790. |
| [10] | Lanning D K, Rhee K J, Knight K L. Intestinal bacteria and development of the B-lymphocyte repertoire[J]. Trends in Immunology, 2005, 26(8): 419–425. DOI: 10.1016/j.it.2005.06.001 |
| [11] | Kleerebezem M, Hols P, Bernard E, et al. The extracellular biology of the lactobacilli[J]. FEMS Microbiology Reviews, 2010, 34(2): 199–230. DOI: 10.1111/j.1574-6976.2009.00208.x |
| [12] | Boot H J, Kolen C P, van Noort J M, et al. S-layer protein of Lactobacillus acidophilus ATCC4356:purification, expression in Escherichia coli, and nucleotide sequence of the corresponding gene[J]. Journal of Bacteriology, 1993, 175(19): 6089–6096. DOI: 10.1128/jb.175.19.6089-6096.1993 |
| [13] | Jakava-Viljanen M, Palva A. Isolation of surface(S)layer protein carrying Lactobacillus species from porcine intestine and faeces and characterization of their adhesion properties to different host tissues[J]. Veterinary Microbiology, 2007, 124(3/4): 264–273. |
| [14] | Gatti M, Rossetti L, Fornasari M E, et al. Heterogeneity of putative surface layer proteins in Lactobacillus helveticus[J]. Applied and Environmental Microbiology, 2005, 71(11): 7582–7588. DOI: 10.1128/AEM.71.11.7582-7588.2005 |
| [15] | Hagen K E, Guan L L, Tannock G W, et al. Detection, characterization, and in vitro and in vivo expression of genes encoding S-proteins in Lactobacillus gallinarum strains isolated from chicken crops[J]. Applied and Environmental Microbiology, 2005, 71(11): 6633–6643. DOI: 10.1128/AEM.71.11.6633-6643.2005 |
| [16] | Wang B, Wei H, Yuan J, et al. Identification of a surface protein from Lactobacillus reuteri JCM1081 that adheres to porcine gastric mucin and human enterocyte-like HT-29 cells[J]. Current Microbiology, 2008, 57(1): 33–38. DOI: 10.1007/s00284-008-9148-2 |
| [17] | Li P, Yu Q, Ye X, et al. Lactobacillus S-layer protein inhibition of Salmonella-induced reorganization of the cytoskeleton and activation of MAPK signalling pathways in Caco-2 cells[J]. Microbiology, 2011, 157: 2639–2646. DOI: 10.1099/mic.0.049148-0 |
| [18] | Martinez M G, Prado Acosta M, Candurra N A, et al. S-layer proteins of Lactobacillus acidophilus inhibits JUNV infection[J]. Biochemical and Biophysical Research Communications, 2012, 422(4): 590–595. DOI: 10.1016/j.bbrc.2012.05.031 |
| [19] | Konstantinov S R, Smidt H, de Vos W M, et al. S layer protein A of Lactobacillus acidophilus NCFM regulates immature dendritic cell and T cell functions[J]. Proc Natl Acad Sci USA, 2008, 105(49): 19474–19479. DOI: 10.1073/pnas.0810305105 |
| [20] | Short K R, Brooks A G, Reading P C, et al. The fate of influenza A virus after infection of human macrophages and dendritic cells[J]. The Journal of General Virology, 2012, 93: 2315–2325. DOI: 10.1099/vir.0.045021-0 |
| [21] | Ashida N, Yanagihara S, Shinoda T, et al. Characterization of adhesive molecule with affinity to Caco-2 cells in Lactobacillus acidophilus by proteome analysis[J]. Journal of Bioscience and Bioengineering, 2011, 112(4): 333–337. DOI: 10.1016/j.jbiosc.2011.06.001 |
| [22] | Johnson-Henry K C, Hagen K E, Gordonpour M, et al. Surface-layer protein extracts from Lactobacillus helveticus inhibit enterohaemorrhagic Escherichia coli O157:H7 adhesion to epithelial cells[J]. Cellular Microbiology, 2007, 9(2): 356–367. DOI: 10.1111/cmi.2007.9.issue-2 |
| [23] | Huang Y, Li X, Zhang H, et al. Human infection with an avian influenza A(H9N2)virus in the middle region of China[J]. Journal of Medical Virology, 2015, 87(10): 1641–1648. DOI: 10.1002/jmv.24231 |
| [24] | Sleytr U B, Beveridge T J. Bacterial S-layers[J]. Trends in Microbiology, 1999, 7(6): 253–260. DOI: 10.1016/S0966-842X(99)01513-9 |
| [25] | Sara M. Conserved anchoring mechanisms between crystalline cell surface S-layer proteins and secondary cell wall polymers in Gram-positive bacteria?[J]. Trends in Microbiology, 2001, 9(2): 47–50. DOI: 10.1016/S0966-842X(00)01905-3 |
| [26] | Lebeer S, Claes I, Tytgat H L, et al. Functional analysis of Lactobacillus rhamnosus GG pili in relation to adhesion and immunomodulatory interactions with intestinal epithelial cells[J]. Applied and Environmental Microbiology, 2012, 78(1): 185–193. DOI: 10.1128/AEM.06192-11 |
| [27] | Londrigan S L, Tate M D, Brooks A G, et al. Cell-surface receptors on macrophages and dendritic cells for attachment and entry of influenza virus[J]. Journal of Leukocyte Biology, 2012, 92(1): 97–106. DOI: 10.1189/jlb.1011492 |




