文章信息
- 冯哲叶, 陈莎莎, 王文超, 杨华, 邓照亮, 李真, 王世梅, 徐阳春
- FENG Zheye, CHEN Shasha, WANG Wenchao, YANG Hua, DENG Zhaoliang, LI Zhen, WANG Shimei, XU Yangchun
- 几株溶磷细菌的筛选和鉴定及其溶磷效果
- Screening and identification of several phosphate-solubilizing bacteria and effect of their P-solubility
- 南京农业大学学报, 2017, 40(5): 842-849
- Journal of Nanjing Agricultural University, 2017, 40(5): 842-849.
- http://dx.doi.org/10.7685/jnau.201612008
-
文章历史
- 收稿日期: 2016-12-05
磷是植物生长及作物高产的限制因子。我国有74%的耕地土壤缺磷, 土壤中95%以上的磷素与土壤中Ca2+、Fe3+、Al3+等金属离子结合而丧失植物有效性, 施入土壤的可溶性磷肥也因为土壤的固定作用, 当季利用率只有5%~10%, 加上作物的后效, 利用率不超过25%[1]。农业生产需要持续不断的磷投入, 而现有磷储量有限, Gilbert[2]认为磷为一种正在消失的元素, 因此活化土壤中大量的难溶性磷是解决我国磷素危机的重要途径。土壤中含有大量的溶磷微生物, 其溶磷机制是通过产生有机酸降低局部环境pH值, 溶解或螯合难溶性矿物磷, 从而促进土壤难溶性磷素的活化[3]。充分利用微生物活化土壤磷素, 对提高植物磷素吸收效率和减少化学磷肥投入具有重要意义。
目前已有大量关于溶磷微生物活化土壤磷素的报道, 研究人员从环境中分离筛选出一系列溶磷微生物, 如溶磷细菌(Bacillus、Pseudomonas、Azorobacre、Chromobacrerium、Thiobacillus、Rhizobium、Micrococcus、Arthrobacter、Alcaligenes等)、溶磷放线菌(Streptomyces)、溶磷真菌(Penicillium、Rhizopus、Aspergillus、Meyerozyma)等[4-6]。然而, 在实验室分离获得的高效溶磷菌株, 经过多次传代后, 溶磷效率下降, 特别是盆栽或田间试验效果不稳定[7]。不同生态环境筛选出的溶磷菌株生物学特性不同, 因此, 普适性的溶磷菌株较难获得, 且单一菌株亦难以在土壤环境中形成“气候”。本文旨在筛选一些功能多样兼具植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)性能的溶磷菌株, 比较其生物学特征, 并对菌株进行组合, 考察其对植物生长的促进作用, 研究结果为溶磷微生物的开发利用提供理论支持。
1 材料与方法 1.1 供试土样及培养基 1.1.1 土样采集用于分离、筛选溶磷菌的供试土样, 采自南京傅家边农业科技园大豆田和安徽凤阳的玉米田(石灰性土壤), 采样时间为2015年3月和6月。
1.1.2 培养基蒙金娜液体培养基(Pikovskaya′s medium)[8]:葡萄糖10.0 g, FeSO4 · 7H2O 0.03 g, MgSO4 · 7H2O 0.3 g, NaCl 0.3 g, KCl 0.3 g, (NH4)2SO40.5 g, MnSO4 · 7H2O 0.03 g, Ca3(PO4)25.0 g, H2O 1 000 mL, pH值7.20~7.40。
刚果红液体培养基:甘露醇10.0 g, K2HPO4 · 3H2O 0.5 g, MgSO4 · 7H2O 0.2 g, NaCl 0.1 g, 酵母膏1.0 g, NH4NO31.0 g, L-色氨酸0.1 g, 2.5 g · L-1刚果红溶液10.0 mL, H2O 1 000 mL, pH7.0。
铁载体检测培养基(CAS):铬天青S 0.060 5 g, 十六烷基三甲基溴化铵(HDTMA)0.072 9 g, 1 mmol · L-1 FeCl310.0 mL, 0.1 mol · L-1磷酸盐缓冲液50.0 mL, 水940 mL, 琼脂9 g · L-1。
1.2 溶磷菌的筛选及纯化称取10 g土样溶于90 mL无菌水中, 室温振荡20 min, 静置5 min, 然后取土壤悬液系列稀释, 再选择合适稀释度的悬液, 各取0.1 mL涂布于蒙金娜培养基平板上, 平板倒置于28 ℃培养箱培养3~5 d。选取有溶磷圈且形态不同的菌落, 进一步划线纯化, 获得单菌落, 转接LB斜面培养, 4 ℃保存备用。
1.3 溶磷菌的鉴定 1.3.1 溶磷菌的菌落形态及菌体形态观察将筛选出的具有溶磷能力的菌株划线于蒙金娜固体培养基上, 置于28 ℃恒温培养箱中培养5 d, 测量其溶磷圈直径(D)和菌落直径(d), 根据比值(D/d)大小初步判断各菌株解磷能力的强弱, 即采用溶磷圈法[9]判断。将各菌株培养6~12 h进行Gram染色, 油镜下观察菌体形态特征[10]。
1.3.2 生理生化试验生理生化试验包括淀粉水解、甲基红(M.R.)试验、V-P反应、脲酶测定、明胶液化等, 测定方法参照文献[11]进行。
1.3.3 菌株的16S rRNA序列分析菌株DNA提取及16S rRNA的PCR扩增方法参照文献[12], PCR产物送南京市金陵生物医疗科技产业园测序。测序所得16S rRNA序列通过EzTaxon在线比对(http://www.ezbiocloud.net )进行相关有效种相似性搜索, 并将相似率较高菌株的16S rRNA基因序列用BioEdit软件进行序列比对分析, 随后用MEGA 6.0软件构建系统发育树。
1.4 溶磷菌株的生物学特性1.4.1菌株溶磷能力的测定
在250 mL的三角瓶中加入100 mL无机磷液体培养基, 并分别以0.5 g Ca3(PO4)2及氟磷灰石(100目)为磷源, 121 ℃灭菌20 min, 备用。将培养至对数期的溶磷菌按1%(体积分数)的接种量分别接入到液体培养基中, 以不接菌的处理作为空白对照, 每个处理3个重复; 置于30 ℃、170 r · min-1摇床培养6 d。每天定时取样5 mL, 将菌液以4 ℃、5 000 r · min-1离心10 min, 采用钼锑抗比色法测定上清液中的水溶性磷(PO43-)含量[13], 并测定上清液pH值的变化。
1.4.2 菌株分泌有机酸的种类及含量测定将活化的溶磷菌按1%(体积分数)的接种量分别接入到以Ca3(PO4)2为唯一磷源的液体培养基中, 振荡培养6 d后, 离心取样, 检测培养液中有机酸种类和含量的变化[14]。用HPLC(美国岛津Waters475, 紫外检测器Waters487) 测定有机酸种类及含量。色谱条件:分析柱C18, 4.6 mm×250 mm; 检测波长214 nm; 流动相为0.04 mol · L-1KH2PO4缓冲液(pH2.75) 和甲醇, 其体积比为99.6 : 0.4, 流速0.4 mL · min-1; 柱温为25 ℃。有机酸标准样品:草酸、酒石酸、苹果酸、丙二酸、乳酸、乙酸、柠檬酸、丁二酸等。
1.4.3 菌株产吲哚乙酸(IAA)及铁载体(siderophore)的定性检测将待测菌株接种于50 mL刚果红液体培养基中, 28 ℃、125 r · min-1振荡培养2~5 d后取样, 5 000 r · min-1离心10 min, 取上清液。在白色比色板上分别加入100 μL IAA比色液(0.5 mol · L-1 FeCl31.0 mL、浓硫酸30.0 mL、水50.0 mL)和100 μL菌悬液, 静置15 min后观察。显红色为阳性, 表明菌株分泌IAA, 且颜色越深表明分泌IAA能力越强。将待测菌株点种于CAS平板上, 28 ℃培养5 d。若菌落周围出现橘黄色透明晕圈, 表明有铁载体产生。
1.5 溶磷菌株对大豆促生效果试验选择溶磷效果较好的菌株san8、DLT4, 考察其对盆栽试验大豆的促生效果, 并以本实验室前期分离的溶磷效果较好的黑曲霉NJAU-12[15]为对照。盆栽试验处理有不接种对照(CK)、san8、DLT4、san8+DLT4、NJAU-12和san8+DLT4+NJAU-12。供试大豆品种为‘中黄13’。每盆装石灰性土壤4.5 kg, 种植大豆3株, 溶磷菌接种量为每盆50 mL菌悬液(106 CFU · mL-1), 每个处理10个重复。大豆生长45 d后收获, 测量植株干质量和全磷量, 以及土壤速效磷含量, 测定方法参照文献[16], 并计数根瘤数量。盆栽用石灰性土壤有机质含量12.9 mg · g-1, 速效磷3.4 mg · g-1, pH7.8。
2 结果与分析 2.1 溶磷菌株的形态特征及生理生化特性在蒙金娜平板上初次筛选得到20株溶磷细菌, 通过复筛及进一步纯化, 部分菌株降低或失去了溶磷能力, 最终获得7株溶磷能力较高且性能稳定的菌株, 分别命名为san5、san6、san8、DLT2、DLT3、DLT4、DK6。部分菌株在蒙金娜平板上的形态特征见图 1和表 1, 理化特性见表 2。
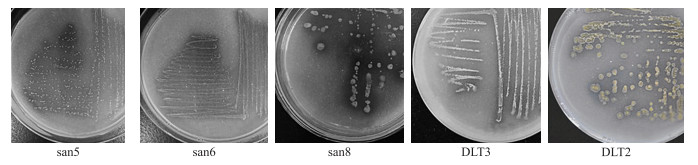
|
图 1 溶磷菌株在蒙金娜培养基平板上的菌落形态及溶磷圈 Figure 1 Dissolved phosphorus zone and colony morphology of strains on Pikovskaya′s media |
| 菌株编号 Strain number |
菌落颜色 Colour of strain |
荚膜 Capsule |
菌落直径/cm Colony diameter |
菌体形态 Morphology of strain |
革兰氏染色 Gram stain |
芽孢 Spore |
来源 Source |
| san5 | 淡黄 Light yellow | + | 0.28±0.11 | 短棒状 Short rod | G- | - | 大豆根际 Soybean rhizosphere |
| san6 | 淡黄 Light yellow | + | 0.31±0.07 | 杆状 Rod | G- | - | 大豆根际 Soybean rhizosphere |
| san8 | 乳白 White | ++ | 0.20±0.04 | 杆状 Rod | G- | - | 大豆根际 Soybean rhizosphere |
| DLT2 | 黄色 Yellow | ++ | 0.86±0.15 | 杆状 Rod | G- | - | 玉米根际 Maize rhizosphere |
| DLT3 | 乳白 White | + | 0.30±0.09 | 短棒状 Short rod | G- | - | 玉米根际 Maize rhizosphere |
| DLT4 | 乳白 White | + | 0.14±0.02 | 短棒状 Short rod | G- | - | 玉米根际 Maize rhizosphere |
| DK6 | 乳白 White | + | 0.45±0.14 | 杆状 Rod | G- | - | 草莓根际 Strawberry rhizosphere |
| 注:“+”:产荚膜Produce capsule; “++”:产丰富荚膜Produce abundant capsule; “-”:不产芽孢No produce spore. | |||||||
| 菌株编号 Strain number |
淀粉水解 Amylolysis |
V-P反应 Voges-prokauer reaction |
甲基红试验 Methyl red test |
明胶液化 Gelatin liquefaction |
脲酶 Urease |
| san5 | + | - | + | - | + |
| san6 | - | - | + | + | + |
| san8 | + | - | - | - | + |
| DLT2 | + | + | - | + | + |
| DLT3 | - | - | + | - | + |
| DLT4 | - | - | + | - | + |
| DK6 | + | + | + | + | + |
| 注:“+”表示阳性反应“+”indicates positive reaction; “-”表示阴性反应“-”indicates negative reaction. | |||||
分别提取7株溶磷细菌的DNA, 进行16S rRNA扩增。其序列在GenBank中进行序列比对分析发现:san5与Enterobacter ludwigii(KC355304)16S rRNA的同源性为99.52%, san6与Pantoea rodasii(KF425003) 的同源性为98.34%, san8与Enterobacter ludwigii(KC355304) 的同源性为98.59%, DLT2与Pantoea ananatis(KX118708) 的同源性为97.37%, DLT3与Acinetobacter soli(GU113083) 的同源性为99.25%, DLT4与Acinetobacter calcoaceticus(FJ976563) 的同源性为99.18%, DK6与Enterobacter asburiae(KJ830708) 的同源性为98.49%。根据菌株的形态特征、理化特性并结合16S rRNA序列分析, 分别将7株溶磷细菌初步鉴定为Enterobacter sp. san5、Pantoea sp. san6、Enterobacter sp. san8、Pantoea sp. DLT2、Acinetobacter sp. DLT3、Acinetobacter sp. DLT4和Enterobacter sp. DK6。
2.3 溶磷菌株对Ca3(PO4)2的溶解能力从图 2可知:7株菌株在溶液中培养3~4 d, 水溶性磷含量即达到平衡。随着时间的延长, 培养液中的营养逐渐被消耗。一定时间后, 菌液中的磷含量不再增加。菌株san5、san6、san8、DLT3、DLT4的培养液中水溶性磷含量显著高于菌株DLT2和DK6的。
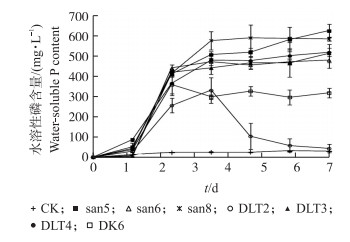
|
图 2 不同菌株对Ca3(PO4)2的溶解能力 Figure 2 The capacity of dissolving Ca3(PO4)2 of the various strains |
培养液中pH值的下降幅度反映出各菌株产生的有机酸含量不同(图 3)。菌株DLT2培养液的pH值下降幅度明显低于其他菌株, 此结果与图 2中的DLT2溶磷效率较低相对应。通过7株细菌溶解Ca3(PO4)2能力的比较, 选择溶磷效果较好的菌株san8和DLT4进行溶解氟磷灰石的试验。
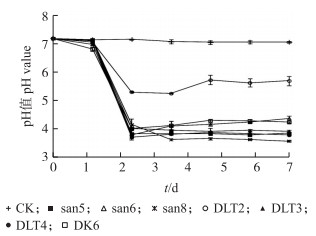
|
图 3 在溶磷培养液中接种不同菌株其pH值变化 Figure 3 The change of pH value with the various strains in the media |
从图 4可知:在以氟磷灰石为唯一磷源的液体培养基中, 菌株san8、DLT4的溶磷量随着培养时间的延长逐渐增加。菌株san8培养5 d后溶液中水溶性磷含量基本达到平衡, 其含量约102.13 mg · L-1。随着培养时间的延长, 菌株DLT4溶液中水溶性磷含量也在不断增加, 但增速缓慢。培养10 d时, 水溶性磷含量仅为52.26 mg · L-1, 其溶磷效果远低于菌株san8。菌株在培养前期pH值降幅较大, 培养3~4 d后pH值趋于稳定。如菌株san8、DLT4培养液的起始pH值为7.2, san8培养2 d的pH值最低, 降至3.45, DLT4培养8 d的pH值最低, 降至3.83。

|
图 4 不同菌株溶解氟磷灰石的能力 Figure 4 The capacity of dissolving fluorapatite of the various strains SP:水溶性磷Water-soluble phosphate. |
由表 3可见:各菌株分泌的有机酸种类和数量差异较大, 菌株san6、san8和DLT2可分泌草酸和苹果酸, DLT3和DLT4能够分泌丙二酸但不分泌苹果酸, DK6分泌乙酸和柠檬酸, 菌株san5和san8可分泌乳酸。各菌株分泌有机酸总量差异显著, 菌株san8培养液总有机酸含量最高, 为4 153.21 mg · L-1, 菌株DLT2的总有机酸含量最低, 仅为465.52 mg · L-1。
| 菌株 Strain |
有机酸含量/(mg·L-1) Organic acids content | 水溶性磷含量/(mg·L-1) Available phosphatecontent |
||||||||
| 草酸 Oxalic acid |
酒石酸 Tartaric acid |
苹果酸 Malic acid |
丙二酸 Propanedioic acid |
乳酸 Lactic acid |
乙酸 Acetic acid |
柠檬酸 Citric acid |
丁二酸 Succinic acid |
总有机酸 Total organic acid |
||
| san5 | 589.77 | — | — | — | 532.60 | 1 067.34 | — | — | 2 189.71b | 623.64a |
| san6 | 327.11 | — | 149.26 | 101.40 | — | — | — | — | 577.77f | 479.71d |
| san8 | 1 168.42 | — | 652.67 | — | 1 438.12 | 894.00 | — | — | 4 153.21a | 589.69b |
| DLT2 | 9.43 | — | 38.30 | — | — | — | — | 417.79 | 465.52g | 329.73f |
| DLT3 | 573.98 | — | — | 294.13 | — | — | — | — | 868.11d | 512.76c |
| DLT4 | 647.50 | — | — | 115.70 | — | — | — | — | 763.20e | 517.93c |
| DK6 | — | 6.22 | — | — | — | 357.99 | 1 457.73 | — | 1 821.94c | 357.84e |
| 注: 1) 不同字母表示不同处理间在0.05水平差异显著。Different letters indicate significant difference between the different treatments at 0.05 level. The same as follows. 2)“—”表示培养液中不含该有机酸。“— ”indicates that the organic acid is not contained in the culture medium. |
||||||||||
总有机酸含量较高的菌株san5和san8其水溶性磷含量达600 mg · L-1左右, 远高于其他菌株。总有机酸含量最低的菌株DLT2, 其溶液中水溶性磷含量也是最低, 说明培养液水溶性磷含量与总有机酸含量有一定的相关性, 但也并非总有机酸含量越高, 溶磷效果愈好。如菌株san8分泌的总有机酸含量高于菌株san5, 但水溶性磷含量却低于菌株san5, 说明不同种类的有机酸溶磷效率不同。
2.6 溶磷菌株分泌吲哚乙酸(IAA)及铁载体能力将溶磷菌株接种于刚果红液体培养基中振荡培养5 d, 离心后的上清液同IAA比色液充分混匀, 室温下显色15 min发现, 菌株san6产IAA能力最强, san8和DK6产IAA能力较弱, 菌株DLT3和DLT4不产IAA(表 4)。
| 项目 Items | san5 | san6 | san8 | DLT2 | DLT3 | DLT4 | DK6 |
| 吲哚乙酸 IAA | ++ | +++ | + | ++ | - | - | + |
| 铁载体 Siderophore | - | + | - | - | + | + | - |
| 注: +:产IAA和铁载体能力低 The IAA and the siderophore producing ability is low; ++:产IAA能力较高 The IAA producing ability is higher; +++:产IAA能力最高 The IAA producing ability is the highest; -:阴性反应 Negative reaction. | |||||||
在蓝色鉴别平板(CAS)上, san6、DLT3和DLT4的菌落周围出现了透明晕圈, 说明菌株产生铁载体, 而没有透明晕圈的菌株表明不产铁载体(表 4、图 5)。
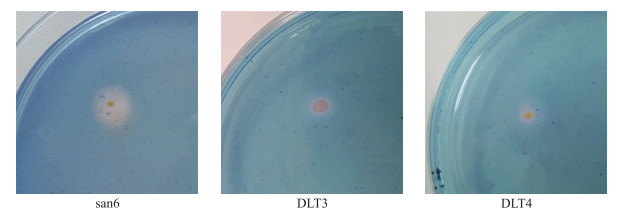
|
图 5 溶磷菌株san6、DLT3、DLT4产生铁载体的定性检测 Figure 5 Detection of siderophore from strain san6, DLT3, DLT4 |
分别接种不同特征的单一溶磷菌san8、DLT4、NJAU-12以及3株菌的复合接种研究其对大豆生长及土壤速效磷含量变化的影响(表 5)。从表 5可见:无论大豆生物量、根瘤数、植株全磷及土壤速效磷含量, 接种溶磷菌的处理均高于对照(除san8处理外), 其中复合菌接种处理的效果均高于单一菌接种处理。san8+DLT4+NJAU-12复合菌处理的植株干质量、土壤速效磷含量比CK分别增加24.62%和28.29%, 复合菌处理的植株全磷含量和根瘤数分别是CK的3.8和4.6倍。菌株NJAU-12处理的根瘤数虽略高于复合菌处理, 但两者没有显著差异。
| 处理 Treatment |
植株干质量/g Dry weight of plant |
根瘤数 Root nodules |
植株全磷含量/mg Total P content per pot |
土壤速效磷含量/(mg·kg-1) Soil available P content |
| 对照CK | 1.95±0.31c | 1.27±1.33c | 0.10±0.01c | 10.04±0.62bc |
| san8 | 2.07±0.32bc | 6.73±3.94a | 0.16±0.06bc | 9.38±0.30c |
| DLT4 | 2.39±0.39a | 2.93±1.49bc | 0.31±0.14a | 12.01±1.28ab |
| san8+DLT4 | 2.39±0.35a | 3.53±2.56b | 0.30±0.09abc | 11.70±1.74ab |
| NJAU-12 | 2.27±0.23ab | 6.93±2.74a | 0.23±0.09abc | 11.80±1.00ab |
| san8+DLT4+NJAU-12 | 2.43±0.28a | 5.80±2.83a | 0.38±0.12ab | 12.88±2.25a |
磷元素作为土壤中吸收效率最低的营养元素之一, 研究其释放机制以及发掘提高释放效率的途径是土壤研究的重要方向。土壤微生物在磷的地球化学循环中起着重要作用, 特别是溶磷微生物[17]。本研究采用常用的磷酸钙和氟磷灰石进行研究。磷酸钙是石灰性土壤磷的主要存在形式, 而氟磷灰石是自然界最广泛存在的矿石磷源。自然界超过90%的磷储藏在磷灰石中, 而磷灰石中95%以上是氟磷灰石[18], 因此采用氟磷灰石作研究材料可以解释自然界最为普遍的磷元素释放过程。通过溶磷细菌对二者的溶解区别可以解析土壤中溶磷菌对磷素生物地球化学循环的作用机制。本文从土壤中分离获得了7株溶磷效果较好的细菌菌株san5、san6、san8、DLT2、DLT3、DLT4、DK6。在平板筛选时, 虽然部分菌株溶磷圈较明显, 如菌株DLT2, 但其在液体培养条件下的溶磷效果较差。Nautiyal[19]在研究中也发现类似的现象, 认为溶磷圈的大小不能作为判定溶磷微生物溶磷能力大小的依据。
对于磷灰石而言, 其磷元素释放最大的制约因素是溶解度。中性条件下其释放效率仅为1 mg · L-1左右。但是在酸性条件下, 磷灰石的溶解度会急剧增加。如在pH2.0时, 磷的溶解度可增加到300 mg · L-1以上。溶磷菌主要的溶磷机制是通过释放小分子有机酸, 包括草酸、乙酸、柠檬酸、苹果酸、酒石酸、乳酸。前期对于溶磷真菌的研究表明:草酸是分泌最多的有机酸, 其电离常数也高于其他有机酸, 因此草酸是溶磷真菌产生的最重要溶磷有机酸[15]。然而, 对溶磷细菌的相关研究还不明确。
本试验中, 各溶磷细菌菌株在液体中培养3~4 d, 水溶性磷(PO43-)含量即达到平衡。其原因可能是:随着培养时间的延长, 培养液里的碳、氮等营养逐渐被消耗, 一定时间后菌体生长达到稳定期, 水溶性磷不再增加。各菌株溶磷过程中培养液pH值下降幅度反映出菌株分泌有机酸含量的不同。本研究发现各菌株分泌的有机酸种类和数量差异较大。培养液中水溶性磷含量与总有机酸含量有一定的相关性, 但也并非有机酸含量越高, 溶磷效果越好。这说明不同种类的有机酸溶磷效率不同。王光华等[20]在研究不同种类低分子质量的有机酸对磷矿粉的释磷效应时也发现, 低浓度有机酸条件下(1.3~5.0 mmol · L-1), 柠檬酸和草酸对磷矿粉的释磷效果较好, 而当有机酸浓度大于5.0 mmol · L-1时, 酒石酸和草酸的释磷量较大。石灰性土壤中微生物溶磷的机制是依靠其代谢过程中分泌有机酸降低局部土壤的pH值, 使土壤中难溶态的磷酸钙在酸性条件下溶解, 同时分泌的有机酸能与钙、镁等金属离子螯合或络合, 将与之结合的磷酸根释放出来, 达到解磷的目的[21]。在土壤生态环境中微生物所分泌有机酸的浓度很低, 因此在研究微生物溶磷的过程中, 应筛选分泌柠檬酸和草酸含量较多的菌株, 以提高溶磷效率。
大豆是我国最重要的油料作物, 也是需磷量较大的农作物之一, 其籽粒磷含量远远高于水稻、小麦和玉米[22]。大豆对磷素的吸收在不同生育时期也有所不同, 其中幼苗到开花期是对磷素需求最为敏感的阶段。磷能促进大豆光合作用, 有利于种子氨基酸、蛋白质的积累, 促进大豆形态建成。缺磷情况下的大豆植株生长受到严重抑制, 并且影响根瘤菌在大豆根际的生长、侵入结瘤以及固氮酶活性[23-25]。大豆盆栽试验结果表明:接种单一溶磷菌及复合溶磷菌处理的植株干质量、根瘤数和磷含量显著高于不接种处理, 而且施入土壤的复合菌的应用效果好于单一菌株。究其原因, 主要是单一菌介入土壤易受环境胁迫, 影响其溶磷功能。复合菌群菌株间协同共栖, 对大豆根系分泌物的资源占有量加大, 分泌的不同种类有机酸相互配合, 更利于发挥溶磷作用。李阜棣[26]认为外源微生物介入土壤必须经过与土著微生物生态位的竞争(包括营养、空间等), 才能在根际定殖并发挥作用。因此, 在后续研究中应该对溶磷复合菌群之间的协同作用及功能菌与植物根际的互作进行深入研究, 以进一步提高功能菌活化土壤磷素的效率。
| [1] | 王光华, 周可琴, 金剑, 等. 不同氮源对3种溶磷真菌溶解磷矿粉能力的影响[J]. 农业系统科学与综合研究, 2003, 19(4): 260–263. |
| [2] | Gilbert N. Phosphate-based fertilizers have helped spur agricultural gains in the past century, but the world may soon run out of them[J]. Nature, 2009, 461(8): 716–718. |
| [3] | Son H J, Park G T, Cha M S, et al. Solubilization of insoluble inorganic phosphates by a novel salt-and pH-tolerant Pantoea agglomerans R-42 isolated from soybean rhizosphere[J]. Bioresource Technology, 2006, 97: 204–210. DOI: 10.1016/j.biortech.2005.02.021 |
| [4] | Chung H, Park M, Madhaiyan M. Isolation and characterization of phosphate solubilizing bacteria from the rhizosphere of crop plants of Korea[J]. Soil Biology and Biochemistry, 2005, 37(10): 1970–1974. DOI: 10.1016/j.soilbio.2005.02.025 |
| [5] | 张小兰, 韦中, 梅新兰, 等. 一种基于根际定殖能力筛选溶磷菌的方法[J]. 南京农业大学学报, 2014, 37(2): 79–84. DOI: 10.7685/j.issn.1000-2030.2014.02.013 |
| [6] | Nakayan P, Hameed A, Singh S, et al. Phosphate-solubilizing soil yeast Meyerozyma guilliermondii CC1 improves maize(Zea mays L.)productivity and minimizes requisite chemical fertilization[J]. Plant Soil, 2013, 373: 301–315. DOI: 10.1007/s11104-013-1792-z |
| [7] |
林启美, 赵小蓉, 孙焱鑫, 等. 四种不同生态环境中解磷菌的数量及种群分布[J].
土壤与环境, 2000, 9(1): 34–37.
Lin Q M, Zhao X R, Sun Y X, et al. Community characters of soil phosphobacteria in four ecosystems[J]. Soil and Environmental Sciences, 2000, 9(1): 34–37. (in Chinese with English abstract) |
| [8] |
冯伟, 杨军芳, 周晓芬, 等. 5种解磷溶磷菌肥在晋察冀西山区旱地玉米上的肥效试验[J].
河北农业科学, 2013, 17(2): 38–40.
Feng W, Yang J F, Zhou X F, et al. Study on 5 kinds of phosphorus dissolving microbial fertilizer efficiency of dryland maize in west mountain regions of Hebei Province[J]. Journal of Hebei Agricultural Sciences, 2013, 17(2): 38–40. (in Chinese with English abstract) |
| [9] | 李繁, 涂然, 陈三凤. 7株解磷细菌的分离和鉴定[J]. 农业生物技术学报, 2006, 14(3): 600–605. |
| [10] |
田广文, 陈德育, 杨祥. 微生物学实验教学中革兰氏染色三步法应用试验[J].
安徽农学通报, 2008, 14(15): 58–66.
Tian G W, Chen D Y, Yang X. Application of Gram stain three-step method to microbiology experiment teaching[J]. Anhui Agricultural Science Bulletin, 2008, 14(15): 58–66. DOI: 10.3969/j.issn.1007-7731.2008.15.025 (in Chinese with English abstract) |
| [11] |
布坎南R E.
伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984: 732-735.
Breed R E. Bergey's Manual of Systemaic Bacteriology[M]. 8th ed. Beijing: Science Press, 1984: 732-735. (in Chinese with English abstract) |
| [12] |
奥斯伯F M.
精编分子生物学实验指南[M]. 北京: 科学出版社, 2005.
Ausubel F M. Manual of Molecular Biology Experiment[M]. Beijing: Science Press, 2005. (in Chinese with English abstract) |
| [13] |
陆文静. 石灰性土壤难溶态磷的微生物转化和利用[J].
植物营养与肥料学报, 1999, 5(4): 377–383.
Lu W J. Calcareous soil microbial transformation and utilization of undissolved state of phosphorus[J]. Plant Nutrition and Fertilizer Science, 1999, 5(4): 377–383. DOI: 10.11674/zwyf.1999.0413 (in Chinese with English abstract) |
| [14] | Hafeez F Y, Malik K A. Manual on Biofertilizer Technology[M]. Faisalabad: NIBGE, 2000. |
| [15] | Li Z, Bai T S, Dai L T, et al. A study of organic acid production in contrasts between two phosphate solubilizing fungi:Penicillium oxalicum and Aspergillus niger[J]. Scientific Report, 2016, 6: 25313. DOI: 10.1038/srep25313 |
| [16] |
鲍士旦.
土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 70-97.
Bao S D. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2000: 70-97. (in Chinese with English abstract) |
| [17] | Mathew M, Takagi S. Structures of biological minerals in dental research[J]. Journal of Research of the National Institute of Standards and Technology, 2001, 106: 1035–1044. DOI: 10.6028/jres.106.054 |
| [18] | Lal R, Stewart B A. Soil Phosphorus[M]. Florida: CRC Press, 2016: 1-22. |
| [19] | Nautiyal C S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiol Lett, 1999, 170: 265–270. DOI: 10.1111/fml.1999.170.issue-1 |
| [20] |
王光华, 周德瑞, 杨谦, 等. 低分子量有机酸对磷矿粉的释磷效应[J].
农业环境科学学报, 2004, 23(1): 80–84.
Wang G H, Zhou D R, Yang Q, et al. Effects of low-molecular-weight organic acids on release of phosphorus from rock phosphate[J]. Journal of Agro-Environment Science, 2004, 23(1): 80–84. (in Chinese with English abstract) |
| [21] |
宋建利, 石伟勇. 磷细菌肥料的研究和应用现状概述[J].
化肥工业, 2005(4): 18–20.
Song J L, Shi W Y. Study of phosphorus bacterial fertilizers and present status of their use[J]. Fertilizer Industry, 2005(4): 18–20. (in Chinese with English abstract) |
| [22] |
李喜焕, 常文锁, 张彩英. 中国大豆磷素营养及磷高效品种筛选最新进展[J].
大豆科学, 2011, 30(2): 322–327.
Li X H, Chang W S, Zhang C Y. Advances of soybean phosphorus nutrition and high P-efficient germplasms screening in China[J]. Soybean Science, 2011, 30(2): 322–327. (in Chinese with English abstract) |
| [23] |
郜春花, 王岗, 董云中. 解磷菌剂盆栽及大田施用效果[J].
山西农业科学, 2003, 31(3): 40–43.
Gao C H, Wang G, Dong Y Z. Effect of phosphate-solubilizing bacteria agent under the condition of potted and field[J]. Shanxi Agricultural Science, 2003, 31(3): 40–43. (in Chinese with English abstract) |
| [24] | Alva A K, Edwards D G. Effects of acid soil infertility factors on growth and nodulation of soybean[J]. Agronomy Journal, 1987, 79(2): 302–306. DOI: 10.2134/agronj1987.00021962007900020025x |
| [25] |
李晓林, 曹一平. 菌根和非菌根三叶草根际土壤磷钾浓度变化[J].
土壤通报, 1992(4): 180–182.
Li X L, Cao Y P. Concentration change of soil phosphorus and kalium in mycorrhiza and nonmycorrhiza clover rhizosphere[J]. Chinese Journal of Soil Science, 1992(4): 180–182. (in Chinese with English abstract) |
| [26] |
李阜棣.
土壤微生物学[M]. 北京: 中国农业出版社, 1996.
Li F D. Soil Microbiology[M]. Beijing: China Agriculture Press, 1996. (in Chinese with English abstract) |




