文章信息
- 高海涛, 吴希宝, 于佳星, 张伟, 董立尧
- GAO Haitao, WU Xibao, YU Jiaxing, ZHANG Wei, DONG Liyao
- 耿氏假硬草种子萌发条件的研究
- Study on the environmental factors affecting seed germination of Pseudosclerochloa kengiana
- 南京农业大学学报, 2017, 40(5): 835-841
- Journal of Nanjing Agricultural University, 2017, 40(5): 835-841.
- http://dx.doi.org/10.7685/jnau.201701034
-
文章历史
- 收稿日期: 2017-01-18
耿氏假硬草, 又叫耿氏硬草, 拉丁名Pseudosclerochloa kengiana(Ohwi)Tzvelev, 英文名stiffgrass。2002年出版的中国植物志[1]以及以前的相关记载均称之为硬草[Sclerochloa kengiana(Ohwi)Tzvel.], 直到2013版《中国植物志》英文修订版[2]将其正式命名为耿氏假硬草。耿氏假硬草为禾本科(Graminales)早熟禾族(POEAE R. Br.)硬草属(Sclerochloa Beauv), 一年生或越年生草本植物, 主要分布于江苏、安徽、河南等地。近年来, 随着耕作制度的改变以及长期单一使用骠马、异丙隆、炔草酯、苯磺隆等药剂, 农田杂草的草相发生了明显的变化, 禾本科杂草日本看麦娘、菵草、硬草、早熟禾上升明显, 看麦娘、野燕麦下降明显[3]。其中耿氏假硬草作为南方麦田杂草, 随着南种北移, 危害面积逐年扩大, 已经成为长江流域稻茬麦田的优势草种[4]。有报道称耿氏假硬草每年发生面积达40万hm2, 造成小麦减产5亿kg[4], 给国家的经济造成不可挽回的损失。耿氏假硬草一般在10月中下旬(日平均温度15~18 ℃)开始萌发出苗, 与当地小麦出苗基本同步。第2年4月中旬开始陆续抽穗, 5月中下旬全部成熟, 比小麦成熟期提前20 d左右, 全生育期最长约210 d[5]。
杂草种子的萌发和出苗是一个复杂的过程, 种子能否萌发、出苗, 受外界生态条件诸如水分、温度、氧气、光照、土壤酸碱度、土壤盐分和埋土深度等因素的影响[6]。研究外界生态因子对种子萌发及出苗的影响, 对指导杂草的防除以及减少化学除草剂的施用量具有十分重要的作用。例如很多杂草萌发对水分胁迫较为敏感, 如鳢肠、鸭舌草、加拿大一只黄花等[7], 在实际生产中可以通过控制水势对其进行控制; 又如埋土深度对很多杂草的出苗有影响, 可通过深翻耕, 将土表的杂草种子翻入深土层来抑制种子萌发。
针对耿氏假硬草的发生危害, 许多学者对其防除措施[8-10]、抗性状况[11]进行了研究, 但系统讨论耿氏假硬草的萌发特性鲜见报道, 仅在20世纪80年代, 唐洪元等[12]研究了硬草的出苗特性, 单业发[13]研究了硬草的萌发特性。但是由于当时受到各种条件的限制, 其研究结果比较散乱且不统一。因此, 笔者系统地研究了生态条件对耿氏假硬草种子萌发和出苗的影响, 旨在明确耿氏假硬草籽实的萌发与休眠特性, 为农田杂草的综合治理, 保障农业安全生产提供理论依据。
1 材料与方法 1.1 试验材料供试种子:耿氏假硬草(P.kengiana)种子于2016年5月采于江苏省扬州市江都区丁沟镇腾飞村一处小麦田, 该小麦田前茬作物为水稻, 土壤pH值为7.8, 播种小麦前浅耕1次。
供试试剂:邻苯二甲酸氢钾、氢氧化钠, 分析纯, 南京寿德试剂有限公司; 浓盐酸, 分析纯, 南京化学试剂股份有限公司; 次氯酸钠, 分析纯, 上海凌峰化学试剂有限公司; 聚乙二醇6000(PEG6000)、2-(N-吗啉)乙磺酸(MES)、4羟乙基哌嗪乙磺酸(HEPES)、N-3(羟甲基)甲基甘氨酸(tricine), Solarbio专业生化试剂供应商。
1.2 储存方式与休眠解除将新采集的耿氏假硬草种子分别按下列方式进行储存:室温干储、4 ℃冰箱干储、5 cm土下层积、30% NaClO消毒后4 ℃水中浸泡。每隔10 d从各处理中分别取出一部分种子进行试验。萌发试验采用培养皿法。
1.3 耿氏假硬草种子萌发特性的研究将已解除休眠的耿氏假硬草种子置于2层滤纸铺垫的直径9 cm玻璃培养皿中, 每皿25粒。每皿移入5 mL蒸馏水或测试液, 除温度和光照处理外, 其他处理均置于光/暗为20 ℃/15 ℃、光/暗为12 h/12 h、光照度8 000 lx的光照培养箱内培养, 14 d后观察记录其萌发数并进行统计分析。每个试验每个处理均重复4次。
1.3.1 温度对种子萌发的影响培养温度分别设定为10/5、15/10、20/15、25/20(光/暗, 单位:℃), 光周期为12 h/12 h(光/暗), 光照度为8 000 lx。每天记录各处理种子萌发数。
1.3.2 光照对种子萌发的影响培养时光照时间分别设定为0/24、6/18、12/12、18/6、24/0(光/暗, 单位:h), 温度为20 ℃/15 ℃(光/暗), 光照度为8 000 lx, 14 d后记录各处理种子萌发数。
1.3.3 pH值对种子萌发的影响将种子分别置于pH值为4、5、6、7、8、9和10的缓冲液中, pH值为4的缓冲液用2 mmol · L-1邻苯二甲酸氢钾与1 mol · L-1的HCl配制; pH值分别为5、6的缓冲液用2 mmol · L-1的2-(N-吗啉)乙磺酸(MES)与1 mol · L-1的NaOH配制; pH值分别为7、8的缓冲液用2 mmol · L-1的4羟乙基哌嗪乙磺酸(HEPES)与1 mol · L-1的NaOH配制; pH值分别为9、10的缓冲液用2 mmol · L-1的N-3(羟甲基)甲基甘氨酸(tricine)与1 mol · L-1的NaOH配制[10-11]。以蒸馏水(pH6.8) 为对照, 其他条件不变。
1.3.4 水势对种子萌发的影响用聚乙二醇6000(PEG6000) 和蒸馏水配置质量浓度分别为72.6、114.7、147.4、174.9、199.0、222.2和242.2 g · L-1的水溶液, 与之相对应的水溶液水势为-0.1、-0.2、-0.3、-0.4、-0.5、-0.6、-0.7 MPa[14]。用蒸馏水作为对照, 每皿移取对应水溶液5 mL, 每3 d更换1次滤纸, 以减少水势变动。
1.3.5 盐胁迫对种子萌发的影响分别用浓度为10、20、40、80、160、320 mmol · L-1的氯化钠(NaCl)溶液和蒸馏水为培养液进行萌发试验, 14 d后记录各处理种子萌发数。
1.3.6 埋土深度对出苗的影响在直径为12 cm、深度约13 cm的底部带孔的塑料盆钵内装入适量的风干土, 底部覆盖单层滤纸, 底部浸水至土壤湿润。每杯播种25粒耿氏假硬草种子, 分别设不覆土和9个覆土深度(分别为0.5、1、2、3、4、5、6、7、8 cm)处理。置于光照培养箱内, 温度为20 ℃/15 ℃(光/暗), 光周期为12 h/12 h(光/暗), 光照度为8 000 lx, 培养14 d记录出苗数。每个处理均重复4次。试验期间注意保持土壤湿润。
1.4 数据计算与统计方法 1.4.1 种子萌发率萌发种子数占供试种子的百分数。计算方法如式(1):
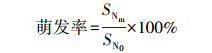
|
(1) |
式中:SNm为供试种子发芽粒数; SN0为供试种子数。
1.4.2 种子萌发指数反映种子发芽整齐程度的指标。计算方法如式(2):

|
(2) |
式中:Ni表示第i天萌发种子数; Di表示相应的萌发时间(d); n表示萌发持续时间(d)。
1.4.3 种子平均萌发时间
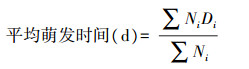
|
(3) |
试验数据采用SPSS 21.0数据处理软件进行方差分析, 并用LSD法进行差异显著性比较。采用SigmaPlot 10.0数据处理软件拟合曲线。利用回归分析研究确定了水势、盐胁迫以及埋土深度与最终萌发(出苗)率的拟合曲线方程为:

|
(4) |
式中:x为盐胁迫浓度、埋土深度或者水势; G为水势或盐分胁迫为x条件下的萌发率; Gmax为最大萌发率; x50为最大萌发率50%时的水势、盐浓度或者埋土深度; Grate为方程的斜率。
确定了温度、盐胁迫和水势与实时萌发率的拟合曲线方程(式5), 计算达到最大萌发率50%所需的时间(tE50)。

|
(5) |
式中:E是随着时间x变化的萌发率; a为最大萌发率; b为方程的斜率。
2 结果与分析 2.1 储存条件对耿氏假硬草种子休眠解除的影响我们将新采集的及室温放置10、20、30 d后的耿氏假硬草种子置于20 ℃/15 ℃(光/暗)、光照周期为12 h/12 h(光/暗)条件下进行萌发试验, 发现其萌发率均低于10%, 说明耿氏假硬草存在至少1个月以上的休眠期。
其不同储存方式对耿氏假硬草种子解除休眠的效果不同。由图 1可知:经30% NaClO消毒后放在4 ℃冰箱中水储解除休眠速度最快, 处理20 d后其萌发率达到82%;而土下5 cm层积解除休眠的效果最好, 处理30 d后其萌发率达到94%;而4 ℃冰箱干储处理后休眠率低于40%, 说明低温干燥条件不能有效解除耿氏假硬草种子休眠。
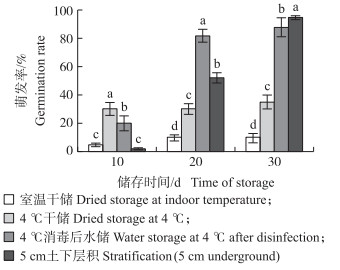
|
图 1 储存条件对耿氏假硬草种子萌发的影响 Figure 1 Effect of different storage condition on seed germination of Pseudosclerochloa kengiana 不同小写字母表示不同处理间在0.05水平差异显著。 The different lowercase letters in the same column show the significant difference at 0.05 level. The same as follows. |
由图 2可见:耿氏假硬草在10 ℃/5 ℃、15 ℃/10 ℃、20 ℃/15 ℃条件下其最终萌发率均达到80%以上, 其中在15 ℃/10 ℃时萌发率最高达到98%;而在20 ℃以上时耿氏假硬草萌发逐渐减少, 直至不再萌发。而从表 1可知, 10 ℃/5 ℃、15 ℃/10 ℃处理时硬草萌发50%所需要的时间、平均萌发时间要比20 ℃/15 ℃处理下长2~4 d。因此, 尽管在低温下耿氏假硬草最终都能萌发且萌发率较高, 但是其萌发所需时间较长且种子萌发整齐度较低。所以15~20 ℃是耿氏假硬草最适宜萌发温度。

|
图 2 温度对耿氏假硬草种子萌发的影响 Figure 2 Effect of temperature on seed germination of P.kengiana |
| 处理 Treatments |
萌发50%所需时间/d tE50 |
平均萌发时间/d Mean germination time(MGT) |
萌发指数 Germination index |
|
| 温度(光/暗)/℃ Temperature(light/night) |
10/5 | 13.33±0.87a | 14.58±0.46a | 1.49±0.14bc |
| 15/10 | 11.71±0.31a | 12.53±0.59a | 2.03±0.09ab | |
| 20/15 | 9.25±0.42b | 10.12±0.58b | 2.38±0.17a | |
| 25/20 | 6.36±1.22b | 8.04±1.07b | 1.02±0.34c | |
| 盐胁迫/(mmol·L-1) NaCl stress |
0 | 6.18±0.21d | 6.70±0.23d | 3.81±0.13a |
| 10 | 6.51±0.43d | 7.19±0.51d | 3.58±0.25ab | |
| 20 | 6.27±0.18cd | 6.86±0.27cd | 3.69±0.17ab | |
| 40 | 7.16±0.32cd | 7.68±0.36cd | 3.22±0.24bc | |
| 80 | 7.60±0.45c | 8.01±0.43bc | 3.02±0.11c | |
| 160 | 8.42±0.15b | 8.95±0.13b | 2.33±0.10d | |
| 320 | 10.35±0.37a | 10.93±0.21a | 0.35±0.06e | |
| 水势/MPa Osmotic potential |
0 | 6.75±0.10d | 7.68±0.13f | 2.33±0.12a |
| -0.1 | 7.00±0.09d | 7.92±0.15ef | 2.41±0.11a | |
| -0.2 | 7.59±0.27cd | 8.67±0.24de | 2.02±0.08ab | |
| -0.3 | 8.04±0.84bc | 8.89±0.53cd | 2.15±0.12ab | |
| -0.4 | 9.01±0.28b | 9.53±0.15c | 1.69±0.30b | |
| -0.5 | 11.00±0.63a | 11.04±0.29b | 1.15±0.07c | |
| -0.6 | 11.58±0.39a | 12.08±0.31a | 0.50±0.15d | |
| -0.7 | — | — | — | |
如图 3所示:在不同的光照条件下, 萌发率之间没有差异, 均达到80%以上, 这说明光并不是限制耿氏假硬草种子萌发的因素, 并且光照时间的延长并不能影响耿氏假硬草种子的萌发率, 这也是耿氏假硬草可以在阴暗、潮湿的地方生长的原因。

|
图 3 光照对耿氏假硬草种子萌发的影响 Figure 3 Effect of light on seed germination of P.kengiana |
pH的改变对耿氏假硬草种子的萌发并无影响(图 4), 试验设计pH值范围内其萌发率均达到90%以上, 且与清水(pH6.8) 比较并无显著性差异。酸碱性环境不是其萌发的限制因素, 适合我国大部分的土壤条件。
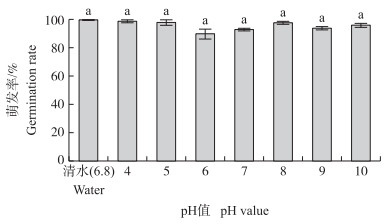
|
图 4 pH值对耿氏假硬草种子萌发的影响 Figure 4 Effect of pH value on seed germination of P.kengiana |
根据1.4.4节得出水势与耿氏假硬草种子萌发率拟合曲线方程为:G(%)=95.32/[1+(x/-0.55)7.50](R2=0.99), 拟合曲线如图 5所示。随着水势的降低耿氏假硬草的萌发率逐渐降低, 而抑制耿氏假硬草50%萌发率所需要的水势为-0.55 MPa。同时, 随着水势的降低耿氏假硬草的平均萌发时间以及萌发50%所需时间逐渐增大, 而萌发指数逐渐降低(表 1)。当水势为-0.6、-0.7 MPa时, 其耿氏假硬草种子仍可以萌发, 其萌发率分别为32.88%、15.07%(图 5)。这与它的生长环境相一致, 耿氏假硬草多发生在冬小麦田中, 它并不需要过多的水分支持就可以萌发。
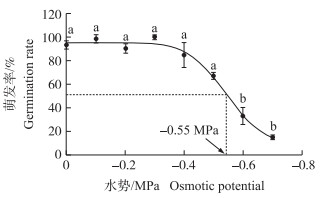
|
图 5 水势对耿氏假硬草种子萌发的影响 Figure 5 Effect of osmotic potential on seed germination of P.kengiana |
根据1.4.4节得出盐分与耿氏假硬草种子萌发率拟合曲线方程为:G(%)=96.75/[1+(x/228.29)4.99](R2=0.99)。结果(图 6)表明:当盐浓度低于160 mmol · L-1时, 耿氏假硬草的萌发率均大于80%, 而随着盐浓度的上升, 萌发率逐渐下降, 抑制其50%萌发率所需要的盐浓度为228.29 mmol · L-1, 在最高盐浓度320 mmol · L-1处理中仍有部分种子可以萌发, 表明耿氏假硬草对盐分具有较高的适应性, 可以在盐分较高的土壤中萌发, 因此存在向不同土壤类型田块扩散的风险。

|
图 6 盐胁迫对耿氏假硬草种子萌发的影响 Figure 6 Effect of salt stress on seed germination of P.kengiana |
根据1.4.4节得出埋土深度与耿氏假硬草出苗率拟合曲线方程为:G(%)=98.12/[1+(x/1.08)4.00](R2=0.98)。当埋土深度为0、0.5、1、2 cm时, 其出苗率分别为94%、99%、55%和11%(图 7)。当埋土深度超过2 cm以上时耿氏假硬草基本不再出苗。表明耿氏假硬草在土壤中的垂直分布, 与耿氏假硬草的发生有着密切联系, 其最适出苗的土壤深度为0~1 cm, 不同的耕作方式可能对耿氏假硬草的发生产生显著影响。

|
图 7 埋土深度对耿氏假硬草出苗的影响 Figure 7 Effect of burial depth on seeding emergence rate of P.kengiana |
杂草种子的休眠具有很重要的生态学意义。休眠是植物在长期发展中对于相对稳定的季节变化所形成的主动适应。种子休眠在植物中十分普遍, 是植物适应逆境和保护物种延续的一种策略[14-15]。休眠是杂草种子在长期的自然选择中对不良环境逐渐适应的结果。通常认为导致杂草休眠的原因有2个[16]:1) 内在因素, 主要是因为胚胎不发达, 种子生理上不成熟, 缺乏必要的激素刺激; 2) 外在因素, 如种皮、胚乳或果皮导致的机械阻塞或不渗透性, 或种子内存在抑制发芽的物质。本研究表明, 耿氏假硬草种子存在一定的休眠期, 成熟种子落入土壤中在土下层积一段时间可以打破种子的休眠。叶贵友[4]曾进行了种子颖壳对萌发的影响试验, 发现脱去颖壳的种子仅13 d就可发芽, 而带颖壳的种子50 d都不发芽。认为耿氏假硬草种子外面覆盖着颖壳, 落入土壤中的种子具有很强的抗逆性, 是因颖壳中具有抑制发芽的物质。本研究中低温可以促进耿氏假硬草种子的后熟作用, 低温下处理一段时间可以显著提高耿氏假硬草种子的萌发率。而当温度超过20 ℃时耿氏假硬草的萌发率则会显著下降。
很多杂草种子的萌发是需要光照的, 如看麦娘(Alopecurus aequalis)、鳢肠(Ecliptaprostrata)等在光照条件下萌发率有显著提高[17-18]。根据种子萌发对光反应不同分为需光性种子、忌光性种子和中性种子3类[19]。需光种子的基本特点是在缺光下不能萌发或很少萌发, 光对胚启动发芽起决定性作用, 是萌发不可缺少的因素, 如看麦娘和车前草(Plantagolessingii)种子; 忌光性种子即为受光抑制的, 比较典型的有黑种草(Nigella damascena)和门市喜林草(Nemophilainsignis); 而对于中性种子的萌发, 光不是必不可少的因素, 它能在缺光条件下萌发, 如早熟禾[20]。本试验结果显示, 耿氏假硬草属于中性种子, 因此耿氏假硬草落入土壤中, 在颖壳腐烂后, 只要土壤条件适宜, 种子在当年即可萌发。耿氏假硬草对土壤酸碱度的改变具有很强的适应性, 在pH值4~10范围内均可正常萌发, 因此, 耿氏假硬草在长期使用化肥和农药的土地中仍具有危害性。水势和盐分都是通过控制种子吸水来影响种子萌发的。棒头草在水势为-0.4 MPa时已完全不能萌发[21], 而耿氏假硬草在水势为-0.7 MPa时仍有部分种子可以萌发, 这也说明耿氏假硬草可以适应一定的干旱, 使其进一步增加其危害范围。我国盐分最高的土壤出现在辽河流域, 其土壤含水量为1.6%, 大约相当于NaCl含量为280 mmol · L-1[22]。而耿氏假硬草在320 mmol · L-1时仍有部分种子可以萌发, 其对盐胁迫的高耐受性可以对我国的大多数高盐地区适应。近年来, 耿氏假硬草在江苏沿海地区的危害逐年加重可能与此有关。
由于耿氏假硬草种子体积较小, 胚乳或子叶所含的养分较少, 种子不易从较深的土层出苗, 只有处于或近于表土层的种子才能萌发出苗。当种子处于土层2 cm以下的深度时, 就基本不会再萌发。所以在耕作过程中, 只要在小麦播种前进行一次深耕, 即可有效控制种子出苗, 会大大减少田间耿氏假硬草的种子数量, 减轻危害。根据试验结果, 我们发现20 ℃/15 ℃是种子萌发的最佳温度, 高温处理可抑制耿氏假硬草种子的萌发; 光照、酸碱并不是耿氏假硬草种子萌发的限制因素; 其对水分胁迫和盐胁迫均有较高的忍耐力; 埋土深度为0~1 cm下还能出苗, 但是在2 cm土层下, 几乎不能出苗。这为实际生产提供了良好的理论基础, 例如更改耕作方式, 采用深耕处理, 将表层土翻下去, 将表层土中前一年脱落的耿氏假硬草种子翻到深层土下, 抑制它的萌发。根据温度、水势、盐胁迫以及埋土深度对耿氏假硬草种子的影响, 我们应当制定合理的防除措施, 因地制宜、综合治理, 减轻其对农作物的危害, 提高农作物的产量。
| [1] |
中国植物志编委会.
中国植物志[第9(2) 卷][M]. 北京: 科学出版社, 2002: 276-277.
Editorial Board of Flora of China. Flora of China[Volume 9(2)][M]. Beijing: Higher Education Press, 2002: 276-277. (in Chinese with English abstract) |
| [2] |
中国植物志编委会.
中国植物志[M]. 北京: 科学出版社, 2013.
Editorial Board of Flora of China. Flora of China[M]. Beijing: Higher Education Press, 2013. (in Chinese with English abstract) |
| [3] | 杨进, 刘学儒, 丁涛, 等. 扬州市麦田草相特点及杂草防除对策[J]. 杂草科学, 2014, 32(4): 28–31. |
| [4] |
叶贵友. 硬草种子萌发条件[J].
杂草科学, 1996(3): 8–9.
Ye G Y. Germination conditions of Sclerochloa kengiana[J]. Weed Science, 1996(3): 8–9. (in Chinese with English abstract) |
| [5] |
张凤海, 胡兰英. 麦田硬草的发生特点及防除途径探讨[J].
杂草科学, 1998(1): 42–43.
Zhang F H, Hu L Y. Occurrence characteristics and control measures of Sclerochloa kengiana in wheat field[J]. Weed Science, 1998(1): 42–43. (in Chinese with English abstract) |
| [6] | 张红香, 周道玮. 种子生态学研究现状[J]. 草业科学, 2016, 33(11): 2221–2236. DOI: 10.11829/j.issn.1001-0629.2016-0222 |
| [7] | 张冬雨, 金燕, 吕波, 等. 加拿大一枝黄花(Solidago canadensis L.)水浸提液对小麦的化感作用及机制[J]. 南京农业大学学报, 2014, 37(5): 87–92. DOI: 10.7685/j.issn.1000-2030.2014.05.014 |
| [8] |
吴干, 耿辉辉, 蒋晴, 等. 8%炔草酸EW对小麦田硬草防除试验[J].
大麦与谷类科学, 2016, 33(1): 56–57.
Wu G, Geng H H, Jiang Q, et al. Using clodinafop to control Sclerochloa kengiana in wheat field[J]. Barley and Cereal Sciences, 2016, 33(1): 56–57. (in Chinese with English abstract) |
| [9] |
崔冬梅, 王卫星. 丙草胺封闭小麦田防治硬草的效果研究[J].
安徽农业科学, 2013, 41(19): 8180–8181.
Cui D M, Wang W X. Control effect of pretilachor against Sclerochloa kengiana in closed wheat filed[J]. Journal of Anhui Agricultural Science, 2013, 41(19): 8180–8181. DOI: 10.3969/j.issn.0517-6611.2013.19.040 (in Chinese with English abstract) |
| [10] |
熊战之, 陈香华. 防除麦田恶性禾本科杂草硬草的药剂筛选与用量确定[J].
江苏农业科学, 2013, 41(11): 149–151.
Xiong Z Z, Chen X H. To determine the chemical screening and dosage of gramineous weeds in wheat fields of Sclerochloa kengiana[J]. Journal of Jiangsu Agricultural Science, 2013, 41(11): 149–151. DOI: 10.3969/j.issn.1002-1302.2013.11.056 (in Chinese with English abstract) |
| [11] | Yuan G H, Liu W T, Bi Y L, et al. Molecular basis for resistance to ACCase-inhibiting herbicides in Pseudosclerochloa kengiana populations[J]. Pesticide Biochemistry and Physiology, 2015, 119: 9–15. DOI: 10.1016/j.pestbp.2015.03.004 |
| [12] |
唐洪元, 王学鹗, 胡亚琴, 等. 上海农田主要杂草种子在土层内的出苗规律[J].
上海农业学报, 1986, 2(4): 111–118.
Tang H Y, Wang X E, Hu Y Q, et al. The seedling emergence of Shanghai main weed species seeds sown at different soil depths[J]. Acta Agriculturae Shanghai, 1986, 2(4): 111–118. (in Chinese with English abstract) |
| [13] |
单业发. 硬草种子萌发特性初步观察及其在防治上的应用[J].
江苏杂草科学, 1984(1): 9–12.
Shan Y F. Preliminary observation on seed germination characteristics of Keng stiffgrass and its application in control[J]. Journal of Jiangsu Weed Science, 1984(1): 9–12. (in Chinese with English abstract) |
| [14] | Wu X, Li J, Xu H L, et al. Factors affecting seed germination and seedling emergence of asia minor bluegrass(Polypogon fugax)[J]. Weed Science, 2015, 63: 440–447. DOI: 10.1614/WS-D-14-00093.1 |
| [15] | Javaid M M, Tanveer A. Germination ecology of Emex spinosa and Emex australis, invasive weeds of winter crops[J]. Weed Research, 2014, 54: 565–575. DOI: 10.1111/wre.12111 |
| [16] | 黄丹, 许岳香, 胡海波. 植物种子休眠原因与机理的研究进展[J]. 亚热带植物科学, 2010, 39(2): 78–83. |
| [17] |
罗小娟, 吕波, 李俊, 等. 鳢肠种子萌发及出苗条件的研究[J].
南京农业大学学报, 2012, 35(2): 71–75.
Luo X J, Lü B, Li J, et al. Study on the environmental factors affecting seed germination and seedling emergence of Eclipta prostrata[J]. Journal of Nanjing Agricultural University, 2012, 35(2): 71–75. DOI: 10.7685/j.issn.1000-2030.2012.02.012 (in Chinese with English abstract) |
| [18] | Xia W W, Pan L, Li J, et al. Molecular basis of ALS-and/or ACCase-inhibitor resistance in shortawn foxtail(Alopecurus aequalis Sobol.)[J]. Pesticide Biochemistry and Physiology, 2015, 122: 76–80. DOI: 10.1016/j.pestbp.2014.12.019 |
| [19] |
孟庆伟, 高辉远.
植物生理学[M]. 北京: 中国农业出版社, 2011: 254-255.
Meng Q W, Gao H Y. Plant Physiology[M]. Beijing: China Agriculture Press, 2011: 254-255. (in Chinese with English abstract) |
| [20] | 王红春, 娄远来, 李宜慰. 早熟禾萌发特性研究[J]. 江苏农业科学, 2009(4): 138–140. |
| [21] | 吴宪. 棒头草种子生物学、生态适应性及其化学防除技术研究[D]. 南京: 南京农业大学, 2015: 28-29. http://d.g.wanfangdata.com.cn/Thesis_Y3185575.aspx |
| [22] |
巴逢辰, 赵羿. 中国海涂土壤资源[J].
土壤通报, 1997, 28(2): 49–51.
Ba F C, Zhao Y. The coastal soil resources in China[J]. Chinese Journal of Soil Science, 1997, 28(2): 49–51. (in Chinese with English abstract) |




