文章信息
- 吴小婷, 邵帅旭, 李英, 张昌伟, 侯喜林, 沈振国, 刘同坤
- WU Xiaoting, SHAO Shuaixu, LI Ying, ZHANG Changwei, HOU Xilin, SHEN Zhenguo, LIU Tongkun
- 不结球白菜BrCDF1的克隆和蛋白亚细胞定位及其与BrFKF1蛋白的互作验证
- Cloning of BrCDF1 gene and protein subcellular localization and identification of its interaction with BrFKF1 in non-heading Chinese cabbage
- 南京农业大学学报, 2017, 40(5): 812-819
- Journal of Nanjing Agricultural University, 2017, 40(5): 812-819.
- http://dx.doi.org/10.7685/jnau.201612049
-
文章历史
- 收稿日期: 2016-12-30
2. 南京农业大学生命科学学院, 江苏 南京 210095
2. College of Life Sciences Nanjing Agricultural University Nanjing 210095, China
不结球白菜(Brassica rapa ssp. chinensis)类作物绝大多数属于一年生冬性蔬菜作物[1], 它们具有低温通过春化、高温长日照促进抽薹开花的特性[2], 先期抽薹不仅降低了其生物产量, 而且影响其商品性和食用价值[3]。因此, 深入研究不结球白菜抽薹开花的响应机制和调控网络, 分离鉴定出不结球白菜抽薹开花关键基因, 并对其遗传特性、生物学功能以及调控机制进行研究, 从分子水平解析不结球白菜抽薹开花机制, 将为晚抽薹不结球白菜种质创新与新品种选育提供重要的理论指导[4]。不结球白菜与模式植物拟南芥(Arabidopsis thaliana)同属十字花科(Cruciferae)芸薹属(Brassica), 因此拟南芥开花途径的分子机制研究结果对不结球白菜开花方面的研究有较大借鉴意义。目前已知的对拟南芥开花途径的分子机制研究表明, 拟南芥的开花受春化途径、光周期途径、自主途径和赤霉素途径调控[5]。
CDF1 属于Dof(DNA binding with one finger)基因家族, Dof基因家族属于锌指类超家族中的一员, 是植物中特有的一种转录因子[6-7]。研究发现, Dof转录因子含有2个主要的结构域, 分别为位于N端保守的DNA结合域(Dof保守域)和位于C端的转录调控域[8]。其中, Dof保守域的高度保守结构决定了Dof转录因子具有相似的特异性识别功能, 而其功能的多样化取决于C端转录调控域中多变的氨基酸序列[9]。FKF1 (FLAVIN-BINDING, KELCH REPEAT, F BOX 1 ) 属于F-box基因家族, F-box蛋白在成花调控中起了很重要的作用[10]。FKF1 具有3个重要的保守结构域, 分别为LOV结构、重复的Kelch序列和中间保守F-box序列。其中LOV结构域是蓝光吸收域, 通过吸收蓝光信号, 参与调控CO(CONSTANS)来影响开花[11]; Kelch重复序列主要功能是特异识别底物蛋白, 与多种蛋白复合形成复合物[12]。CDF1 是拟南芥的一个内源节律基因, CDF1 超表达可以抑制拟南芥开花因子CO基因及其调控因子FT(FLOWERING LOCUS T)的表达, 开花显著推迟[13]。有研究表明, FKF1基因和足够的光照是FT激活必不可少的条件[14-15]。拟南芥光周期开花的关键机制是控制CO的表达和活性。FKF1蛋白调节CO的转录[16], 而CDF1 可结合CO启动子, 具有高水平的CDF1的植物在开花后期CO表达显著降低[17]。FKF1通过降解CDF1来控制CO的表达[18]。拟南芥FKF1能够和CDF1互作形成FKF1-CDF1复合体降解CDF1蛋白, 从而正调控CO基因的表达, 通过CO-FT调节机制来调控开花[19]。不结球白菜与拟南芥同属于十字花科长日照植物, 因此我们推测FKF1-CDF1-CO-FT这条途径在不结球白菜中也是保守的。
本研究利用同源克隆的方法获得了BrCDF1 和BrFKF1 基因片段, 对BrCDF1进行亚细胞定位分析; 同时, 利用酵母双杂交技术和双分子荧光互补技术验证BrCDF1和BrFKF1蛋白之间是否存在相互作用, 旨在深入研究该基因在不结球白菜抽薹开花过程中的调控机制及作用, 为晚抽薹不结球白菜的选育奠定基础, 从而有效地提高不结球白菜的商品性和食用价值。
1 材料与方法 1.1 BrCDF1和BrFKF1的克隆采用同源克隆方法, 用Primer Premier 5.0设计基因克隆引物, 引物序列见表 1。以不结球白菜‘苏州青’ cDNA为模板进行PCR克隆。PCR反应体系50 μL:2×Prime STAR Max DNA聚合酶25 μL, 10 μmol · L-1的5′端和3′端引物各0.5 μL, cDNA模板2 μL, ddH2O 22 μL。反应程序:95 ℃预变性10 s; 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s, 35个循环。PCR产物用10 g · L-1琼脂糖凝胶电泳进行检测, 然后用离心柱型琼脂糖凝胶DNA回收试剂盒(天根生化科技有限公司, 北京)对目的片段进行切胶回收。用DNA A-尾试剂盒(TaKaRa, 大连)对回收得到的PCR产物加poly A。总反应体系:10×A-尾缓冲液1 μL, dNTP混合物0.8 μL, A-尾酶0.1 μL, DNA片段2 μL, ddH2O 6.1 μL, 体系总体积为10 μL。反应程序为72 ℃ 15 min, 4 ℃保温。将加poly A的目的片段与测序载体pMD18-T(TaKaRa, 大连)连接, 转化Escherichia coli DH5α感受态细胞, 挑取阳性单克隆, 委托上海生工生物工程技术服务有限公司测序。
| 引物名称 Primer name |
引物序列(5′→3′) Primer sequence(5′→3′) |
| BrCDF1-F | ATGCTAGAAAGTAAAGATCC |
| BrCDF1-R | TCACATCTGTTCATGGAAAT |
| BrFKF1-F | ATGGAGTGGGACAGCGATTC |
| BrFKF1-R | TCATGTCTTGATGATGCTGT |
| gateway-BrCDF1-F | GGGGACAAGTTTGTACAAAAAAGCAGGCTATGCTAGAAAGTAAAGATCC |
| gateway-BrCDF1-R | GGGGACCACTTTGTACAAGAAAGCTGGGTATCACATCTGTTCATGGAAAT |
| gateway-BrFKF1-F | GGGGACAAGTTTGTACAAAAAAGCAGGCTATGGAGTGGGACAGCGATTC |
| gateway-BrFKF1-R | GGGGACCACTTTGTACAAGAAAGCTGGGTATCATGTCTTGATGATGCTGT |
BrCDF1 (Bra029261) 和BrFKF1 (Bra038831) 载体构建采用gateway技术[20]。为构建BrCDF1 基因gateway入门载体, 在正向引物和反向引物两端分别加上attB1和attB2位点序列, 分别设计gateway引物(表 1)。使用Phusion超保真酶PCR扩增反应程序:98 ℃ 30 s; 98 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 30 s, 35个循环; 72 ℃ 10 min, 4 ℃保温。用10 g · L-1琼脂糖凝胶电泳检测PCR产物并回收。
1.2.2 BP重组反应将上一步的PCR回收产物与入门载体pdonr221进行重组反应。反应体系(5 μL):目的基因的PCR产物2.7 μL, pdonr221载体1.0 μL, BP酶混合物0.3 μL, 5×BP反应缓冲液1.0 μL。瞬时离心后将混合体系于25 ℃水浴4 h, 加入1.0 μL蛋白酶K(100 μmol · L-1)溶液, 37 ℃反应10 min终止BP反应。将反应产物用热激法转化DH5α感受态细胞, 均匀涂于含50 mg · L-1卡那霉素的LB平板。37 ℃培养16 h后, 挑取单克隆在含有50 mg · L-1卡那霉素的LB液体培养基中振荡培养, 然后提取质粒进行PCR检测, 将带有扩增产物且片段大小正确的克隆进行测序。测序正确后即获得重组质粒(入门载体)pdonr221-BrCDF1 和pdonr221-BrFKF1 。
1.3 BrCDF1亚细胞定位分析由于质粒pdonr221和pEarlyGate101筛选抗性基因相同, 因此在LR重组反应前先用限制性内切酶MluⅠ对pdonr221-BrCDF1 进行单酶切, 然后与pEarlyGate101进行LR重组反应。反应体系(5 μL):线性化的pdonr221-BrCDF1 3 μL, 目的载体pEarlyGate101 1 μL, LR酶混合物1 μL。瞬时离心后将混合体系于25 ℃水浴4 h, 随后加入1.0 μL蛋白酶K(100 μmol · L-1)溶液, 37 ℃反应10 min终止LR反应。取3 μL反应产物用热激法转化DH5α感受态细胞, 均匀涂于含50 mg · L-1卡那霉素的LB平板, 37 ℃培养16 h后, 挑取单克隆在含有50 mg · L-1卡那霉素的LB液体培养基中过夜振荡培养。然后提取质粒进行PCR检测, 将有扩增产物且片段大小正确的克隆进行测序。测序验证后即获得重组质粒(亚细胞定位载体)pEarlyGate101-BrCDF1 -YFP。利用液氮冻融法将其重组融合表达载体pEarlyGate101-BrCDF1 -YFP转入农杆菌GV3101。
将含有表达载体pEarlyGate101-BrCDF1-YFP的GV3101农杆菌单菌落接种于含卡那霉素的YEB培养基中, 28 ℃、180 r · min-1培养20 h。加入用10 g · L-1菌液到同样的YEB培养基中, 28 ℃、200 r · min-1培养至菌液D600为1.0。在4 000 r · min-1下离心15 min, 收集菌体细胞, 用终浓度为10 mmol · L-1 MgCl2、10 mmol · L-1 MES(pH5.7)、150 μmol · L-1乙酰丁香酮的注射缓冲液重悬至D600为0.8, 室温放置5 h后, 用1 mL的无针头注射器将含有pEarlyGate101-BrCDF1-YFP的农杆菌菌液注射烟草叶片, 用H2B-RFP作为细胞核标记。将注射后的烟草植株置于25 ℃、16 h/8 h的光/暗周期下培养3 d后, 在激光共聚焦显微镜下观察YFP荧光信号及H2B-RFP红色细胞核荧光信号, 进行BrCDF1蛋白的亚细胞定位分析。
1.4 酵母双杂交分析通过LR反应, 分别将入门载体pdonr221-BrCDF1 和pdonr221-BrFKF1 转化成酵母表达载体pGADT7-BrCDF1 和pGBKT7-BrFKF1 。反应体系(5 μL):入门质粒3 μL, 目的载体1 μL, LR酶混合物1 μL。瞬时离心后将混合体系于25 ℃水浴4 h, 随后分别加入1.0 μL蛋白酶K(100 μmol · L-1)溶液, 37 ℃反应10 min终止反应。取3 μL反应产物用热激法转化DH5α感受态细胞。分别涂于含100 mg · L-1氨苄青霉素(pGADT7-BrCDF1 ) 和50 mg · L-1卡那霉素(pGBKT7-BrFKF1 ) 的LB平板。37 ℃培养16 h后, 挑取单克隆送至擎科生物技术有限公司测序, 测序验证后即获得pGADT7-BrCDF1 和pGBKT7-BrFKF1 目的载体。
根据酵母双杂交系统使用说明书(MatchmakerTM Gold Yeast Two-Hybrid System User Manual), 利用LiAc法制备感受态酵母菌AH109和Y187。用PEG/LiAc法将pGBKT7空载和重组载体pGBKT7-BrFKF1 分别转化AH109酵母感受态细胞, 转化后均匀涂于SD/-Trp筛选平板, 30 ℃培养3~5 d。同样的方法将pGADT7空载和重组载体pGADT7-BrCDF1 分别转化Y187酵母感受态细胞, 转化后将转化细胞均匀涂于SD/-Leu筛选平板, 30 ℃培养3~5 d。分别挑取SD/-Trp、SD/-Leu平板上的菌落, 将转化至AH109酵母感受态细胞的pGBKT7空载和重组载体pGBKT7-BrFKF1 转化菌落与转化至Y187酵母感受态细胞的pGADT7空载和重组载体pGADT7-BrCDF1 转化菌落两两组合, 即AH109[pGBKT7]×Y187[pGADT7]、AH109[pGBKT7]×Y187[pGADT7-BrCDF1 ]、AH109[pGBKT7-BrFKF1 ]×Y187[pGADT7]、AH109[pGBKT7-BrFKF1 ]×Y187[pGADT7-BrCDF1 ]。同时接种于500 μL的2×YPDA液体培养基中, 30 ℃振荡培养18~20 h, 然后将融合菌液均匀涂于SD/-Trp-Leu筛选平板上, 在30 ℃培养箱中培养4 d, 若酵母细胞能在SD/-Trp-Leu筛选平板上生长则证明两两互作的质粒已经转入同一个酵母细胞。最后将SD/-Trp-Leu平板上直径最大的酵母阳性克隆涂于SD/-Trp-Leu-His筛选平板上, 观察其生长情况。
1.5 双分子荧光互补分析将入门载体pdonr221-BrCDF1 和pdonr221-BrFKF1 进行LR反应转化成目的载体pSITE-YN-BrCDF1 和pSITE-YC-BrFKF1 。反应体系(5 μL):入门质粒3 μL, 目的载体1 μL, LR酶混合物各1 μL。瞬时离心后将混合体系于25 ℃水浴4 h, 随后分别加入1.0 μL蛋白酶K(100 μmol · L-1)溶液, 37 ℃反应10 min终止反应。取3 μL反应产物用热激法转化DH5α感受态细胞。转化后将部分转化细胞均匀涂于含50 mg · L-1壮观霉素的LB平板。37 ℃培养16 h后, 挑取单克隆培养送至公司测序, 测序验证后即获得pSITE-YN-BrCDF1 和pSITE-YC-BrFKF1 目的载体。
将构建好的重组载体pSITE-YN-BrCDF1 和pSITE-YC-BrFKF1 共同转化农杆菌GV3101, 同时设置空载体pSITE-YN和pSITE-YC共同转化农杆菌为阴性对照, H2B-RFP转化农杆菌用于定位烟草细胞核位置。将测序正确的农杆菌阳性克隆于28 ℃振荡培养, 3 000 g离心5 min, 弃上清液, 将收集的菌体分别用稀释液溶解后稀释至D600为1.0后等体积混合, 用1 mL的无针头注射器将2种重组质粒(pSITE-YN-BrCDF1 和pSITE-YC-BrFKF1 ) 和2种阴性对照质粒(pSITE-YN和pSITE-YC)注入烟草叶片下表皮; H2B-RFP作为核标记。于28 ℃温室中培养48 h后, 取出烟草叶片, 使用激光共聚焦显微镜观察烟草表皮细胞荧光蛋白表达情况。
2 结果与分析 2.1 不结球白菜BrCDF1 克隆、序列及进化分析以不结球白菜‘苏州青’cDNA为模板, 扩增获得的片段大小与预期的片段一致(图 1)。序列测序和分析表明, 不结球白菜‘苏州青’中的BrCDF1 基因含有876 bp开放阅读框, 编码292个氨基酸。
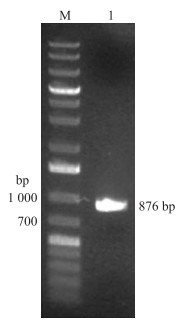
|
图 1 BrCDF1 基因PCR扩增产物 Figure 1 PCR amplified product of BrCDF1 gene M:1 kb ladder plus M1191 marker; 1:BrCDF1 扩增产物BrCDF1 PCR amplified. |
从NCBI中下载6个其他物种的CDF1蛋白序列, 并用DNAMAN 5.0软件对所得的序列进行氨基酸序列比对, 结果(图 2)显示:该蛋白与甘蓝型油菜(Brassica napus)、野甘蓝(原变种)(Brassica oleracea var. oleracea)、萝卜(Raphanus sativus)、天蓝遏蓝菜(Noccaea caerulescens)、拟南芥(Arabidopsis thaliana)、亚麻荠(Camelina sativa)同源性分别为91.11%、88.25%、84.76%、76.19%、72.06%、70.48%, 比对结果显示其保守性较高。
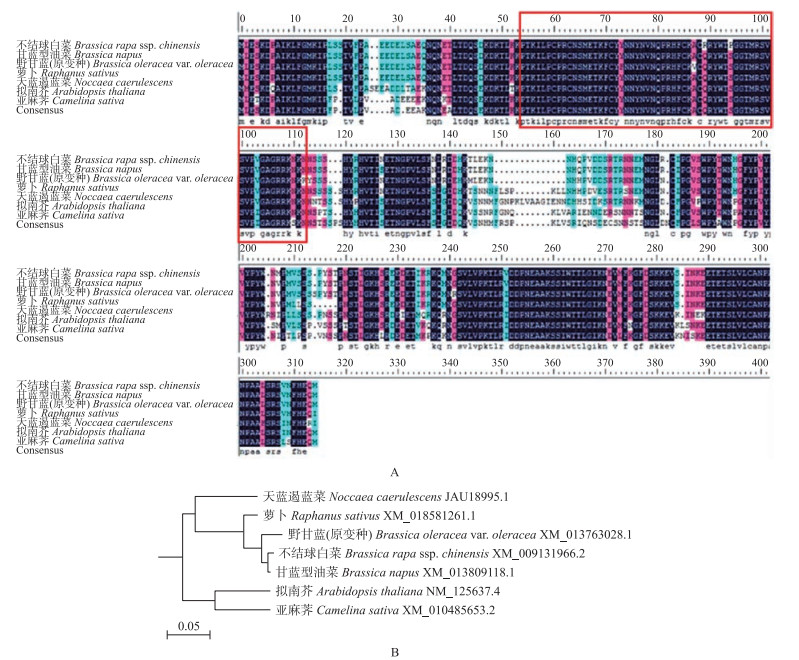
|
图 2 不结球白菜与其他物种CDF1同源氨基酸序列比对及进化树分析 Figure 2 The alignment of amino acid of CDF1 from Brassica rapa and other plants and phylogentic tree A:不结球白菜与其他物种的CDF1同源氨基酸序列比对(红色方框:位于第54~112个氨基酸的保守结构域); B:不结球白菜与其他物种的CDF1进化树分析。 A:The alignment of amino acid of CDF1 from Brassica rapa and other plants(red box:the conserved domain at position 54-112 amino acids); B:The phylogentic tree of CDF1 from Brassica rapa ssp. chinensis and other plants. |
将含有pEarlyGate101-BrCDF1-YFP的农杆菌侵染烟草植株36 h后, 利用荧光共聚焦显微镜观察本氏烟叶片中的荧光。结果(图 3)显示:在激光共聚焦显微镜下, 试验组pEarlyGate101-BrCDF1-YFP在YFP激发光下可以检测到较为明显的黄色荧光信号, 红色荧光信号表示本氏烟植株细胞核位置; 2张荧光信号重叠表明BrCDF1定位于细胞核, 这与该基因发挥转录因子功能及编码蛋白的功能性质有关。
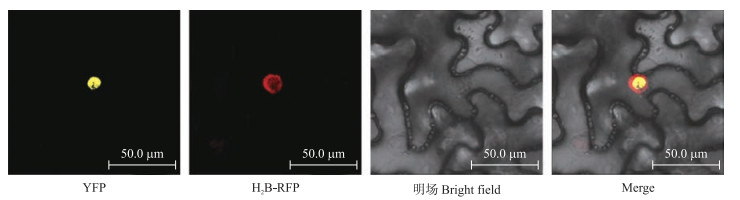
|
图 3 BrCDF1在本氏烟叶片中的亚细胞定位 Figure 3 Subcellular localization of BrCDF1 in leaves of Nicotiana benthamiana YFP:YFP激发光下的黄色荧光信号; H2B-RFP:H2B-RFP激发光下的红色荧光信号; Merge:YFP、H2B-RFP和明场的叠加。 YFP:The yellow fluorescence signals in YFP-excited; H2B-RFP:The red fluorescence signals in H2B-RFP-excited; Merge:The merge of YFP, H2B-RFP and bright field. The same as follows. |
由图 4可见:4个试验组在SD/-Trp-Leu平板上均生长良好, 这说明两两互作的质粒已经转入同一个酵母细胞, 而在SD/-Trp-Leu-His筛选平板上只有试验组AH109[pGBKT7-BrFKF1 ]×Y187[pGADT7-BrCDF1 ]出现生长状况良好的菌落。初步证明BrFKF1和BrCDF1这2个蛋白之间可能存在互作。

|
图 4 酵母双杂交和双分子荧光互补验证BrCDF1和BrFKF1的互作 Figure 4 The interaction identification of BrCDF1 and BrFKF1 by yeast two-hybrid and bimolecular fluorescence complementation methods 1:AH109[pGBKT7]×Y187[pGADT7];2:AH109[pGBKT7]×Y187[pGADT7-BrCDF1 ];3:AH109[pGBKT7-BrFKF1 ]×Y187[pGADT7];4:AH109[pGBKT7-BrFKF1 ]×Y187[pGADT7-BrCDF1 ];pSITE-YN+pSITE-YC+H2B-RFP:阴性对照Negative control group; pSITE-YN-BrCDF1 +pSITE-YC-BrFKF1 +H2B-RFP:试验组Experimental group. |
由图 4可见:在激光共聚焦显微镜下, 阴性对照组pSITE-YN和pSITE-YC检测不到黄色荧光; 试验组pSITE-YN-BrCDF1 和pSITE-YC-BrFKF1 在YFP激发光下可以检测到较为明显的黄色荧光信号, 将图片叠加后明显看到试验组pSITE-YN-BrCDF1 和pSITE-YC-BrFKF1 的黄色荧光信号与细胞核的红色荧光信号重叠, 表明BrCDF1和BrFKF1蛋白能够在植物细胞核内相互结合, 进一步验证了酵母双杂交的结果。
3 讨论抽薹开花性状为数量性状遗传, 受多基因控制[21], 由这些基因编码的转录因子在不结球白菜抽薹开花过程中发挥重要作用[22]。本研究运用同源克隆技术, 从不结球白菜中克隆出与其抽薹开花相关的BrCDF1和BrFKF1基因。其中BrCDF1属于Dof转录因子家族成员, Dof蛋白除了在其N末端有1个由52个氨基酸组成的高度保守的Dof结构域外[23], 不同Dof蛋白变化多样的C端区域也是与其他蛋白作用的区域, 调控不同类型蛋白或物质的反应, 受不同途径信号的调控而激活或抑制基因的转录[7]。胡娟等[24]对茶树CsCDF1 基因的克隆与编码蛋白的分析中发现CsCDF1蛋白有很强的核定位信号, 推测CsCDF1蛋白可能定位于细胞核, 而本试验通过亚细胞定位发现不结球白菜BrCDF1定位于细胞核, 这与该蛋白在茶树中的生物信息学分析推测一致。
BrFKF1 属于F-box蛋白家族成员, F-box蛋白质N末端是由40~50个氨基酸组成的F-box结构域, C末端的二级结构与其他蛋白质的相互作用密切相关, 这些结构使底物识别产生特异性[25]。F-box蛋白是SCF复合物中的重要组成成分, 具有的Kelch重复区域自身形成α螺旋和β折叠, 使之与泛素介导的蛋白底物结合, 完成蛋白之间的互作。前人研究发现, 由于拟南芥中存在约700个F-box基因, 所以植物体内可形成大量不同的SCF复合物, 这些复合物可以通过特异识别不同的靶蛋白而参与调控许多生理现象, 包括激素信号反应、光信号反应、生物钟、开花时间和抗病反应等[26]。
在拟南芥中, CO是调控光周期开花的关键因子, 拟南芥co突变体在长日照条件下晚开花[27]。在拟南芥、水稻[28]、大豆[14]和龙眼[15]的研究中发现, 拟南芥、水稻、大豆和龙眼的FKF1和GI基因共同作用调控开花, 其作用机制都是CO的转录水平受到FKF1和GI调控, 该调控是通过FKF1和GI分别和CDF1 互作形成FKF1-GI-CDF1复合体分布在CO启动子上, 调控CO的表达, 从而控制开花。近年来研究发现, 光周期途径中CDF1和GI的表达受节律钟调控, CDF1和GI感受昼夜节律基因的变化, 并把信号传递给CO[29]。CO的表达受到CDF1基因的抑制和GI基因的促进, 在下午CDF1蛋白在FKF1的参与下发生降解, 此时CO的表达量将会上升[30]。通过分析上述这些前人的研究发现, FKF1和CDF1之间存在一定的互作关系, 且FKF1蛋白在CDF1蛋白被泛素化降解发挥着重要作用, 但是目前在不结球白菜中并没有发现与这2个转录因子是否存在互作的研究。
本文通过对前人试验数据的分析, 推测FKF1-CDF1-CO-FT途径在不结球白菜中同样保守, 利用酵母双杂交系统和双分子荧光互补技术进行验证, 表明不结球白菜中BrCDF1和BrFKF1蛋白的确存在一定的互作关系, 该结论对于研究不结球白菜抽薹开花具有较大的参考价值。
| [1] |
黄细松. 白菜开花时间相关基因的分子标记及春化相关基因的克隆和表达分析[D]. 杭州: 浙江大学, 2006.
Huang X S. Molecular tagging of flowering time-related genes as well as cloning and expression analysis of vernalization-related genes in Brassica rapa[D]. Hangzhou:Zhejiang University, 2006(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10335-2006084846.htm |
| [2] |
张学铭. 白菜类作物抽薹开花的遗传分析[D]. 北京: 中国农业科学院, 2014.
Zhang X M. Genetic analysis of the bolting and flowering time in Brassica rapa[D]. Beijing:Chinese Academy of Agricultural Sciences, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326481.htm |
| [3] |
户秋稳, 吕炜, 张蜀宁, 等. 优质晚抽薹四倍体不结球白菜的创制及特性[J].
南京农业大学学报, 2015, 38(5): 757–763.
Hu Q W, Lü W, Zhang S N, et al. The induction and characteristics of high quality and late-bolting tetraploid non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2015, 38(5): 757–763. DOI: 10.7685/j.issn.1000-2030.2015.05.009 (in Chinese with English abstract) |
| [4] | Li L, Li X, Liu Y, et al. Flowering responses to light and temperature[J]. Science China Life Sciences, 2016, 59(4): 403–408. DOI: 10.1007/s11427-015-4910-8 |
| [5] | Song Y H, Shim J S, Kinmonth-Schultz H A, et al. Photoperiodic flowering:time measurement mechanisms in leaves[J]. Annual Review of Plant Biology, 2015, 66: 441–464. DOI: 10.1146/annurev-arplant-043014-115555 |
| [6] | 黄和喜, 王岩, 许玉超, 等. 不结球白菜雄蕊瓣化相关AP3 基因的克隆和表达分析[J]. 南京农业大学学报, 2015, 38(5): 748–756. DOI: 10.7685/j.issn.1000-2030.2015.05.008 |
| [7] | Xu P P, Chen H Y, Ying L, et al. AtDOF5.4/OBP4, a DOF transcription factor gene that negatively regulates cell cycle progression and cell expansion in Arabidopsis thaliana[J]. Scientific Reports, 2016, 6: 27705. DOI: 10.1038/srep27705 |
| [8] | Yan H, Huang J, Liao B, et al. DOF transcription factors in developing peanut(Arachis hypogaea)seeds[J]. American Journal of Molecular Biology, 2012, 2: 60–71. DOI: 10.4236/ajmb.2012.21007 |
| [9] | Cai X F, Zhang Y Y, Zhang C J, et al. Genome-wide analysis of plant-specific Dof transcription factor family in tomato[J]. Plant Biology, 2013, 55(6): 552–566. |
| [10] | Cui X H, Xu X F, He Y Y, et al. Overexpression of an F-box protein gene disrupts cotyledon vein patterning in Arabidopsis[J]. Plant Physiology and Biochemistry, 2016, 102: 43–52. DOI: 10.1016/j.plaphy.2016.02.012 |
| [11] | Ito S, Song Y H, Imaizumi T. LOV domain-containing F-box proteins:light-dependent protein degradation modules in Arabidopsis[J]. Molecular Plant, 2012, 5(3): 573–582. DOI: 10.1093/mp/sss013 |
| [12] | Schwager K M, Calderon-Villalobos L I A, Dohmann E M N, et al. Characterization of the VIER F-BOX PROTEINE genes from Arabidopsis reveals their importance for plant growth and development[J]. The Plant Cell, 2007, 19(4): 1163–1178. DOI: 10.1105/tpc.105.040675 |
| [13] | Fornara F, Panigrahi K C S, Gissot L, et al. Arabidopsis DOF transcription factors act redundantly to reduce CONSTANS expression and are essential for a photoperiodic flowering response[J]. Developmental Cell, 2009, 17: 75–86. DOI: 10.1016/j.devcel.2009.06.015 |
| [14] |
李芳. 大豆FKF1和GI基因克隆、表达模式及功能分析[D]. 北京: 中国农业科学院, 2012.
Li F. Molecular cloning, expression profiles and founctional analysis of FKF1 and GI genes in soybean(Glycine max)[D]. Beijing:Chinese Academy of Agricultural Sciences, 2012(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-82101-1012416004.htm |
| [15] |
黄芬娜. 龙眼DlGI和DlFKF1 基因的克隆及功能研究[D]. 福州: 福建农林大学, 2016.
Huang F N. Cloning and founctional analysis of DlGI and DlFKF1 in Longan(Dimocarpus longan Lour.)[D]. Fuzhou:Fujian Agriculture and Forestry University, 2016(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10389-1016134097.htm |
| [16] | Imaizumi T, Schultz T F, Harmon F G, et al. FKF1 F-box protein mediates cyclic degradation of a repressor of CONSTANS in Arabidopsis[J]. Science, 2005, 309: 293–297. DOI: 10.1126/science.1110586 |
| [17] |
吴连成, 常丽丽, 陈晓, 等. CO基因的调控表达与植物光周期反应[J].
中国农学通报, 2010, 26(2): 116–121.
Wu L C, Chang L L, Chen X, et al. Expression regulation of CONSTANS and plant photoperiod responses[J]. Chinese Agricultural Science Bulletin, 2010, 26(2): 116–121. (in Chinese with English abstract) |
| [18] | Sawa M, Nusinow D A, Kay S A, et al. FKF1 and GIGANTEA complex formation is required for day-length measurement in Arabidopsis[J]. Science, 2007, 318: 261–265. DOI: 10.1126/science.1146994 |
| [19] | Imaizumi T, Kay S A, Schroeder J I. Daily watch on metabolism[J]. Science, 2007, 318: 1730–1731. DOI: 10.1126/science.1151360 |
| [20] | Halabian R, Fathabad M E, Masroori N, et al. Expression and purification of recombinant human coagulation factor Ⅶ fused to a histidine tag using Gateway technology[J]. Blood Transfusion, 2009, 7(4): 305–312. |
| [21] |
盖钧镒, 章元明, 王建康. QTL混合遗传模型扩展至2对主基因+多基因时的多世代联合分析[J].
作物学报, 2000, 26(4): 385–391.
Gai J Y, Zhang Y M, Wang J K. A joint analysis of multiple generations for QTL models extended to mixed two major genes plus polygene[J]. Acta Agronomica Sinica, 2000, 26(4): 385–391. (in Chinese with English abstract) |
| [22] |
郁有健. 大白菜抽薹开花相关基因SNP分析与晚抽薹开花性状QTL定位[D]. 哈尔滨: 东北农业大学, 2010.
Yu Y J. Dissertation for the masteral degree in agricultural SNP analysis of bolting and flowering gene and QTL localization of late-bolting and late-flowering in Chinese cabbage[D]. Harbin:Northeast Agricultural University, 2010(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10224-2010264275.htm |
| [23] | Kim H S, Kim S J, Abbasi N, et al. The DOF transcription factor Dof5.1 influences leaf axial patterning by promoting Revoluta transcription in Arabidopsis[J]. The Plant Journal, 2010, 64(3): 524–535. DOI: 10.1111/tpj.2010.64.issue-3 |
| [24] |
胡娟, 王丽鸳, 韦康, 等. 茶树CsCDF1 基因克隆及表达分析[J].
茶叶科学, 2015, 35(5): 501–511.
Hu J, Wang L Y, Wei K, et al. Cloning and expression analysis of CsCDF1 (Cycling Dof Factor1 ) gene in tea plant(Camellia sinensis)[J]. Journal of Tea Science, 2015, 35(5): 501–511. (in Chinese with English abstract) |
| [25] | Zheng N N, Wang Z W, Wei W Y. Ubiquitination-mediated degradation of cell cycle-related proteins by F-box proteins[J]. International Journal of Biochemistry and Cell Biology, 2016, 73: 99–110. DOI: 10.1016/j.biocel.2016.02.005 |
| [26] | Ho M S, Tsai P I, Chien C T. F-box proteins:the key to protein degradation[J]. Journal of Biomedical Science, 2006, 13: 181–191. DOI: 10.1007/s11373-005-9058-2 |
| [27] | Putterill J, Robson F, Lee K, et al. The CONSTANS gene of Arabidopsis promotes flowering and encodes a protein showing similarities to zinc finger transcription factors[J]. Cell, 1995, 80: 847–857. DOI: 10.1016/0092-8674(95)90288-0 |
| [28] |
彭凌涛. 控制拟南芥和水稻开花时间光周期途径的分子机制[J].
植物生理学通讯, 2006, 42(6): 1021–1031.
Peng L T. Molecular mechanism of flowering time controlling photoperiod pathway in Arabidopsis and rice[J]. Plant Physiology Communications, 2006, 42(6): 1021–1031. (in Chinese with English abstract) |
| [29] | Han S H, Yoo S C, Lee B D, et al. Rice FLAVIN-BINDING, KELCH REPEAT, F-BOX 1(OsFKF1) promotes flowering independent of photoperiod[J]. Plant Cell Environment, 2015, 3: 95–107. |
| [30] | Niwa Y, Ito S, Nakamichi N, et al. Genetic linkages of the circadian clock-associated genes, TOC1, CCA1 and LHY, in the photoperiodic control of flowering time in Arabidopsis thaliana[J]. Plant and Cell Physiology, 2007, 48(7): 925–937. DOI: 10.1093/pcp/pcm067 |




