文章信息
- 文锴, 王远, 胡蝶, 袁敬平, 侯喜林, 李英
- WEN Kai, WANG Yuan, HU Die, YUAN Jingping, HOU Xilin, LI Ying
- 不结球白菜BcOPR3基因的克隆与功能分析
- Cloning and expression analysis of BcOPR3 gene in non-heading Chinese cabbage
- 南京农业大学学报, 2017, 40(5): 804-811
- Journal of Nanjing Agricultural University, 2017, 40(5): 804-811.
- http://dx.doi.org/10.7685/jnau.201612018
-
文章历史
- 收稿日期: 2016-12-11
不结球白菜(Brassica campestris ssp. chinensis Makino)为十字花科芸薹属白菜类蔬菜, 广泛栽培于中国。近年来, 欧美、日本、东南亚等地区和国家也不断进行引种, 不结球白菜逐渐成为世界性蔬菜之一[1]。目前, 不结球白菜生长过程中常常遭受霜霉菌的侵染, 导致其产量下降和品质变差[2]。茉莉酸类化合物(jasmonic acids, JA)在植物生长过程中发挥着重要作用[3]。茉莉酸是植物的内源信号分子, 植物体受到伤害时, 未受伤害的部位可通过它进入警戒状态, 以此来抵御致病菌和昆虫的危害[4-7]。
12-氧-植物二烯酸还原酶(12-oxo-phytodienoic acid reductase, OPR)是茉莉酸生物合成途径的关键酶, 催化12-氧-植物二烯酸(OPDA)还原反应生成茉莉酸化合物[8]。OPR属于古老黄酶(old yellow enzyme, OYE)家族, 且以多基因家族形式存在。在OYE家族中, 拟南芥AtOPR1 首先被发现[9]。基于对底物结合的特异性, 可将OPR蛋白分为两大类:OPRⅠ和OPRⅡ[10-11]。近年来研究发现, 在植物生长的过程中, 茉莉酸(JA)、乙烯、水杨酸(SA)和脱落酸(ABA)信号途径在胁迫反应中是共同作用的[12-18]。其中, 施用外源SA, 可以提高植物次级代谢产物的积累, 诱导植物抗性的产生[15]。茉莉酸参与非生物胁迫的反应, 如低温[7]。OPR基因的功能已经在玉米[19]、番茄[20-21]、水稻[13,22-23]和豌豆[24]中得到验证。在拟南芥中, OPR3的突变体dde1和opr3均缺失合成JA的功能, 这2种突变体均为雄性不育, 喷施JA可恢复育性表型, 通过调控OPR3 基因的表达水平可调节JA的生物合成, 进而调节植物的很多生理过程[8]。然而, 在不结球白菜中, OPR基因的克隆研究尚未见报道。
本研究利用大白菜BrOPR3 (http://brassicadb.org/brad/)比对同源基因设计引物, 从不结球白菜中获得BcOPR3基因, 同时利用RT-qPCR技术研究其在非生物胁迫下的基因表达水平, 旨在为不结球白菜抗逆分子系统和OPR3 对非生物胁迫因子协同响应分子机制的研究提供理论基础。
1 材料与方法 1.1 试验材料与霜霉病菌收集不结球白菜品种‘苏州青’(高抗霜霉病)和‘矮脚黄’(高感霜霉病)由南京农业大学白菜系统生物学实验室提供。挑取2个品种饱满并大小一致的种子, 用蒸馏水冲洗干净, 置于培养皿中催芽48 h左右, 然后在穴盘中播种, 并移至人工气候室。人工气候室设置光照12 h/黑暗12 h, 温度18~24 ℃。白菜类霜霉病菌取自南京农业大学白菜试验田, 要求病叶表面纯净新鲜无杂菌。先用蒸馏水冲洗病叶, 刷洗其叶表层孢子囊, 然后在18~24 ℃黑暗、80%相对湿度中保湿24 h以培养新鲜的孢子囊。将孢子囊放入100 g · L-1二甲基亚砜(DMSO)和5 g · L-1脱脂乳的混合液中, -20 ℃保存, 用于接种。
1.2 BcOPR3基因CDS全长序列的克隆用RNA提取试剂盒(TaKaRa, 大连)分别提取‘苏州青’和‘矮脚黄’4叶1心期叶片的总RNA。使用反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit, Thermo)合成第1链cDNA作为模板扩增基因。利用Primer Premier 5.0软件设计引物, 即BcOPR3 -F和BcOPR3 -R(表 1)。
| 引物 Primer | 序列(5′→3′) Sequence | 用途 Usage |
| BcOPR3 -F/R | ATGGCGGCGCAGGGAAACTCCACGG/TCAGAGGCGAGAAGCTGGAGCCAAG | BcOPR3 基因克隆 Cloning of BcOPR3 gene |
| Cell-F/R | ACGCGTCGACATGGCGGCGCAGGGAAACTCCACG/ CGGAATTCTAGAGGCGAGAAGCTGGAGCCAAGAA | 亚细胞定位 Subcellular localization |
| qRT-F/R | AATCTATTCGGAGGAACAAG/ATTAGGTTGATACAATGGATGA | BcOPR3 实时荧光定量 PCR RT-qPCR of BcOPR3 |
| Actin-F/R | CTCAGTCCAAAAGAGGTATTCT/GTAGAATGTGTGATGCCAGATC | 实时荧光定量内参基因 Reference gene in RT-qPCR |
PCR反应体系:模板1 μL、引物BcOPR3 -F/R各1 μL、ddH2O 14.5 μL、dNTPS混合物2 μL、Prime STAR GXL DNA聚合酶0.5 μL、5×Prime STAR GXL缓冲液5 μL。反应程序:96 ℃ 2 min; 96 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 2 min, 35个循环; 72 ℃ 10 min。产物经10 g · L-1凝胶电泳检测, 并回收目的条带。将回收的片段与pMD19-T载体链接, 转化大肠杆菌, 挑取阳性单克隆, 测序验证。
1.3 BcOPR3基因生物信息学分析用Cluster 1.8和DNAMAN 6.0软件对该基因的核苷酸序列和推导的氨基酸序列进行序列比对。利用MEGA 5.0软件中的邻近相连法(NJ)构建系统进化树, 校验参数BootStrap设定为1 000次。
1.4 BcOPR3亚细胞定位分析在WoLF PSORT(http://www.genscript.com/psort/wolf_psort.html)预测BcOPR3蛋白亚细胞定位。构建BcOPR3与pMDC43的融合表达载体, 通过基因枪轰击洋葱表皮使其进入细胞内部, 经黑暗16 h后在激光共聚焦显微镜下观察。将经黑暗处理的洋葱内表皮置于载玻片上, 在激光共聚焦显微镜下观察并拍照。
1.5 逆境胁迫处理将霜霉病菌(孢子囊1×105 mL-1)接种于4叶1心期‘苏州青’和‘矮脚黄’幼苗叶片背面, 接种后迅速喷雾盖棚保湿, 以蒸馏水为对照。试验重复3次, 每个处理5株。分别于接种后0、4、12、24、48、168、336和504 h采集样品, 将样品用液氮冷冻, 并保存于-80 ℃冰箱。
分别用0.1 μmol · L-1脱落酸(ABA)、50 μmol · L-1茉莉酸(JA)和2 μmol · L-1水杨酸(SA)溶液喷雾处理‘苏州青’叶片, 以乙醇为对照, 接种后于0、4、8、12和24 h采集材料; 在叶片上打3个孔, 作为伤害胁迫, 未受伤害的作为对照, 于0、4、8、12和24 h采集样品; 4 ℃低温和42 ℃高温处理幼苗, 以室温为对照, 于0、4、8、12和24 h收集样品。所有试验均重复3次, 每个处理5株。采集的样品, 保存于-80 ℃冰箱备用。
1.6 实时荧光定量PCR用总RNA提取试剂盒(TIANGEN, 北京)提取不结球白菜叶片总RNA。用反转录试剂盒合成第1链cDNA, 以稀释10倍的cDNA为模板。用Beacon Designer 7软件设计荧光定量试验的特异引物qRT-F/R(表 1)。反应体系:正向引物0.4 μL、反向引物0.4 μL、SYBR GREEN PCR MasterMix 10 μL、模板100 ng。每个处理设置3次生物学重复和3次技术重复。用Rotor-Gene Real-time Analysis Software 6.1和Excel 2007软件分析数据。用2-ΔΔCT法分析BcOPR3的相对表达量, 并计算标准差。
2 结果与分析 2.1 BcOPR3基因在不结球白菜中的克隆与序列分析分别以不结球白菜品种‘苏州青’(高抗霜霉病)和‘矮脚黄’(高感霜霉病)4叶1心期叶片cDNA为模板, 克隆得到相应片段(图 1)。测序结果表明, BcOPR3在2个品种中的序列大小一致。核苷酸和氨基酸序列比对结果表明, BcOPR3在2个品种中序列一致, 其序列与大白菜BrOPR3 序列一致(图 2)。

|
图 1 BcOPR3基因在不结球白菜中的扩增结果 Figure 1 Full cDNA amplification of BcOPR3 in non-heading Chinese cabbage M:DL2000 marker; 1:‘苏州青’‘Suzhouqing’; 2:‘矮脚黄’‘Aijiaohuang’. |

|
图 2 不结球白菜OPR3的核苷酸(A)和氨基酸(B)序列比对 Figure 2 Comparison of OPR3 nucleotide(A)and amino acid(B)sequences of non-heading Chinese cabbage |
在GenBank数据库, 对不结球白菜BcOPR3和其他植物物种的OPR3氨基酸序列进行同源比对, 其中BcOPR3 与甘蓝型油菜(Brassica napus)、马齿苋(Portulaca oleracea)、萝卜(Raphanus sativus)、荠菜(Eutrema salsugineum)、拟南芥(Arabidopsis thaliana)、亚麻荠(Camelina sativa)、高山南芥(Arabis alpina)、蔓花生(Arachis duranensis)、大豆(Glycine max)、美花烟草(Nicotiana sylvestris)、木薯(Manihot esculenta)和赤豆(Vigna angularis)的同源性分别为98%、97%、97%、90%、89%、88%、89%、75%、74%、74%、75%和76%, 表明OPR3 基因序列在进化上具有较高的保守性(图 3)。在系统进化树中, 不结球白菜与油菜均为十字花科芸薹属, 进化关系最相近; 在不同科属间, 不结球白菜BcOPR3与马齿苋科的马齿苋的进化关系较近(图 4)。用NCBI软件分析BcOPR3蛋白二级结构中保守的结构域, 结果(图 5)显示:该蛋白含有1个PLM12411结构域, 属于TIM phosphate binding superfamily。

|
图 3 BcOPR3与其他植物OPR3蛋白同源性比较 Figure 3 Comparison of homology between BcOPR3 and other plant OPR3 proteins |

|
图 4 不结球白菜BcOPR3与其他植物OPR3蛋白的氨基酸序列系统进化树 Figure 4 Phylogenic tree of amino acid sequences of OPR3 proteins in non-heading Chinese cabbage and other plant species |

|
图 5 BcOPR3氨基酸序列的保守结构域 Figure 5 Conserved domains of amino acid sequences of BcOPR3 |
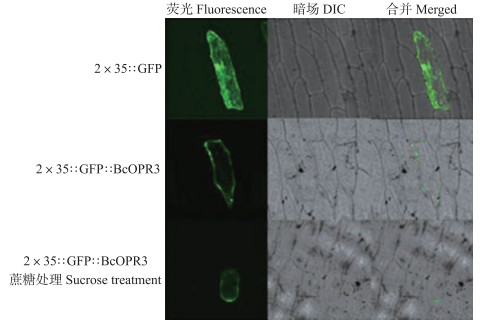
通过软件预测, BcOPR3存在于细胞质中。由图 6可见:BcOPR3的荧光信号全部集中在细胞膜和细胞壁, 通过300 g · L-1蔗糖溶液使其质壁分离后, 观测到荧光信号在细胞膜上, 表明:BcOPR3很有可能在细胞膜上发挥作用。
|
图 6 pMDC43-BcOPR3蛋白在洋葱表皮细胞中的亚细胞定位 Figure 6 Subcellular localization of pMDC43-BcOPR3 protein in the onion epidermis cells |
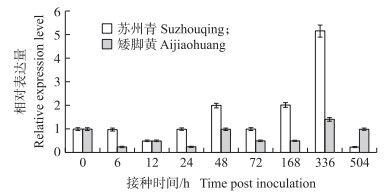
由图 7可见:在霜霉病菌诱导下, 抗病和感病材料中BcOPR3基因表达量均出现2个峰值。侵染‘苏州青’初期, BcOPR3基因在12 h时下调表达, 12~48 h表达量逐渐上升, 48 h时出现第1个峰值, 72 h时再次下调表达, 72~336 h表达量快速上升, 336 h时出现第2个峰值。侵染‘矮脚黄’期间, BcOPR3基因的表达量要低于‘苏州青’且上调表达迟钝, 均处于较低表达水平, 336 h时表达量峰值达到最大。
|
图 7 霜霉病菌侵染条件下不结球白菜叶片中BcOPR3基因的相对表达量 Figure 7 The relative expression level of BcOPR3 gene in leaf of non-heading Chinese cabbage infected by downy mildew |
由图 8可见:‘苏州青’经0.1 μmol · L-1ABA诱导初期, BcOPR3基因在4 h时下调表达, 8 h时表达量迅速上升, 后期稳定在较低水平; ‘苏州青’经50 μmol · L-1JA诱导初期, BcOPR3基因表达量在0~8 h快速上升, 8 h时出现峰值, 12 h时表达量突然下降, 但后期稳定在较高水平; ‘苏州青’经2 μmol · L-1SA诱导初期, BcOPR3基因在4 h时上调表达, 4~8 h稳定在较高水平, 12 h时其表达量突然下降, 且后期稳定在较低水平。

|
图 8 脱落酸(ABA)、茉莉酸(JA)和水杨酸(SA)诱导下不结球白菜‘苏州青’叶片中BcOPR3基因的相对表达量 Figure 8 The relative expression level of BcOPR3 gene in leaf of non-heading Chinese cabbage'Suzhouqing'induced by abscissic acid(ABA), jasmonic acid(JA)and salicylic acid(SA) |
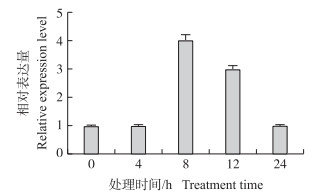
由图 9可见:抗病材料‘苏州青’经机械伤害胁迫后, BcOPR3基因的表达量在8 h突然上升且达到峰值, 之后呈逐渐下调趋势。
|
图 9 伤害诱导下不结球白菜‘苏州青’叶片中BcOPR3基因的相对表达量 Figure 9 The relative expression level of BcOPR3 gene in leaf of non-heading Chinese cabbage'Suzhouqing'induced by wounding |
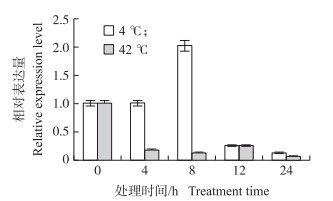
由图 10可见:抗病材料‘苏州青’经冷害处理初期, BcOPR3基因的表达量在8 h时表达量突然上升, 之后下调表达, 呈先升后降规律; 经热激处理, BcOPR3基因均下调表达, 表明热激处理抑制BcOPR3基因的表达。
|
图 10 冷害(4 ℃)和热激(42 ℃)诱导下不结球白菜‘苏州青’叶片中BcOPR3基因的相对表达量 Figure 10 The relative expression level of BcOPR3 gene in leaf of non-heading Chinese cabbage'Suzhouqing'induced by cold(4 ℃)and heat(42 ℃)shock |
茉莉酸是植物对生物和非生物胁迫的重要调节剂, 并在植物生长发育中具有重要作用。研究表明OPR3 的转录受JA诱导, 且对JA的合成过程具有重要作用[25-26]。近年来研究表明, JA可以调控植物生殖器官的发育[24]。本研究在不结球白菜中克隆了一个与茉莉酸生物合成途径相关的关键酶基因OPR。
当植物受到病原菌胁迫时, 体内茉莉酸的含量明显增加[8]。茉莉酸可以激活许多抗逆基因的表达, 如硫素[27]、渗透蛋白[28]、核糖体失活蛋白[29]等。茉莉酸可以提高植物过氧化氢酶(CAT)和超氧化物歧化酶(SOD)的活性[30], 从而调节植物的抗逆性。本研究中, 霜霉病菌侵染植株后, 抗病自交系‘苏州青’叶片中BcOPR3基因的表达量及上调速度均大于感病自交系‘矮脚黄’, 表明BcOPR3在JA合成过程中发挥重要作用, 可推断其在抗病自交系中响应JA的能力强于感病自交系。结合BcOPR3具有清除过氧化氢的作用, 推断抗病自交系中清除过氧化氢的能力大于感病自交系。多余过氧化氢的清除有效缓解了细胞的氧化伤害, 减少了病斑的发生。在植物生长的过程中, JA、SA和ABA信号途径在胁迫反应中是共同作用的[12-16]。大量研究表明, 植物防卫反应与胁迫反应之间存在交互作用, 在植物对病原应答的基因中包含一些伤害、干旱、冷害、热激、高盐以及其他非生物胁迫基因[31]。在正常情况下, “胁迫基因”保持沉默状态, 但遭受到胁迫时则迅速表达, 参与胁迫反应[32]。本研究发现, JA、SA、ABA、机械伤害、冷害和热激胁迫可明显抑制或诱导BcOPR 3的表达。上述结果表明, BcOPR3参与了多种生物胁迫反应, 由于非生物胁迫和生物胁迫存在许多相同机制, 由此推测, BcOPR3 具有参与生物和非生物胁迫反应的作用。因此, BcOPR3基因在植物防御反应、抵抗病原体侵害方面可能具有重要作用。
总之, 不结球白菜BcOPR3基因针对不同非生物胁迫因子具有不同的应答模式, 探究其所涉及的信号途径对不结球白菜今后的育种及生产应用具有重要意义。
| [1] | 侯喜林. 不结球白菜育种研究新进展[J]. 南京农业大学学报, 2003, 26(4): 111–115. DOI: 10.7685/j.issn.1000-2030.2003.04.026 |
| [2] |
刘世拓, 肖栋, 许玉超, 等. 不结球白菜过氧化还原蛋白基因Brc2-Cys Prx的克隆和表达分析[J].
南京农业大学学报, 2017, 40(1): 40–47.
Liu S T, Xiao D, Xu Y C, et al. Clone and expression analysis of Brc2-Cys Prx gene from non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2017, 40(1): 40–47. DOI: 10.7685/jnau.201603040 (in Chinese with English abstract) |
| [3] |
蒋科技, 皮妍, 侯嵘. 植物内源茉莉酸类物质的生物合成途径及其生物学意义[J].
植物学报, 2010, 45(2): 137–148.
Jiang K J, Pi Y, Hou R, et al. Jasmonate biosynthetic pathway:its physiological role and potential application in plant secondary metabolic engineering[J]. Chinese Bulletin of Botany, 2010, 45(2): 137–148. (in Chinese with English abstract) |
| [4] | Liechti R, Farmer E E. The jasmonatepathway[J]. Science, 2002, 296(5573): 1649–1650. DOI: 10.1126/science.1071547 |
| [5] | Zavala J A, Baldwin I T. Jasmonic acid signaling and herbivore resistance traits constrain regrowth after herbivore attack in Nicotiana attenuata[J]. Plant Cell Environ, 2006, 29: 1751–1760. DOI: 10.1111/pce.2006.29.issue-9 |
| [6] | Kniskern J M, Traw M B, Bergelson J. Salicylic acid and jasmonic acid signaling defense pathways reduce natural bacterial diversity on Arabidopsis thaliana[J]. Mol Plant Microbe, 2007, 20: 1512–1522. DOI: 10.1094/MPMI-20-12-1512 |
| [7] | Hu Y R, Jiang L Q, Wang F, et al. Jasmonate regulates the inducer of cbf expression-C-repeat binding factor/DRE binding factor 1 cascade and freezing tolerance in Arabidopsis[J]. Plant Cell, 2013, 25: 2907–2924. DOI: 10.1105/tpc.113.112631 |
| [8] | Strassner J, Schaller F, Frick U B, et al. Characterization and cDNA-microarray expression analysis of 12-oxophytodienoate reductases reveals differential roles for octadecanoid biosynthesis in the local versus the systemic wound response[J]. The Plant Journal, 2002, 32: 585–601. DOI: 10.1046/j.1365-313X.2002.01449.x |
| [9] | Sobajima H, Takeda M, Sugimori M, et al. Cloning and characterization of a jasmonic acid responsive gene encoding 12-oxophytodienoic acid reductase in suspension-cultured rice cells[J]. Planta, 2003, 216: 692–698. |
| [10] | Schaller F, Hennig P, Weiler E W. 12-oxophytodienoate-10, 11-reductase:occurrence of two isoenzymes of different specificity against stereoisomers of 12-oxophytodienoicn acid[J]. Plant Physiol, 1998, 118: 1345–1351. DOI: 10.1104/pp.118.4.1345 |
| [11] | Schaller F, Biesgen C, Mussig C, et al. 12-oxophytodienoate reductase 3(OPR3) is the isoenzyme involved in jasmonate biosynthesis[J]. Planta, 2000, 210: 979–984. DOI: 10.1007/s004250050706 |
| [12] | Strassner J, Furholz A, Macheroux P, et al. A homolog of old yellow enzyme in tomato:spectral properties and substrate specificity of the recombinant protein[J]. J Biol Chem, 1999, 274: 35067–35073. DOI: 10.1074/jbc.274.49.35067 |
| [13] | Agrawa G K, Tamogami S, Han O, et al. Rice octadecanoid pathway[J]. Biochem Biophys Res Commun, 2004, 317: 1–15. DOI: 10.1016/j.bbrc.2004.03.020 |
| [14] | McConn M, Creelman R A, Bell E, et al. Jasmonate is essential for insect defense in Arabidopsis[J]. Proc Natl Acad Sci USA, 1997, 94: 5473–5477. DOI: 10.1073/pnas.94.10.5473 |
| [15] |
刘丽, 李姿, 马雪莲, 等. 外源水杨酸处理对活血丹中次生代谢产物积累的影响[J].
南京农业大学学报, 2016, 39(3): 379–385.
Liu L, Li Z, Ma X L, et al. Effect of salicylic acid on the accumulation of bioactive compounds in Glechoma longituba[J]. Journal of Nanjing Agricultural University, 2016, 39(3): 379–385. DOI: 10.7685/jnau.201508041 (in Chinese with English abstract) |
| [16] | Reymond P, Weber H, Damond M, et al. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis[J]. Plant Cell, 2000, 12: 707–720. DOI: 10.1105/tpc.12.5.707 |
| [17] | Schenk P M, Kazan K, Wilson I, et al. Coordinated plant defense responses in Arabidopsis revealed by microarray analysis[J]. Proc Natl Acad Sci USA, 2000, 97: 11655–11660. DOI: 10.1073/pnas.97.21.11655 |
| [18] | Hermsmeier D, Schittko U, Baldwin I T. Molecular interactions between the specialist herbivore Manduca sexta(Lepidoptera, Sphingidae)and its natural host Nicotiana attenuata.Ⅰ. Large scale changes in the accumulation of growth-and defense-related plant mRNAs[J]. Plant Physiol, 2001, 125: 683–700. DOI: 10.1104/pp.125.2.683 |
| [19] | Zhang J L, Carl S, Nasser Y, et al. Genomic analysis of the 12-oxo-phytodienoic acid reductase gene family of Zea mays[J]. Plant Mol Biol, 2005, 59: 323–343. DOI: 10.1007/s11103-005-8883-z |
| [20] | Matsui H, Nakamura G, Ishiga Y, et al. Structure and expression of 12-oxophytodienoate reductase(subgroupⅠ)genes in pea, and characterization of the oxidoreductase activities of their recombinant products[J]. Mol Genet Genomics, 2004, 271: 1–10. DOI: 10.1007/s00438-003-0948-6 |
| [21] | Breithaupt C, Kurzbauer R, Lilie H, et al. Crystal structure of 12-oxophytodienoate reductase 3 from tomato:self-inhibition by dimerization[J]. Proc Natl Acad Sci USA, 2006, 103: 14337–14342. DOI: 10.1073/pnas.0606603103 |
| [22] | Sobajima H, Takeda M, Sugimori M, et al. Cloning and characterization of a jasmonic acid-responsive gene encoding 12-oxophytodienoic acid reductase in suspension-cultured rice cells[J]. Planta, 2003, 216: 692–698. |
| [23] | Agrawal G K, Jwa N S, Shibato J, et al. Diverse environmental cues transiently regulate OsOPR1 of the"octadecanoid pathway"revealing its importance in rice defense/stress and development[J]. Biochem Biophys Res Commun, 2003, 310: 1073–1082. DOI: 10.1016/j.bbrc.2003.09.123 |
| [24] | 张占芳, 李睿, 仲天庭, 等. 水稻细胞质雄性不育系和保持系对外源茉莉酸响应以及内源茉莉酸合成的差异[J]. 南京农业大学学报, 2014, 37(6): 7–12. DOI: 10.7685/j.issn.1000-2030.2014.06.002 |
| [25] | Mussig C, Biesgen C, Lisso J, et al. A novel stress-inducible 12-oxophytodienoate reductase from Arabidopsis thaliana provides a potential link between brassinosteroid-action and jasmonic acid synthesis[J]. J Plant Physiol, 2000, 157: 143–152. DOI: 10.1016/S0176-1617(00)80184-4 |
| [26] | Halim V A, Altmann S, Ellinger D, et al. PAMP-induced defense responses in potapo require both salicylic acid and jasmonic acid[J]. Plant Journal, 2009, 57: 230–242. DOI: 10.1111/tpj.2009.57.issue-2 |
| [27] | Becker W, Apel K. Isolation and characterization of a cDNA encoding a naval Jasmonate-induced protein of barley(Hordeumvu lgare L.)[J]. Plant Molecular Biology, 1992, 19: 1065–1067. DOI: 10.1007/BF00040538 |
| [28] | Xu Y, Chang P F, Liu D, et al. Plant defense genes are synergistically induced byethylene and methyl jasmonate[J]. Plant Cell, 1994, 6: 1077–1085. DOI: 10.1105/tpc.6.8.1077 |
| [29] | Chaudhry B, Mueller U F, Cameron M V, et al. The barley 60 kD jasmonate-induced protein(JIP60) isa noval ribosome-inactivating protein[J]. Plant Journal, 1994, 6: 815–824. DOI: 10.1046/j.1365-313X.1994.6060815.x |
| [30] | Wang S Y. Methyl jasmonate reduces water stress in strawberry[J]. Journal of Plant Growth Regulation, 1999, 18(3): 127–134. DOI: 10.1007/PL00007060 |
| [31] | Dombrowski J M. Salt stress activation of wound-related genes in tomato plants[J]. Plant Physiol, 2003, 132: 2098–2107. DOI: 10.1104/pp.102.019927 |
| [32] | Shinozake Y, Yamaguchi S K. Molecular responses to dehydration and low temperature:differences and cross-talk between two stress signalling pathways[J]. Current Opinion in Plant Biology, 2000, 3: 217–223. DOI: 10.1016/S1369-5266(00)00067-4 |




