文章信息
- 汪国湘, 蔡跃, 尤小满, 燕海刚, 王亮, 金洁, 张文伟, 江玲
- WANG Guoxiang, CAI Yue, YOU Xiaoman, YAN Haigang, WANG Liang, JIN Jie, ZHANG Wenwei, JIANG Ling
- 水稻胚乳突变体b140的表型分析及基因克隆
- Phenotyping and gene cloning of a floury endosperm mutant b140 in rice
- 南京农业大学学报, 2017, 40(5): 780-788
- Journal of Nanjing Agricultural University, 2017, 40(5): 780-788.
- http://dx.doi.org/10.7685/jnau.201703043
-
文章历史
- 收稿日期: 2017-03-31
水稻胚乳中含有淀粉、蛋白质、脂肪、无机盐和维生素等物质。含水量为14%的精米粉中总淀粉占76.7%~78.4%, 蛋白质占6.3%~7.8%, 而其他营养物质只占不到4%[1]。胚乳中淀粉的结构与含量直接影响稻米的品质, 且受遗传机制与环境条件的共同调控[2-3]。
高等植物中已报道克隆多种淀粉合成酶的基因。根据氨基酸序列的差异, 淀粉合成酶分成淀粉颗粒合成酶(granule-bound starch synthase, GBSS)和4类可溶性淀粉合成酶(starch synthases, SS)[4]。GBSS分为亚型Ⅰ和Ⅱ两种, GBSSⅠ主要存在于贮藏组织中, 而GBSSⅡ主要存在于非贮藏组织中, 它们都负责直链淀粉链的延伸; SS有4类(SSⅠ~SSⅣ), 在水稻中存在8种同工酶, SSⅠ1种(OsSSI), SSⅡ3种(OsSSⅡa、OsSSⅡb和OsSSⅡc), SSⅢ 2种(OsSSⅢa和OsSSⅢb), SSⅣ 2种(OsSSⅣa和OsSSⅣb), 分别负责支链淀粉中不同长短链的合成, 且这些SS之间存在功能冗余, 其中OsSS Ⅲ a基因突变造成籽粒心白的表型[5]。同时, 腺苷二磷酸葡萄糖(adenosine diphosphate glucose, ADPG)是淀粉合成的前体, 腺苷磷酸葡萄糖焦磷酸化酶(adenosine diphosphoglucose pyrophosphprylase, AGPase)催化ADPG的合成, 该基因突变体的籽粒表现为粉质、皱缩[6]。此外, 淀粉分支酶(starch branching enzyme, SBE)是支链淀粉合成中的重要酶, RNA干扰沉默水稻SBE, 使得籽粒中直链淀粉含量升高[7]。
由于水稻淀粉合成途径突变体的胚乳常出现粉质表型, 因此该类粉质突变体的发掘是研究水稻淀粉合成机制的一种重要手段。目前已报道的水稻粉质胚乳突变体有7个, 即flo1~flo7 [8-14], 突变基因分别定位于不同的染色体。此外, Matsushima等[15]分离鉴定了5个淀粉颗粒异常的突变体(substandard starch grain, ssg), 分别为ssg1~ssg5, 突变体的胚乳也表现为粉质, 其中ssg1、ssg2和ssg3与SBE Ⅱ b突变体为同一个位点, ssg4突变体的淀粉含量显著降低[16]。Matsushima等[17]又报道ssg6 突变体中直链淀粉含量降低, 可溶性糖含量较野生型显著升高。这些突变体均表现出淀粉的不正常积累, 但它们如何影响淀粉积累的作用机制还不清楚。
目前, 水稻胚乳中淀粉合成和调控的分子机制尚未完全阐明, 挖掘更多的粉质突变体, 有助于进一步解析胚乳淀粉形成的机制, 为改良稻米品质奠定基础。在本研究中, 我们筛选获得1个水稻粉质胚乳突变体b140, 通过图位克隆和测序发现b140中SSG4基因发生点突变。进一步分析b140籽粒的理化性质以及淀粉结构, 比较不同发育时期胚乳中淀粉合成相关基因的表达情况, 测定AGPase和尿苷磷酸葡萄糖焦磷酸化酶(uridine diphosphoglucose pyrophosphprylase, UGPase)的相对酶活性, 旨在探讨SSG4 基因突变对胚乳淀粉合成的影响。
1 材料与方法 1.1 材料从粳稻品种‘W017’经N-甲基亚硝基脲诱变获得的M2代群体中, 筛选获得粉质胚乳突变体b140。b140与籼稻品种‘南京11’杂交, 产生F1代, 在F1代植株上收获F2群体, 在F2群体中挑选极端个体进行图位克隆。野生型和突变体完全成熟后, 随机选取20株, 考查株高、主穗长、每穗粒数、结实率等农艺性状。每组重复3次, 取平均值。野生型和突变体于2016年正季种植于南京农业大学牌楼实验基地。
1.2 成熟种子直链淀粉、总淀粉和可溶性糖含量的测定将成熟种子去壳、研磨成精米后打成精米粉进行测定。直链淀粉含量测定按照农业部标准《米质测定方法:NY147—1988》进行, 总淀粉含量使用Megazyme总淀粉测定试剂盒(爱尔兰Megazyme国际有限公司)测定。可溶性糖含量使用D-葡萄糖/D-果糖/蔗糖检测试剂盒(北京泰乐祺科技有限公司)测定。每个样品重复3次, 取平均值。
1.3 灌浆期干物质积累量的测定选取灌浆期内5个时间点的100粒种子, 以种子的干质量绘制灌浆期干物质积累曲线, 具体方法如下:开花期间, 选取野生型和b140当天开花且长势一致的颖花进行标记, 从开花后5~30 d 16:00取样, 每隔5 d取1次。小穗置于105 ℃烘箱中30 min杀青处理后, 将烘箱调至70 ℃, 烘干72 h到质量恒定, 剥去颖壳后, 随机取100粒称取质量, 重复3次。
1.4 米粉的尿素膨胀体积测定配制0~9 mol · L-1尿素溶液, 均用醋酸调节pH值至6.0。称量20 mg米粉, 加入1.5 mL EP管中, 分别向每个EP管加入不同浓度的尿素溶液1 mL, 每个浓度设置3个重复。混合均匀后在25 ℃、200 r · min-1振荡24 h。室温、8 000 g离心20 min, 静置1 h。淀粉颗粒在尿素中的溶解度用膨胀体积来衡量, 淀粉颗粒的膨胀体积=总体积(1 mL)-上清液的体积。
1.5 成熟种子横切面扫描电镜观察分别取野生型和突变体成熟种子, 从中间部分横切制成样品, 用3%的戊二醛溶液室温浸泡3 h, 再用0.1 mol · L-1磷酸钠溶液(pH6.8) 清洗3~5次, 每次15 min; 用2%的四氧化锇溶液4 ℃固定过夜, 再用0.1 mol · L-1的磷酸钠溶液(pH6.8) 清洗3~4次, 每次15 min; 用70%、80%、95%、100%乙醇溶液逐级脱水, 每次5 min, 用乙醇-异戊基醋酸(体积比为1 : 3) 混合液浸泡1 h, 取出干燥, 利用真空镀膜仪对横断面镀金, 用日立S-3000N型扫描电镜在20 kV加速电压下对稻米横截面的不同部位进行观察和拍照。
1.6 b140基因的图位克隆b140与‘南京11’F2种子, 去壳后挑取其中与突变体b140表型一致的F2种子, 浸种48 h后置于30 ℃黑暗培养箱中催芽24 h, 将露白的种子移至土壤中生长, 待幼苗长至7~8 cm时, 提取DNA进行基因精细定位。利用本实验室已有的SSR和Indel标记, 用44个极端个体进行初步的连锁分析。确定连锁区间后扩大F2群体, 同时开发标记, 缩小定位区间, 标记的开发基于Gramene网站和Primer Premier 5.0软件, 测序由南京杰李公司完成。基因组DNA采用CTAB法提取。10 μL PCR扩增体系如下:2 μL DNA模板(约100 ng), 前、后引物(均为0.2 μmol · L-1)各1 μL, 1 μL dNTP(0.5 mmol · L-1), 1.2 μL 10×缓冲液(含Mg2+)和0.2 μL Taq DNA聚合酶(5 U · μL-1), 用ddH2O补足10 μL。PCR程序如下:94 ℃预变性5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 40 s, 35个循环; 72 ℃ 10 min, 4 ℃下保存。PCR产物采用80 g · L-1聚丙烯酰胺凝胶电泳, 银染显色。所有定位引物如表 1所示。
| 标记Markers | 正向引物序列(5′→3′)Forward primer sequence | 反向引物序列(5′→3′)Reverse primer sequence | 物理位置/bp Physical location |
| RM1331 | CACCAGCTTCATGCATGC | AGCACTCAACTGATGCAGTG | 1 669 139 |
| Indel1-3 | GGGAAATTTGGGAGGAAGAC | CGAGCAAGCTACCCGAATTA | 5 299 180 |
| Indel1-4 | CAGCATACAGTACGCATCATCA | GCTCGTATCTCGATGAGTCCA | 7 803 224 |
| 01-108 | CAAGACGAGGTAACACGC | GGGCAGCAACAGAAGATG | 2 155 267 |
| RM1329 | GAGCTCAATCGAATCTAGACC | ATTGACATTCCTTTGCTTTG | 3 944 847 |
| RM220 | GGAAGGTAACTGTTTCCAAC | GAAATGCTTCCCAAATGTCT | 4 424 392 |
| RM283 | GTCTACATGTACCCTTGTTGGG | CGGCATGAGAGTCTGTGATG | 4 887 049 |
| 01-109 | CAAGTGGATGCGGGAAAT | GGGCTGGCGTGTAGGATA | 4 052 832 |
| K2 | TGTGCAAGTAGTCTTCTGCG | ACTGCCTAGTCGATCCGTC | 4 102 034 |
| K4 | CTCCTTGTGTCATGTGCTGG | GACTGTTGCCTTAAATTCCACA | 4 158 535 |
| K5 | TGGTCTTGTTTACATCCCAACA | ACTGTAGCACCACATTGTCA | 4 202 202 |
| K7 | CCACTGCTCCGAGTACTCTT | TTTGCCTCTGCTGTGCATTT | 4 334 633 |
2016年正季取开花后6、9、12 d未成熟种子, 去壳后放入1.5 mL的EP管中, 在-80 ℃条件下保存备用。使用TIANGEN公司的植物总RNA提取试剂盒提取RNA, 反转录得到cDNA后使用SYBR Premix Ex TaqTM(TaKaRa)试剂盒, 在ABI PRISM 7500HT上扩增, 进行实时定量PCR。反应体系包括:1 μL cDNA模板, 10 μL 2×SYBR Premix Ex Taq Ⅱ, 1.2 μL 10 μmol · L-1 PCR正向引物, 1.2 μL 10 μmol · L-1 PCR反向引物, 用ddH2O补足至20 μL。反应程序采用三步法:第一步95 ℃起始变性15 s; 第二步扩增反应, 95 ℃ 5 s, 60 ℃ 34 s, 40个循环; 第三步熔解曲线反应, 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s, 60 ℃ 15 s。用2-ΔΔCT法对实时定量PCR结果进行分析, 以水稻Ubiquitin(UBQ)基因作为内参。所有定量引物如表 2所示。
| 基因Genes | 正向引物序列(5′→3′)Forward primer sequence | 反向引物序列(5′→3′)Reverse primer sequence |
| ISA3 | ACAGCTTGAGACACTGGGTTGAG | GCATCAAGAGGACAACCATCTG |
| BE Ⅰ | TGGCCATGGAAGAGTTGGC | CAGAAGCAACTGCTCCACC |
| BEⅡa | CAGAAGCAACTGCTCCACC | GCGCAACATAGGATGGGTTT |
| BEⅡb | ATGCTAGAGTTTGACCGC | AGTGTGATGGATCCTGCC |
| AGPS2b | AACAATCGAAGCGCGAGAAA | GCCTGTAGTTGGCACCCAGA |
| AGPL2 | AGTTCGATTCAAGACGGATAGC | CGACTTCCACAGGCAGCTTATT |
| SSⅠ | GGGCCTTCATGGATCAACC | CCGCTTCAAGCATCCTCATC |
| SSⅡa | GCTTCCGGTTTGTGTGTTCA | CTTAATACTCCCTCAACTCCACCAT |
| SSⅡb | TAGGAGCAACGGTGGAAGTGA | GTGAACGTGAGTACGTGACCAAT |
| SSⅢa | GCCTGCCCTGGACTACATTG | GCAAACATATGTACACGGTTCTGG |
| GBSSⅠ | AACGTGGCTGCTCCTTGAA | TTGGCAATAAGCCACACACA |
| GBSSⅡb | AGGCATCGAGGGTGAGGAG | CCATCTGGCCCACATCTCTA |
AGPase和UGPase的活性测定参照韩小花[18]的方法。分别取10粒野生型和突变体开花后9 d的水稻种子, 剥壳后加液氮进行研磨, 将粉末置于2.0 mL的EP管中, 按0.1 g · mL-1的比例加入提取液, 13 000 r · min-1、4 ℃离心10 min, 取上清液用于酶活性测定试验。AGPase酶活性测定的操作步骤:在1.5 mL EP管中分别加入100 μL ADPG(14 mmol · L-1)、50 μL MgCl2(50 mmol · L-1)、700 μL Hepes(N-2-hydroxyethylpiperazine-N-ethane-sulphonicacid)缓冲液和20 μL粗酶提取液; 振荡摇匀后30 ℃预热10 min, 然后加入100 μL的PPi(sodium pyrophosphate)(20 mmol · L-1)在30 ℃的条件下反应15 min, 再在沸水中煮1 min, 终止反应, 冷却至室温。最后再加100 μL NADP(nicotinamide adenine dinucleotide phosphate)(20 mmol · L-1)、1.5 U的磷酸葡萄糖变位酶、1.375 U的葡萄糖-6-磷酸脱氢酶和300 μL的Hepes缓冲液, 30 ℃水浴10 min, 用分光光度计测定D340。UGPase活性的测定参照AGPase的测定方法。100 mL提取液的配方:50 mmol · L-1 Hepes, 2 mmol · L-1 MgCl2, 50 mmol · L-1 β-巯基乙醇, 12.5%甘油。1 mol · L-1Hepes缓冲液配方:23.8 g Hepes溶于90 mL的水, 再用2 mol · L-1的NaOH调pH值至7.4~7.5, 定容至100 mL。
2 结果与分析 2.1 b140表型分析野生型成熟种子的胚乳透明, 横断面致密均匀(图 1-A、C); b140成熟种子胚乳不透明, 横断面呈粉质(图 1-B、C)。

|
图 1 野生型与b140成熟籽粒表型 Figure 1 Phenotype of wild type(WT)and b140 mature seeds |
b140成熟种子的千粒质量、粒宽和粒厚均显著低于野生型, 但粒长没有显著的差异, b140的株高、主穗长、每穗粒数、结实率等农艺性状与野生型相比均无显著差异(表 3)。
| 材料 Materials |
株高/cm Plant height |
主穗长/cm Length of panicle |
每穗粒数 Grains per panicle |
粒长/mm Length of grain |
粒宽/mm Width of grain |
粒厚/mm Thickness of grain |
千粒质量/g 1 000-grain weight |
结实率/% Seed setting rate |
| WT | 120.8±6.7 | 23.2±1.5 | 130.6±14.0 | 6.7±0.4 | 3.2±0.2 | 2.3±0.01 | 23.8±0.3 | 89.3±5.4 |
| b140 | 121.6±5.8 | 23.0±2.7 | 128.5±15.7 | 6.7±0.3 | 3.0±0.2* | 2.2±0.02* | 21.0±0.1* | 88.9±4.3 |
| Note:*P < 0.05. The same as follows. | ||||||||
灌浆动态分析的结果表明:在开花10 d后, 野生型和b140干物质出现明显差异, 并在开花后15 d时, 差异最大。在灌浆后期两者间的差异不明显(图 2)。
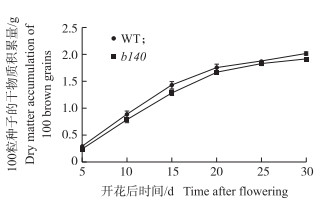
|
图 2 野生型与b140的干物质积累量 Figure 2 Dry matter accumulation of WT and b140 |
b140成熟籽粒的总淀粉含量和直链淀粉含量分别为野生型的94%和91%, 显著低于野生型(P < 0.05)。b140成熟籽粒的可溶性糖含量极显著高于野生型(P < 0.01), 其中葡萄糖含量较野生型增加了28.1%, 果糖含量增加了84.6%, 蔗糖含量增加了195%(表 4)。
| 材料 Materials |
直链淀粉含量/% Amylose content |
总淀粉含量/% Total starch content |
葡萄糖含量/(mg·g-1) Glucose content |
果糖含量/(mg·g-1) Fructose content |
蔗糖含量/(mg·g-1) Sucrose content |
| WT | 15.4±0.2 | 80.3±1.3 | 0.108±0.011 | 0.012±0.002 | 0.101±0.013 |
| b140 | 14.1±0.3* | 75.8±0.3* | 0.138±0.009** | 0.022±0.001** | 0.297±0.012** |
| Note:* *P < 0.01. The same as follows. | |||||
对b140和野生型种子的横断面进行扫描电镜观察, 发现野生型籽粒横断面的淀粉颗粒为多面体, 排列紧密(图 3-A、B、C); 而突变体籽粒横断面的淀粉颗粒多呈球形或不规则状, 排列疏松(图 3-D、E、F)。

|
图 3 野生型和b140胚乳中淀粉颗粒结构 Figure 3 Structure of starch granules in the endosperm of WT and b140 A, B, C:野生型; D, E, F:b140。A, D:胚乳横断面, 标尺=1 mm。B, E:胚乳中心区域(红色矩形内), 标尺=10 μm。C, F:胚乳边缘区域(蓝色矩形内), 标尺=10 μm。 A, B, C:Wild type; D, E, F:b140. A, D:Endosperm cross-section, bar=1 mm. B, E:The central area of mature endosperm from the cross-sections in A and D was indicated by a red square, bar=10 μm. C, F:The outer portion of mature endosperm from the cross-sections in A and D was indicated by a blue square, bar=10 μm. |
从图 4可见:在低浓度尿素溶液(0~3 mol · L-1)中, b140和野生型米粉的膨胀体积没有变化; 随着尿素浓度的逐渐增大, b140和野生型米粉的膨胀体积均逐渐变大; 在5 mol · L-1时两者的差异显著; 在高浓度尿素溶液(9 mol · L-1)中, 两者几乎没有差异。

|
图 4 尿素浓度对野生型和b140米粉膨胀体积的影响 Figure 4 Effects of the urea concentration on swelling volume of powered starch from WT and b140 |
将b140与‘南京11’杂交, 杂种F1自交产生F2群体, 统计F2群体中正常胚乳和粉质胚乳数并进行χ2测验。结果表明, F2群体中正常胚乳与粉质胚乳的分离比符合3 : 1, 说明该表型受到1对隐性基因控制(表 5)。
| 胚乳表型 Endosperm phenotype | 观察值 Observation | 理论数 Theory | χ2 | χ(0.05, 1)2 |
| 正常 Normal | 871 | 847.5 | 0.624 | |
| 粉质 Floury | 259 | 282.5 | 1.872 | |
| 总数 Total | 1 130 | 1 130 | 2.496 | 3.841 |
在b140与‘南京11’F2群体中挑选与b140表型一致的极端个体进行基因定位。首先用44个极端个体将该基因连锁在第1号染色体短臂上(图 5-A), 随后扩大定位群体, 最终利用950个粉质极端个体将基因定位在标记k2和k4之间内, k2处有1个交换, k4处有2个交换, 但均在SSG4 处发生共分离, 该区间物理距离为56 kb(图 5-B)。根据水稻数据库(http://rice.plantbiology.msu.edu/ )数据, 该区间内有8个预测的开放读码框(open reading frame, ORF)(图 5-C)。对b140该区域片段进行测序发现, 只有ORF6(Os01g0179400) 在其编码区第13个外显子上发生了突变(C变成T), 导致脯氨酸(CCG)变成丝氨酸(TCG)(图 5-D)。查阅文献[14]发现, Os01g0179400影响质体的发育, 推测该基因突变造成了粉质的表型。
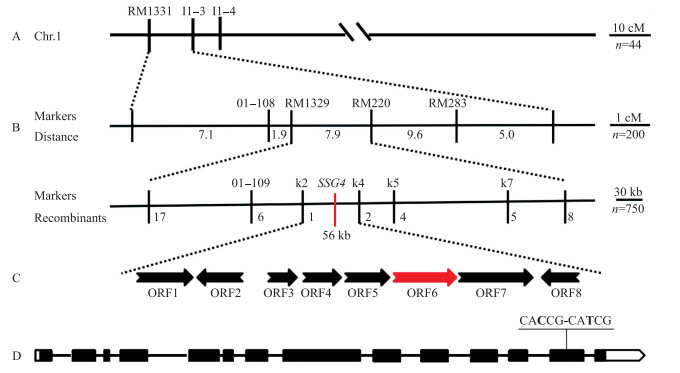
|
图 5 b140突变基因的图位克隆 Figure 5 Map-based cloning of the mutated gene from b140 A:b140基因与标记RM1331和I1-3连锁; B:利用950个极端个体将b140基因精细定位在56 kb区间内; C:b140候选基因分析(红色箭头表示候选基因); D:突变体Os01g0179400中发生单碱基替换(红色标出), Os01g0179400由14个外显子(黑色方框表示)和13个内含子组成。 A:b140 was linked with markers RM1331 and I1-3;B:b140 was located in a 56 kb region based on 950 individuals; C:The red arrow represents the candidated gene for b140; D:A single nucleotide substitution in Os01g08420 (in red)which is composed of 14 exons(filled box)and 13 introns. |
花后6、9和12 d, b140淀粉合成相关基因SS Ⅰ、SS Ⅱ a、SS Ⅱ b、SS Ⅲ a、BE Ⅰ、BE Ⅱ a、BE Ⅱ b、GBSS Ⅰ、GBSS Ⅱ、AGPL 2、AGPS2b、ISA3的表达量均低于野生型。与野生型相比, b140淀粉合成相关基因SS Ⅱ b、BE Ⅰ、BE Ⅱ a、GBSS Ⅱ、ISA 3 的表达量在开花后9 d时差异最大, SS Ⅰ、SS Ⅱ a、SS Ⅲ a、BE Ⅱ b、GBSS Ⅰ、AGPL 2、AGPS2 b的表达量在开花后12 d时差异最大(图 6), 说明灌浆时期b140中淀粉合成相关基因的表达量均出现不同程度的下调。
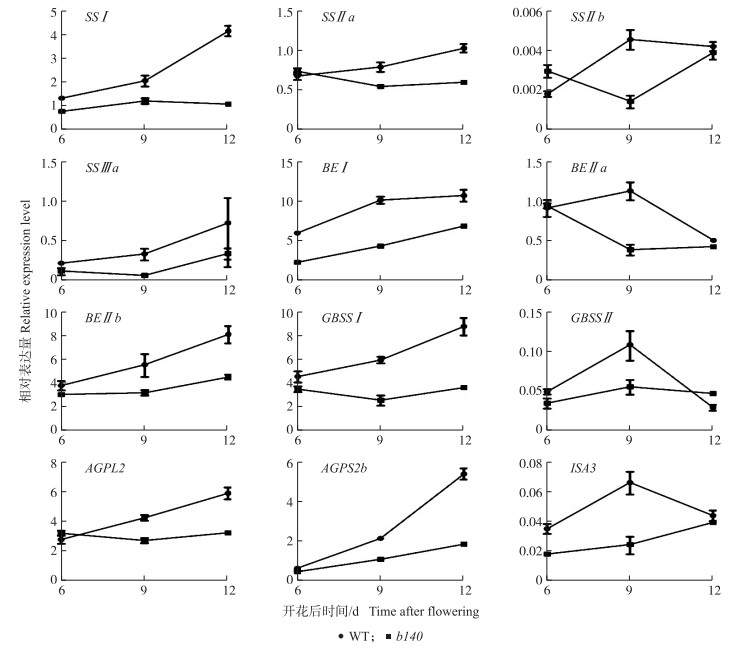
|
图 6 野生型和b140胚乳发育过程中淀粉合成相关基因表达量 Figure 6 Expression levels of starch synthesis genes during seed development in WT and b140 |
花后9 d, b140中AGPase的活性较野生型极显著下降, 而UGPase的活性较野生型下降不显著(图 7)。
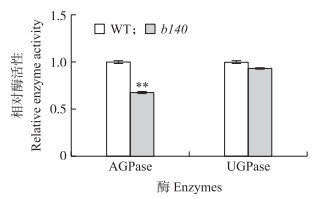
|
图 7 野生型和b140发育胚乳中AGPase和UGPase的相对酶活性 Figure 7 Relative activities of AGPase and UGPase in developing endosperm of WT and b140 |
在籽粒灌浆时期, 淀粉和贮藏蛋白快速积累, 如果淀粉或蛋白积累相关基因发生突变, 均可能造成粉质胚乳表型。例如:AGPL2 突变产生粉质胚乳和皱缩籽粒[6]; 谷蛋白前体增加突变体gpa1、gpa2、gpa3胚乳均为粉质[19-20]。还有一些基因, 虽然不直接涉及淀粉和蛋白的合成, 但它们突变也能造成胚乳粉质。例如:FLO2 调控淀粉和贮藏蛋白合成相关基因的表达, flo2 籽粒变小、心白, 直链淀粉含量降低, 品质下降[9]; ssg4、ssg6胚乳中淀粉颗粒发育异常, 导致粉质胚乳[16-17]。
在之前的报道中, SSG4 定位在造粉体中[16], SSG6 定位在造粉体膜上[17]。半薄切片观察表明, SSG4和SSG6均影响淀粉颗粒的发育[16-17]。SSG4 包含1个DUF490保守结构域, 目前只在细菌和高等植物中发现了DUF490, 并且ssg4 突变体第3叶出现白色条纹, 因此推测SSG4 可能影响质体的发育[16-17]。在许多淀粉合成酶缺陷突变体中, 胚乳的淀粉颗粒大小表现异常。例如水稻和玉米BEⅡb基因的突变造成淀粉颗粒变小[15, 21], 而拟南芥SSⅣ 突变导致叶绿体中淀粉颗粒变大[22]。虽然淀粉合成相关基因突变可能影响淀粉颗粒大小, 但具体分子机制仍然不清楚。
在本研究中, 我们从W017突变体库中筛选得到一份粉质胚乳突变体b140。通过图位克隆将b140突变基因定位在1号染色体56 kb的区间内, 该区间包含SSG4, 经测序发现b140中SSG4基因发生了单碱基的替换。ssg4是第811位甘氨酸(GGT)突变成丝氨酸(AGT), b140则为第937位脯氨酸(CCG)突变成丝氨酸(TCG), 且b140第3叶没有出现白色条纹的表型。通过对籽粒横断面扫描电镜的观察结果发现, b140胚乳淀粉结构松散不致密, 中间含有大量的空隙, 导致光线通过时发生折射, 推测是造成突变体胚乳不透明的直接原因。目前, Os01g0179400在植物中的同源基因还没有注释功能, 拟南芥中的同源基因是At2g25660, 其T-DNA敲除突变体emb2410 胚发育异常[23]。
b140成熟籽粒的直链淀粉含量显著低于野生型, 而可溶性糖含量极显著高于野生型。这与ssg4和ssg6突变体的结果类似[16-17], 因此SSG4 可能影响胚乳中淀粉的积累。拟南芥磷酸葡萄糖变位酶突变体(phosphoglucomutase, pgm)花中淀粉含量下降, 但可溶性糖含量升高。这是因为在pgm1 突变体中, 光合作用产物转化成淀粉的效率太低[24], 而淀粉积累变少也可能造成可溶性糖不正常积累。与pgm相似, b140中AGPL2和AGPS2 b的表达量相对野生型低, 且AGPase的活性较野生型显著下降。b140中AGPase的活性降低, 导致可溶性糖向ADPG的转化效率降低, 从而造成b140中淀粉含量降低, 可溶性糖含量升高。另外, b140中淀粉合成基因的表达量均出现不同程度的下调, 可能是导致总淀粉含量降低的原因, 其中GBSSⅠ的表达量下降, 推测是b140直链淀粉含量降低的原因。b140在5 mol · L-1尿素溶液中淀粉膨胀体积显著低于野生型, 表明b140中淀粉结构可能发生了改变。上述结果表明, SSG4影响了淀粉的合成。
Os01g0179400基因产物中的保守结构域DUF490的功能至今还不清楚, Os01g0179400如何影响淀粉积累还有待研究。b140的发现为进一步探究DUF490结构域的功能奠定了基础, 对深入理解水稻淀粉合成和调控的机制具有一定的意义。
| [1] |
黄发松, 孙宗修, 胡培松, 等. 食用稻米品质形成研究的现状与展望[J].
中国水稻科学, 1998, 12(3): 172–176.
Huang F S, Sun Z X, Hu P S, et al. Present situations and prospects for the research on rice grain quality forming[J]. Chinese Journal of Rice Science, 1998, 12(3): 172–176. (in Chinese with English abstract) |
| [2] |
沈直, 唐设, 张海祥, 等. 灌浆期开放式增温对水稻强势粒和弱势粒淀粉代谢关键酶相关基因表达水平的影响[J].
南京农业大学学报, 2016, 39(6): 898–906.
Shen Z, Tang S, Zhang H X, et al. Effect of T-FACE high temperature on genes expression level of key enzymes involved in starch metabolism in superior spikelets and inferior spikelets of rice during grain filling period[J]. Journal of Nanjing Agricultural University, 2016, 39(6): 898–906. DOI: 10.7685/jnau.201604047 (in Chinese with English abstract) |
| [3] | 张蕊, 丁艳锋, 李刚华, 等. 水稻强弱势粒间淀粉粒和蛋白体积累的差异[J]. 南京农业大学学报, 2014, 37(1): 15–20. DOI: 10.7685/j.issn.1000-2030.2014.01.003 |
| [4] | Fujita N. Starch biosynthesis in rice endosperm[J]. AGri-Bioscience Monographs, 2014, 4(1): 1–18. DOI: 10.5047/agbm.2014.00401.0001 |
| [5] | Ryoo N, Yu C, Park C S, et al. Knockout of a starch synthase gene OsSS Ⅲ a/Flo 5 causes white-core floury endosperm in rice(Oryza sativa L.)[J]. Plant Cell Rep, 2007, 26(7): 1083–1095. DOI: 10.1007/s00299-007-0309-8 |
| [6] | Tang X J, Peng C, Zhang J, et al. ADP-glucose pyrophosphorylase large subunit 2 is essential for storage substance accumulation and subunit interactions in rice endosperm[J]. Plant Science, 2016, 249: 70–83. DOI: 10.1016/j.plantsci.2016.05.010 |
| [7] | Jiang H Y, Zhang J, Wang J M, et al. RNA interference-mediated silencing of the starch branching enzyme gene improves amylose content in rice[J]. Genetics and Molecular Research, 2013, 12(3): 2800–2808. |
| [8] | Satoh H, Omura T. New endosperm mutations induced by chemical mutagens in rice(Oryza sativa L.)[J]. Ikushugaku Zasshi, 1981, 31(3): 316–326. DOI: 10.1270/jsbbs1951.31.316 |
| [9] | She K C, Kusano H, Koizumi K, et al. A novel factor FLOURY ENDOSPERM2 is involved in regulation of rice grain size and starch quality[J]. Plant Cell, 2010, 22(10): 3280–3294. DOI: 10.1105/tpc.109.070821 |
| [10] | Nishio T, Iida S. Mutants having a low content of 16-kDa allergenic protein in rice(Oryza sativa L.)[J]. Theoretical and Applied Genetics, 1993, 86(2/3): 317–321. |
| [11] | Kang H G, Park S, Matsuoka M, et al. White-core endosperm floury endosperm-4 in rice is generated by knockout mutations in the C4-type pyruvate orthophosphate dikinase gene(OsPPDKB)[J]. Plant J, 2005, 42(6): 901–911. DOI: 10.1111/tpj.2005.42.issue-6 |
| [12] | Zhou H, Wang L, Liu G, et al. Critical roles of soluble starch synthase SSⅢa and granule-bound starch synthase Waxy in synthesizing resistant starch in rice[J]. Proc Natl Acad Sci USA, 2016, 113(45): 12844–12849. DOI: 10.1073/pnas.1615104113 |
| [13] | Peng C, Wang Y, Liu F, et al. FLOURY ENDOSPERM6 encodes a CBM48 domain-containing protein involved in compound granule formation and starch synthesis in rice endosperm[J]. Plant J, 2014, 77(6): 917–930. DOI: 10.1111/tpj.2014.77.issue-6 |
| [14] | Zhang L, Ren Y, Lu B, et al. FLOURY ENDOSPERM7 encodes a regulator of starch synthesis and amyloplast development essential for peripheral endosperm development in rice[J]. Journal of Experimental Botany, 2015, 67(3): 633–647. |
| [15] | Matsushima R, Maekawa M, Fujita N, et al. A rapid, direct observation method to isolate mutants with defects in starch grain morphology in rice[J]. Plant and Cell Physiology, 2010, 51(5): 728–741. DOI: 10.1093/pcp/pcq040 |
| [16] | Matsushima R, Maekawa M, Kusano M, et al. Amyloplast-localized SUBSTANDARD STARCH GRAIN4 protein influences the size of starch grains in rice endosperm[J]. Plant Physiology, 2014, 164(2): 623–636. DOI: 10.1104/pp.113.229591 |
| [17] | Matsushima R, Maekawa M, Kusano M, et al. Amyloplast membrane protein SUBSTANDARD STARCH GRAIN6 controls starch grain size in rice endosperm[J]. Plant Physiology, 2016, 170(3): 1445–1459. |
| [18] |
韩小花. 水稻籽粒中控制淀粉合成关键基因OsPDIL 1-1的图位克隆及功能分析[D]. 南京: 南京农业大学, 2011.
Han X H. Map-based cloning and functional analysis of a key gene OsPDIL 1-1 involved in the starch biosynthesis in rice[D]. Nanjing:Nanjing Agricultural University, 2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1014219038.htm |
| [19] | Ren Y, Wang Y, Liu F, et al. GLUTELIN PRECURSOR ACCUMULATION 3 encodes a regulator of post-Golgi vesicular traffic essential for vacuolar protein sorting in rice endosperm[J]. Plant Cell, 2014, 26(1): 410–425. DOI: 10.1105/tpc.113.121376 |
| [20] | Liu F, Ren Y, Wang Y, et al. OsVPS9A functions cooperatively with OsRAB5A to regulate post-Golgi dense vesicle-mediated storage protein trafficking to the protein storage vacuole in rice endosperm cells[J]. Molecular Plant, 2013, 6(6): 1918–1932. DOI: 10.1093/mp/sst081 |
| [21] | Li J H, Guiltinan M J, Thompson D B. Mutation of the maize sbe 1 a and ae genes alters morphology and physical behavior of wx-type endosperm starch granules[J]. Carbohydrate Research, 2007, 342(17): 2619–2627. DOI: 10.1016/j.carres.2007.07.019 |
| [22] | Roldán I, Wattebled F, Mercedes Lucas M, et al. The phenotype of soluble starch synthase Ⅳ defective mutants of Arabidopsis thaliana suggests a novel function of elongation enzymes in the control of starch granule formation[J]. Plant J, 2007, 49(3): 492–504. DOI: 10.1111/tpj.2007.49.issue-3 |
| [23] | Matsushima R, Hamamura Y, Higashiyama T, et al. Mitochondrial dynamics in plant male gametophyte visualized by fluorescent live imaging[J]. Plant and Cell Physiology, 2008, 49(7): 1074–1083. DOI: 10.1093/pcp/pcn084 |
| [24] | Blüsing O E, Gibon Y, Günther M, et al. Sugars and circadian regulation make major contributions to the global regulation of diurnal gene expression in Arabidopsis[J]. Plant Cell, 2005, 17(12): 3257–3281. DOI: 10.1105/tpc.105.035261 |




