文章信息
- 贾坤, 廖燕红, 徐磊, 王虎虎, 徐幸莲
- JIA Kun, LIAO Yanhong, XU Lei, WANG Huhu, XU Xinglian
- 酰基-高丝氨酸内酯(AHL)对鼠伤寒沙门氏菌生物菌膜形成的影响
- Effect of acylated homoserine lactones(AHL)on the biofilm formation of Salmonella typhimurium
- 南京农业大学学报, 2017, 40(4): 744-749
- Journal of Nanjing Agricultural University, 2017, 40(4): 744-749.
- http://dx.doi.org/10.7685/jnau.201611023
-
文章历史
- 收稿日期: 2016-11-22
沙门氏菌已成为全球范围内危害公众健康最主要的食源性致病菌, 每年都会引发食物中毒事件, 在欧洲已经成为食物中毒最主要的原因[1]。沙门氏菌可以在不同的食品加工表面附着、定殖并形成生物菌膜。生物菌膜可引发大范围的交叉污染, 并且对外源清洗剂和杀菌剂有一定的耐受性[2-3]。
食品加工过程中沙门氏菌形成生物菌膜的能力受食品加工接触面存在的天然微生物群落的影响, 尤其是微生物群落所产生的群体感应信号分子对生物菌膜的形成和消散具有重要作用[4]。细菌的群体感应是根据自身细胞密度变化进行调节的一种群体行为, 许多细菌能产生并释放一种被称为自诱导物的信号分子[5]。信号分子随着细菌密度的增加而不断积累, 当其积累到一定信号浓度时, 信号分子将与受体蛋白结合, 从而调控细菌相关基因的表达, 使细菌有效地抵御外界不利环境[6-7]。革兰氏阴性菌之间通常以酰基-高丝氨酸内酯(AHL)作为群体感应信号分子, 该信号分子是一种小分子水溶性化合物[8-9]。而且许多食源性微生物都具有产AHL的能力, 比如假单胞菌属、肠杆菌属和气单菌属等[10], 其中铜绿假单胞菌作为一种典型的食品腐败菌广泛存在于环境中, 对食品污染严重。但是在沙门氏菌和铜绿假单胞菌共存的食品加工接触面, 当铜绿假单胞菌产生的AHL信号分子被沙门氏菌识别以后会发生什么变化, 尤其是沙门氏菌在食品加工接触面形成生物菌膜的能力会不会受到影响, 这些都少见报道。
近年来, 关于沙门氏菌之间群体感应信号分子的研究已经引起越来越多人的关注。研究表明, 致病菌的黏附和致毒可能通过群体感应来调控[4-5]。迄今为止, 对于沙门氏菌群体感应的研究大部分是利用DNA技术来研究其自身所产生的物质对其菌体特性的影响[11-12]。然而很少有人研究沙门氏菌对其他食源性细菌所产生信号分子的识别和反应能力, 尤其是对自身不产生却有很大作用的AHL。
因此, 本试验研究了铜绿假单胞菌所产生群体感应信号分子AHL的成分, 并通过不同AHL添加量来研究其对鼠伤寒沙门氏菌生物菌膜的形成、浮游菌体的生长以及菌体泳动能力的影响, 以期为不同菌体间群体感应的研究提供参考, 为沙门氏菌的控制措施提供帮助。
1 材料与方法 1.1 材料与试剂鼠伤寒沙门氏菌、铜绿假单胞菌分离自生鲜鸡肉; Agrobacterium tumefaeiens R10(pCF218) 和KYC55菌株由南京农业大学生命科学学院朱军教授惠赠。合成的AHL(200 nmol·mL-1 C12-HSL)、X-Gal购自Sigma公司; 食品级304不锈钢表面(2b光洁面, 75 mm×25 mm×1 mm)购于南通顺丰医疗器械有限公司; 胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)、木糖赖氨酸脱氧胆酸钠(XLD)、琼脂粉等培养基购于北京陆桥责任有限公司; 乙酸乙酯、甲酸、甲醇等分析纯级试剂购于南京化学试剂有限公司; 四环素(tetracycline, Tc)购于南京生兴技术有限公司; 0.22 μm滤膜购于南京科泰有限公司。
1.2 仪器与设备Scan1200自动影像分析菌落计数仪(Interscience, 法国); C18反相薄层层析板(Merck, 美国); 生物安全柜(Baker, 美国); 高压灭菌锅(Hirayama, 日本); 生化培养箱(博讯, 上海); BS223S电子天平(赛多利斯, 北京); 离心机(Beckman, 美国)等。
1.3 方法 1.3.1 AHL的制备将活化好的铜绿假单胞菌接种于500 mL TSB培养基中, 置于28 ℃下培养48 h。上述培养菌液经12 000 g, 4 ℃离心15 min, 上清液经过0.22 μm的滤膜过滤除菌得到无菌上清培养液。部分无菌上清培养液放在100 ℃下加热5 min。将加热与未加热的上清液分别与等体积酸化的乙酸乙酯(含0.5%甲酸)混合萃取3次, 得到的混合液室温下放置10 min, 使水相和有机相完全分开[13]。利用分液漏斗收集乙酸乙酯相, 40 ℃真空旋转蒸发去除有机溶剂。将提取物溶解于1 mL无菌水, 然后经过0.22 μm孔径的滤膜进行除菌[14]。同样将活化好的根瘤土壤杆菌R10接种于500 mL含有四环素抗性(2 μg·mL-1)的TSB中, 将其置于28 ℃培养24 h, AHL的提取方法同上。
1.3.2 薄层层析法(TLC)检测采用薄层层析法[15]测定待测菌的AHL产物, 将上述得到的乙酸乙酯提取物1.5 μL点样于C18反相薄层板上, 待甲醇/水(体积比为60 : 40) 充分展开后, 从层析缸里取出, 室温下放置10 min挥干溶剂。在过夜培养的A.tumefaeiens KYC55 LB培养液中添加等体积10 g·L-1琼脂和300 μg·mL-1 X-Gal, 立即铺于TLC平板上, 生物安全柜内吹干, 然后置于消毒的密闭容器中28 ℃培养24 h, 根据蓝色斑点的显色位置来确定AHL的迁移位置。以合成的AHL(200 nmol·ml-1C12-HSL)和可以过量表达3-氧-辛酰高丝氨酸内酯(3-oxo-C8-HSL)信号分子的根瘤土壤杆菌R10提取物作为阳性对照。
1.3.3 菌液制备将冻存于-80 ℃的鼠伤寒沙门氏菌血清型菌株采用划线法在TSA平板中活化2次, 挑取单菌落接种于10 mL TSB培养基中, 将其置于37 ℃培养24 h。培养后的菌液4 ℃条件下8 000 g离心10 min, 弃上清液, 用10 mL PBS缓冲液(pH7.2) 反复洗涤菌体沉淀3次, 测定并调整菌悬液的浓度达到1×109 CFU·mL-1, 备用。
1.3.4 生物菌膜的制备和测定将加热过后的铜绿假单胞菌提取物AHL按照0%、0.5%、1.0%、1.5%、2.0%(体积分数)的比例分别加到10 mL载有不锈钢片的TSB中, 以没有添加AHL的离心管为阴性对照。将上述制备好的菌悬液用PBS稀释10 000倍, 使其菌液浓度达到1×105 CFU·mL-1, 然后取100 μL接种于上述TSB中, 置于37 ℃培养5 d。在规定时间内对不锈钢表面形成的生物菌膜进行计数, 计数前为防止不锈钢片表面未黏附的游离菌体造成干扰, 先用无菌生理盐水清洗表面3次, 再用棉球擦拭不锈钢表面的黏附菌体, 擦拭后的棉球置于10 mL含有一定数量无菌玻璃珠的无菌生理盐水中, 涡旋2 min, 使棉球上的菌体充分脱落[16-17]。取1 mL进行10倍梯度稀释, 选取适当的稀释度采用全自动螺旋接种仪将100 μL菌液涂布至XLD平板中, 37 ℃下培养24 h后计数。每组试验重复5次。
1.3.5 游离菌体的制备和测定将加热过后的铜绿假单胞菌提取物AHL按照0%、0.5%、1.0%、1.5%、2.0%(体积分数)的比例分别加到10 mL TSB中, 以未添加AHL的离心管为阴性对照。将上述制备好的菌悬液用PBS稀释10 000倍, 使其菌液浓度达到1×105 CFU·mL-1。取稀释备用的悬浮液100 μL接种于10 mL上述TSB中, 将接种好样品置于37 ℃培养5 d, 规定时间取样后计数, 方法同上。
1.3.6 菌体泳动能力的测定参照Cong等[18]和Hidalgo等[19]的方法并做适当的修改。利用软琼脂平板法对各时间段培养的菌液进行泳动能力的测定。群体泳动性(swarming)平板的营养配方为25 g·L-1 LB、5 g·L-1琼脂粉和0.5 g·L-1葡萄糖; 单体泳动性(swimming)平板的营养配方为:10 g·L-1胰蛋白胨、5 g·L-1 NaCl、2.5 g·L-1葡萄糖和3 g·L-1琼脂粉。取3 μL菌株的菌悬液接种至上述2种平板的中心位置, 于室温下静置20 min, 待菌悬液充分吸收; 将群体泳动性平板置于37 ℃下培养20 h, 单体泳动性平板置于37 ℃培养8 h, 用游标卡尺测定菌株扩散圈的直径(mm)。每组试验重复5次。
1.4 数据分析采用SPSS 13.0软件对数据进行统计分析, 采用独立样本t检验进行两重比较, 采用Duncan′s ANOVA进行多重比较。
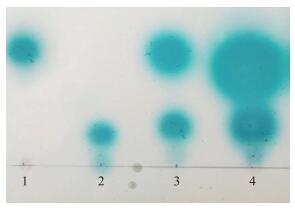
2 结果与分析 2.1 AHL的薄层层析(TLC)图谱由R10、C12-HSL、AHL溶液、100 ℃加热5 min的AHL溶液在薄层层析板上的迁移位置(图 1)可以看出:铜绿假单胞菌TSB培养液中存在2种相同类型的AHL分子(C12-HSL和3-oxo-C8-HSL); 100 ℃加热5 min并没有改变铜绿假单胞培养上清液中AHL成分, 高温同时可以消除菌体胞外分泌物和酶等有可能影响沙门氏菌生物菌膜形成的因素。
|
图 1 铜绿假单胞菌产AHL的薄层层析图谱 Figure 1 TLC profile of AHL produced by Pseudomonas aeruginosa 1:根瘤土壤杆菌R10培养上清液; 2:合成的C12-HSL; 3:铜绿假单胞菌培养上清液; 4:铜绿假单胞菌培养上清液100 ℃加热5 min 1:Cell-free culture supernatants(CFS)of Agrobacterium tumefaeiens R10(pCF218);2:Synthetic C12-HSL; 3:CFS of P.aeruginosa; 4:CFS of P.aeruginosa heating at 100 ℃ for 5 min |
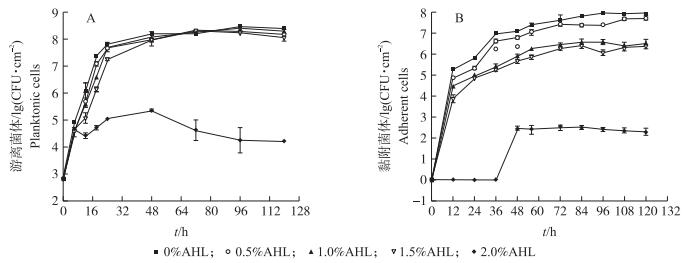
由图 2-A可见:与对照组(0% AHL)相比, 虽然在最初48 h中0.5%、1.0%、1.5%AHL对鼠伤寒沙门氏菌游离菌体的生长有一定抑制作用, 但是一旦其生长达到稳定期(48~96 h), 添加0.5%、1.0%、1.5% AHL后沙门氏菌生长与对照相比无显著性变化(P > 0.05)。当AHL添加量达到2%时, 沙门氏菌生长受到显著抑制, 整个生长周期均显著低于其他组(P < 0.05), 在48 h时达到最高值, 随后迅速进入衰亡期。由图 2-B可见:不同AHL添加量对鼠伤寒沙门氏菌生物菌膜形成均有显著抑制作用, 且随着AHL添加量的增加, 其抑制作用增强。当AHL添加量为2.0%时, 鼠伤寒沙门氏菌黏附能力受到显著抑制, 在36 h之前没有生物菌膜形成, 而在36 h后生物菌膜开始形成并迅速增加, 直到48 h后黏附菌体数量达到最大并逐渐趋于稳定。
|
图 2 AHL对鼠伤寒沙门氏菌游离菌体(A)和黏附菌体(B)的影响(n=5) Figure 2 Effects of AHL on the planktonic cells(A)and adherent cells(B)of Salmonella typhimurium |
由图 3-A可见:随着AHL添加量的增加, 鼠伤寒沙门氏菌单体泳动能力显著降低。与对照组相比, 添加1.5% AHL后, 其泳动能力在4和8 h分别下降了91.28%、96.28%;但当AHL添加量增加至2.0%时, 其菌体泳动能力与添加1.5% AHL的无显著性差异。由图 3-B可知:鼠伤寒沙门氏菌群体泳动能力随着AHL添加量的增加(0%~1.5%)整体呈上升趋势, 并且这种趋势随着时间的延长愈发明显。当AHL添加量从1.5%增加到2.0%时, 群体泳动性出现一定程度的下降。

|
图 3 AHL对鼠伤寒沙门氏菌单体泳动能力(A)和群体泳动能力(B)的影响(n=5) Figure 3 Effects of AHL on the swimming(A)and the swarming(B)of S.typhimurium 不同小写字母表示同一时间不同处理组间差异显著(P < 0.05)。 Different small letters in different treatments at the same time mean significant difference at 0.05 level. |
细菌的群体感应是通过群体感应信号分子来实现的, 特定的酶所合成的物质都可以用特定的传感器来检测[20]。薄层层析法由于简单而且灵敏度高被广泛用于AHL的检测[21]。目前, 通过信号分子的检测来研究食品腐败和安全已经引起越来越多人的关注, 其中铜绿假单胞菌作为一种在冷冻肉和肉品加工环境中占主导地位的腐败菌, 它所产生的AHL信号分子被广泛研究[5]。本研究发现, 铜绿假单胞菌在TSB中会产生群体感应信号分子AHL, 薄层层析结果显示铜绿假单胞菌培养液中存在2种相同类型AHL分子(C12-HSL和3-oxo-C8-HSL), 且100 ℃加热5 min并没有改变AHL的成分, 同时加热可以消除胞外分泌物、酶等可能对沙门氏菌生物菌膜产生影响的成分, 这与Wang等[22]的结果相一致。本试验采用铜绿假单胞菌在对数生长时期所产生的AHL为研究对象, 这是因为前人研究发现菌体主要是在对数生长期的后期与稳定生长期的前期合成AHL[23], 而且Pearson等[24]发现铜绿假单胞菌在对数生长期合成的AHL比在稳定期的多。
沙门氏菌作为一种常见的食源性致病菌自身是不产生AHL信号分子的, 但它含有由sdiA编码的AHL信号接收器, 可以识别其他细菌产生的AHL信号分子。本研究发现, 低添加量的AHL(1.5%以下)对鼠伤寒沙门氏菌浮游菌体的指数生长期有一定抑制作用, 这与Dourou等[25]的研究结果相一致, 但是一旦生长达到稳定期(48~96 h), AHL对其生长没有显著影响; 而2% AHL则显著降低了浮游菌体含量, 且在生长后期加剧了菌体的死亡。
本研究表明, 不同AHL添加量对鼠伤寒沙门氏菌生物菌膜形成均有一定抑制作用, 且随着AHL添加量的增加, 其抑制作用显著增强。这与Asahi等[26]的研究结果相一致。由上面分析可知, 1.5%以下AHL添加量对沙门氏菌浮游菌体的生长无显著影响, 但其对黏附菌体的生长却有明显的抑制作用, 且随着添加量的提高抑制作用增强。而当AHL添加量达到2.0%时, 对浮游菌体和黏附菌体的影响极其显著, 且在36 h之前, 没有黏附菌体形成, 这可能是因为开始时AHL信号分子浓度过大并迅速达到某个阈值, 启动相关基因来抑制沙门氏菌的黏附[27]; 另一方面, 开始阶段菌体浓度比较低, 其本身黏附就较困难, 所以在36 h之前并没有黏附菌体形成。随着时间的延长菌体浓度增大, 部分菌体开始在不锈钢表面黏附, 所以在36~48 h出现一个快速增长期。但不可忽略的是, 此时菌液中仍有较高浓度的AHL来抑制菌体的黏附, 所以48 h以后菌体又逐渐趋于稳定。
细菌的泳动能力主要包括单体泳动能力和群体泳动能力。单体泳动能力是一种单一菌体运动行为, 而群体泳动能力是一种群体菌体运动的行为[18]。本研究发现, 随着AHL添加量(0.5%、1.0%、1.5%)的增加, 单体泳动性显著降低, 但当AHL添加量达到2%时, 其菌体的泳动能力与添加1.5%相比无显著性差异, 说明AHL对鼠伤寒沙门氏菌单体泳动性的影响受添加量调控, 当AHL添加量达到一定值后, 其抑制作用不再加强。群体泳动性随着AHL添加量的增加(0%~1.5%)整体呈上升趋势, 而当AHL添加量从1.5%增加到2%时, 群体泳动性出现一定程度下降, 说明AHL对鼠伤寒沙门氏菌群体泳动性的影响也在一定程度上受到添加量调控。
综上所述, 群体感应信号分子AHL对鼠伤寒沙门氏菌浮游菌体生长的影响受AHL添加量调控, 当添加量增加到一定值时浮游菌体生长才受到抑制, 但对生物菌膜的形成有明显抑制作用, 且随着AHL添加量升高, 抑制作用增强。AHL对单一菌体泳动性有显著抑制作用, 而对群体泳动性有不同程度的促进作用。
| [1] | European Food Safety Authority and European Centre for Disease Prevention and Control. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2010[J]. EFSA Journal, 2012, 10(3): 2597. DOI: 10.2903/j.efsa.2012.2597 |
| [2] | Chia T W R, Goulter R M, McMeekin T, et al. Attachment of different Salmonella serovars to materials commonly used in a poultry processing plant[J]. Food Microbiology, 2009, 26: 853–859. DOI: 10.1016/j.fm.2009.05.012 |
| [3] | Lapidot A, Romling U, Yaron S. Biofilm formation and the survival of Salmonella typhimurium on parsley[J]. International Journal of Food Microbiology, 2006, 109: 229–233. DOI: 10.1016/j.ijfoodmicro.2006.01.012 |
| [4] | Vendeville A, Winzer K, Heurlier K, et al. Making'sense'of metabolism:autoinducer 2, luxs and pathogenic bacteria[J]. Nature Reviews Microbiology, 2005, 3: 383–396. DOI: 10.1038/nrmicro1146 |
| [5] | Bai A J, Rai V R. Bacterial quorum sensing and food industry[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(3): 183–193. DOI: 10.1111/j.1541-4337.2011.00150.x |
| [6] | Holden M T G, Chhabra S R, de Nys R, et al. Quorum-sensing cross talk:isolation and chemical characterization of cyclic dipeptides from Pseudomonas aeruginosa and other gram-negative bacteria[J]. Molecular Microbiology, 1999, 33(6): 1254–1266. |
| [7] | Wagner V E, Frelinger J G, Barth R K, et al. Quorum sensing:dynamic response of Pseudomonas aeruginosa to external signals[J]. Trends in Microbiology, 2006, 14(2): 55–58. DOI: 10.1016/j.tim.2005.12.002 |
| [8] | Gram L, Christensen A B, Ravn L, et al. Production of acylated homoserine lactones by Psychrotrophic members of the Enterobacteriaceae isolated from foods[J]. Applied and Envirommental Microbiology, 1999, 65(8): 3548–3463. |
| [9] | Ravn L, Christensen A B, Molin S, et al. Methods for detecting acylated homoserine lactones produced by Gram-negative bacteria and their application in studies of AHL-production kinetics[J]. Journal of Microbiological Methods, 2001, 44(3): 239–251. DOI: 10.1016/S0167-7012(01)00217-2 |
| [10] | Priha O, Juvonen R, Tapani K, et al. Acyl homoserine lactone production of brewery process surface bacteria[J]. Journal of the Institute of Brewing, 2011, 117(2): 182–187. DOI: 10.1002/(ISSN)2050-0416 |
| [11] | Annous B A, Fratamico P M, Smith J L. Quorum sensing in biofilms:why bacteria behave the way they do[J]. Journal of Food Science, 2009, 74: 24–37. |
| [12] | Jesudhasan P R, Cepeda M L, Widmer K, et al. Transcriptome analysis of genes controlled by luxS/autoinducer-2 in Salmonella enterica serovar Typhimurium[J]. Foodborne Pathogens and Disease, 2010, 7(4): 399–410. DOI: 10.1089/fpd.2009.0372 |
| [13] | Truchado P, Tomás-Barberán F A, Larrosa M, et al. Food phytochemicals act as quorum sensing inhibitors reducing production and/or degrading autoinducers of Yersinia enterocolitica and Erwinia carotovora[J]. Food Control, 2012, 24: 78–85. |
| [14] | Zhu J, Chai Y R, Zhong Z T, et al. Agrobacterium bioassay strain for ultrasensitive detection of N-acylhomoserine lactone-type quorum-sensing molecules:detection of autoinducers in Mesorhizobium huakuii[J]. Applied and Environmental Microbiology, 2003, 69(11): 6949–6953. DOI: 10.1128/AEM.69.11.6949-6953.2003 |
| [15] | McClean K H, Winson M K, Fish L, et al. Quorum sensing and Chromobacterium violaceum:exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones[J]. Microbiology, 1997, 143(12): 3703–3711. DOI: 10.1099/00221287-143-12-3703 |
| [16] | Winkelstroter L K, Gomes B C, Thomaz M R S, et al. Lactobacillus sakei 1 and its bacteriocin influence adhesion of Listeria monocytogenes on stainless steel surface[J]. Food Control, 2011, 22(8): 1404–1407. DOI: 10.1016/j.foodcont.2011.02.021 |
| [17] | Midelet G, Carpentier B. Transfer of microorganisms, including Listeria monocytogenes, from various materials to beef[J]. Applied and Environmental Microbiology, 2002, 68(8): 4015–4024. DOI: 10.1128/AEM.68.8.4015-4024.2002 |
| [18] | Cong Y, Wang J, Chen Z, et al. Characterization of swarming motility in Citrobacter freundii[J]. FEMS Microbiology Letters, 2011, 317(2): 160–171. DOI: 10.1111/fml.2011.317.issue-2 |
| [19] | Hidalgo G, Chan M, Tufenkji N. Inhibition of Escherichia coli CFT073 fliC expression and motility by cranberry materials[J]. Applied and Environmental Microbiology, 2011, 77(19): 6852–6857. DOI: 10.1128/AEM.05561-11 |
| [20] | Fan J Q, Qian G L, Chen T, et al. The acylhomoserine lactone(AHL)-type quorum sensing system affects growth rate, swimming motility and virulence in Acidovorax avenae subsp.Citrulli[J]. World Journal of Microbiology and Biotechnology, 2017, 27: 1155–1166. |
| [21] | Steindler L, Venturi V. Detection of quorum-sensing N-acyl homoserine lactone signal molecules by bacterial biosensors[J]. FEMS Microbiology Letters, 2006, 266(1): 1–9. |
| [22] | Wang H H, Ye K P, Zhang Q Q, et al. Biofilm formation of meat-borne Salmonella enterica and inhibition by the cell-free supernatant from Pseudomonas aeruginosa[J]. Food Control, 2013, 32: 650–658. DOI: 10.1016/j.foodcont.2013.01.047 |
| [23] | Cha C, Gao P, Chen Y C, et al. Production of acyl-homoserine lactone quorum-sensing signals by gram-negative plant-associated bacterial[J]. Molecular Plant-Microbe Interactions, 1998, 11(11): 1119–1129. DOI: 10.1094/MPMI.1998.11.11.1119 |
| [24] | Person J P, Gray K M, Passador L, et al. Structure of the autoinducer required for expression of Pseudomonas aeruginosa virulence genes[J]. Proc Natl Acad Sci USA, 1994, 91(1): 197–201. DOI: 10.1073/pnas.91.1.197 |
| [25] | Dourou D, Ammor M S, Skandamis P N, et al. Growth of Salmonella enteritidis and Salmonella typhimurium in the presence of quorum sensing signalling compounds produced by spoilage and pathogenic bacteria[J]. Food Microbiology, 2011, 28: 1011–1018. DOI: 10.1016/j.fm.2011.02.004 |
| [26] | Asahi Y, Noiri Y, Igarashi J, et al. Effects of N-acyl homoserine lactone analogues on Porphyromonas gingivalis biofilm formation[J]. Journal of Periodont Research, 2010, 45: 255–261. DOI: 10.1111/jre.2010.45.issue-2 |
| [27] | Gobbetti M, de Angelis M, Di Cagno R, et al. Cell-cell communication in food related bacteria[J]. International Journal of Food Microbiology, 2007, 120: 34–45. DOI: 10.1016/j.ijfoodmicro.2007.06.012 |




