文章信息
- 王玮, 滕爽, 朱业培, 徐幸莲, 周光宏
- WANG Wei, TENG Shuang, ZHU Yepei, XU Xinglian, ZHOU Guanghong
- 动物过敏原牛血清白蛋白表面等离子共振传感器检测方法的建立
- Development of a surface plasmon resonance sensor for detection of animal allergen bovine serum albumin
- 南京农业大学学报, 2017, 40(4): 739-743
- Journal of Nanjing Agricultural University, 2017, 40(4): 739-743.
- http://dx.doi.org/10.7685/jnau.201612009
-
文章历史
- 收稿日期: 2016-12-08
随着生活水平的提高, 食品的种类越来越丰富, 食物过敏的发生也随之升高。在过去20年中, 过敏性疾病患病人数显著上升, 全球范围内有4%~6%儿童和1%~3%成人患有食物过敏症[1]。据报道, 约90%的食物过敏反应主要是由大豆、花生、小麦、坚果、牛奶、蛋类、鱼类和甲壳类动物等常见的八类食物过敏原引起[2]。最近研究表明, 肉类食物过敏也已成为一种新的重要的食品安全问题, 过敏症患病率为0.5%~8%, 其过敏症状主要表现为皮疹、麻疹、湿疹、哮喘、呕吐、腹泻、红眼以及喉咙肿胀和发痒等[3]。其中牛肉过敏尤其影响儿童的身体健康, 儿童对牛肉过敏的发生率为3.3%~6.5%, 约占总人口的0.3%[4]。现已证实引起牛肉过敏的主要过敏原是存在于血浆中的牛血清白蛋白(BSA)[4]。此外, BSA在临床医学及生物领域有着广泛的应用[5], 这使得过敏患者很难避免接触过敏原BSA而遭受健康威胁。
为保护消费者的健康, 很多国家和地区都制定了针对食品致敏原标签、标识的法律、法规, 对其进行相关标注业已成为设置国际贸易技术壁垒的新区域, 而食品过敏原检测分析是其中最关键的环节, 也是当今过敏原研究的热点之一。目前, 食物过敏原的检测主要采用酶联免疫法(ELISA)[6]、PCR法[7]和质谱法[8]。尽管上述常规检测方法能在复杂背景中检测, 检测限较低, 但存在对操作人员要求高、耗时长、无法实现在线检测等不足。表面等离子共振(SPR)技术是近年来发展的一种新型免疫生化检测技术, 其检测原理是当芯片表面的物质或者物质量发生变化时, 折射率发生变化, 表现为共振角的偏移[9], 可采用共振单位(resonance units, RU)来表征。与常规检测方法相比, SPR技术具有无需标记、样品用量少、检测周期短、易操作、可再生、结果直观并可进行高通量实时在线检测等优势[10], 目前已广泛应用于临床诊断[11], 蛋白质组学[12], 环境监控[13], 细菌[14]、病毒[15]以及细胞间相互作用分析[16]等。本试验针对目前牛肉过敏原蛋白检测方面研究相对较少的现状, 基于SPR技术建立了一种快速检测微量BSA的新方法, 并与ELISA方法进行市售食品的检测结果比较, 旨在为过敏疾病预防、食品过敏原监测预警以及食品安全法的顺利实施提供可靠的技术保障。
1 材料与方法 1.1 试验材料供试材料为各种市售食品, 如牛肉松、牛肉丸、牛肉肠、牛肉干和生牛肉等样品, 均购自南京市农贸市场或超市。
牛血清白蛋白(BSA)购自美国Sigma公司; 鼠抗BSA单克隆抗体(纯度>95%), 本中心的实验室自制[17]; N-羟基琥珀酰亚胺(NHS)、1-(3-二甲基丙基)-3-乙基碳二亚胺(EDC)均购自美国Sigma公司; 羧甲基化葡聚糖CM5传感芯片、盐酸乙醇胺(1 mol·L-1, pH8.5) 均购自美国GE Healthcare公司; Bovine Albumin ELISA Quantitation Kit购自美国Bethyl公司; 其他化学试剂均为分析纯。所有溶液均采用超纯去离子水(18.2 MΩ·cm)配制; 用于BiacoreTM T200生物传感器测定的试液需经过0.22 μm滤膜过滤和真空抽气或超声脱气。
BiacoreTM T200生物传感器购自美国GE Healthcare公司; arium® pro超纯水系统购自德国Sartorius公司; Allegra 64R型台式高速冷冻离心机购自美国Beckman Coulter公司; iMark酶标仪购自美国Bio-Rad公司; PHS-2C精密酸度计购自上海雷磁仪器厂。
1.2 试验方法 1.2.1 SPR生物传感芯片制备整个试验过程流速均设定为10 μL·min-1。将CM5芯片置于BiacoreTM T200生物传感器中, 待基线平稳后, 依次进行以下3个步骤:1) 将50 μL 0.4 mol·L-1 EDC和50 μL 0.1 mol·L-1 NHS混合, 注入100 μL混合物以活化芯片; 2) 注入100 μL 100 μg·mL-1鼠抗BSA单克隆抗体[用0.01 mmol·L-1 PBS缓冲液(pH5.0) 配制]; 3) 用100 μL 1 mol·L-1盐酸乙醇胺封闭未结合抗体的位点。通过以上步骤可制备直接用于检测BSA的芯片。
1.2.2 样品检测与芯片再生1) 样品检测:先通入含0.5 g·L-1 Tween-20的0.01 mmol·L-1 PBST缓冲液(pH7.4), 除去非特异性吸附, 待稳定后通入待测样品。进样检测时, 待测液体积为50 μL, 整个试验样流速为10 μL·min-1, 进样时间为5 min。试验数据经过扣除缓冲液背景, 每个待测样品及空白对照均检测3次。2) 芯片再生:为提高生物传感器芯片的使用率, 对检测样品后的芯片用2 mmol·L-1NaOH溶液进行再生。注入NaOH溶液的流速为10 μL·min-1, 进行抗原抗体的解离。
1.2.3 标准曲线的绘制将BSA标准样品用0.01 mmol·L-1 PBS缓冲液(pH7.4) 分别稀释为6.25、12.5、25、50、100、200和400 ng·mL-1, 按1.2.2节方法进行样品检测。以BSA浓度为横坐标, 响应值的变化量为纵坐标, 绘制标准曲线, 确定最佳线性范围。检测限(LOD)计算公式:LOD=3.3s/m, 式中:s为Y轴截距的标准偏差, m为线性曲线斜率[18]。
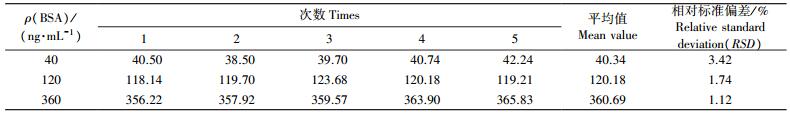
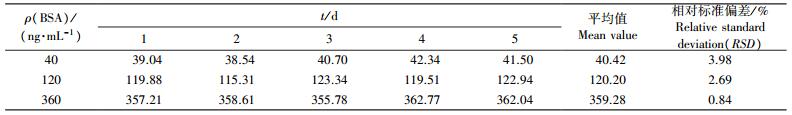
1.2.4 方法的重复性验证将BSA标准样品用0.01 mol·L-1 PBS缓冲液(pH7.4) 分别稀释为40、120和360 ng·mL-1, 按1.2.2节方法分别检测日内相对标准偏差(relative standard deviation, RSD)(1 d内测定5次)和日间相对标准偏差(连续测定5 d), 以评价该方法的重复性。
1.2.5 方法的实际应用采用1.2.2节方法检测市售食品中BSA含量, 并与ELISA检测结果进行比对, 以此验证该方法检测结果的准确性。本试验选取6种不同市售食品, 分别取5 g样品用分析研磨机粉碎, 加入50 mL 0.01 mol·L-1 PBS缓冲液(pH7.4), 10 000 r·min-1均质1 min后, 16 000 g离心30 min, 收集上清液, 并将上清液经0.45 μm孔径膜过滤和超声脱气处理。取上清液稀释至标准曲线的范围内, 稀释液立即用于检测或-20 ℃保存备用。ELISA检测参照Bovine Albumin ELISA Quantitation Kit试剂盒说明书进行操作。
1.3 数据分析采用Microcal Origin 7.5软件分析数据并制图, 数据分析采用方差分析(ANOVA)。试验均3次重复, 以平均值±标准差(x±SD)表示。
2 结果与分析 2.1 SPR生物传感器的制备本试验中SPR生物传感器的制备如图 1所示, 在该条件下抗体与芯片结合的共振单位(resonance units, RU)值约为18 000, 即为抗体的最终固定量。
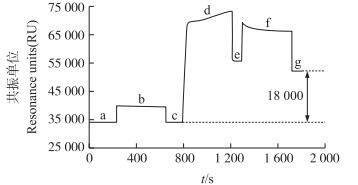
|
图 1 抗体标记的实时表面等离子共振(SPR)图谱 Figure 1 Real-time surface plasmon resonance(SPR)spectrum of antibody labeling a. PBST缓冲液冲洗过程, 以获得稳定基线; b. EDC/NHS活化过程, 激活CM5芯片表面葡聚糖; c. PBST缓冲液冲洗过程, 以清洗残留EDC/NHS; d.抗体固定过程; e. PBST缓冲液冲洗过程, 以冲洗游离或结合较弱的抗体; f.盐酸乙醇胺封闭过程, 以封闭芯片表面未与抗体结合的位点; g. PBST缓冲液冲洗过程, 以冲洗残留盐酸乙醇胺。 a. Inject the PBST to obtain a constant baseline; b. To activate the CM5 dextran surface, the mixed solution of EDC and NHS was injected; c.Inject the PBST to wash down the residual EDC/NHS; d. Antibodies were immobilized on the sensor surface; e. Inject the PBST to wash down the unbound or weakly binding antibodies; f. Inject ethanolamine solution to block the carboxyl spots that were not bound with the antibodies on the sensor surface; g. Inject the PBST to wash down the residual ethanolamine solution. |
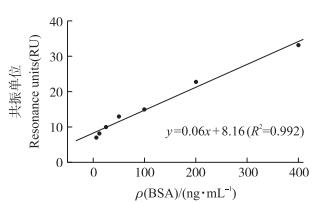
将BSA各浓度样品的RU值对时间连续作图, 由图 2可见:不同浓度BSA的RU值不同, 浓度越大RU值越大。检测BSA时, RU值呈逐渐增大的趋势, 这也体现出抗原抗体结合过程。根据在不同浓度下得到的结合信号, 以BSA浓度为横坐标, 响应值的变化量为纵坐标, 通过线性拟合分析建立两者之间关系模型(图 3)。两者在6.25~400 ng·mL-1范围内呈显著正相关(P < 0.05), 回归方程为y=0.06x+8.16(R2=0.992, P < 0.000 1), LOD为33.68 ng·mL-1。
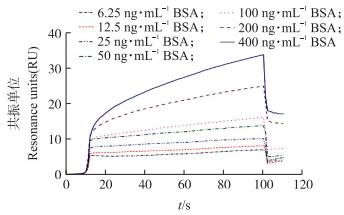
|
图 2 牛血清白蛋白(BSA)与抗体结合的实时SPR图谱 Figure 2 Real-time SPR spectrum of interaction between bovine serum albumin(BSA)and antibody |
|
图 3 SPR方法检测BSA含量的标准曲线 Figure 3 Standard curve for determination of BSA content by SPR method |
为验证SPR方法的重复性, 选取3种不同质量浓度的BSA标准品进行日内和日间重复性检测。由表 1和表 2可见:SPR方法检测BSA含量的日内RSD为1.12%~3.42%;日间RSD为0.84%~3.98%, 均小于5%, 这表明SPR方法检测BSA具有较好的重复性。
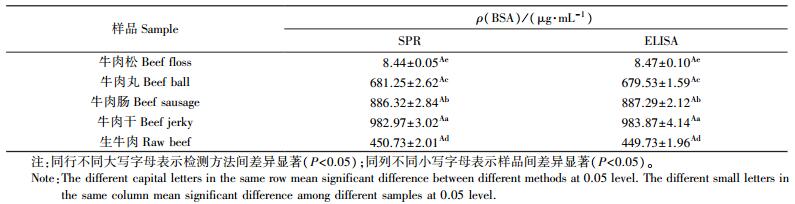
为证实SPR方法的准确性和实际应用价值, 选取5种不同的市售食品为研究对象, 比较SPR和ELISA检测结果。结果(表 3)显示, 2种方法检测不同市售食品结果, 无显著性差异(P>0.05)。从试验结果还可看出, 不同市售食品中BSA含量可能因其加工处理方式不同而存在显著差异(P < 0.05)。
|
近年来, 过敏疾病的患病率越来越高, 食物过敏问题已经成为重要的食品安全问题。虽然引起过敏反应的过敏原阈值因人而异, 但是微量甚至痕量的过敏原就会使绝大部分患者产生过敏症状。为避免过敏患者接触过敏原, 过敏原检测成为当务之急。SPR在食品安全分析方面已得到广泛应用, 但迄今针对食物过敏原检测方面的应用研究却相对较少[19]。
本研究将SPR技术应用于检测牛肉过敏原BSA展示了该技术的优越性。国外研究者通过双盲安慰剂对照食物激发试验证实摄入55 mg BSA可引发牛肉过敏患者的过敏症状[20]。此外, 《中华人民共和国药典》(2010年版)中规定生物制品中BSA残留量应低于50 ng·mL-1。本研究中SPR方法的线性回归方程为y=0.06x+8.16(R2=0.992), 其检测的线性范围为6.25~400 ng·mL-1, 检测限为33.68 ng·mL-1, 并在市售食品检测时发现, 该方法的检测结果与商业化ELSIA试剂盒差异不显著。该方法操作步骤简单, 检测周期短, 试剂用量和检测样本量小, 灵敏度高, 重复性好, 可以满足牛肉及其制品中过敏原BSA检测的需求。
本研究通过对牛肉过敏原蛋白SPR检测方法的初步研究, 可进一步拓展食物过敏原多样本和多组分的同时检测研究以及多组分高通量同时定量研究, 以解决食物过敏原及其制品同时快速检测的定性、定量鉴别问题。
| [1] | Wang W, Han J X, Wu Y, et al. Simultaneous detection of eight food allergens using optical thin-film biosensor chips[J]. Journal of Agriculture and Food Chemistry, 2011, 59(13): 6889–6894. DOI: 10.1021/jf200933b |
| [2] | Paschke A, Ulberth F. Allergens in foods[J]. Analytical and Bioanalytical Chemistry, 2009, 395(1): 15–16. DOI: 10.1007/s00216-009-2989-0 |
| [3] | Klug C, Focke M, Hemmer W, et al. Identification and characterization of meat allergens for improved diagnosis of meat allergy[J]. Clinical and Translational Allergy, 2013, 3(Suppl 3): 174. DOI: 10.1186/2045-7022-3-S3-P174 |
| [4] | Fiocchi A, Restani P, Riva E. Beef allergy in children[J]. Nutrition, 2000, 16(6): 454–457. DOI: 10.1016/S0899-9007(00)00285-9 |
| [5] |
郭玲, 刘爱国, 胡志和. 牛血浆中主要蛋白质的研究进展[J].
食品科学, 2009, 30(21): 489–492.
Guo L, Liu A G, Hu Z H. Research advances in main proteins in bovine blood plasma[J]. Food Science, 2009, 30(21): 489–492. DOI: 10.3321/j.issn:1002-6630.2009.21.111(in Chinese with English abstract) |
| [6] | Wang H Y, Li G, Wu Y J, et al. Development of an indirect competitive immunoassay for walnut protein component in food[J]. Food Chemistry, 2014, 147: 106–110. DOI: 10.1016/j.foodchem.2013.09.013 |
| [7] | Eischeid A C. Development and evaluation of a real-time PCR assay for detection of lobster, a crustacean shellfish allergen[J]. Food Control, 2016, 59: 393–399. DOI: 10.1016/j.foodcont.2015.06.013 |
| [8] | Monaci L, Pilolli R, de Angelis E, et al. Multi-allergen detection in food by micro high-performance liquid chromatography coupled to a dual cell linear ion trap mass spectrometry[J]. Journal of Chromatography A, 2014, 1358: 136–144. DOI: 10.1016/j.chroma.2014.06.092 |
| [9] | Mullett W M, Lai E P C, Yeung J M. Surface plasmon resonance-based immunoassays[J]. Methods, 2000, 22(1): 77–91. DOI: 10.1006/meth.2000.1039 |
| [10] | Shankaran D R, Gobi K V A, Miura N. Recent advancements in surface plasmon resonance immunosensors for detection of small molecules of biomedical, food and environmental interest[J]. Sensors and Actuators B:Chemical, 2007, 121(1): 158–177. DOI: 10.1016/j.snb.2006.09.014 |
| [11] | Inamori K, Kyo M, Nishiya Y, et al. Detection and quantification of on-chip phosphory-lated peptides by surface plasmon resonance imaging techniques using a phosphate capture molecule[J]. Analytical Chemistry, 2005, 77(13): 3979–3985. DOI: 10.1021/ac050135t |
| [12] | Kim M, Jung S O, Park K, et al. Detection of Bax protein conformational change using a surface plasmon resonance imaging-based antibody chip[J]. Biochemical and Biophysical Research Communications, 2005, 338(4): 1834–1838. DOI: 10.1016/j.bbrc.2005.10.155 |
| [13] | Forzani E S, Zhang H, Chen W, et al. Detection of heavy metal ions in drinking water using a high-resolution differential surface plasmon resonance sensor[J]. Environmental Science and Technology, 2005, 39(5): 1257–1262. DOI: 10.1021/es049234z |
| [14] | Mader C, Huber C, Moll D, et al. Interaction of the crystalline bacterial cell surface layer protein SbsB and the secondary cell wall polymer of Geobacillus stearothermophilus PV72 assessed by real-time surface plasmon resonance biosensor technology[J]. Journal of Bacteriology, 2004, 186(6): 1758–1768. DOI: 10.1128/JB.186.6.1758-1768.2004 |
| [15] | Rich R L, Myszka D G. Spying on HIV with SPR[J]. Trends in Microbiology, 2003, 11(3): 124–133. DOI: 10.1016/S0966-842X(03)00025-8 |
| [16] | Quinn J G, Neill S O, Doyle A, et al. Development and application of surface plasmon resonance-based biosensor for the detection of cell-ligand interactions[J]. Analytical Biochemistry, 2000, 281(2): 135–143. DOI: 10.1006/abio.2000.4564 |
| [17] |
朱业培, 王玮, 吕青骎, 等. 动物过敏原牛血清白蛋白间接竞争ELISA检测方法的建立[J].
南京农业大学学报, 2016, 39(2): 305–311.
Zhu Y P, Wang W, Lü Q Q, et al. Development of an indirect competitive ELISA for detection of animal allergen bovine serum albumin[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 305–311. DOI: 10.7685/jnau.20150814(in Chinese with English abstract) |
| [18] | Apostol I, Miller K J, Ratto J, et al. Comparison of different approaches for evaluation of the detection and quantitation limits of a purity method:a case study using a capillary isoelectrofocusing method for a monoclonal antibody[J]. Analytical Biochemistry, 2009, 385(1): 101–106. DOI: 10.1016/j.ab.2008.09.053 |
| [19] |
石良, 王锡昌, 刘源, 等. 食物过敏原免疫学检测技术研究进展[J].
分析测试学报, 2010, 29(9): 981–986.
Shi L, Wang X C, Liu Y, et al. Research progress on immunoassays for food allergen[J]. Journal of Instrumental Analysis, 2010, 29(9): 981–986. (in Chinese with English abstract) |
| [20] | Kanny G, de Hauteclocque C, Moneret-Vautrin D A. Food anaphylaxis to bovine serum albumin[J]. Journal of Allergy and Clinical Immunology, 1998, 101(1): 137–139. DOI: 10.1016/S0091-6749(98)70210-6 |