文章信息
- 李平华, 黄阳, 贺丽春, 汪涵, 牛清, 龚磊, 黄瑞华
- LI Pinghua, HUANG Yang, HE Lichun, WANG Han, NIU Qing, GONG Lei, HUANG Ruihua
- 不同来源油脂及剂量对仔猪生长性能和血清脂质指标以及肝脏胆固醇代谢的影响
- Effects of dietary fat source and dosage on growth performance, serum lipid index and liver cholesterol metabolism of piglets
- 南京农业大学学报, 2017, 40(4): 710-717
- Journal of Nanjing Agricultural University, 2017, 40(4): 710-717.
- http://dx.doi.org/10.7685/jnau.201606038
-
文章历史
- 收稿日期: 2016-06-29
2. 南京农业大学淮安研究院, 江苏 淮安 223005;
3. 江苏省如皋市长寿集团友联畜牧有限公司, 江苏 如皋 226532
2. Huai'an Academy of Nanjing Agricultural University, Huai'an 223005, China;
3. Youlian Animal Husbandry Co. Ltd., the Changshou Group Corporation, Rugao 226532, China
新生仔猪在面临出生后营养物质供给和生活环境的巨大变化, 会产生很大的应激反应, 同时仔猪断奶后, 由于断奶应激, 加上仔猪体脂含量偏低, 会导致供能不足, 死亡率升高, 影响总体生产成绩, 降低生产效率[1]。为满足仔猪的快速生长, 需要提高日粮中养分浓度和能量水平。脂肪是效率最高的能量物质, 在仔猪断奶前、后教槽料中添加油脂, 可为仔猪特别是弱小仔猪提供快速可以利用的能量, 促进生长[2], 但对于选用何种类型油脂及其添加剂量仍存在一定争议。油脂由甘油和脂肪酸两部分组成的, 其中甘油的质量仅占油脂的5%左右, 不同油脂中所含脂肪酸的种类、结构和性质对油脂的理化特性和总营养价值有着直接的关系。油脂中脂肪酸的种类和油脂添加剂量对动物的生长代谢均有不同的影响, 特别是脂肪酸饱和程度和脂肪酸链的长短, 都会影响仔猪对油脂的消化率[3], 因此为仔猪选用适宜类型和剂量的油脂具有重要价值。
脂类是动物体的重要组成部分, 其中胆固醇不仅是生物体细胞膜的组成成分, 也是维生素D、类固醇激素和胆汁酸等的前体物质, 对机体的生命活动具有重要作用。胆固醇过高会增加动脉粥样硬化和心脏病的危险, 因此维持机体胆固醇的内环境稳态对机体非常重要。肝脏是胆固醇代谢的主要场所, 在维持机体胆固醇稳态方面具有重要作用, 并参与调控胆固醇代谢过程中对外源胆固醇的摄取、胆固醇的内源性合成以及胆固醇转化为胆汁酸, 而这些代谢过程中起关键作用的酶分别是低密度脂蛋白受体(low density lipoprotein-receptor, LDLR)、3-羟-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGCR)和胆固醇7α-羟化酶(cholesterol 7 alpha-hydroxylase, CYP7A1)[4-5]。同时, 胆固醇代谢过程中, 不论是在生物体内的运输, 还是外源胆固醇的吸收, 胆固醇都是以胆固醇酯的形式存在并参与相关代谢活动的, 而机体内多余的胆固醇也是以胆固醇酯的形式储存。乙酰辅酶A乙酰基转移酶(acetyl coenzyme A acetyltransferase, ACAT)是生物体内催化胆固醇与脂肪酸结合生成胆固醇酯的酶, 因此是生物体内参与胆固醇代谢的一个重要酶[6]。影响肝脏胆固醇代谢的一个重要因素就是营养。近年来, 对于在动物饲料中添加油脂的研究以及日粮中脂类添加对机体生长性能, 肝脏胆固醇合成、转运、分泌和转化影响的研究越来越多, 主要集中在脂肪酸的饱和程度以及长链脂肪酸和中链脂肪酸添加效果的研究上, 但研究结果存在较大差异。有研究发现添加油脂对仔猪采食量、日增重没有显著影响[7], 也有研究发现添加油脂能够升高[8]或者降低[9]生长性能。中链脂肪酸能升高[10]或者降低[11]血清甘油三酯和总胆固醇含量, 而椰子粉富含以饱和中链脂肪酸为主的椰子油, 豆油富含多不饱和长链脂肪酸。关于仔猪日粮中添加椰子油或是豆油及其适宜添加量的研究较少。本试验通过分析日粮中添加不同类型和剂量的油脂对仔猪生长性能、血清脂质指标和肝脏胆固醇代谢关键酶的酶活性及其相关基因表达量的影响, 为仔猪实际生产中选用适宜剂量和类型的油脂提供试验依据。
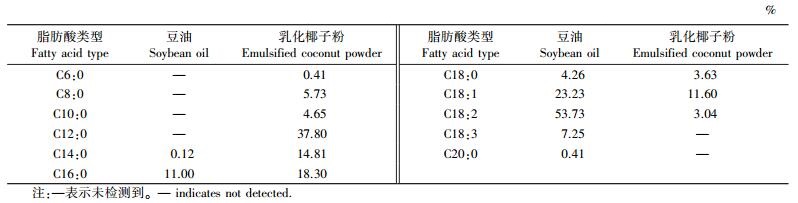
1 材料与方法 1.1 试验材料及仪器 1.1.1 试验材料试验中使用的豆油和乳化椰子粉由南京郁氏农牧开发有限公司提供(豆油和乳化椰子粉中脂肪酸含量见表 1)。其他化学试剂如盐酸、乙醚、石油醚(沸程30~60 ℃)、无水乙醇等, 均为分析纯; HMGCR ELISA测定试剂盒、ACAT ELISA测定试剂盒、CYP7A1 ELISA测定试剂盒均购自南京建成生物工程研究所; 定量PCR反应引物由上海捷瑞生物工程有限公司合成。
|
低温高速离心机(美国Kaltis 390)、全自动生化分析仪(奥林巴斯Au2700)、电子天平(Startarious)、华东电子酶标仪(DG5033A)、超微量可见分光光度计(Thermo NANO DROP 1000), 7300实时荧光定量PCR仪、梯度PCR仪(美国Applied Biosystems公司)、电泳凝胶成像系统(美国Bio-Rad公司)。
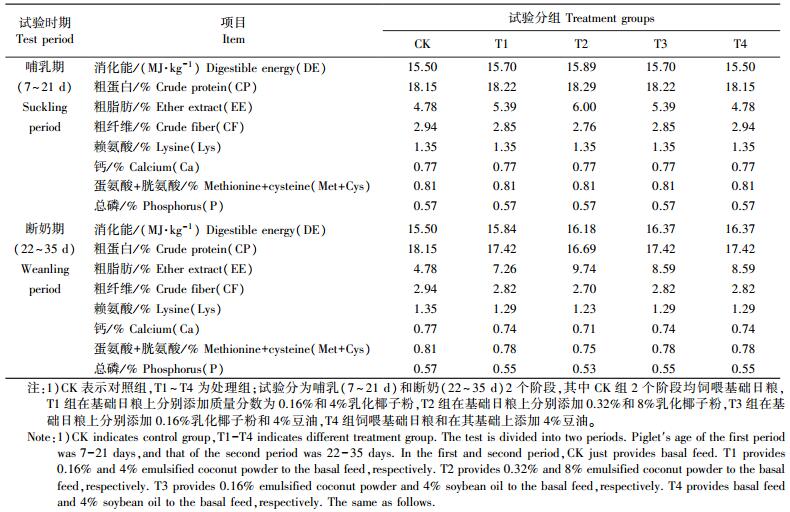
1.1.3 试验动物和日粮试验动物为江苏省如皋市长寿集团友联畜牧有限公司提供的母本胎次相近(3~5胎)、初生日期相近(3天以内)的7日龄健康长大二元杂交仔猪20窝。试验仔猪在整个试验期的基础日粮为南京郁氏农牧开发有限公司提供的乳猪料。试验各组日粮营养水平见表 2。
试验动物以窝为单位随机分为5个组, 分别标注为对照组(CK组)和4个处理组(T1~T4), 每组4窝(重复), 每窝不少于8头。试验分为哺乳期(前期)和断奶期(后期)2个时期进行, 分别对应为仔猪出生后7日龄到仔猪断奶(21日龄)和22~35日龄。5组仔猪在2个时期的日粮组成分别为:CK组前、后期均喂乳猪料; T1组前期是在乳猪料基础上添加0.16%(质量分数, 以下均同)乳化椰子粉, 后期是乳猪料基础上添加4%乳化椰子粉; T2组前期是在乳猪料基础上添加0.32%乳化椰子粉, 后期是在乳猪料基础上添加8%乳化椰子粉; T3组前期是在乳猪料基础上添加0.16%乳化椰子粉, 后期是在乳猪料基础上添加4%豆油; T4组前期是乳猪料, 后期是在乳猪料基础上添加4%豆油。
1.2.2 饲养管理在整个试验期, 所有仔猪在同一栋猪舍饲养, 自由采食和饮水, 猪舍内部各个区域温湿度一致, 试验哺乳期舍内温度设定为25 ℃, 断奶期舍内温度设定为23 ℃。仔猪日常清理和免疫按照猪场正常程序进行。同时, 为做好试验日粮从哺乳到断奶时期过渡, 将哺乳期和断奶时期的日粮分别按照质量比为2 : 1、1 : 1、1 : 2的比例混匀饲喂, 过渡期为3 d。
1.2.3 试验样品采集在试验的哺乳期结束和断奶期结束时, 分别从每窝仔猪中挑选接近该窝仔猪平均体质量的一公一母2个个体, 在屠宰之前进行前腔静脉采血, 分离血清, -80 ℃保存后用于检测与分析。仔猪屠宰后, 进行后续试验需要的样品采集工作。肝脏样品均取自不同试验仔猪肝脏的相同部位, 放入冻存管中, 然后-80 ℃保存备用。
1.3 测定指标 1.3.1 生长性能指标分别在仔猪试验开始前(7日龄)、仔猪断奶时(21日龄)和试验结束后(35日龄), 对每窝仔猪逐个称量体质量, 并记录个体质量, 然后按照试验分组, 计算每个试验组仔猪在不同时期的平均体质量, 计算仔猪的平均日增重(average daily gain, ADG); 在试验期间, 每天记录仔猪的饲料饲喂量和剩余量, 计算仔猪平均日采食量(average daily feed intake, ADFI); 并计算试验期仔猪的料重比(feed to gain ratio, F/G)。仔猪于断奶前以采食母乳为主, 因此在试验的哺乳期不计算仔猪料重比。
1.3.2 血清脂质指标分别测定血清中总胆固醇(total cholesterol, TC)、甘油三酯(total glyceride, TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)含量, 血清脂质指标的测定由南京军区总医院生化检验科采用全自动生化分析仪检验, 各指标的测定都是按照相关试剂盒方法进行, 其中总胆固醇采用酶终点法, 甘油三酯采用GPO-PAP法, 高密度脂蛋白胆固醇和低密度脂蛋白胆固醇采用化学沉淀法。
1.3.3 肝脏胆固醇代谢相关酶活性及相关基因表达水平分析断奶时期结束后采集35日龄仔猪的肝脏样品进行前处理, 编号分装并送检, 分别测定肝脏胆固醇代谢相关的乙酰辅酶A乙酰基转移酶(ACAT)、羟甲基戊二酸单酰辅酶A还原酶(HMGCR)和胆固醇7α-羟化酶(CYP7A1) 的活性, 并测定CYP7A1、LDLR和HMGCR基因mRNA表达量。其中酶活性测定试剂盒购自南京建成生物工程研究所, 按照文献[12]中的步骤进行。mRNA表达量采用荧光定量PCR方法测定, 每个个体测定3组重复。
总RNA的提取和cDNA的制备:仔猪肝脏样品总RNA提取按常规Trizol法进行。RNA浓度测定采用Thermo NANO DROP 1000超微量可见分光光度计。RNA反转录在PCR仪上进行, 采用20 μL反转录体系, 其中包括4 μL 5 × PrimeScriptTM Buffer、0.5 μL Random 6 mers(100 mol·L-1)、1 μL PrimeScriptTMRT Enzyme Mix、0.5 μL Oligo dT Prmier(50 mol·L-1)、500 ng总RNA和剩余体积的ddH2O。反转录反应条件:37 ℃, 15 min; 85 ℃, 5 s; 4 ℃保存。反转录生成的cDNA于-20 ℃保存备用。
引物设计与PCR扩增:基因引物采用Primer Premier 5.0软件设计, 各个基因的引物序列见表 3。

|
CYP7A1、LDLR和HMGCR mRNA表达量的检测采用Real-time PCR技术, 以GAPDH为内参。PCR反应体系20 μL, 包括10 μL Premix Ex Taq酶、引物各0.4 μL、2.0 μL cDNA模板、0.4 μL ROX Reference Dye和6.8 μL ddH2O。反应程序:95 ℃, 30 s; 95 ℃, 5 s, 60 ℃, 34 s, 共40个循环。采用2-ΔΔCT方法计算各目的基因的相对表达量[13]。
1.4 数据处理与统计分析试验数据采用SPSS 18.0软件进行单因素方差分析, 并用Duncan′s法进行多重比较, 其中, 日增重、日采食量和料重比分析时将试验组初始体质量作为协变量进行分析, 试验的数据均以平均值±标准误(x±SE)表示。
2 结果与分析 2.1 不同来源油脂及剂量对仔猪生长性能的影响从表 4可以看出:试验开始时各组仔猪体质量差异不显著(P > 0.05);21日龄时, 与饲喂基础乳猪料的T4组相比, 添加0.32%乳化椰子粉(T2) 组仔猪体质量增加, 仔猪平均日采食量降低(P < 0.1), 但各组仔猪哺乳时期生长性能各指标差异不显著(P > 0.05)。

|
断奶阶段:与对照组相比, 各处理35日龄仔猪体质量差异不显著(P > 0.05)。同时, 断奶阶段的平均日采食量、日增重和料重比也无显著差异(P > 0.05)。
2.2 不同来源油脂及剂量对仔猪血清脂质指标的影响试验哺乳期对照组(CK)与T4组饲喂相同的对照日粮, 因此分析时将两组合并为CK+T4组, 同时T1与T3组饲喂相同的低剂量乳化椰子粉日粮, 因此分析时将两组合并为T1+T3组。从表 5可以看出:在试验哺乳期, 相比于对照组, 低剂量与高剂量的乳化椰子粉使仔猪血清甘油三酯含量分别提高了8.54%和7.32%, 但差异不显著(P > 0.05);同时, 添加不同剂量乳化椰子粉对21 d仔猪血清中总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇含量也无显著影响(P > 0.05)。

|
从表 6可以看出:与对照组相比, 断奶期高剂量乳化椰子粉的添加(T2组)可显著增加血清总胆固醇含量(P < 0.05), 同时血清甘油三酯、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇含量均增加, 分别提高了24.49%、15.32%和12.79%, 但差异不显著(P > 0.05), 其中血清甘油三酯和高密度脂蛋白胆固醇呈明显升高的趋势(P < 0.1)。比较T1和T2组会发现, 高剂量的乳化椰子粉与低剂量相比显著增加血清总胆固醇含量(P < 0.05)。与对照组相比, 添加低剂量豆油(T4) 使仔猪血清总胆固醇和甘油三酯含量分别增加了13.33%和18.37%, 但差异不显著(P > 0.05)。同时, 比较T1和T3组会发现, 在哺乳期添加低剂量椰子粉基础上, 断奶期添加低剂量豆油与椰子粉对仔猪血清脂质指标均无显著影响, 且两组间无显著差异(P > 0.05)。

|
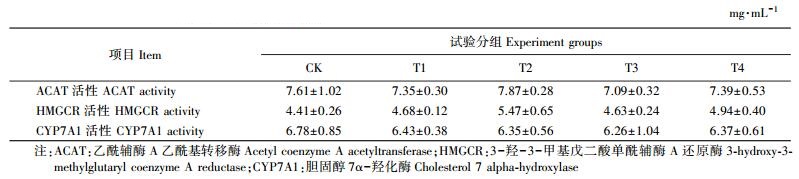
由表 7可见:与对照组相比, 添加不同来源和剂量油脂会增加HMGCR酶活性, 降低CYP7A1酶活性, 但差异不显著(P > 0.05), 其中, 仅8%乳化椰子粉有增加HMGCR酶活性的趋势(P < 0.1)。添加高剂量椰子粉虽然能增加ACAT酶活性, 但差异也不显著(P > 0.05)。
|
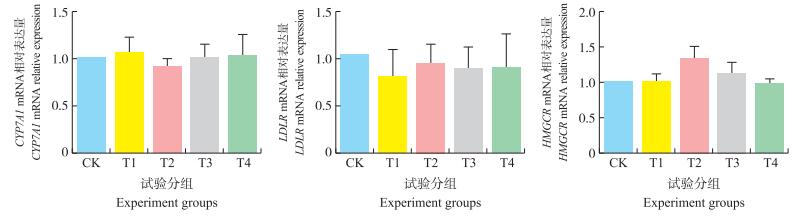
由图 1-A可知:添加8%乳化椰子粉的T2组仔猪肝脏中CYP7A1 mRNA相对表达量比对照组低10%(P > 0.05), 且各试验组肝脏中CYP7A1 mRNA表达水平与对照组相比, 均无显著差异(P > 0.05)。
|
图 1 不同来源油脂及剂量对仔猪肝脏CYP7A1、LDLR、HMGCR mRNA相对表达量的影响 Figure 1 Effect of dietary fat source and dosage on mRNA relative expression levels of liver CYP7A1, LDLR, HMGCR gene of piglet |
由图 1-B可知:与对照组相比, 各试验组肝脏LDLR基因mRNA表达水平差异不显著(P > 0.05)。其中, 添加4%乳化椰子粉T1组和添加4%豆油的T3、T4组中肝脏LDLR基因mRNA表达量比对照组分别降低了19%、11%和10%(P > 0.05)。
2.4.3 对仔猪肝脏HMGCR mRNA相对表达量的影响由图 1-C可知:各组HMGCR基因表达水平与对照组差异均不显著(P > 0.05), 但其中添加8%乳化椰子粉组(T2) 比对照组增加了33%(P < 0.1)。
3 讨论 3.1 不同来源油脂及剂量对仔猪生长性能的影响早期对日粮中添加油脂对断奶仔猪影响研究很多, 得出的结论大部分都是日粮中添加油脂没有显著影响仔猪的生产性能[14]。但是由于养殖业的迅速发展, 为了提高生产效率, 仔猪断奶技术早已开始普及, 早期断奶对仔猪最大的影响就是断奶应激, 营养来源的改变导致仔猪采食量低, 营养物质摄取不足, 从而影响仔猪的生长。人们对于油脂在日粮中的添加又重新开始研究。本试验结果显示, 日粮中不同来源油脂及剂量对仔猪在各个时期的体质量变化和平均日采食量、平均日增重以及料重比等生长性能指标无显著影响, 这与前人的研究结果[9]一致, 而Dove等[15]研究表明日粮中添加油脂能显著提高仔猪的平均日增重。同时也有研究表明, 日粮中添加油脂对断奶仔猪2周之后的生产性能有明显的提高, 但是对断奶仔猪2周内的生产性能影响不大[7]。
影响日粮中油脂添加对仔猪应用效果的因素很多, 如油脂类型、添加剂量、试验动物种类和大小等。不同油脂中脂肪酸不同, 而脂肪酸的饱和程度和脂肪酸碳链的长短是影响油脂利用效果的主要因素。短、中链脂肪酸相比较长链脂肪酸更易被吸收, 而不饱和脂肪酸比饱和脂肪酸的消化率更高[16]。油脂添加对仔猪断奶初期的应用效果不佳的原因可能是由于断奶应激造成仔猪采食量的下降, 尽管断奶仔猪营养摄入不足, 需要通过日粮进行补充, 但是由于采食量偏低, 导致日粮中添加油脂仍然不能满足仔猪生长需要。断奶仔猪消化系统发育不完善和体内脂肪酶活性低可能是油脂添加效果不佳的另一个原因。仔猪早期断奶后, 消化道内绝大多数酶的活性有所降低, 并需要一段时间进行恢复[17]。对于油脂在早期断奶仔猪日粮中添加的应用效果的影响因素, 还有待进一步研究。
3.2 不同来源油脂及剂量对仔猪血清脂质指标的影响本试验的结果表明, 在试验的第1期, 添加不同剂量的椰子油对哺乳仔猪的血液指标无显著影响。这一时期仔猪处于哺乳阶段, 其主要营养和能量来源依旧是母乳, 而且这个时期仔猪的胃肠道消化系统机能还不完善, 对于补饲饲料中的营养物质的利用效率不高可能是导致椰子油应用效果不佳的原因。在试验的第2期, 由于断奶应激及自身发育特点, 仔猪在断奶的前2个星期对饲料的采食量并不高, 再加上饲料和母乳相比, 干物质消化能相差甚大, 可能导致仔猪对饲料的利用效率并不高。本试验中, 添加4%豆油对断奶仔猪的血脂指标没有显著的影响。但对人类的研究结果表明, 单不饱和脂肪酸和多不饱和脂肪酸均有良好的降低血清总胆固醇、甘油三酯和低密度脂蛋白胆固醇的作用[18]。本试验添加8%乳化椰子粉提高了仔猪血清总胆固醇水平, 这与Cater等[10]的结果一致。李珂[19]的研究结果表示, 高脂日粮的摄入提高血清甘油三酯、总胆固醇和低密度脂蛋白胆固醇的含量。在本试验中, 相比较于添加低剂量的乳化椰子粉, 添加高剂量显著提高了血清中总胆固醇含量。但是, 长期饲喂高脂日粮会导致仔猪血脂代谢水平过高, 可能会引发动脉粥样硬化。
仔猪早期断奶应激给仔猪的生长发育带来了极大的不利, 尽管这个时候仔猪对饲料的利用效率不佳, 但还是必须要通过日粮中添加油脂等营养物质来保证仔猪生长发育所必需的养分[20]。血清总胆固醇和甘油三酯常用作脂代谢的最主要指标, 通过总胆固醇和甘油三酯的含量可以准确估算出机体脂代谢的强弱, 进而判断日粮添加油脂的不同种类和剂量对仔猪脂代谢的影响, 为生产中油脂的利用提供理论依据和判断标准。
3.3 不同来源油脂及剂量对仔猪肝脏胆固醇代谢相关酶活性和基因表达量的影响本试验结果显示, 添加不同种类和剂量的油脂对断奶仔猪肝脏中ACAT、HMGCR和CYP7A1酶活性无显著影响, 但是8%乳化椰子粉有增加HMGCR酶活性的趋势。HMGCR酶是机体内源合成胆固醇的关键酶, 它的活性除了受到激素影响, 还受自身胆固醇水平的负反馈调节。当自身胆固醇水平升高, 会抑制其活性, 减少胆固醇的内源性合成, 而当机体胆固醇水平降低, 可上调其活性, 促使胆固醇合成的增加, 维持机体胆固醇稳态[21]。Duckworth等[22]研究表明HMGCR酶活性与其mRNA表达量成线性关系, 本研究也发现8%乳化椰子粉有增加HMGCR基因表达的趋势。Harding等[23]的研究也表明高脂饮食可以诱导肝脏HMGCR基因的表达。
肠道ACAT可以调节胆固醇的吸收。饱和脂肪酸可以通过抑制肝脏中ACAT活性, 导致血清游离胆固醇升高, 而大量的游离胆固醇抑制LDLR的表达, 最终使血清TC升高[24]。CYP7A1是体内胆固醇转变为胆汁酸过程中的限速酶, 它的活性和表达量影响着胆汁酸的生成, 对体内胆固醇的稳态非常重要。研究表明, 胆汁酸能有效抑制CYP7A1的活性[25]。本研究结果显示, 添加不同油脂对CYP7A1活性无影响, 说明不同种类和剂量的油脂对体内胆固醇代谢的调节可能没有影响到体内胆固醇的正常转化过程, 因而没有引起CYP7A1活性的变化。同时, 添加不同种类和剂量的油脂对断奶仔猪肝脏胆固醇代谢相关基因CYP7A1、LDLR和HMGCR的表达量均无显著的影响, 这在一定程度上解释了CYP7A1酶活性在各处理组与对照组之间无显著差异的原因。
机体胆固醇代谢是一个非常复杂的过程。本研究中发现日粮添加不同油脂对肝脏胆固醇代谢相关酶活和基因表达量均没有显著影响, 但是添加8%乳化椰子粉组仔猪肝脏HMGCR酶活性和HMGCR基因表达呈增加趋势, 而添加8%乳化椰子粉又显著增加血清总胆固醇含量。我们推测可能是高剂量的饱和脂肪酸增加了仔猪肝脏胆固醇的内源性生物合成, 导致血清总胆固醇含量增加, 但是对于油脂添加改变机体胆固醇代谢的机制, 还有待更深入地研究。
| [1] | Lallès J P, Bosi P, Smidt H, et al. Weaning-A challenge to gut physiologists[J]. Livestock Science, 2007, 108: 82–93. DOI: 10.1016/j.livsci.2007.01.091 |
| [2] |
刘元述, 戴德渊. 椰子油在猪日粮中的应用探讨[J].
饲料工业, 2010, 31(13): 50–52.
Liu Y S, Dai D Y. Explore the coconut oil used in swine diets[J]. Feed Industry Magazine, 2010, 31(13): 50–52. DOI: 10.3969/j.issn.1001-991X.2010.13.016(in Chinese with English abstract) |
| [3] | Cera K R, Mahan D C, Reinhart G A. Apparent fat digestibilities and performance responses of postweaning swine fed diets supplemented with coconut oil, corn oil or tallow[J]. Journal of Animal Science, 1989, 67: 2040–2047. DOI: 10.2527/jas1989.6782040x |
| [4] | Trapani L, Segatto M, Simeoni V, et al. Short-and long-term regulation of 3-hydroxy 3-methylglutaryl coenzyme A reductase by a 4-methylcoumarin[J]. Biochimie, 2011, 93(7): 1165–1171. DOI: 10.1016/j.biochi.2011.04.009 |
| [5] | Pikuleva I A. Cytochrome P450s and cholesterol homeostasis[J]. Pharmacology and Therapeutics, 2006, 112(3): 761–773. DOI: 10.1016/j.pharmthera.2006.05.014 |
| [6] |
李伯良, 段治军. 胆固醇代谢平衡调控的分子机理[J].
生物工程进展, 1996, 16(5): 27–33.
Li B L, Duan Z H. Molecular mechanisms of regulation of cholesterol homeostasis[J]. Progress in Biotechnology, 1996, 16(5): 27–33. (in Chinese with English abstract) |
| [7] | Li D F, Thaler R C, Nelssen J L, et al. Effect of fat sources and combinations on starter pig performance, nutrient digestibility and intestinal morphology[J]. Journal of Animal Science, 1990, 68: 3694–3704. DOI: 10.2527/1990.68113694x |
| [8] | Dove C R. The effect of adding copper and various fat sources to the diets of weanling swine on growth performance and serum fatty acid profiles[J]. Journal of Animal Science, 1993, 71: 2187–2192. |
| [9] | Tokach M, Pettigrew J, Johnston L, et al. Effect of adding fat and(or)milk products to the weanling pig diet on performance in the nursery and subsequent grow-finish stages[J]. Journal of Animal Science, 1995, 73: 3358–3368. DOI: 10.2527/1995.73113358x |
| [10] | Cater N B, Heller H J, Denke M A. Comparison of the effects of medium-chain triacylglycerols, palm oil, and high oleic acid sunflower oil on plasma triacylglycerol fatty acids and lipid and lipoprotein concentrations in humans[J]. The American Journal of Clinical Nutrition, 1997, 65(1): 41–45. |
| [11] |
薛长勇, 刘英华, 王觐, 等. 中长链脂肪酸食用油对高甘油三酯血症患者脂代谢的影响[J].
营养学报, 2008, 30(4): 363–368.
Xue C Y, Liu Y H, Wang J, et al. Effects of medium and long chain fatty acid triacylglycerol on lipid metabolism in hypertriacylglyerolemia patients[J]. Acta Nutrimenta Sinica, 2008, 30(4): 363–368. (in Chinese with English abstract) |
| [12] |
肖越. SCF/c-Kit信号通路在抑郁症致病机理中的作用[D]. 上海: 上海交通大学, 2010: 121-124.
Xiao Y. The role of SCF/c-Kit signaling pathway in the pathogenesis of depression[D]. Shanghai:Shanghai Jiaotong University, 2010:121-124(in Chinese with English abstract). |
| [13] | Lee E J, Schmittgen T D. Comparison of RNA assay methods used to normalize cDNA for quantitative real-time PCR[J]. Analytical Biochemistry, 2006, 357(2): 299–301. DOI: 10.1016/j.ab.2006.06.011 |
| [14] |
张鹤亮, 呙于明. 断奶仔猪脂肪营养研究进展[J].
中国饲料, 1998, 19: 15–17.
Zhang H L, Guo Y M. Weaned fat nutrition research progress[J]. China Feed, 1998, 19: 15–17. (in Chinese with English abstract) |
| [15] | Dove C R, Haydon K D. The effect of copper and fat addition to the diets of weanling swine on growth performance and serum fatty acids[J]. Journal of Animal Science, 1992, 70: 805–810. DOI: 10.2527/1992.703805x |
| [16] | Freeman C P. Properties of fatty acids in dispersions of emulsified lipid and bile salt and the significance of these properties in fat absorption in the pig and the sheep[J]. British Journal of Nutrition, 1969, 23(2): 249–263. DOI: 10.1079/BJN19690032 |
| [17] |
蒋宗勇. 仔猪早期断奶营养综合症及其防治[J].
广东畜牧兽医科技, 1994(3): 23–24.
Jiang Z Y. Advances in early weaning piglet syndrome and its prevention[J]. Animal Husbandry and Veterinary Medicine Technology in Guangdong, 1994(3): 23–24. (in Chinese with English abstract) |
| [18] |
戴军, 苏宜香. 膳食脂肪酸与血脂及动脉粥样硬化[J].
中国公共卫生, 1998, 14(8): 4942–4961.
Dai J, Su Y X. Dietary fatty acids and lipids and atherosclerosis[J]. Chinese Journal of Public Health, 1998, 14(8): 4942–4961. (in Chinese with English abstract) |
| [19] |
李珂. 高脂日粮诱导肥胖表型猪相关基因差异表达分析及分子网络构建[D]. 雅安: 四川农业大学, 2011: 18-19.
Li K. Differential expression analysis and molecular network reconstruction for genes associated with obesity in an obese pig model induced by high-fat diet[D]. Ya'an:Sichuan Agricultural University, 2011:18-19(in Chinese with English abstract). |
| [20] |
陈才勇, 王恬. 油脂在断奶仔猪生产中应用的最新研究进展[J].
饲料世界, 2003(3): 7–9.
Chen C Y, Wang T. Latest research progress of grease applications in weaned production[J]. The World of Feed, 2003(3): 7–9. (in Chinese with English abstract) |
| [21] | Lefebvre P, Cariou B, Lien F, et al. Role of bile acids and bile acid receptors in metabolic regulation[J]. Physiological Reviews, 2009, 89(1): 147–191. DOI: 10.1152/physrev.00010.2008 |
| [22] | Duckworth P F, Vlahcevic Z R, Studer E J, et al. Effect of hydrophobic bile acids on 3-hydroxy-3-methylglutaryl-coenzyme A reductase activity and mRNA levels in the rat[J]. Journal of Biological Chemistry, 1991, 266(15): 9413–9418. |
| [23] | Harding S V, Rideout T C, Jones P J H. Hepatic nuclear sterol regulatory binding element protein 2 abundance is decreased and that of ABCG5 increased in male hamsters fed plant sterols[J]. The Journal of Nutrition, 2010, 140(7): 1249–1254. DOI: 10.3945/jn.109.120311 |
| [24] | Montano C E, Fernandez M L, McNamara D J. Regulation of apolipoprotein B-containing lipoproteins by vitamin C level and dietary fat saturation in guinea pigs[J]. Metabolism, 1998, 47(7): 883–891. DOI: 10.1016/S0026-0495(98)90131-7 |
| [25] | Crestani M, Karam W G, Chiang J Y L. Effects of bile acids and steroid/thyroid hormones on the expression of cholesterol 7α-hydroxylase mRNA and the CYP7 gene in HepG2 cells[J]. Biochemical and Biophysical Research Communications, 1994, 198(2): 546–553. DOI: 10.1006/bbrc.1994.1080 |