文章信息
- 高志参, 李照耀, 周静, 陈婧, 周斌
- GAO Zhican, LI Zhaoyao, ZHOU Jing, CHEN Jing, ZHOU Bin
- 4个种属Mx蛋白抑制水疱性口炎病毒的研究
- Research of Mx proteins from four species against vesicular stomatitis virus
- 南京农业大学学报, 2017, 40(4): 690-696
- Journal of Nanjing Agricultural University, 2017, 40(4): 690-696.
- http://dx.doi.org/10.7685/jnau.201703023
-
文章历史
- 收稿日期: 2017-03-27
Lindenmann等[1-2]于1962年首次研究发现一近交小鼠品系A2G小鼠能高度抵制流感病毒的感染, 而这种抗性由16号常染色体上的单基因Mx 1控制[3]。之后, 研究人员一直探索Mx蛋白抗病毒的分子机制[4]。如同发动蛋白(dynamin)一样, Mx蛋白也是进化保守的GTP酶家族成员之一, 因此, 其也同样具有N端GTP酶结构域(G)、中央结构域(MD)和C端GTP酶效应结构域(GED), 但其缺乏参与膜定位的PH结构域和参与蛋白间互作的PR结构域[5-6]。Mx蛋白的寡聚与GTP酶水解活性都是其抗病毒活性所必需的条件。MxA蛋白晶体结构[7]显示:MxA蛋白的MD和GED共同组成了一个茎结构, 茎结构通过束信号元件(BSE)与G相联; 茎结构C端附近的Loop L4环(532~572位氨基酸)和2C12表位是MxA蛋白靶标识别病毒的重要结构, 将Loop L4环缺失掉将会损害其抗病毒活性。
Mx蛋白不但能抑制RNA病毒, 也能抑制DNA病毒。例如, 人MxA蛋白能抑制丙型肝炎病毒(HBV)[8]及非洲猪瘟病毒(ASFV)[9]的复制。另外, 不同种属Mx蛋白具有特定的抗病毒活性, 且Mx蛋白的亚细胞定位会影响其抗病毒特异性。通常胞核Mx蛋白(如小鼠Mx1蛋白)能抑制在胞核中复制的病毒(如流感病毒[10]和托高土病毒[11]等), 而胞质Mx蛋白(如小鼠Mx2蛋白)能抑制在胞质中复制的病毒(如水疱性口炎病毒[12]和汉坦病毒[13]等)。
水疱性口炎病毒(VSV)是一种线性、不分节段的单股负链RNA病毒, 属于弹状病毒科、水疱病毒属, 病毒粒子呈子弹状或圆柱状, 有囊膜。G蛋白是VSV的囊膜糖蛋白, 它在病毒识别、结合宿主细胞受体与成熟病毒粒子的出芽过程中都发挥着重要作用; G蛋白决定着VSV的毒力, 其被敲除后能降低VSV的感染性, 而G蛋白抗体能有效中和VSV; G蛋白是VSV的保护性抗原, 能诱导机体产生中和抗体, 呈型、亚型、甚至株的特异性。牛、马、猪是VSV的主要易感宿主, 患病动物多表现为口腔黏膜、舌、唇、乳头和蹄冠部上皮发生水疱[14]。人与患病动物接触也易感本病, 患者无临床症状或仅表现为轻微的流感样症状, 因此, 防控本病有一定的公共卫生意义。然而, 目前还没有较成功的商品化疫苗来防控本病。因此探索新的抗VSV途径, 研制新型抗病毒蛋白制剂显得尤为重要。
本研究拟探讨4个种属Mx蛋白(猪、人、小鼠、牛)的抗VSV活性, 这对于揭示Mx蛋白的保守性结构赋予其自身特定抗病毒特性机制具有一定的意义, 也为探索抗VSV制剂等新的抗病毒方法奠定基础。
1 材料与方法 1.1 细胞系和病毒PK-15细胞、Vero细胞和水疱性口炎病毒(VSV, Indiana serotype)均为南京农业大学农业部动物疫病诊断与免疫重点开放实验室保存。
1.2 主要试剂RPMI-1640、DMEM、Opti-MEM营养液(Gibco公司); 胎牛血清(Gibco公司); 青链霉素(Hyclone公司); Platinum® Taq DNA Polymerase High Fidelity、LipofectamineTM 3000 Reagent(Invitrogen公司); 核酸电泳琼脂糖、低熔点琼脂糖(Sigma公司); DNA marker(DL5000)、Hand Ⅲ、Xho Ⅰ、T4 DNA ligase、DNA胶回收试剂盒、质粒小提试剂盒、Trizol试剂、PrimeScriptTM RT Master Mix、SYBR Premix Ex Taq(Tli RNaseH Plus)(TaKaRa公司); RIPA裂解液、4%多聚甲醛、结晶紫(碧云天公司); 聚偏二氟乙烯膜(PVDF膜)、ECL化学发光检测试剂盒(Bio-Rad公司); α-Mx1单克隆抗体(能交叉识别不同种属的Mx蛋白, 有良好的保守性)、荧光二抗羊抗鼠IgG(488)、荧光二抗羊抗兔IgG(568)(Abcam公司); 羊抗鼠IgG-HRP、羊抗兔IgG-HRP(Santa Cruz公司); VSV-G兔源多克隆抗体(南京金斯瑞公司); 4′, 6-二脒基-2-苯基吲哚(DAPI)、β-actin单克隆抗体(碧云天公司)。其他试剂均为国产分析纯。
1.3 PCR扩增与载体构建根据GenBank已发表的猪Mx基因(poMx 1, M65087;poMx 2, AB854078.1)、牛Mx基因(boMx 1, JQ766265) 序列及Uniprot收录的人Mx基因(HuMxA, P20591)、小鼠Mx基因(mmMx, 2Q9WVP9) 序列, 通过Primer Premier 5.0软件设计5对特异性引物(表 1), 并在上、下游引物中分别引入Hand Ⅲ与Xho Ⅰ酶切位点。以原有质粒pMD19-poMx 1、pMD19-poMx 2、pMD19-boMx 1 (本实验室保存)与pMD19-HuMxA、pMD19-mmMx 2 (中山大学肿瘤预防与控制中心高嵩教授馈赠)为模板, 利用高保真Taq DNA聚合酶进行PCR扩增。PCR反应体系为50 μL:质粒300 ng, 10×Buffer 5 μL, 10 mmol·L-1 dNTPs 1 μL, 50 mmol·L-1 MgSO4 1 μL, 上、下游引物各20 pmol, 高保真Taq DNA聚合酶(1 U·μL-1)1 μL, ddH2O补至50 μL, 混匀。PCR反应条件:95 ℃ 5 min; 95 ℃ 30 s, 55 ℃ 30 s, 68 ℃ 2 min 30 s, 30个循环; 68 ℃ 5 min。
PCR扩增片段经10 g·L-1的琼脂糖凝胶电泳分析, 胶回收目的片段, 回收片段与空载体pcDNA3.0经Hand Ⅲ/Xho Ⅰ双酶切, 经T4 DNA连接酶连接后, 转化DH5α, 次日挑取单克隆进行菌液PCR验证, 阳性质粒经双酶切、测序鉴定, 鉴定正确的质粒命名为pcDNA3.0-poMx 1、pcDNA3.0-poMx 2、pcDNA3.0-HuMxA、pcDNA3.0-mmMx 2、pcDNA3.0-boMx 1。
1.4 4个种属Mx蛋白表达活性的Western blot验证将生长状态良好的PK-15细胞铺设6孔细胞板, 待细胞汇合至70%~90%时, 利用lipofectamine 3000转染试剂瞬时转染上述构建好的重组质粒, 转染程序按照说明书进行。37 ℃过表达24 h, 收获细胞样本进行Western blot以验证Mx蛋白的表达活性。Western blot操作步骤:4 ℃预冷的PBS洗涤细胞3次, RIPA裂解液冰上裂解细胞15 min, 收集细胞裂解液, 12 000 g 4 ℃离心10 min, 取160 μL上清液并加40 μL 5×SDS Loading Buffer, 混匀后煮沸10 min, 制得蛋白样本; 蛋白样本进行SDS-PAGF电泳, 转印PVDF膜, 10%脱脂乳室温封闭2 h; PBS洗涤后加入α-Mx1单克隆抗体, 4 ℃过夜; PBS洗涤后再加入羊抗鼠IgG-HRP, 室温1 h。最后, 用ECL发光试剂盒检测Mx蛋白的表达活性。
1.5 4个种属Mx蛋白在细胞内的分布将生长状态良好的PK-15细胞铺设在细胞培养皿, 待细胞汇合至70%~90%时, 瞬时转染上述重组质粒, 37 ℃过表达24 h, 收获细胞样本, 进行间接免疫荧光试验(IFA)。IFA操作步骤:细胞样本先用4 ℃预冷的PBS洗涤, 再用4%多聚甲醛固定20 min; PBS洗涤, 0.1% Triton X-100透膜处理10 min; PBS洗涤, 加入10%羊血清封闭30 min; PBS洗涤, 加入α-Mx1单克隆抗体, 4 ℃孵育过夜; PBS洗涤, 再加入荧光二抗羊抗鼠IgG(488), 37 ℃避光孵育1 h; PBS洗涤, DAPI室温避光染核10 min; PBS洗涤, 60%的PBS甘油封边。最后, 用激光共聚焦显微镜观察。
1.6 4个种属Mx蛋白的抗VSV活性分析将生长状态良好的PK-15细胞铺设在12孔细胞板, 待细胞汇合至70%~90%时, 瞬时转染上述重组质粒, 37 ℃过表达24 h, 以病毒感染复数(MOI)为0.1的量接种VSV, 分别于接毒8或16 h后收获细胞培养上清液和细胞样本, 用于以下试验。
1.6.1 RT-qPCR分析用细胞培养上清液抽提总RNA进行RT-qPCR[15]分析。参照GenBank收录的VSV(AM690337.2) 基因全长序列, 设计1对荧光定量引物(表 1), 用于定量分析VSV-G mRNA的转录水平。用Trizol试剂抽提细胞培养上清液中的病毒总RNA, 反转录为cDNA, 进行荧光定量PCR, 具体操作步骤参照文献[16]。最后, 运用相对定量2-ΔΔCT法分析试验组相对于对照组VSV-G mRNA转录水平的变化。
1.6.2 噬斑减少试验分析用胞培养上清液进行噬斑减少试验, 分析子代病毒滴度的变化。将细胞培养上清液10倍梯度稀释, 每个稀释度分别感染6孔细胞板中已90%汇合的Vero细胞, 37 ℃吸附1.5 h。双无营养液洗3次, 每孔添加2 mL融化的DMEM/低熔点琼脂糖预混液(含体积分数为2%的胎牛血清(FBS)及10 g·L-1低熔点琼脂糖), 4 ℃凝固5 min, 37 ℃温箱培养24~48 h。待单层细胞长出噬斑后, 用1%结晶紫染液染色2 h。轻甩掉表面的琼脂糖, 灯光下计数每孔的噬斑数并计算出病毒滴度。作图并分析试验组相对于对照组子代病毒滴度的变化。
1.6.3 Western blot分析用细胞样本抽提总蛋白以进行Western blot分析[17]。一抗为VSV-G兔源多克隆抗体、α-Mx1单克隆抗体及β-actin单克隆抗体, 以分别鉴定VSV-G蛋白、Mx蛋白及β-actin的含量, 从而分析Mx蛋白的表达对VSV-G蛋白合成的抑制效果。
1.6.4 间接免疫荧光试验分析取细胞样本用4%多聚甲醛固定后进行IFA观察[17]。一抗为VSV-G兔源多克隆抗体及α-Mx1单克隆抗体, 荧光二抗为羊抗兔IgG(568)、羊抗鼠IgG(488), 用以捕获细胞中的VSV-G蛋白及Mx蛋白, 从而分析Mx蛋白抑制VSV复制的活性。
2 结果与分析 2.1 PCR扩增与双酶切鉴定PCR产物电泳结果(图 1)显示:克隆了4个种属的5个Mx基因, 分别为poMx 1 (1 992 bp)、poMx 2 (2 136 bp)、HuMxA(1 986 bp)、mmMx 2 (1 965 bp)、boMx 1 (1 947 bp)。
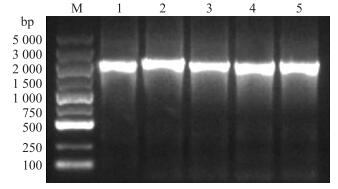
|
图 1 PCR扩增结果 Figure 1 Results of PCR amplification M.DNA marker(DL5000);1.poMx 1; 2.poMx 2; 3.HuMxA; 4.mmMx 2; 5.boMx 1 |
胶回收目的片段, 经酶切后连接pcDNA3.0, 构建重组表达质粒。双酶切鉴定阳性克隆结果(图 2)显示:标准序列均成功切出2条大小正确的目的条带。将酶切结果正确的重组质粒进行测序鉴定, 测序结果与目的基因进行序列比对, 结果完全正确。这说明成功构建了真核表达质粒:pcDNA3.0-poMx 1、pcDNA3.0-poMx 2、pcDNA3.0-HuMxA、pcDNA3.0-mmMx 2、pcDNA3.0-boMx 1。
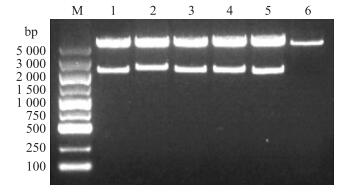
|
图 2 重组质粒的双酶切鉴定 Figure 2 Double digestion identification of the recombinant plasmids M.DNA marker(DL5000);1.pcDNA3.0-poMx 1; 2.pcDNA3.0-poMx 2; 3.pcDNA3.0-HuMxA; 4.pcDNA3.0-mmMx 2; 5.pcDNA3.0-boMx 1; 6.pcDNA3.0 |
4个种属Mx蛋白在PK-15细胞中过表达24 h后进行Western blot分析, 结果(图 3)显示:在PK-15细胞中, 4个种属Mx蛋白均成功过表达, 经鉴定, poMx1、poMx2、HuMxA、mmMx2、boMx1的相对分子质量分别为76×103、82×103、75.8×103、75×103、74.3×103。
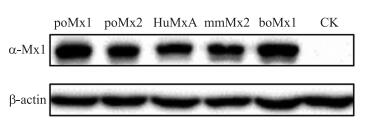
|
图 3 4个种属Mx蛋白在PK-15细胞中的表达分析 Figure 3 Analysis of expression of Mx proteins from four species in PK-15 cells CK:空白细胞对照Blank control |
IFA结果(图 4)显示:在PK-15细胞中, poMx1蛋白及mmMx2蛋白均以棒状形式分布于细胞质中; poMx2、HuMxA及boMx1蛋白均以颗粒形式弥散分布于细胞质中。
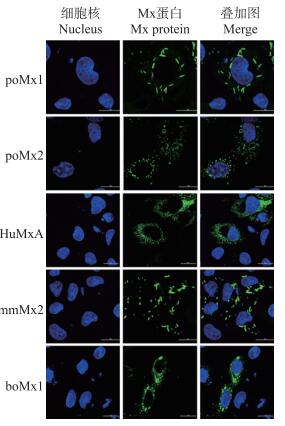
|
图 4 4个种属Mx蛋白在PK-15细胞中表达分布的IFA观察 Figure 4 IFA observation of expression and distribution of Mx proteins from four species in PK-15 cells |
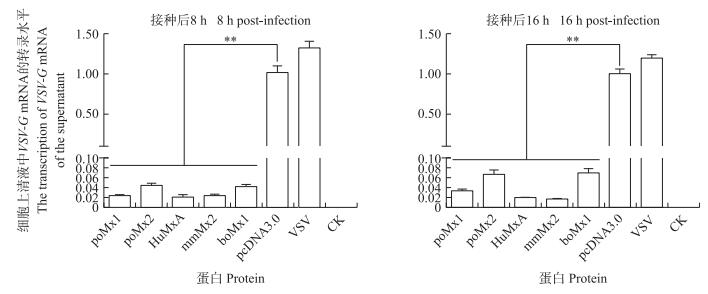
结果(图 5)显示:在感染病毒8或16 h后, 相对于pcDNA3.0空载体组或阳性病毒对照组, 4个种属Mx蛋白的过表达均能极显著抑制VSV-G mRNA的转录。
|
图 5 4个种属Mx蛋白抑制VSV-G mRNA转录的RT-qPCR分析 Figure 5 RT-qPCR analysis of Mx proteins from four species inhibit the transcription of VSV-G mRNA pcDNA3.0:空载体阴性对照Negative control; VSV:病毒阳性对照Positive control. * * P < 0.01. The same as follows. |
结果(图 6)显示:在感染病毒8或16 h后, 相对于pcDNA3.0空载体组或阳性病毒对照组, 4个种属Mx蛋白的过表达均能极显著降低子代病毒的滴度。

|
图 6 4个种属Mx蛋白抑制VSV复制的病毒噬斑分析 Figure 6 Virus plaque analysis of Mx proteins from four species inhibit the replication of VSV |
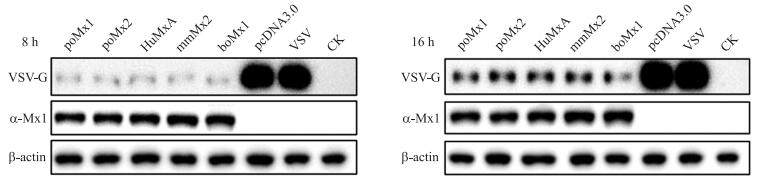
结果(图 7)显示:在感染病毒8或16 h后, 相对于pcDNA3.0空载体组或阳性病毒对照组, 4个种属Mx蛋白均能极显著减少VSV-G蛋白的合成, 抑制VSV的复制。
|
图 7 4个种属Mx蛋白抑制VSV-G蛋白合成的Western blot分析 Figure 7 Western blot analysis of Mx proteins from four species inhibit the synthesis of VSV-G protein |
结果(图 8)显示:在pcDNA3.0空载体组或阳性病毒对照组, VSV感染率几乎为100%, 且病毒在胞质中复制; 而在过表达Mx蛋白组, VSV感染率极低。这说明4个种属Mx蛋白均能极显著抑制VSV的扩增, 降低其子代病毒的产量。

|
图 8 4个种属Mx蛋白抑制VSV增殖的IFA观察 Figure 8 IFA observation of Mx proteins from four species inhibit the proliferation of VSV |
Mx蛋白是由Ⅰ型干扰素(IFN)(α/β)或Ⅲ型IFN(λ)诱导合成的抗病毒蛋白[18], 几乎存在于所有的脊椎动物中。如妊娠母牛Mx蛋白不仅能被Ⅰ型IFN(α/β)诱导合成, 还能被Ⅰ型IFN(t)(母牛妊娠期间产生的一种Ⅰ型IFN)诱导合成[19]; 同样, 鱼Mx蛋白能被Ⅰ型IFN但不能被Ⅱ型IFN或脂多糖诱导合成[20-21]。根据现有Mx基因序列, 除去GTP酶结构域前高度变异的N端区域, 用ClustalX 2软件构建系统进化树。系统进化树分析结果揭示不同亚科动物的Mx蛋白可以分成3个族群[22]:鱼类; 两栖动物、爬行动物和鸟类; 哺乳动物类。鱼类有1~9个Mx基因, 这种多重Mx基因可能由基因复制产生, 因为其编码蛋白更密切相关于鱼类的旁系Mx蛋白而不是鱼类的直系Mx蛋白; 两栖动物、爬行动物和鸟类为Mx单基因, 该基因可能类似于哺乳动物Mx基因的祖先; 哺乳动物出现后, 原先的Mx单基因复制成2个旁系Mx基因, 即Mx 1、Mx 2 (人的又称为MxA、MxB)。值得注意的是, 在系统进化树中2个啮齿类动物Mx基因属于同一个分支, 且这2个基因均与其他哺乳动物的Mx基因更密切相关。
Mx蛋白抑制病毒复制的方式迥异, 但大部分胞质Mx蛋白都能抑制VSV的复制。例如, 本课题组Zhang等[15]研究发现:原核表达的含蛋白转导域(PTD)的猪Mx1蛋白(PTD-poMx1) 经亲和纯化后, 能成功转导进Vero细胞并使其获得强烈的抗VSV活性; Maarifi等[17]研究发现:SUMO1蛋白或MxA蛋白都能通过阻断VSV的初级转录来抑制VSV的复制, 且SUMO1蛋白是通过增强MxA蛋白的寡聚和稳定性来抑制VSV增殖的, 而将MxA基因沉默后, SUMO1蛋白便不具有抗VSV活性; Sasaki等[23]研究发现:猪Mx2蛋白514位氨基酸和鸡Mx1蛋白631位氨基酸的单核苷酸多态性在抗VSV复制中发挥关键作用; Garigliany等[24]研究发现:牛Mx1蛋白转基因小鼠在感染VSV后, 其发病率和死亡率都明显降低, 而且用高表达牛Mx1蛋白转基因小鼠制备的胚胎成纤维细胞对VSV不敏感, 这都表明牛Mx1蛋白在体内(外)都能显著抑制VSV的复制; Stertz等[25]发现棉鼠Mx2蛋白而不是Mx1蛋白具有抗VSV活性; Zurcher等[26]研究发现:稳定过表达小鼠Mx2蛋白的3T3细胞系获得了强烈的抗VSV特性, 但不具有抗流感病毒活性, 而小鼠Mx2蛋白的这种抗病毒特性类似于大鼠Mx2蛋白。本文首次证明:在PK-15细胞中, 4个种属(猪、人、小鼠、牛)Mx蛋白都能通过降低VSV-G mRNA的转录来减少VSV-G蛋白的合成, 最终显著抑制VSV的增殖。
此外, 本课题组He等[27]的研究结果表明:在稳定过表达猪Mx1蛋白的PK-15细胞中, 猪瘟病毒(CSFV)的增殖受到显著抑制; 原核表达的PTD-poMx1融合蛋白转导进PK-15细胞后, PTD-poMx1融合蛋白能以剂量依赖性方式抑制CSFV的复制, 且子代病毒滴度明显降低。另外, 本课题组Zhou等[28]发现:IFN-α能以剂量依赖性方式抑制乙型脑炎病毒(JEV)的复制, 但在敲除掉Mx 1或Mx2基因的PK-15细胞与BHK-21细胞中, IFN-α对乙型脑炎病毒的抑制效果并没有受到影响; 相应地, Mx1或Mx2蛋白的过表达也不会影响IFN-α抑制JEV复制的活性; 此外, 尽管布雷霉素(BFA)破坏了JEV诱导合成的运输囊泡, 但过表达Mx1或Mx2蛋白依然不能抑制JEV的增殖; 总之, IFN-α抵抗JEV感染的活性并不依赖于Mx蛋白路径。这些数据丰富完善了现有Mx蛋白抗病毒谱, 对进一步理解Mx蛋白抗病毒的作用机制有重要意义。
无论是根据Mx蛋白系统进化树分析结果, 还是根据现有研究Mx蛋白抗病毒结果, 我们可知4个种属(猪、人、小鼠、牛)Mx蛋白的保守性结构赋予自身广泛的抗病毒活性, 本文结果也证明了这一点, 这对于进一步揭示Mx蛋白抗病毒活性的分子机制具有一定的意义。同时, 以VSV为模式病毒所探索的Mx蛋白抗病毒条件, 也为进一步探索4个种属Mx蛋白抗其他病毒活性积累了一定的理论依据。
| [1] | Lindenmann J, Lane C, Hobson D. The resistance of A2G mice to myxoviruses[J]. Journal of Immunology, 1963, 90(6): 942–951. |
| [2] | Lindenmann J. Resistance of mice to mouse-adapted influenza A virus[J]. Virology, 1962, 16: 203–204. DOI: 10.1016/0042-6822(62)90297-0 |
| [3] | Staeheli P, Pravtcheva D, Lundin L G, et al. Interferon-regulated influenza virus resistance gene Mx is localized on mouse chromosome 16[J]. Journal of Virology, 1986, 58(3): 967–969. |
| [4] | Verhelst J, Hulpiau P, Saelens X. Mx proteins:antiviral gatekeepers that restrain the uninvited[J]. Microbiology and Molecular Biology Reviews, 2013, 77(4): 551–566. DOI: 10.1128/MMBR.00024-13 |
| [5] | Haller O, Kochs G. Interferon-induced Mx proteins:dynamin-like GTPases with antiviral activity[J]. Traffic, 2002, 3(10): 710–717. DOI: 10.1034/j.1600-0854.2002.31003.x |
| [6] | Praefcke G J, McMahon H T. Thedynamin superfamily:universal membrane tubulation and fission molecules?[J]. Nature Reviews, Molecular Cell Biology, 2004, 5(2): 133–147. DOI: 10.1038/nrm1313 |
| [7] | Gao S, von der Malsburg A, Paeschke S, et al. Structural basis of oligomerization in the stalk region of dynamin-like MxA[J]. Nature, 2010, 465(7297): 502–506. DOI: 10.1038/nature08972 |
| [8] | Li N, Zhang L, Chen L, et al. MxA inhibits hepatitis B virus replication by interaction with hepatitis B core antigen[J]. Hepatology, 2012, 56(3): 803–811. DOI: 10.1002/hep.25608 |
| [9] | Netherton C L, Simpson J, Haller O, et al. Inhibition of a large double-stranded DNA virus by MxA protein[J]. Journal of Virology, 2009, 83(5): 2310–2320. DOI: 10.1128/JVI.00781-08 |
| [10] | Pillai P S, Molony R D, Martinod K, et al. Mx1 reveals innate pathways to antiviral resistance and lethal influenza disease[J]. Science, 2016, 352(6284): 463–466. DOI: 10.1126/science.aaf3926 |
| [11] | Pichlmair A, Buse J, Jennings S, et al. Thogoto virus lacking interferon-antagonistic protein ML is strongly attenuated in newborn Mx1-positive but not Mx1-negative mice[J]. Journal of Virology, 2004, 78(20): 11422–11424. DOI: 10.1128/JVI.78.20.11422-11424.2004 |
| [12] | Jin H K, Takada A, Kon Y, et al. Identification of the murine Mx 2 gene:interferon-induced expression of the Mx2 protein from the feral mouse gene confers resistance to vesicular stomatitis virus[J]. Journal of Virology, 1999, 73(6): 4925–4930. |
| [13] | Jin H K, Yoshimatsu K, Takada A, et al. Mouse Mx2 protein inhibits hantavirus but not influenza virus replication[J]. Archives Virology, 2001, 146(1): 41–49. DOI: 10.1007/s007050170189 |
| [14] |
陈溥言.
兽医传染病学[M]. 5版. 北京: 中国农业出版社, 2013: 78-79.
Chen P Y. Veterinary Epidemiology[M]. 5th ed. Beijing: Chinese Agriculture Press, 2013: 78-79. (in Chinese with English abstract) |
| [15] | Zhang X M, He D N, Zhou B, et al. In vitro inhibition of vesicular stomatitis virus replication by purified porcine Mx1 protein fused to HIV-1 Tat protein transduction domain(PTD)[J]. Antiviral Research, 2013, 99(2): 149–157. DOI: 10.1016/j.antiviral.2013.05.009 |
| [16] |
张小敏, 周斌, 何丹妮, 等. 实时荧光定量PCR检测猪源Mx1方法的建立及应用[J].
南京农业大学学报, 2013, 36(1): 92–96.
Zhang X M, Zhou B, He D N, et al. Establishment and application of the SYBR green Ⅰ real-time PCR assay for detection of porcine antiviral protein Mx 1 gene[J]. Journal of Nanjing Agricultural University, 2013, 36(1): 92–96. DOI: 10.7685/j.issn.1000-2030.2013.01.016(in Chinese with English abstract) |
| [17] | Maarifi G, Hannoun Z, Geoffroy M C, et al. MxA mediates SUMO-induced resistance to vesicular stomatitis virus[J]. Journal of Virology, 2016, 90(14): 6598–6610. DOI: 10.1128/JVI.00722-16 |
| [18] | Holzinger D, Jorns C, Stertz S, et al. Induction of MxA gene expression by influenza A virus requires type Ⅰ or type Ⅲ interferon signaling[J]. Journal of Virology, 2007, 81(14): 7776–7785. DOI: 10.1128/JVI.00546-06 |
| [19] | Yankey S J, Hicks B A, Carnahan K G, et al. Expression of the antiviral protein Mx in peripheral blood mononuclear cells of pregnant and bred, non-pregnant ewes[J]. The Journal of Endocrinology, 2001, 170(2): R7–R11. DOI: 10.1677/joe.0.170R007 |
| [20] | Collet B, Secombes C J. The rainbow trout(Oncorhynchus mykiss)Mx1 promoter. Structural and functional characterization[J]. European Journal of Biochemistry, 2001, 268(6): 1577–1584. DOI: 10.1046/j.1432-1327.2001.02021.x |
| [21] | Ooi E L, Hirono I, Aoki T. Functional characterisation of the Japanese flounder, Paralichthy solivaceus, Mx promoter[J]. Fish and Shellfish Immunology, 2006, 21(3): 293–304. DOI: 10.1016/j.fsi.2005.12.004 |
| [22] | Larkin M A, Blackshields G, Brown N P, et al. Clustal W and Clustal X version 2. 0[J]. Bioinformatics, 2007, 23(21): 2947–2948. DOI: 10.1093/bioinformatics/btm404 |
| [23] | Sasaki K, Tungtrakoolsub P, Morozumi T, et al. A single nucleotide polymorphism of porcine Mx 2 gene provides antiviral activity against vesicular stomatitis virus[J]. Immunogenetics, 2014, 66(1): 25–32. DOI: 10.1007/s00251-013-0745-2 |
| [24] | Garigliany M M, Cloquette K, Leroy M, et al. Modulating mouse innate immunity to RNA viruses by expressing the Bos taurus Mx system[J]. Transgenic Research, 2009, 18(5): 719–732. DOI: 10.1007/s11248-009-9268-x |
| [25] | Stertz S, Dittmann J, Blanco J C, et al. The antiviral potential of interferon-induced cotton rat Mx proteins against orthomyxovirus(influenza), rhabdovirus, and bunyavirus[J]. Journal of Interferon and Cytokine Research, 2007, 27(10): 847–855. DOI: 10.1089/jir.2006.0176 |
| [26] | Zurcher T, Pavlovic J, Staeheli P. Mouse Mx2 protein inhibits vesicular stomatitis virus but not influenza virus[J]. Virology, 1992, 187: 796–800. DOI: 10.1016/0042-6822(92)90481-4 |
| [27] | He D N, Zhang X M, Liu K, et al. In vitro inhibition of the replication of classical swine fever virus by porcine Mx1 protein[J]. Antiviral Research, 2014, 104: 128–135. DOI: 10.1016/j.antiviral.2014.01.020 |
| [28] | Zhou J, Wang S Q, Wei J C, et al. Mx is not responsible for the antiviral activity of interferon-α against Japanese encephalitis virus[J]. Viruses, 2017, 9(1). DOI: 10.3390/v9010005 |





