文章信息
- 王炫清, 苗嘉曦, 陈兴, 孔志坚, 刘东阳, 沈其荣
- WANG Xuanqing, MIAO Jiaxi, CHEN Xing, KONG Zhijian, LIU Dongyang, SHEN Qirong
- 高效木质纤维素分解菌Aspergillusy fumigatus Z5原位分解小麦秸秆的研究
- Insight into the degradation of wheat straw by an efficient lignocellulosic-decomposing fungus Aspergillus fumigatus Z5
- 南京农业大学学报, 2017, 40(4): 671-680
- Journal of Nanjing Agricultural University, 2017, 40(4): 671-680.
- http://dx.doi.org/10.7685/jnau.201610010
-
文章历史
- 收稿日期: 2016-10-12
木质纤维素作为植物细胞壁的主要组成部分, 是自然界中分布最广泛且含量最多的生物质资源, 其结构比较复杂, 主要由纤维素、半纤维素以及木质素相互铰接而成[1-2]。纤维素是一种由成千上万个吡喃葡萄糖通过β-1, 4-糖苷键连接在一起形成的高聚合度化合物(分子式为C6H10O5)[3]; 半纤维素是由几种不同类型的单糖构成的异质多聚体, 主要包括木糖、阿拉伯糖和半乳糖, 它结合在纤维素表面并相互连接构成坚硬的细胞连接网络; 木质素是由聚合的芳香醇构成的一类物质, 其主要作用是通过形成交织网来硬化细胞壁, 木质素主要位于纤维素和半纤维之间, 起到抗压作用[4]。
由于综合利用技术的缺乏, 这一资源没有得到充分利用, 而是被随意地弃置或焚烧, 既浪费了资源又造成了严重的环境污染。如果能够将其转化成可利用的能源物质, 对缓解能源短缺与环境污染问题将具有重大的意义。木质纤维素的分解主要是通过各种木质纤维素酶的催化氧化实现。木质纤维素酶是指能够水解木质纤维素及其衍生物的一系列酶的总称。它是由多种酶组成的一个复杂酶系, 主要包括纤维素酶、半纤维素酶、木质素酶等[5]。纤维素酶来源非常广泛, 可存在于动物、植物、微生物和昆虫当中, 其中微生物中的来源占主要部分, 目前应用最多的木质纤维素酶也主要来源于各种不同的微生物, 尤其是丝状真菌青霉、木霉、曲霉等[6-8]。
农作物秸秆作为主要的木质纤维素类型, 因其富含木质纤维素而具有高价值的利用潜能, 由于很难快速被分解, 其巨大的潜能还远未被开发出来。因此, 本试验以小麦秸秆为材料, 研究其在真菌分解过程中的物理、化学特性的变化, 旨在揭示木质纤维素生物降解过程的规律及其生物学机制, 为综合利用农作物秸秆与开发生物有机肥提供理论依据。
1 材料与方法 1.1 材料 1.1.1 样品采集小麦秸秆采自南京农业大学教学科研实习基地, 选取新鲜未腐烂的小麦秸秆清洗干净并风干, 剪成2~3 cm长的段, 于干燥处保存备用。
1.1.2 菌株及发酵培养基所用菌株为本实验室从堆肥样品中分离、筛选到的高温纤维素分解菌Aspergillus fumigatus Z5[4], 该菌株的ITS序列在NCBI的登录号为GQ337429。为防止菌种退化, 菌种孢子悬浮于15%(体积分数)甘油水溶液后, 保存于-70 ℃超低温冰箱。
PDA固体培养基:马铃薯200 g, 葡萄糖20 g, 琼脂20 g, 自来水1 000 mL, pH自然。
Mandels盐溶液[9]:0.3 g·L-1尿素, 1.4 g·L-1(NH4)2SO4, 2.0 g·L-1KH2PO4, 0.3 g·L-1 CaCl2, 0.3 g·L-1MgSO4, 0.25 g·L-1酵母膏, 0.75 g·L-1蛋白胨, 5 g·L-1 FeSO4·7H2O, 20 mg·L-1CoCl2, 1.6 mg·L-1 MnSO4, 1.4 mg·L-1 ZnSO4。
1.1.3 主要试剂滤纸(Whatman No.1)、羧甲基纤维素钠(CMC, Sigma, USA)、4-硝基苯基-β-D-纤维二糖苷(pNPC, Sigma, USA)、4-硝基苯基-β-D-葡萄糖苷(pNPG, Sigma, USA)、海带多糖(Aladdin Chemistry Co.Ltd., Cat. No.9008-22-4)、地衣多糖(Megazyme, Bry, Ireland)、木聚糖(桦木源, Sigma, CAS:9014-63-5)、BCA蛋白定量试剂盒(北京鼎国昌盛生物技术有限公司)。
1.1.4 试验仪器分光光度计722(上海精密科学仪器有限公司)、酶标仪(Spectra max M5, Molecular Devices)、元素分析仪(Vario EL Ⅲ, Elementar Analysensysteme GmbH, 德国)、TOC仪器(multi N/C 3000, Analytik Jena AG, 德国)、X-Ray Diffractometry(D/MAX-2500德国)、球磨仪(MM400, RETSCH, 德国)、傅里叶红外分析仪(Thermo Nicolet NexusTM 670, 美国)、环境扫描电镜(Phillips, XL30, 德国)、原子力显微镜(Digital Instruments Inc., CA, 美国)、核磁共振仪(Bruker MSL-300, 德国)。
1.2 方法 1.2.1 接种与培养将活化的菌种接种到装有50 mL固体PDA培养基的250 mL三角瓶中, 在50 ℃条件下培养3~4 d后, 无菌条件下加入10 mL高温灭菌的NaCl溶液(9 g ·L-1), 120 r·min-1振荡30 min后, 用2层无菌纱布过滤除去菌丝及孢子囊, 并用血球计数板统计孢子悬液里面的孢子浓度。
称取10 g处理好的干小麦秸秆于1 L的大三角瓶中, 加入20 mL配制好的Mandels盐溶液, 等固形物和盐溶液充分混匀后121 ℃高温灭菌30 min后备用。根据孢子悬液溶度, 每克基质接入107真菌孢子, 接种后, 将三角瓶置于50 ℃恒温培养箱中静置培养, 直到试验结束。培养期间, 分别在1、3、7、14、21和28 d取样, 并测定相关的指标。
1.2.2 粗酶液制备及胞外蛋白含量测定取样后, 按照1 : 10(m : V)的比例往三角瓶中加入去离子水, 并添加适当数量的玻璃珠。封口膜封口后于30 ℃条件下200 r·min-1振荡60 min。待充分提取后, 用2层纱布过滤除去大颗粒的固形物和菌丝。将过滤后的上清液转移到50 mL的离心管中, 4 ℃条件下12 000 r·min-1离心10 min, 上清液即为粗酶液。
蛋白含量的测定:利用BCA蛋白定量试剂盒测定粗酶液中的蛋白溶度, 取经适当稀释的粗酶液10 μL加入到96孔板的样品孔内, 每个样品测定4~5个平行, 向样品中加入200 μL的BCA工作液(样品与工作液的体积比为1 : 2) 并混匀, 37 ℃水浴反应30 min后冷却到室温, 在562 nm波长下测定吸光值。将配制好的体系37 ℃水浴反应30 min后冷却到室温, 在562 nm波长下测定吸光值, 根据标准曲线, 计算出样品中的蛋白质含量。
1.2.3 常规化学指标的测定样品含水率测定采用失重法, 用元素分析仪(Elmentar, Germany)测定样品的总碳和总氮含量。样品中水溶性碳、氮的提取方法:10 g鲜样中加入10 mL的去离子水(m : V=1 : 10), 并加入少许玻璃珠, 室温条件下170 r·min-1提取2 h, 4 ℃条件下12 000 r·min-1离心10 min, 将上清液经0.22 μm的滤膜过滤, 并利用TOC仪分析样品的水溶性碳、氮含量。纤维素、半纤维素、木质素含量按照田维亮等[10]的方法进行测定。
1.2.4 纤维素酶和半纤维素酶活力测定滤纸酶(FPA)活力[4]测定:取0.5 mL适当稀释的粗酶液, 加2 mL醋酸缓冲液和1条滤纸(Whatman No.1, 1 cm×6 cm, 约50 mg)于25 mL刻度试管中, 50 ℃水浴1 h, 水浴结束后向试管里加入3 mL的DNS试剂, 沸水浴10 min, 定容后在520 nm波长下测定其吸光值, 以每分钟产生1 μmol还原糖所需的酶量, 定义为1 U。以100 ℃水浴灭活5 min的粗酶液为对照, 其余步骤相同。酶活力均指减去灭活酶液中还原糖后计算得到的结果。
纤维素内切酶活力[4]的测定:取2 mL羧甲基纤维素溶液于25 mL刻度试管中, 加0.1 mL经适当稀释的粗酶液, 混合均匀后于50 ℃水浴20 min。水浴结束后, 向试管里加入3 mL的DNS试剂后, 沸水浴10 min, 冷却后加去离子水定容至25 mL, 混匀并在520 nm波长下测吸光值, 以每分钟产生1 μmol还原糖所需的酶量, 定义为1 U。
纤维素外切酶与β-葡萄糖苷酶活力[11]的测定:在96孔板中加入10 μL 5 mmol·L-1的pNPC或pNPG, 后加入适当稀释的40 μL粗酶液和50 μL的醋酸缓冲液(pH5.0), 同时以灭活的粗酶液为空白对照, 然后将96孔板于50 ℃水浴10 min。取出后每个样品中加入100 μL 1 mol·L-1的Na2CO3溶液进行显色。最后在402 nm波长处用酶标仪读取吸光值, 根据标线计算出对硝基酚的含量。在上述条件下每分钟酶解pNPC或pNPG得到1 μmol对硝基酚所需的酶量, 定义为1 U。
半纤维素酶包括木聚糖酶、海带多糖酶以及地衣多糖酶, 木聚糖酶活力测定按照王斐[12]的方法。反应结束后在520 nm下用酶标仪读取吸光值。根据标线计算出还原糖的含量。在上述条件下每分钟分解木聚糖得到1 μmol还原糖所需的酶量, 定义为1 U。海带多糖和地衣多糖酶活力的测定参照Lition等[13]的方法稍作修改:取粗酶液0.2 mL加入到1 mL海带多糖或地衣多糖中, 再加0.8 mL醋酸缓冲液, 同时以灭活的粗酶液为空白对照, 40 ℃条件下水浴30 min。取出后加入0.5 mL 0.3 mol·L-1 HCl终止反应, 再用0.1 mL 2.5 mol·L-1的K2CO3中和, 再加入2 mL DNS水浴8 min后, 定容到25 mL。最后用酶标仪在520 nm处读取吸光值。根据标线计算出还原糖的含量。上述条件下每分钟酶解海带多糖得到1 μmol还原糖所需的酶量, 定义为1 U。
1.2.5 环境扫描电镜及原子力显微镜观察将样品经戊二醛、锇酸双固定, 乙醇梯度脱水后, 在临界点干燥并离子溅射镀金后, 利用环境扫描电镜观察其表面特征。将样品利用去离子水清洗多遍并利用真空干燥仪脱水处理后, 转移到原子力显微镜专用载片上, 按照Zara等[14]的方法, 于1、14和28 d观察样品表面的特征。观察模式为敲击模式, 采用NP-S氮化硅悬臂探针, 频率为250~360 kHz, 观察的分辨率为512×512像素。
1.2.6 博里叶红外光谱及结晶度分析采用傅里叶红外光谱法分析菌株Z5处理小麦秸秆1、7、21和28 d的样品, 傅里叶红外光谱分析按照Kim等[15]的方法, 利用球磨仪(用不锈钢罐和珠子)将样品研磨成粉末状并过100目筛后, 将样品与KBr按体积比为1 : 99的比例混合后在研钵中研磨后压片, 并在傅里叶红外光谱仪上进行观察, 每个样品重复检测3遍, 吸收波长范围为370~7 800 cm-1。
纤维素结晶度分析参照Howell等[16]的方法:将样品在105 ℃烘干至恒质量后, 用球磨仪粉碎成50 μm的粒径, 粉末样品通过X射线衍射(X-Ray Diffractometry)分析结晶度。结晶指数(CrI)=(I002-Iam)/ I002×100%。式中:I002表示002峰在2θ=22.5°时的最大值; Iam表示2θ=18.5°处的最小值。
1.2.7 二维核磁共振(HSQC)分析取处理1 d和28 d的样品, 利用球磨仪(氧化锆罐子和珠子)连续研磨, 直至主要成分颗粒直径为50 μm。取30 mg研磨好的粉末装入5 mm的核磁共振管中, 加入500 μL的溶胀剂DMSO-d6, 随后进行超声助溶约3 h, 待形成均匀的半透明胶体后即可取出。按照Rio等[17]的方法进行二维核磁共振的分析, HSQC试验的中1H核磁的参数为5 000 Hz, 13C核磁的参数为20 843 Hz。根据Ralph等[18]报道的植物细胞壁及木质素核磁数据库解析HSQC的结果。
2 结果与分析 2.1 小麦秸秆生物分解过程中常规化学指标的变化从表 1可知:接种菌株Z5后1 d, 小麦秸秆总碳初始含量为47.62%, 是所有采样点中含量最高的。随着时间的增加, 小麦秸秆总碳含量逐渐减小, 28 d时达到最小值, 为37.12%, 与对照相比, 其相对含量减少了22.05%。从总碳的测定结果可以得出, 小麦秸秆的含碳量逐渐降低, 大部分的含碳化合物得到了分解。小麦秸秆中总氮含量的变化规律正好与总碳含量的变化规律相反。随着降解时间的增加, 总氮含量逐渐增加, 接种后1 d小麦秸秆的总氮含量为0.99%, 然后逐渐增加到1.75%。与对照相比, 总氮的相对含量增加了76.77%。水溶性碳和氮在接种菌株Z5后3 d达到最大值, 分别为38.27和1.50 mg·g-1, 然后随着时间的增加而逐渐降低, 28 d时水溶性碳的含量为9.34 mg·g-1, 水溶性氮的含量为0.47 mg·g-1。
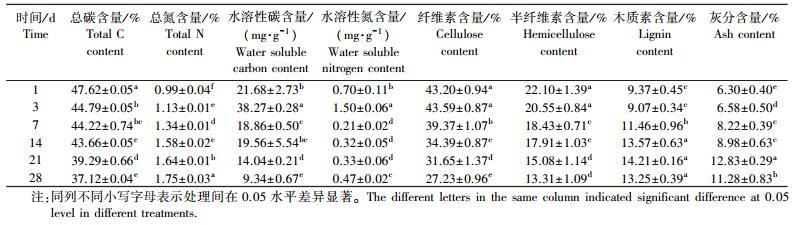
|
接种Z5后1 d, 小麦秸秆中的纤维素含量为43.20%, 随着处理时间的延长其含量逐渐降低, 28 d时降低到27.23%, 与对照相比, 其相对含量下降了36.97%;半纤维素的变化规律和纤维素基本一致, 接种1 d后含量最高, 为22.10%, 然后逐渐降低, 28 d时降到13.31%, 与对照相比, 其相对含量下降了39.77%。木质素的变化规律与纤维素、半纤维素都不相同, 随着时间的延长其含量逐步升高, 由1 d时的9.37%增加到28 d时的13.25%。灰分的含量变化规律和木质素含量的变化一致。
2.2 小麦秸秆生物分解过程中水解酶活力的变化纤维素酶主要包括滤纸酶(FPA)、内切葡聚糖酶(EG)、外切葡聚糖酶(CBH)和β-葡萄糖苷酶。从表 2可知:滤纸酶活力呈先升高后降低的趋势, 接种Z5 7 d时达到最大值, 为80.92 U·g-1, 随后逐渐降低到14.19 U·g-1。内切葡聚糖酶活力与滤纸酶活力变化相似, 也在接种Z5 7 d时达到最大值, 为393.41 U·g-1, 随后逐步降低为134.15 U·g-1。外切葡聚糖酶活力在7 d时达到最大值, 为29.95 U·g-1, 28 d时降为14.78 U·g-1。β-葡萄糖苷酶活力在接种后7~28 d的变化不大, 7 d时酶活力最大, 为36.13 U·g-1。
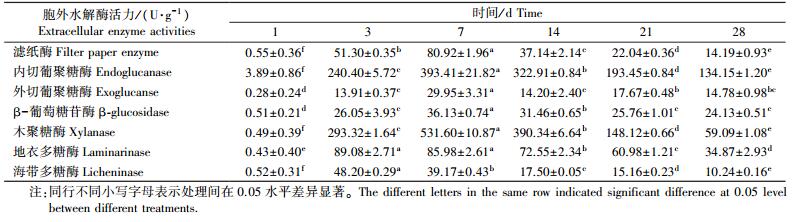
|
半纤维素酶主要包括木聚糖酶、海带多糖酶和地衣多糖酶。在小麦秸秆降解过程中, 7 d时木聚糖酶活力达到最大值, 为531.60 U·g-1, 随后逐步降低到59.09 U·g-1。处理3 d时地衣多糖酶活力最大, 为89.08 U·g-1, 1 d时最小, 为0.43 U·g-1。海带多糖酶最大酶活力也出现在处理3 d时, 达到48.20 U·g-1, 随后逐渐减小, 28 d时降为10.24 U·g-1。从半纤维素酶活力的测定结果可以得出, 最大酶活力一般出现在3~7 d, 这表明半纤维素的降解主要发生在这个时间段内。
2.3 小麦秸秆生物分解过程中扫描电镜与原子力显微镜观察结果从图 1-A可以看出Z5菌株典型的菌丝和孢子囊结构; 菌株Z5处理1 d后小麦秸秆粗糙, 结构比较致密(图 1-B); Z5处理14 d后的小麦秸秆表面蜡质层和纤维素已经被破坏, 在秸秆中布满了大量的真菌菌丝, 大量的小纤维素丝已经从木质素中脱离出来(图 1-C); 降解28 d后, 大部分的纤维素和半纤维素已经从小麦秸秆中的木质素上剥离, 并得到了充分分解, 同时在秸秆中可以发现明显的分解大洞(图 1-D), 这说明菌株Z5可以有效地分解小麦秸秆。
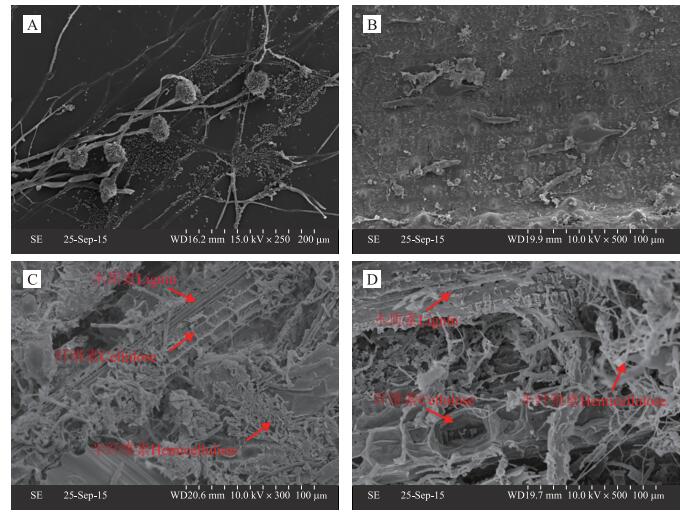
|
图 1 A.fumigatus Z5分解小麦秸秆过程中的扫描电镜图 Figure 1 The graph of scanning electron microscope during the wheat straw biodegradation by A.fumigatus Z5 A.木质纤维素分解菌的菌丝; B、C、D分别为菌株Z5处理小麦秸秆表面在1、14、28 d的电镜扫描结果。A is the mycelium of the lignocellulosic strain A.fumigatus Z5;B, C and D mean the characterization of wheat straw surface sampled at 1, 14 and 28 day, respectively. |
从不同取样时间点的小麦秸秆表面的原子力显微镜扫描结果(图 2)可知:未处理的小麦秸秆表面相对平整, 没有明显的分解痕迹, 秸秆表面的粗糙度为0.97%(图 2-A)。未处理秸秆的最大高度值为23.27 nm(图 2-B); 经过28 d分解的小麦秸秆表面有大量的颗粒聚集(图 2-C), 它们是非结晶纤维和颗粒状物质的混合物, 说明了秸秆表面的木质素逐步被降解了; 同时秸秆表面出现大量直径在600~1 000 nm的缺口, 而且在外部接近中心的位置, 一些纤维细丝指向同一个方向(图 2-D), 说明了菌株Z5降解秸秆的方向是逐层从表面到内部; 该时间点的样品的粗糙度明显增加, 达到了43.83%。

|
图 2 A.fumigatus Z5分解小麦秸秆过程中的原子力显微镜观察 Figure 2 The graph of atomic force microscope during the wheat straw biodegradation by A.fumigatus Z5 A、C分别为未处理小麦秸秆和菌株Z5分解28 d后小麦秸秆的相位图; B、D分别为未处理小麦秸秆和菌株Z5分解28 d后小麦秸秆的高度图。 A and C are the phase diagram of the untreated wheat straw and the wheat straw degraded for 28 days, respectively; B and D are the height map of the untreated wheat straw and the wheat straw degraded for 28 days, respectively. |
从图 3可以看出:在2 900 cm-1处, 不同时间Z5处理都有峰出现, 该处是—CH2官能团及与脂肪族结合的典型吸收峰, 脂肪族类化合物是小麦秸秆中的主要成分。在波长1 732 cm-1附近是半纤维素中饱和烷基酯类化合物的典型吸收峰, 4个样品都有吸收峰。说明小麦秸秆中半纤维素并没有完全分解, 与其含量测定的结果是一致的。多酚类化合物的吸收波长主要集中在1 604~1 608 cm-1, 4个样品中都有多酚类化合物存在, 说明小麦秸秆中存在木质素, 而且28 d时吸收峰的相对峰面积下降, 说明木质素已经被菌株Z5破坏或部分分解。1 200~1 000 cm-1波长, 是纤维素与半纤维素混合物的典型的特征吸收峰, C—O—H特征波长在1 064 cm-1, 而β-(1-4) 葡萄糖苷键(C—O—C)的特征波长在1 160 cm-1, 而这些光能团是纤维素与半纤维素的重要组成部分。与处理1 d的样品相比, 该峰的峰面积逐渐减小, 说明随着分解时间的增加, 小麦秸秆中的纤维素和半纤维素已经被大量降解。

|
图 3 小麦秸秆分解过程中的傅里叶红外分析 Figure 3 The Fourier transform infrared spectroscopy analysis results during the wheat straw biodegradation process |
利用X-ray衍射方法, 分析了不同分解时间(1、14、21和28 d)的小麦秸秆粉末的结晶度, 结果见图 4。通过对不同样品衍射图的分析发现, 所有样品中都有Ⅰ型纤维素(典型特征峰的2θ角在15°~22.6°)和Ⅱ型纤维素(典型特征峰的2θ角在12.3°~19.8°), 而且不同样品的衍射峰有显著的差异。特别是当2θ=15.3°时, 随着时间的增加, 纤维素的无定型结晶区去除, 导致了纤维素晶体结构发生改变。当2θ=19.8°时, 是结晶度比较高的区域, 该类型的纤维素有较好的稳定性和抗逆性, 一般不容易被降解, 所以该处的峰型变化不是很大。随着降解时间的增加, 小麦秸秆的结晶度指数由43.8%减小到28.3%, 结晶度下降了35.4%, 说明小麦秸秆中大部分的纤维素和半纤维素分解被菌株Z5破坏。
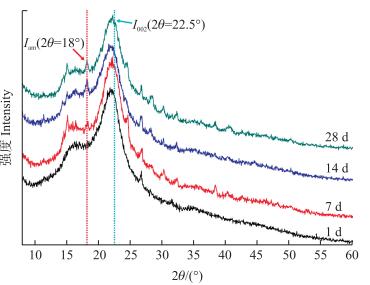
|
图 4 小麦秸秆分解过程中结晶度变化 Figure 4 The change of crystallinity analysis results during the wheat straw biodegradation process |
采用二维核磁共振的方法研究了未处理和被降解28 d后小麦秸秆中不同组分的情况(图 5), 不同功能类化合物的分类如图 6所示。Aα类型的芳香醚经过28 d的降解后, 其含量明显减少, 而β-芳香醚衍生物已经分离成愈创木基(AβG)和紫丁香基(AβS), 其含量也有减少的趋势, 减少的幅度比Aα要小(图 5-A1和A2)。Bα与Bβ为2种不同含香豆满基的化合物, 香豆满基化合物在降解过程中发生了较大的变化, 说明香豆满类型的木质素发生了分解。甲氧基木质素发生了部分的降解, 但是降解的程度不是很好, 还有大量的甲氧基木质素存在。从解析的二维核磁图谱中还可以发现:小麦秸秆中存在Cα、Cβ和Cγ三种类型的松香基类化合物, 其中Cγ经过28 d后已经被彻底分解, 可知Cγ最容易分解; 还发现2-O-乙酰基木聚糖(2-O-Ac-β-D-Xylp)和3-O-乙酰基木聚糖(2-O-Ac-β-D-Xylp)被大量降解。
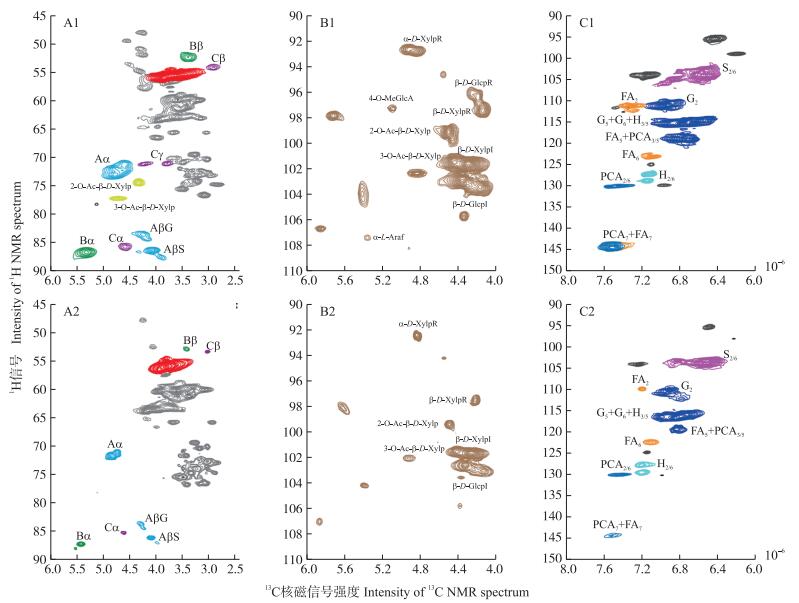
|
图 5 小麦秸秆分解过程中二维核磁共振分析结果
Figure 5 The 2D NMR analysis results during the wheat straw biodegradation process
图A1和A2分别是未处理和处理28 d后小麦秸秆中脂肪族化合物; 图B1和B2分别是未处理和处理28 d后小麦秸秆中多糖类化合物; 图C1和C2分别是未处理和处理28 d后小麦秸秆中芳香族化合物。Graph A1 and A2 are the aliphatic region analysis results of 13C-1H correlation(HSQC)spectra of wheat straw; Graph B1 and B2 are the polysaccharide anomeric region of 13C-1H correlation(HSQC)spectra of wheat straw; Graph C1 and C2 are the aromatic region of 13C-1H correlation(HSQC)spectra of wheat straw. Aα、AβG、AβS分别代表α型、愈创木基型(guaiacyl type)和紫丁香基型(syringyl type)的β-芳香醚基团(β-aryl ether units); Bα和Bβ分别代表α型和β型苯基香豆满(phenylcoumaran units); Cα、Cβ和Cγ分别代表α型、β型和γ型松香基(resinol units); 2-O-Ac-β-D-Xylp为2-甲氧基-乙酰基-木聚糖, 3-O-Ac-β-D-Xylp为3-甲氧基-乙酰基-木聚糖, 4-O-MeGlcA为4-甲氧基葡萄糖醛酸, α-D-XylpR和β-D-XylpR分别代表α型和β型吡喃木糖基; β-D-GlcpI代表β-D-吡喃葡萄糖基; α-L-Araf代表α-L-呋喃阿拉伯糖基; FA代表阿魏酸盐(formulate); PCA代表对-香豆满(p-coumarates); G代表愈创木基(guaiacyl units); H代表对羟基苯基(p-hydroxyphenyl units) |
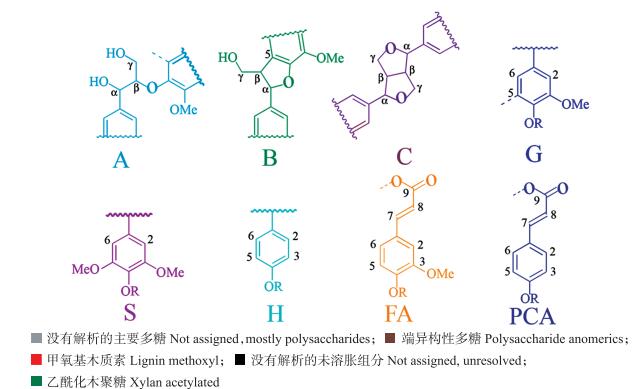
|
图 6 小麦秸秆分解过程中不同类型物质的解析结果 Figure 6 The analysis results of the main components during the wheat straw biodegradation process A为β-芳香醚基(β-O-4), B为苯基香豆满基(β-5), C为松香基(β-β), G为愈创木基木质素, S为紫丁香基木质素, H为对羟苯基, FA为阿魏酸酯, PCA为对香豆酸; 不同颜色代表不同种类的物质, 并与二维核磁共振解析图谱相匹配。The structures in the graph:A is β-aryl ethers(β-O-4);B is phenylcoumarans(β-5);C is resinols(β-β); G is guaiacyl units of lignin; S is syringyl units of lignin; H is p-hydroxyphenyl units, FA is ferulates; PCA is p-coumarates. The colors of different groups represent different functional materials, which match the analytical map of two dimensional NMR results. |
对照木质纤维素核磁共振数据库, 小麦秸秆中主要含有β-(1, 4)-D-吡喃葡萄糖苷基(β-D-Glcp)、β-(1, 4)-D-木吡喃糖苷基(β-D-Xylp)、α-(1, 3)-阿拉伯呋喃糖基(α-L-Araf)和β-D-吡喃甘露糖(β-D-Manp), 这些都是纤维素与半纤维素的重要组成部分。在未处理的小麦秸秆中发现了少量的4-O-甲基-α-D-葡萄糖醛酸类化合物(4-O-MegleA)和α-L-Araf, 经过了28 d后这2类化合物已经被彻底降解, 说明秸秆中木聚糖中的这2种化合物最容易分解。其他类型的多糖都发生了不同程度的分解。β-D-Glcp和β-D-Xylp类型的化合物含量最多, 也是处理28 d后剩下最多的多糖类化合物。
木质素主要成分为芳香族化合物, 还包括阿魏酸盐(FA)和甲氧基木质素(PCA), 而禾本科植物大量存在愈创木基(G)、紫丁香基(S)和对羟苯基(H)。与其他类型的化合物相比木质素是最难分解的, 与未处理的小麦秸秆比, 处理28 d后的样品中所有化合物都没有被完全降解。其中S2/6、G2、G5+G6+H3/5(3种化合物信号重叠区)以及PCA2/6类型的特征峰还比较明显, 说明这一类化合物比较难分解。相对含量减少最多的是PCA7和FA7, 说明PCA7和FA7是小麦秸秆木质素中相对容易被菌株Z5分解的成分。
3 讨论农作物秸秆富含木质纤维素, 是世界上最多的可再生的生物资源。由于木质素比较坚硬, 而且在表面上存在大量的氧化硅和蜡质, 很难被快速分解, 处理成本也非常高, 因此大量的秸秆被焚烧或随意弃置。这不仅浪费了资源而且严重破坏了环境。如何合理利用这些秸秆, 已经成为全世界研究的热点[19]。de Castro等[20]研究指出接种好氧的木质纤维分解微生物, 可以大幅度提高不同农业废弃物, 特别是农作物秸秆的分解。大部分的农作物秸秆中都含有纤维素、半纤维素及木质素, 它们占到秸秆总干质量的69%左右, 这些都可为真菌的生长提供很好的碳源[21]。本试验测定了木质纤维素降解菌株A.fumigatus Z5分解小麦秸秆过程中不同组分含量的变化, 结果表明纤维素和半纤维的相对含量降低, 而木质素和灰分的相对含量却升高。这主要是因为纤维素和半纤维占的比例比较大, 而木质素和其他组分占的比例比较小, 而且前者的降解速度远远大于后者, 导致其相对含量的增加, 但这并不表示木质素没有发生降解。Howell等[16]在研究树木结晶纤维素变化过程中也发现了相同的规律。木材中的木质素相对含量增加了93.8%, 进一步验证了树木中其他组分发生了降解。微生物分解木质纤维主要是通过分泌各种不同的胞外蛋白来实现的。由于小麦秸秆中富含纤维素与半纤维素, 因此本试验测定了与纤维素和半纤维素分解相关的酶活力。从测定结果可以得出, 纤维素酶活力的最大酶活力主要出现在处理第7天, 而半纤维素酶活力最大值主要出现在第3天。这说明半纤维素比纤维素更容易被降解, 这与半纤维素与纤维素的含量测定结果一致。纤维素酶的分泌跟诱导的底物有关系, 底物是影响微生物分泌木质纤维素酶的一个重要因子[22]。我们前期的研究发现, 菌株Z5在以玉米芯为碳源时纤维素酶活力比其他的碳源要高, 主要是因为玉米芯中纤维素和半纤维素的含量最高, 这一类物质更容易诱导产酶[23]。
内切纤维素酶和滤纸酶活力一般用来评价菌株分解秸秆能力的一个指标。本研究中, 在以小麦秸秆为唯一碳源时菌株Z5的最大内切酶活力和滤纸酶活力分别为393.41和80.92 U·g-1。航天诱变菌株黑曲霉ZM-8降解小麦秸秆时, 其最大的内切酶活力和滤纸酶活力分别为22.38和6.57 U·g-1[24]。Thermoascus aurantiacus在以小麦秸秆为碳源时, 虽然其内切酶活力为1 709 U·g-1, 但是其滤纸酶活力仅为5.5 U·g-1[25], 说明其综合酶活力偏低。而菌株Z5内切酶和滤纸酶活力比较均衡, 各个酶系在秸秆分解过程中协同作用, 最终实现秸秆的高效降解, 是一株高效木质纤维素分解菌。
为了更好地研究小麦秸秆在分解过程中具体组分发生了变化, 本试验采用二维核磁共振的方法(HSQC), 将秸秆粉碎后利用DMSO-d6溶胀, 可以将各种组分鉴定出来[18]。从分析结果可以得出, 在秸秆中能鉴定出3种主要成分, 包括脂肪族化合物、多糖类化合物和芳香族化合物。研究结果表明:脂肪族化合物中的松香基类化合物比较容易分解, 而多糖类化合物中α-L-Araf和4-O-MegleA比较容易先被降解, 而芳香族里面PCA7和FA7比较容易分解。这些研究结果与Daniel等[26]的结果相似, 他们通过热处理和酶水解等方法研究了小麦秸秆中各个组分的变化情况, 其中酶处理后的小麦秸秆与菌株Z5降解后的变化趋势是一致的, 进一步说明微生物是通过分泌各种水解酶来破坏木质纤维素, 从而实现小麦秸秆的降解。
| [1] | Potters G, van Goethem D, Schutte F. Promising biofuel resources:lignocellulose and algae[J]. Nature Education, 2010, 3(9): 14. |
| [2] | Yang H, Yan R, Chen H, et al. Characteristics of hemicellulose, cellulose and lignin pyrolysis[J]. Fuel, 2007, 86(12): 1781–1788. |
| [3] | Mahesh V B, Innu C, Allan H G, et al. Effects of extracellular proteome on wheat straw pretreatment during solid-state fermentation of Phlebia radiata ATCC 64658[J]. International Biodeterioration and Biodegradation, 2016, 109: 36–44. DOI: 10.1016/j.ibiod.2015.12.002 |
| [4] | Liu D Y, Zhang R F, Yang X M, et al. Thermostable cellulase production of Aspergillus fumigatus Z5 under solid-state fermentation and its application in degradation of agricultural wastes[J]. International Biodeterioration and Biodegradation, 2011, 65(5): 717–725. DOI: 10.1016/j.ibiod.2011.04.005 |
| [5] |
路瑶, 魏贤勇, 宗志敏, 等. 木质素的结构研究与应用[J].
化学进展, 2013, 25(5): 838–857.
Lu Y, Wei X Y, Zong Z M, et al. Structural investigation and application of lignin[J]. Progress in Chemistry, 2013, 25(5): 838–857. (in Chinese with English abstract) |
| [6] | Lee D S, Wi S G, Lee Y G, et al. Characterization of a new α-L-arabinofuranosidase from Penicillium sp.LYG 0704, and their application in lignocelluloses degradation[J]. Molecular Biotechnology, 2011, 49(3): 229–239. DOI: 10.1007/s12033-011-9396-4 |
| [7] | Andrade J P, Bispo A S, Marbach P A, et al. Production and partial characterization of cellulases from Trichoderma sp. is-05 isolated from sandy coastal plains of northeast Brazil[J]. Enzyme Research, 2011, 16: 1–7. |
| [8] | Sørensen A, Lübeck P S, Lübeck M, et al. β-glucosidases from a new Aspergillus species can substitute commercial β-glucosidases for saccharification of lignocellulosic biomass[J]. Canadian Journal of Microbiology, 2011, 57(8): 638–650. DOI: 10.1139/w11-052 |
| [9] | Juház T Z, Szengyel K, Rézey M, et al. Characterization of cellulases and hemicellulases produced by Trichoderma reesei on various carbon sources[J]. Process Biochemistry, 2005, 40: 3519–3525. DOI: 10.1016/j.procbio.2005.03.057 |
| [10] |
田维亮, 葛振红, 李继兴. 棉子壳中半纤维素、纤维素和木质素含量的测定[J].
中国棉花, 2013, 40(7): 24–25.
Tian W L, Ge Z X, Li J X. Determination of hemicellulose, cellulose and lignin contents in five samples of cotton seed shell[J]. Chinese Cotton, 2013, 40(7): 24–25. (in Chinese with English abstract) |
| [11] | Rohit R, Baljit K, Surender S, et al. Evaluation of secretome of highly efficient lignocellulolytic Penicillium sp.Dal 5 isolated from rhizosphere of conifers[J]. Bioresource Technology, 2016, 216: 985–967. |
| [12] |
王斐. 基质中木聚糖酶活力测定方法的研究进展[J].
天津化工, 2012, 26(5): 15–17.
Wang F. The study of the xylanase activity determination method in different substrates[J]. Tianjin Chemical Industry, 2012, 26(5): 15–17. (in Chinese with English abstract) |
| [13] | Linton S M, Greenaway P. Presence and properties of cellulase and hemicellulase enzymes of the gecarcinid land crabs Gecarcoidea natalis and Discoplax hirtipes[J]. Journal of Experimental Biology, 2004, 207: 4095–4104. DOI: 10.1242/jeb.01252 |
| [14] | Zara M, Kaisa M, Andres K, et al. Chemical characterization of hydrothermally pretreated and enzyme-digested wheat straw:an evaluation of recalcitrance[J]. Food Chemistry, 2016, 198: 132–140. DOI: 10.1016/j.foodchem.2015.07.108 |
| [15] | Kim S B, Lee S J, Lee J H, et al. Pretreatment of rice straw with combined process using dilute sulfuric acid and aqueous ammonia[J]. Biotechnology and Biofuels, 2013, 6(1): 1–11. DOI: 10.1186/1754-6834-6-1 |
| [16] | Howell C, Steenkjær H A C, Goodell B, et al. Temporal changes in wood crystalline cellulose during degradation by brown rot fungi[J]. International Biodeterioration and Biodegradation, 2009, 63(4): 414–419. DOI: 10.1016/j.ibiod.2008.11.009 |
| [17] | Rio J C D, Rencoret A J, Prinsen A P, et al. Structural characterization of wheat straw lignin as revealed by analytical pyrolysis, 2D-NMR, and reductive cleavage methods[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 5922–5935. DOI: 10.1021/jf301002n |
| [18] | Ralph S A, Ralph J. NMR database of lignin and cell wall model compounds[EB/OL].[2016-08-20]. https://www.glbrc.org/databases_and_software/nmrdatabase/NMR_DataBase_2009_Complete.pdf. |
| [19] | Chen Y N, Huang J X, Li Y P, et al. Study of the rice straw biodegradation in mixed culture of Trichoderma viride and Aspergillus niger by GC-MS and FTIR[J]. Environmental Science and Pollution Research, 2015, 22(13): 9807–9815. DOI: 10.1007/s11356-015-4149-8 |
| [20] | de Castro A M, Castilho L R, Freire D M G, et al. Multivariate optimization and supplementation strategies for the simultaneous production of amylases, cellulases, xylanases, and proteases by Aspergillus awamori under solid-state fermentation conditions[J]. Applied Biochemistry and Biotechnology, 2015, 175: 1588–1602. DOI: 10.1007/s12010-014-1368-2 |
| [21] | He Y F, Pang Y Z, Liu Y P, et al. Physicochemical characterization of rice straw pretreated with sodium hydroxide in the solid state for enhancing biogas production[J]. Energy and Fuel, 2008, 22: 2775–2781. DOI: 10.1021/ef8000967 |
| [22] | Bansal N, Tewari R, Soni R, et al. Production of cellulases from Aspergillus niger NS-2 in solid state fermentation on agricultural and kitchen waste residues[J]. Waste Management, 2012, 32(7): 1341–1346. DOI: 10.1016/j.wasman.2012.03.006 |
| [23] | Yang X W, Ma F Y, Zeng Y L, et al. Structure alteration of lignin in corn stover degraded by white-rot fungus Irpex lacteus CD2[J]. International Biodeterioration and Biodegradation, 2010, 64(2): 119–123. DOI: 10.1016/j.ibiod.2009.12.001 |
| [24] |
马旭光, 张宗舟. 航天诱变高产单细胞蛋白啤酒酵母YB-6菌株的筛选[J].
中国饲料, 2011, 11(5): 17–19.
Ma X G, Zhang Z Z. Screening of high yield single cell protein Saccharomyces cerevisiae strain YB-6 induced by space radiation[J]. Chinese Feed, 2011, 11(5): 17–19. (in Chinese with English abstract) |
| [25] | Kalogeris E, Christakopoulos P, Katapodis, et al. Production and characterization of cellulolytic enzymes from the thermophilic fungus Thermoascus aurantiacus under solid state cultivation of agricultural wastes[J]. Process Biochemistry, 2003, 38: 1099–1104. DOI: 10.1016/S0032-9592(02)00242-X |
| [26] | Daniel J Y, Prasad K, Christopher G H, et al. Two-dimensional NMR evidence for cleavage of lignin and xylan substituents in wheat straw through hydrothermal pretreatment and enzymatic hydrolysis[J]. Bioenergy Resource, 2013, 6: 211–221. DOI: 10.1007/s12155-012-9247-6 |




