文章信息
- 刘琳琳, 钱国良, 刘凤权
- LIU Linlin, QIAN Guoliang, LIU Fengquan
- 胶状溶杆菌OH17菌株遗传操作系统的构建
- Development of genetic system of Lysobacter gummosus OH17
- 南京农业大学学报, 2017, 40(4): 649-654
- Journal of Nanjing Agricultural University, 2017, 40(4): 649-654.
- http://dx.doi.org/10.7685/jnau.201611007
-
文章历史
- 收稿日期: 2016-11-07
近年来, 微生物资源的开发研究取得了非常大的进展, 已经成功分离鉴定了数万种新型菌株, 溶杆菌属新型生防菌株就是其中之一, 该属细菌在人类健康及农业生产中具有巨大的应用潜力[1-5]。溶杆菌属细菌可以产生多种新型抗生素[6], 如热稳定性抗真菌因子(HSAF)[7]、抗革兰氏阳性细菌活性物质(WAP-8294A2)[8-9]、2, 4-二乙酰基间苯三酚(2, 4-DAPG)、二盐基缩氨酸类抗生素(lysobactin)、缩氨酸类抗生素(tripropeptins)等, 在由真菌、线虫、细菌引起的植物病害的生物防治方面具有很高的应用价值[3], 具有开发高效低毒药物的巨大潜力。胶状溶杆菌(Lysobacter gummosus)OH17(以下简称OH17) 是本实验室从安徽水稻根际土壤中分离获得的一株生防细菌, 其对病原真菌、卵菌、革兰氏阳性细菌以及酿酒酵母均具有良好的拮抗效果[10], 深入研究这一菌株对于生防溶杆菌资源库构建, 以及新型、高效和广谱生物农药(农用抗生素)开发具有重要意义[11]。为了进一步研究次级代谢产物的生物合成分子机制, 我们对该菌株的遗传操作方法进行了研究。
细菌的遗传操作系统(基因敲除和功能互补)是研究基因功能的必要手段, 也是代谢产物合成和调控研究等必需的遗传学方法[12-13]。然而, 由于溶杆菌对多种抗生素具有抗性, 且敏感的抗生素种类也不相同, 导致溶杆菌的基因敲除系统不易构建[14]。pilR基因(Regulator of type Ⅳ pili synthesis)在产酶溶杆菌OH11中已证明参与抗菌物质的生物合成[15], 故本研究以OH17基因组中产酶溶杆菌OH11 pilR基因的同源基因为对象, 利用同源重组技术对该基因进行了缺失突变和互补, 建立了适用于胶状溶杆菌OH17的遗传操作系统, 为今后对OH17及其他胶状溶杆菌进行遗传学操作以及抗菌活性物质的生物合成途径研究奠定基础。
1 材料与方法 1.1 菌株和质粒试验用菌株和质粒及其特性和来源见表 1。OH17菌株分离自安徽水稻根际土壤, 分类命名为胶状溶杆菌(Lysobacter gummosus), 已保藏于中国科学院微生物研究所的中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC), 保藏号为CGMCC No.8649。
常用的LB培养基配方见文献[17], LB中Gm使用终浓度为25 μg·mL-1, Cm为34 μg·mL-1。LA培养基为LB培养基加琼脂粉17 g·L-1。10% TSB液体培养基配方:胰胳胨大豆肉汤3 g, 用ddH2O定容至1 000 mL。10% TSB固体培养基另加琼脂粉17 g·L-1。
1.3 试剂和设备使用的设备包括PCR仪、琼脂糖凝胶电泳仪、高效液相色谱等。本研究所用限制性内切酶、T4 DNA连接酶来源于Fermentas公司, 反转录试剂盒来源于大连TaKaRa公司, Transtaq酶来源于TransGene公司。蔗糖和X-gal为Sigma公司产品。细菌基因组提取试剂盒购于Tiangen公司, 质粒提取试剂盒、DNA胶回收纯化试剂盒、PCR产物纯化试剂盒购于Axygen公司。其他化学药品购自南京寿德生物公司。PCR引物合成和测序工作分别由金唯智生物科技有限公司和上海华大基因公司完成, 本试验所用的引物见表 2。卡那霉素(Km)、庆大霉素(Gm)、链霉素(Str)、氨苄青霉素(Amp)、四环素(Tet)、利福平(Rif)和氯霉素(Cm)等购于南京助研生物公司。
使用实验室7种常用抗生素:Gm、Km、Amp、Tet、Str、Rif和Cm, 分别配成5个浓度梯度的抗性平板, 即5、10、25、50、100 μg·mL-1。将OH17菌液摇至D600≈1.0, 取100 μL菌液涂布于各个抗性平板, 另设一个空白对照。于28 ℃培养箱培养, 待12~24 h后观察菌株生长状况。
1.4.2 OH17基因组DNA的抽提将单菌落接种于10% TSB液体培养基中, 28 ℃、220 r·min-1振荡培养12~24 h(D600≈1.0), 根据Tiangen细菌基因组提取试剂盒说明书抽提DNA。通过琼脂糖凝胶电泳和分光光度计分别对抽提DNA浓度及纯度进行检测, 最后基因组DNA放置-20 ℃保存。
1.4.3 基因敲除重组载体的构建根据目标基因pilR及其上、下游的核苷酸序列, 在基因上、下游各设计1对引物pilR-F1/pilR-R1、pilR-F2/pilR-R2(表 2), 以OH17基因组DNA为模板, 进行PCR反应, 扩增产物回收。将回收的上、下游片段分别用BamHⅠ/EcoRⅠ和EcoRⅠ/XbaⅠ进行酶切, 连接到预先用BamHⅠ和XbaⅠ切好的自杀性载体pJQ200SK上, 热激转化到大肠杆菌DH5α中, 利用LA平板(Gm 25 μg·mL-1, X-gal 100 μg·mL-1)进行蓝白斑筛选, 并进行PCR和双酶切验证, 得到正确的重组载体pJQ-pilR。
1.4.4 一次交换子的构建将得到的重组载体通过电击转化的方法导入OH17感受态细胞中, 利用LA平板(Gm 25 μg·mL-1)筛选获得一次交换子, 对载体上的Gm基因片段进行PCR验证。
1.4.5 突变体的筛选将验证正确的一次交换子在无抗生素LB培养基中振荡培养6~8 h后, 涂布于含10%蔗糖的LB平板上, 利用自杀载体上的筛选标记sacB基因, 通过蔗糖板的压力使未发生二次交换的一次交换子致死, 长出的单菌落即为二次交换子, 然后通过PCR筛选验证可以得到缺失突变株。
1.4.6 互补菌株的构建根据目标基因的核苷酸序列设计1对引物pilR-F/pilR-R, 以OH17基因组DNA为模板, 进行PCR反应, 扩增产物包括基因及其自身启动子。片段用BamHⅠ/HindⅢ进行酶切后, 与预先用BamHⅠ/HindⅢ切过的pSEVA321连接, 热激转化导入到大肠杆菌DH5α中, 用LA平板(Cm 34 μg·mL-1, X-gal 100 μg·mL-1)进行蓝白斑筛选, 并进行PCR验证和双酶切验证, 得到正确的重组载体。将重组载体电转化导入突变体菌株感受态细胞中, 通过表型进行菌落筛选。大肠杆菌感受态的制备、转化和质粒的提取参照文献[17]进行, 质粒抽提采用碱裂解法。
1.4.7 菌落形态的检测挑取LA平板上的野生型及其衍生菌株单菌落于10% TSB培养基中培养, 摇至D600≈1.0, 取2 μL菌液点于LA平板上, 28 ℃培养24~48 h, 观察结果。
1.4.8 缺失突变株的HSAF提取及HPLC分析在容积为150 mL的三角瓶中装25 mL的10% TSB培养基发酵缺失突变体菌株, 野生型为对照。28 ℃、200 r·min-1发酵24 h, 取4 mL发酵液于大试管中, 加入12 μL的浓盐酸进行酸化, 然后加入等体积的乙酸乙酯, 抽提1 h, 吸取2 mL上清液加入2 mL离心管中, 于通风橱吹干后-20 ℃贮存备用。HPLC分析前, 在离心管中加入200 μL甲醇溶解残留物, 用孔径为0.22 μm的有机系滤膜过滤。分析条件为:C18反相柱(5 μm, 4.6 mm×250 mm; Agilent Technologies), 进样量20 μL, 流速1 mL ·min-1, 初始流动相为乙腈和水(体积比为5 : 95, 都含有0.04%TFA), 检测波长为220 nm和318 nm, 检测条件见表 3。HSAF的产量为峰面积与发酵液D600的比值。
为了选择合适的抗性筛选标签, 我们进行了OH17对各种抗生素的抗性试验。结果(表 4)发现:OH17对Gm、Amp、Cm和Rif非常敏感, 最小抑制质量浓度为5 μg·mL-1; 对Tet有一定耐药性, 最小抑制质量浓度为25 μg·mL-1; Km在50 μg·mL-1浓度下可以正常生长, 说明OH17对Km不敏感; Str对菌体生长无影响。基于此, 选择Gm、Cm作为OH17突变株的筛选标记。

|
利用1.4.3节建立的方法, 构建pJQ-pilR重组载体并进行PCR验证, 验证正确的重组载体用BamHⅠ和XbaⅠ进行双酶切验证, 结果正确(图 1)。经电击转化, 重组质粒与基因组DNA的同源序列发生双交换后, 以引物pilR-F1/pilR-R2进行PCR扩增, ΔpilR扩增出大小为1 040 bp的条带, 而野生型OH17对应扩增出2 192 bp条带(图 2)。

|
图 1 重组载体pJQ-pilR的PCR和酶切验证 Figure 1 The PCR confirmation and enzyme digestion of recombination vector pJQ-pilR A:重组载体的PCR验证; B:重组载体的酶切验证。+:阳性对照; -:阴性对照; M:Marker; pJQ-pilR:构建成功的重组载体。 A:PCR confirmation of recombination vector; B:Enzyme digestion of recombination vector.+:Positive control; -:Negative control; M:Marker; pJQ-pilR:Successfully constructed recombination vector. |

|
图 2 突变体的PCR验证 Figure 2 PCR confirmation of mutants of pilR +:阳性对照; -:阴性对照; M:Marker; 方框:构建成功的pilR突变体。 +:Positive control; -:Negative control; M:Marker; Box stands for mutants. |
利用1.4.6节建立的方法构建重组载体pSEVA321-pilR, 经过PCR验证和双酶切验证后得到重组质粒pSEVA321-pilR, 电泳结果如图 3所示。将重组质粒电转化导入ΔpilR感受态细胞中, 在LA平板(34 μg·mL-1 Cm)上筛选转化子。

|
图 3 重组载体pSEVA321-pilR PCR和酶切验证 Figure 3 PCR and enzyme digestion of recombination vector pSEVA321-pilR A:重组载体的PCR验证; B:重组载体的酶切验证。+:阳性对照; -:阴性对照; M:Marker; pSEVA321-pilR:构建成功的重组载体。 A:PCR confirmation of recombination vector; B:Enzyme digestion of recombination vector.+:Positive control; -:Negative control; M:Marker; pSEVA321-pilR:Successfully constructed recombination vector. |
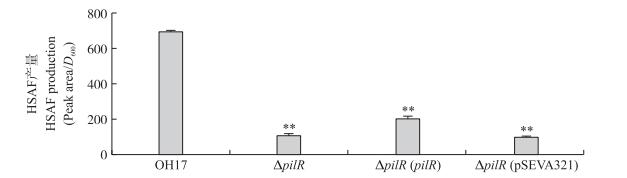
pilR基因缺失突变后, 突变体的菌落形态发生变化, 菌体变湿润且颜色变白(图 4); HPLC检测发现, ΔpilR的发酵产物中HSAF产量明显低于野生型(图 5)。互补菌株的菌落形态恢复到野生型状态(图 4), 并且HPLC检测发现HSAF产量得到了部分回补(图 5)。

|
图 4 pilR基因缺失突变株及其互补菌株的菌落形态 Figure 4 Colony morphology of mutant strain and complemented strain OH17:野生型; ΔpilR:突变体菌株; ΔpilR(pilR):互补菌株; ΔpilR(pSEVA321):空载菌株。 OH17:Wild type; ΔpilR:Mutant strain; ΔpilR(pilR):Complemented strain; ΔpilR(pSEVA321):Empty vector control. |
|
图 5 pilR基因缺失突变株及其互补菌株的发酵产物HSAF的产量 Figure 5 HSAF production of mutant strain and complemented strain * *表示各菌株HSAF产量与野生型差异极显著(P < 0.01)。 * *means highly significant different at 0.01 level compared with wild type. |
菌种改良一直是提高抗生素产量的关键。传统方法盲目性大, 效率低, 工作量大; 而在分析代谢产物合成及调控机制的基础上, 利用代谢工程方法对菌种进行改良, 运用现代分子生物遗传学的工具来改造菌株, 可以达到提高代谢产物产量的目的。这种方法一方面可以改造基因结构, 另一方面可以通过过量表达特异性的正调控因子或失活负调控因子来提高次级代谢产物的产量。因此, 遗传操作系统的构建是进行菌种改良的前提。
前期对溶杆菌属改良机制研究局限在编码基因克隆、原核表达等方面[18], 并未涉及功能基因定向敲除、互补等分子遗传学操作。为了从分子水平上阐述该菌的生防机制, 建立有效的遗传学操作是必要的。溶杆菌属遗传操作系统的构建比较困难, 原因主要包括两个方面, 一是溶杆菌属细菌对多种抗生素不敏感, 因此不容易选择合适的筛选标记, 难以进行筛选; 二是菌株之间存在差异, 遗传学操作系统不能通用。因此本研究构建的适用于胶状溶杆菌OH17的遗传操作系统, 对菌株的遗传改良以及生防机制的研究具有重要意义, 同时也为其他不便进行遗传操作的菌株提供了参考。构建胶状溶杆菌OH17的遗传操作系统, 从遗传学操作上对OH17进行改良, 深入研究其代谢产物合成机制并提高其代谢产物的产量, 对生物农药的开发利用具有重要意义。
| [1] |
姬广海. 溶杆菌属及其在植物病害防治中的研究进展[J].
云南农业大学学报, 2011, 26(1): 124–130.
Ji G H. Advances in the study on Lysobacter spp. bacteria and their effects on biological control of plant diseases[J]. Journal of Yunnan Agricultural University, 2011, 26(1): 124–130. (in Chinese with English abstract) |
| [2] | Kawamura Y, Tomida J, Morita Y, et al. 'Lysobacter enzymogenes ssp.cookii'Christensen 1978 should be recognized as an independent species, Lysobacter cookii sp. nov.[J]. FEMS Microbiology Letters, 2009, 298(1): 118–123. DOI: 10.1111/fml.2009.298.issue-1 |
| [3] | Wang Y, Dai J, Zhang L, et al. Lysobacter ximonensis sp.nov., isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(4): 786–789. DOI: 10.1099/ijs.0.65796-0 |
| [4] | Zhang L, Bai J, Wang Y, et al. Lysobacter korlensis sp.nov.and Lysobacter bugurensis sp.nov., isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(9): 2259–2265. DOI: 10.1099/ijs.0.024448-0 |
| [5] | Liu M, Liu Y F, Wang Y Q, et al. Lysobacter xinjiangensis sp.nov., a moderately thermotolerant and alkalitolerant bacterium isolated from a gamma-irradiated sand soil sample[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(2): 433–437. DOI: 10.1099/ijs.0.016931-0 |
| [6] | Wang Y, Qian G L, Li Y Y, et al. Biosynthetic mechanism for sunscreens of the biocontrol agent Lysobacter enzymogenes[J]. PLoS ONE, 2013, 8(6): e66633. DOI: 10.1371/journal.pone.0066633 |
| [7] |
刘轶儒, 徐菲菲, 钱国良, 等. 产酶溶杆菌rpfG基因的克隆与功能分析[J].
南京农业大学学报, 2013, 36(2): 45–50.
Liu Y R, Xu F F, Qian G L, et al. Clone and functional analysis of gene rpfG in Lysobacter enzymogenes strain OH11[J]. Journal of Nanjing Agricultural University, 2013, 36(2): 45–50. DOI: 10.7685/j.issn.1000.2030.2013.02.008(in Chinese with English abstract) |
| [8] | Li Y Y, Huffman J, Li Y, et al. 3-hydroxylation of the polycyclic tetramate macrolactam in the biosynthesis of antifungal HSAF from Lysobacter enzymogenes C3[J]. Medicinal Chemistry Communications, 2012, 3(8): 982–986. DOI: 10.1039/c2md20026k |
| [9] | Zhang W, Li Y Y, Qian G L, et al. Identification and characterization of the anti-methicillin-resistant Staphylococcus aureus WAP-8294A2 biosynthetic gene cluster from Lysobacter enzymogenes OH11[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(12): 5581–5589. DOI: 10.1128/AAC.05370-11 |
| [10] | Hayward A C, Fegan N, Fegan M, et al. Stenotrophomonas and Lysobater:ubiquitous plant-associated gamm-proteobacteria of developing significance in applied microbiology[J]. Journal of Applied Microbiology, 2010, 108(3): 756–770. DOI: 10.1111/jam.2010.108.issue-3 |
| [11] |
王娜, 武坤毅, 崔浪军, 等. 溶杆菌属细菌鉴定及生防机制概况[J].
西北农林科技大学学报(自然科学版), 2015, 43(5): 174–182.
Wang N, Wu K Y, Cui L J, et al. Advance in bacteria identification and biocontrol mechanism of Lysobacter spp.[J]. Journal of Northwest A & F University(Nat Sci Ed), 2015, 43(5): 174–182. (in Chinese with English abstract) |
| [12] | Dufour N, Rao R P. Secondary metabolites and other small molecules as intercellular pathogenic signals[J]. FEMS Microbiology Letters, 2011, 314(1): 10–17. DOI: 10.1111/fml.2010.314.issue-1 |
| [13] | Rodrigues A P D, Carvalho A S C, Santos A S, et al. Kojic acid, a secondary metabolite from Aspergillus sp., acts as an inducer of macrophage activation[J]. Cell Biology International, 2011, 35(4): 335–343. DOI: 10.1042/CBI20100083 |
| [14] | Tan Y Z, Xu D Q, Li Y, et al. Construction of a novel SacB-based system for marker-free gene deletion in Corynebacterium glutamicum[J]. Plasmid, 2011, 67: 44–52. |
| [15] | Chen Y, Xia J, Su Z, et al. Lysobacter PilR, the regulator of type Ⅳ pilus synthesis, controls antifungal antibiotic production via a cyclic di-GMP pathway[J]. Applied and Environment Microbiology, 2017, 83(7): e0397-16. |
| [16] | Quandt J, Hynes M F. Versatile suicide vectors which allow direct selection for gene replacement in Gram-negative bacteria[J]. Gene, 1993, 127(1): 15–21. DOI: 10.1016/0378-1119(93)90611-6 |
| [17] | Kieser T. Practical Streptomyces Genetics[M].Norwich: The John Innes Foundation, 2000. |
| [18] |
张岩, 伍辉军, 周晓辉, 等. 丁香假单胞大豆致病变种harpin编码基因的克隆表达与功能研究[J].
南京农业大学学报, 2013, 36(1): 6–12.
Zhang Y, Wu H J, Zhou X H, et al. Cloning, expressing and function of a harpin-encoding gene from Pseudomonas syringae pv. glycinea[J]. Journal of Nanjing Agricultural University, 2013, 36(1): 6–12. DOI: 10.7685/j.issn.1000-2030.2013.01.002(in Chinese with English abstract) |







