文章信息
- 朱碧春, 顾丽, 李正, 伍辉军, 顾沁, 吴黎明, 高学文
- ZHU Bichun, GU Li, LI Zheng, WU Huijun, GU Qin, WU Liming, GAO Xuewen
- 南极土壤芽孢杆菌的分离鉴定及其防治玉米细菌性褐腐病的研究
- Isolation and identification of the Antarctic soil Bacillus and its biocontrol effect against brown stalk rot on maize
- 南京农业大学学报, 2017, 40(4): 641-648
- Journal of Nanjing Agricultural University, 2017, 40(4): 641-648.
- http://dx.doi.org/10.7685/jnau.201611008
-
文章历史
- 收稿日期: 2016-11-07
芽孢杆菌是目前应用较广的一类微生物资源, 因其能产生对高温、低温和紫外等不良环境有较高抗逆性的芽孢而具有很强的生存适应能力, 可以广泛应用到农业、畜牧业、工业、医学等领域[1]。芽孢杆菌还能够产生脂肽化合物等多种抗菌物质, 能够抑制植物病原菌的生长和繁殖, 具有生防作用, 是生物菌肥和生物农药研发和应用的重要资源[2-3]。目前, 利用菌落形态特征、rep-PCR指纹图谱分析、16S rDNA及gyrB基因序列比对等多种方法相结合的鉴定手段, 可以更准确、快捷地将芽孢杆菌鉴定到种[4-6]。从普通生境中分离鉴定未知微生物的报道较多, 但新发现的微生物种类日渐减少[7]。极地环境具有独特的地理及气候特征, 低温、干旱和强辐射等自然环境造就了极地微生物在基因组成、酶学特性以及代谢调控等方面具有独特的分子生物学机制与生理生化特性[8], 能为新功能基因的发现, 以及生物菌肥和生物农药的研发提供菌株资源。
近年来, 在河北等地区大规模爆发了一种由菠萝泛菌(Pantoea ananatis)引起的玉米细菌性褐腐病, 症状表现为叶梢枯死卷曲, 叶脉产生黄色病斑, 茎秆处黄褐色干腐[9]。长期以来人们对玉米细菌性病害关注较少, 缺乏有效的防控手段, 筛选具有防病效果的芽孢杆菌菌株是开展该细菌病害生物防治的基础。
本研究从南极长城站地震台附近的企鹅聚居地土壤中分离菌株, 并通过平板抑菌试验和田间防治试验以及抗菌物质脂肽化合物的鉴定, 筛选到防治玉米细菌性褐腐病的芽孢杆菌菌株, 为该病害的防治提供了理论依据和应用菌株。
1 材料与方法 1.1 试验材料及供试菌株用于分离的土壤由中国科技大学朱仁斌教授惠赠, 4个土壤样品均来自南极企鹅聚居地, 采样的土层深度为0~5 cm、>5~10 cm、>10~15 cm、>15~20 cm, 编号分别为:EZ01、EZ05、EZ15、EZ20。Pantoea ananatis菌株DZ-12是笔者所在实验室分离自玉米细菌性褐腐病发病植株的病原菌。Bacillus amyloliquefaciens菌株FZB42由本实验室保存。
细菌培养基为LB培养基; 引物和测序均由南京金斯瑞生物技术有限公司完成; PCR扩增反应试剂购自TaKaRa公司; PCR产物纯化试剂盒购自爱思进生物技术公司。
1.2 芽孢杆菌分子鉴定 1.2.1 16S rDNA序列分析鉴定16S rDNA扩增引物为正向引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′), 反向引物1492R(5′-GGYTACCTTGTTACGACTT-3′)。PCR扩增条件为:95 ℃ 4 min; 94 ℃ 1 min, 50 ℃ 1 min, 72 ℃ 2 min, 共34个循环; 72 ℃ 10 min[10]。吸取5 μL 16S rDNA PCR产物, 使用10 g ·L-1的琼脂糖凝胶于100 V电压下电泳30 min, 然后在凝胶成像仪下观察。将16S rDNA扩增产物回收纯化后测序, 所得序列通过NCBI数据库进行BLAST比对, 通过MEGA 3.1软件[11]对分离芽孢杆菌及模式菌序列进行系统发育分析。
1.2.2 gyrB基因序列分析鉴定gyrB基因扩增引物序列为正向引物UP1f(5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′), 反向引物UP2r(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′)。PCR扩增程序:95 ℃ 4 min; 98 ℃ 10 s, 62 ℃ 1 min, 72 ℃ 2 min, 共30个循环; 72 ℃ 8 min。吸取5 μL gyrB PCR产物, 使用10 g ·L-1的琼脂糖凝胶于100 V电压下电泳30 min, 然后在凝胶成像仪下观察。将gyrB基因扩增产物纯化测序, 所得序列通过NCBI数据库进行BLAST比对, 通过MEGA 3.1软件对分离芽孢杆菌及模式菌序列进行系统发育分析。
1.3 平板抑菌试验吸取5 mL液体培养18 h的菌株DZ-12菌液, 于40 ℃的LB培养基中摇匀后倒平板吹干。然后, 吸取液体培养18 h的芽孢杆菌菌液5 μL, 滴加于预先放入无菌滤纸碟(直径为7 mm)的平板上, 37 ℃恒温培养20 h。记录菌落直径、透明圈直径, 并计算抑菌圈大小。
1.4 芽孢杆菌发酵液防治玉米细菌性褐腐病的田间试验试验共设芽孢杆菌EZ15-07、EZ01-05发酵液2个处理, 芽孢杆菌FZB42发酵液对照和1个空白对照。小区面积40 m2, 随机区组排列, 每个处理重复3次。各芽孢杆菌发酵液使用浓度均为2.0×108 CFU · L-1。采用喷雾法处理, 用市下牌手动喷雾器在玉米(品种为‘江玉403’)灌浆期进行叶面喷施, 空白对照喷等量清水。处理1 d后于叶面喷雾接种玉米细菌性褐腐病病原菌DZ-12, 病原菌菌液使用浓度为2.0×108 CFU · L-1。喷施病原菌后立即进行套袋处理, 直至试验结束。接种后每7 d调查1次, 共调查2次。记载各级发病株数[12], 计算病情指数和防治效果。采用统计学软件SPSS 16.0对试验结果进行差异显著性分析, 比较处理间差异。
1.5 脂肽化合物的粗提和分析对芽孢杆菌菌株EZ15-07和EZ01-05采用Landy培养基进行发酵, 发酵条件参见王帅等[13]方法。发酵结束后, 采用酸沉淀法进行脂肽化合物的粗提。为准确了解菌株产生的脂肽类抗生素种类, 进行基质协助激光解吸附/电离-飞行时间质谱(matrix-assisted laser desorption/ionization-time of flight mass spectrometry, MALDI-TOF-MS)(BRUKER, ultrafle xtreme)分析, 基质为α-氰-4-羟肉桂酸(α-cyano-4-hydroxycinnamic acid)。
2 结果与分析 2.1 16S rDNA序列分析鉴定从南极企鹅聚集地不同深度的土样中分离获得了23株菌落形态不同的芽孢杆菌。其中, 在0~5 cm土层分离得到3株芽孢杆菌, 在>5~10 cm土层分离到4株芽孢杆菌, 在>10~15 cm土层分离到7株芽孢杆菌, 在>15~20 cm土层分离到9株芽孢杆菌。分离获得的芽孢杆菌数量随土层加深而增多。
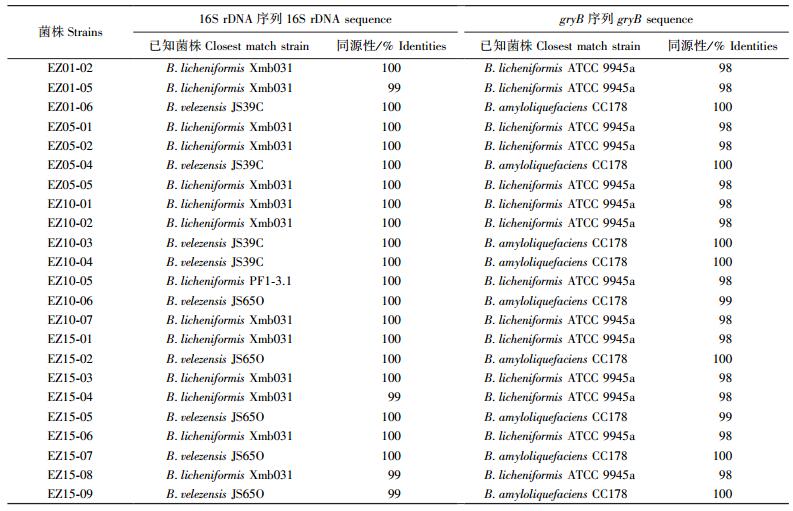
将分离得到的23株芽孢杆菌以基因组DNA为模板扩增16S rDNA片段。扩增到大小约1 500 bp的PCR特征性条带, 与芽孢杆菌16S rDNA的理论值基本相符(图 1)。将测序结果在NCBI中与GenBank中己知序列进行BLAST比对。比对结果(表 1)表明:菌株EZ01-02、EZ01-05、EZ05-01、EZ05-02、EZ05-05、EZ10-01、EZ10-02、EZ10-07、EZ15-01、EZ15-03、EZ15-04、EZ15-06、EZ15-08与B.licheniformis Xmb031的16S rDNA序列同源性均为99%以上; 菌株EZ01-06、EZ05-04、EZ10-03、EZ10-04与B.velezensis JS39C的16S rDNA序列同源性均为100%;菌株EZ10-05与B.licheniformis PF1-3.1的16S rDNA序列同源性为100%;菌株EZ10-06、EZ15-02、EZ15-05、EZ15-07、EZ15-09与B.velezensis JS65O的16S rDNA序列同源性为99%以上。

|
图 1 16S rDNA片段PCR扩增 Figure 1 PCR amplified profile of 16S rDNA fragmen M.DL2000 marker; 1.EZ01-02;2.EZ01-05;3.EZ05-01;4.EZ05-02;5.EZ05-05;6.EZ10-01;7.EZ10-02;8.EZ10-05;9.EZ10-07;10.EZ15-01;11.EZ15-03;12.EZ15-04;13.EZ15-06;14.EZ15-08;15.EZ01-06;16.EZ05-04. The same as follows. |
|
将分离得到的23株芽孢杆菌以基因组DNA为模板扩增gyrB基因, 扩增到大小约1 300 bp的PCR特征性条带, 与芽孢杆菌gyrB基因的理论值基本相符(图 2)。将测序结果与GenBank中己知序列进行BLAST比对。比对结果(表 1)表明:菌株EZ01-02、EZ01-05、EZ05-01、EZ05-02、EZ05-05、EZ10-01、EZ10-02、EZ10-05、EZ10-07、EZ15-01、EZ15-03、EZ15-04、EZ15-06、EZ15-08与B.licheniformis ATCC 9945a的gyrB序列同源性均为98%;菌株EZ01-06、EZ05-04、EZ10-03、EZ10-04、EZ10-06、EZ15-02、EZ15-05、EZ15-07、EZ15-09与B.amyloliquefaciens CC178的gyrB序列同源性均为99%以上。
|
图 2 gyrB基因片段的PCR扩增结果 Figure 2 PCR amplified profile of gyrB gene fragment |
根据16S rDNA、gyrB基因序列对比分析及与模式菌系统进化树分析结果(表 1、图 3和图 4), 最终将菌株EZ01-06、EZ05-04、EZ10-03、EZ10-04、EZ10-06、EZ15-02、EZ15-05、EZ15-07、EZ15-09鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens); 菌株EZ01-02、EZ01-05、EZ05-01、EZ05-02、EZ05-05、EZ10-01、EZ10-02、EZ10-05、EZ10-07、EZ15-01、EZ15-03、EZ15-04、EZ15-06、EZ15-08鉴定为地衣芽孢杆菌(B.licheniformis)。
|
图 3 基于16S rDNA序列构建的芽孢杆菌系统发育树 Figure 3 Phylogenetic tree of Bacillus strains based on 16S rDNA gene sequences |

|
图 4 基于gyrB序列构建的芽孢杆菌菌株系统发育树 Figure 4 Phylogenetic tree of Bacillus strains based on gyrB gene sequences |
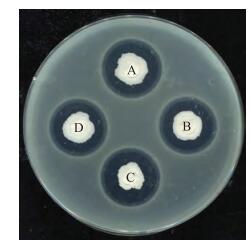
以分离获得的23株芽孢杆菌菌株作为供试菌株, 筛选抑制菌株P.ananatis DZ-12的生防芽孢杆菌。最终筛选出4个抑菌圈大于10 mm的菌株, 其中, 抑菌效果最好即抑菌圈最大的是菌株EZ15-08(表 2、图 5)。

|
|
图 5 芽孢杆菌菌株对玉米细菌性褐腐病病原菌DZ-12的抑制效果 Figure 5 Inhibitory effect of Bacillus strains on P.ananatis DZ-12 A.EZ15-09;B.EZ15-07;C.EZ15-08;D.EZ01-05 |
试验结果(图 6, 表 3)表明:菌株EZ15-07和EZ01-05对玉米细菌性褐腐病都有较好的防治效果, 防治效果均达到55%以上, 与FZB42接近。其中以菌株EZ15-07的防治效果更为突出, 达59.3%。表明菌株EZ15-07和EZ01-05均具有较好的田间应用潜力。

|
图 6 芽孢杆菌防治玉米细菌性褐腐病的田间试验 Figure 6 Controlling of P.ananatis with Bacillus strain in the field |
芽孢杆菌产生的脂肽类化合物是其主要的抗菌物质, 对病原菌有很好的拮抗效果。故对菌株EZ15-07和EZ01-05产生的脂肽类化合物进行了检测。芽孢杆菌产生的脂肽类抗生素相对分子质量为900~2 000[14]。MALDI-TOF-MS图谱显示:菌株EZ15-07在m/z值为1 017.161、1 030.264处有离子峰(簇)出现(图 7-A), 这2个离子峰对应于表面活性素(Surfactin)的相对分子质量; 在m/z值为1 053.467、1 069.448、1 083.461、1 097.461处有离子峰(簇)出现(图 7-B), 这4个离子峰均对应于伊枯草菌素Bacillomycin D的相对分子质量, 表明菌株EZ15-07发酵后产生了脂肽类化合物Surfactin和Bacillomycin D。
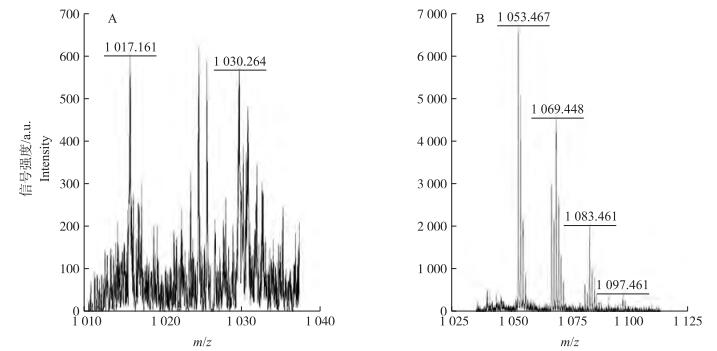
|
图 7 菌株EZ15-07产生的Surfactin(A)和Bacillomycin D(B)的MALDI-TOF-MS检测 Figure 7 MALDI-TOF-MS analysis of Surfactin(A)and Bacillomycin D(B)produced by strain EZ15-07 |
菌株EZ01-05在m/z值为1 053.503、1 067.515、1 081.526处有离子峰(簇)出现(图 8-A), 这3个离子峰均对应于Bacillomycin D的相对分子质量; 在m/z值为1 485.702、1 499.789、1 501.737、1 529.738处有离子峰(簇)出现(图 8-B), 这4个离子峰对应于泛革素(Fengycin)的相对分子质量, 表明菌株EZ01-05发酵后产生了脂肽类化合物Bacillomycin D和Fengycin。
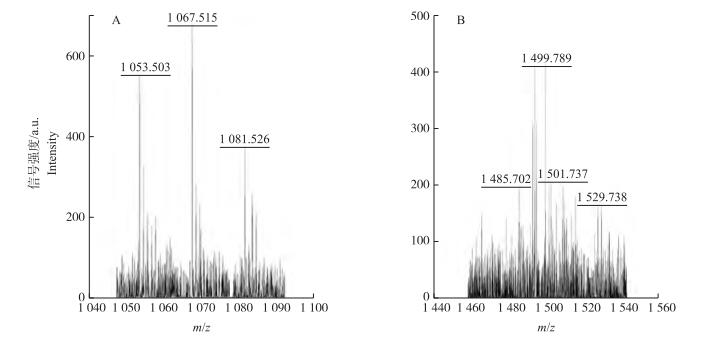
|
图 8 菌株EZ01-05产生的Bacillomycin D(A)和Fengycin(B)的MALDI-TOF-MS检测 Figure 8 MALDI-TOF-MS analysis of Bacillomycin D(A)and Fengycin(B)produced by strain EZ01-05 |
本研究自南极长城站地震台附近的企鹅聚居地土壤中分离、鉴定了23株芽孢杆菌, 分离菌株种类比较单一、数量有限, 极端的严寒环境限制了芽孢杆菌的生存。极端环境微生物研究是目前微生物研究的热点, 南极特殊的极地环境为极端微生物资源的研究、开发及应用提供了平台。特殊环境适应性菌株必定存在着特殊的适应机制[15-18], 本研究为后续的南极芽孢杆菌抗逆性机制探索提供了菌株资源。本课题组后续将进一步检测其在酸、碱和低温条件下的生长特性以及抗氧化胁迫能力, 以期为解释芽孢杆菌低温适应机制、生防菌应用性研究提供理论基础。
基于16S rDNA序列的鉴定已成为微生物种类和遗传多样性分析的一种常用分析手段, 但16S rDNA通常只能鉴定到属。蛋白编码基因的序列分析也被广泛应用于芽孢杆菌属细菌的分类鉴定中, 目前应用于芽孢杆菌分类鉴定的蛋白编码基因主要有gyrA、gyrB、rpoB、rpoC、dnaA和dnaK等。其中, gyrB约有1 400个碱基, 碱基替换频率较高, gyrB基因的变异速度也较其他蛋白质速度快, 其序列分析可应用于细菌种水平的鉴定[19-20]。本研究通过结合16S rDNA及gyrB基因序列分析, 将这23株芽孢杆菌鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens)9株和地衣芽孢杆菌(B.licheniformis)14株。
平板抑菌检测分离菌株试验结果发现:EZ15-09、EZ15-07、EZ15-08、EZ01-05对P.ananatis菌株DZ-12有较好的抑菌效果。但菌株EZ15-08在培养过程中生长较慢, 生长速率远低于菌株EZ15-07和EZ01-05, EZ15-09在平板抑菌试验中抑菌圈小于EZ15-07和EZ01-05, 故选取芽孢杆菌EZ15-07和EZ01-05进行田间试验, FZB42作为对照。田间试验进一步证实EZ15-07和EZ01-05对玉米细菌性褐腐病具有较好的防治效果, 其防治效果与商品化菌株FZB42接近。菌株EZ15-07和EZ01-05分离自南极, 对低温环境具有更强的适应性, 如在早春低温环境条件下使用可能比一般生防芽孢杆菌的生防效果更好, 但需要进一步的试验验证。
脂肽类化合物是芽孢杆菌产生的主要抗菌物质。本研究对筛选获得的对玉米细菌性褐腐病具有较好防治效果的芽孢杆菌EZ15-07和EZ01-05菌株产生的脂肽类化合物的种类进行分析。脂肽类化合物主要包括表面活性素(Surfactin)、伊枯草菌素(Iturin)和泛革素(Fengycin)3大类, 其中, Surfactin对细菌、病毒有很好的抑制活性; Iturin是一种强烈抑制真菌的脂肽类化合物, 主要包括Iturin A、B、C、D、E, Bacillomycin D、F、L和Mycosubtilin等; Fengycin是对真菌有很强抑菌活性的脂肽类化合物[21]。MALDI-TOF-MS检测发现, 菌株EZ15-07能产生Surfactin和Bacillomycin D 2种脂肽类化合物, 菌株EZ01-05能产生Bacillomycin D和Fengycin 2种脂肽类化合物。菌株EZ15-07和EZ01-05都能产生具有抑菌活性的脂肽类化合物, 故在田间试验中2个菌株都表现出了较好的防治效果。表明芽孢杆菌的抑菌和防病作用与产生的脂肽化合物的种类和组成有关。
| [1] |
谢永丽, 徐志伟, 马莉贞, 等. 青海北山林场桦树根围芽孢杆菌分子鉴定及其拮抗活性分析[J].
植物保护学报, 2012, 39(3): 246–252.
Xie Y L, Xu Z W, Ma L Z, et al. Molecular identification of Bacillus strains isolated from rhizosphere of Betula platyphylla in Qinghai Beishan timberland and its antagonistic activity analysis[J]. Acta Phytophylacica Sinica, 2012, 39(3): 246–252. (in Chinese with English abstract) |
| [2] | Chen D, Liu X, Li C Y, et al. Isolation of Bacillus amyloliquefaciens S20 and its application in control of eggplant bacterial wilt[J]. Journal of Environmental Management, 2014, 137: 120–127. DOI: 10.1016/j.jenvman.2014.01.043 |
| [3] |
刘芳, 薛鹏琦, 乔俊卿, 等. 西藏低温适生芽孢杆菌的分离鉴定及其抗菌和促生作用[J].
中国生物防治, 2010, 26(4): 453–460.
Liu F, Xue P Q, Qiao J Q, et al. Isolation and identification of a low-temperature-adapted Bacillus in Tibet and its antagonistic and growth-promoting effect[J]. Chinese Journal of Biological Control, 2010, 26(4): 453–460. (in Chinese with English abstract) |
| [4] | Bavykin S G, Lysov Y P, Zakhariev V, et al. Use of 16S rRNA, 23S rRNA, and gyrB gene sequence analysis to determine phylogenetic relationships of Bacillus cereus group microorganisms[J]. Journal of Clinical Microbiology, 2004, 42(11): 3711–3730. |
| [5] | Romero D, Vicente A, Rakotoaly R H, et al. The iturin and fengycin families of lipoppeptides are key factors in antagonism of Bacillus subtilis toward Podosphaera fusca[J]. Molecular Plant-Microbe Interactions, 2007, 20: 430–440. DOI: 10.1094/MPMI-20-4-0430 |
| [6] | van Trappen S, Mergaert J, van Eygen S, et al. Diversity of 746 heterotrophic bacteria isolated from microbial mats from ten Antarctic lakes[J]. Systematicand Applied Microbiology, 2002, 25: 603–610. DOI: 10.1078/07232020260517742 |
| [7] |
何培青, 王红梅, 沈继红, 等. 南极芽孢杆菌Bacillus sp.107生长特性及抑制植物病原真菌的研究[J].
海洋科学进展, 2011, 29(2): 179–185.
He P Q, Wang H M, Shen J H, et al. Antarctic Bacillus sp. 107 growth characteristics and inhibition against plant pathogenic fungi[J]. Advances in Marine Science, 2011, 29(2): 179–185. (in Chinese with English abstract) |
| [8] | Feller G, Narinx E, Arpigny J L, et al. Temperature dependence of growth, enzyme secretion and activity of psychrophilic Antarctic bacteria[J]. Appl Microbiol Biotechnol, 1994, 41: 477–479. DOI: 10.1007/BF00939039 |
| [9] |
顾沁, 张昊, 黄海, 等. 一种玉米新型细菌性褐腐病的病原鉴定[J].
植物保护, 2016, 42(3): 87–90.
Gu Q, Zhang H, Huang H, et al. Identification of the bacteria causing a new brown stalk rot on maize[J]. Plant Protection, 2016, 42(3): 87–90. (in Chinese with English abstract) |
| [10] | Kumar S, Tamura K, Nei M. MEGA3:Integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics, 2004, 5(2): 150–163. DOI: 10.1093/bib/5.2.150 |
| [11] | Yamamoto S, Harayama S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains[J]. Appl Environ Microbiol, 1995, 61: 1104–1109. |
| [12] |
吕国忠, 张益先, 梁景颐, 等. 玉米灰斑病发生流行规律及品种抗病性[J].
植物病理学报, 2003, 33(5): 462–467.
Lü G Z, Zhang Y X, Liang J Y, et al. Epidemics of gray leaf spot of corn Cercosporazeae-maydisand varietal resistance[J]. Acta Phytophylacica Sinica, 2003, 33(5): 462–467. (in Chinese with English abstract) |
| [13] |
王帅, 高圣风, 高学文, 等. 枯草芽孢杆菌脂肽类抗生素发酵和提取条件[J].
中国生物防治, 2007, 23(4): 342–347.
Wang S, Gao S F, Gao X W, et al. Fermentation optimization in lipopeptide productivity of Bacillus subtilis G1[J]. Chinese Journal of Biological Control, 2007, 23(4): 342–347. (in Chinese with English abstract) |
| [14] | Cho S J, Lee S K, Cha B J, et al. Detection and characterization of the Gloeosporium gloeosporioides growth inhibitory compound iturin A from Bacillus subtilis strain KS03[J]. FEMS Microbiology Letters, 2003, 223: 47–51. DOI: 10.1016/S0378-1097(03)00329-X |
| [15] |
王玉霞, 姜威, 刘宇帅, 等. 寒地耐冷生防菌株筛选鉴定及特性研究[J].
东北农业大学学报, 2016, 47(8): 31–38.
Wang Y X, Jiang W, Liu Y S, et al. Study on isolation and characterization of a psychrotrophic antagonistic bacterium from cold area[J]. Journal of Northeast Agricultural University, 2016, 47(8): 31–38. (in Chinese with English abstract) |
| [16] | Le P T, Makhalanyane T P, Guerrero L D, et al. Comparative metagenomic analysis reveals mechanisms for stress response in hypoliths from extreme hyperarid deserts[J]. Genome Biology and Evolution, 2016, 8(9): 2737–2747. DOI: 10.1093/gbe/evw189 |
| [17] | Davail S, Feller G, Narinx E, et al. Cold adaptation of proteins purification, characterization, and sequence of the heat-labile subtilisin from the antarctic psychrophile Bacillus TA41[J]. Journal of Biological Chemistry, 1994, 269(26): 17448–17453. |
| [18] | Velusamy P, Pachaiappan R, Christopher M, et al. Isolation and identification of a novel fibrinolytic Bacillus tequilensis CWD-67 from dumping soils enriched with poultry wastes[J]. J Gen Appl Microbiol, 2015, 61: 241–247. DOI: 10.2323/jgam.61.241 |
| [19] | Brown E W, Davis R M, Gouk C, et al. Phylogenetic relationships of necrogenic Erwinia and Brenneriaspecies as revealed by glyceraldehyde-3-phosphate dehydragenase gene sequences[J]. International Journal of Systemic Evolutionary Microbiology, 2000, 50(60): 2057–2068. |
| [20] | Küpfer M, Kuhnert P, Korczak B M, et al. Genetic relationships of Aeromonas strains inferred from 16S rRNA, gyrB and rpoB gene sequences[J]. International Journal of Systemic Evolutionary Microbiology, 2006, 56: 2743–2751. DOI: 10.1099/ijs.0.63650-0 |
| [21] |
高学文, 姚仕义, HuongP, 等. 枯草芽孢杆菌B2菌株产生的表面活性素变异体的纯化和鉴定[J].
微生物学报, 2003, 43(5): 647–652.
Gao X W, Yao S Y, Huong P, et al. Purification and identification of surfactin isoforms produced by Bacillus subtilis B2 strain[J]. Acta Microbiologica Sinica, 2003, 43(5): 647–652. (in Chinese with English abstract) |





