文章信息
- 刘鑫, 黄兴如, 张晓霞, 邱吉国, 徐冬青, 何健
- LIU Xin, HUANG Xingru, ZHANG Xiaoxia, QIU Jiguo, XU Dongqing, HE Jian
- 高浓度多环芳烃污染土壤的微生物-植物联合修复技术研究
- Experimental study on plant-microbial remediation of high concentration PAHs-contaminated soil
- 南京农业大学学报, 2017, 40(4): 632-640
- Journal of Nanjing Agricultural University, 2017, 40(4): 632-640.
- http://dx.doi.org/10.7685/jnau.201606036
-
文章历史
- 收稿日期: 2016-06-28
2. 中国农业科学院资源环境与区划研究所, 北京 100081
2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China
多环芳烃(polycyclic aromatic hydrocarbons, 简称PAHs), 是指2个或2个以上苯环以线状、角状或簇状排列的稠环化合物, 是煤、石油、木材、烟草和有机高分子化合物等有机物不完全燃烧或高温裂解的副产物[1]。由于此类化合物具有极低的水溶性, 极高的致癌、致畸、致突变性, 且化学性质稳定, 在环境中很难消除, 给人类健康和生态环境带来很大的危害。因此, PAHs被美国环保局和欧盟同时确定为优先控制污染物, 并把其中的16种作为环境污染的监测参数[2]。我国多环芳烃土壤环境污染形势非常严峻, 尤其在污水灌溉区、市郊及工矿企业周边土壤中受到高浓度PAHs污染, 浓度甚至高达20 000 μg·kg-1[3-5]。如何研发高效、安全且无二次污染的技术修复PAHs污染土壤, 已成为当前环境科学研究亟待解决的问题。
生物修复是一种新型原位生物修复技术, 利用微生物或植物等的代谢活性降解转化有毒有机污染物, 从而实现污染物无害化的技术[6-7]。与物理化学修复技术相比, 生物修复技术具有费用低, 无二次污染, 适合大面积面源污染修复等优点, 是土壤有机污染修复技术的主流和发展方向[8]。微生物修复是研究最早、最深入, 也是应用最为广泛的一种生物修复方法, 是土壤中PAHs降解的主要途径[9]。但微生物修复技术有降解菌剂保存期短, 降解菌难于在土壤中存活等不足, 修复效果往往不稳定, 难于大规模应用推广。微生物和植物联合修复是目前最具发展潜力的一种生物修复技术, 植物能部分降解有机污染物, 而更为重要的是植物根系及其分泌物可以为具备有机污染物降解能力的共生菌、内生菌或根际微生物提供一个良好的生长环境, 有利于降解菌在土壤中的存活和定殖, 从而显著增加对有机污染物的降解效率[10-11]。目前, 国内外已有较多微生物-植物联合修复PAHs的报道, 筛选的植物有荞菜、玉米、蓖麻、黑麦草、紫花苜蓿和高羊茅等, 筛选的PAHs降解菌有植物内生细菌、丛枝菌根真菌和根瘤菌等[12-14]。但到目前为止研究主要针对人为添加PAHs污染土壤的修复, 且大多局限于实验室盆钵试验, 而对于PAHs实地污染土壤及田间试验条件下微生物-植物联合修复PAHs污染土壤的研究鲜有报道。
鉴于此, 本文采用盆栽试验和大田试验方法, 研究了实地PAHs污染土壤的微生物-植物联合修复效果, 测定PAHs各组分的降解效率和降解规律, 为大田条件下PAHs污染土壤的微生物-植物联合修复规模化应用提供理论依据和技术支持。
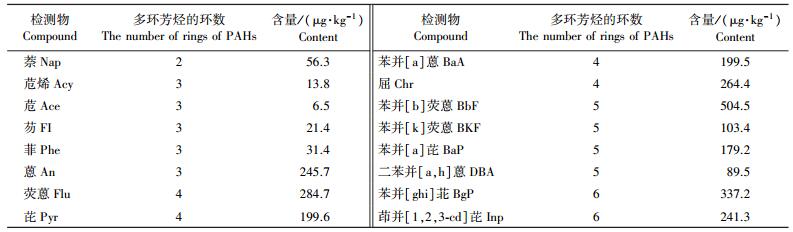
1 材料与方法 1.1 供试土壤 1.1.1 盆栽试验土壤盆栽试验用的污染土壤取自山东新泰某焦化厂, 挖取锅炉旁空地的表层10 cm的土样, 将土样搅拌均匀后带回实验室。取部分土壤样品, 冷冻干燥后测定PAHs含量。土壤的基本理化性质如下:pH8.3, 有机质158 g·kg-1, 总氮0.6 μg·kg-1, C/N为11.3, 土壤含水率为40.5%。土壤中PAHs总含量为20 429.0 μg·kg-1, 16种PAHs组分含量见表 1, PAHs的各环组分含量从大到小的顺序依次为:4环、3环、6环、5环、2环, 占本底PAHs总量分别为28.7%、27.2%、19.8%、19.6%和4.6%。
试验农田位于河北省唐山市某发电厂附近, 农田所在区域有多处大型的钢铁厂、发电厂、焦化厂及石灰厂等, 常年排放大量的污染气体, 该地区属于国内空气污染较为严重的区域之一。试验农田土壤本地PAHs含量检测:取试验农田表层20 cm内土样, 现场混合均匀后带回实验室, 取部分土样分析土壤中本地的PAHs含量, 剩余土壤放入-80 ℃保存备用。土壤中PAHs总含量为2 778.3 μg·kg-1, 16种组分含量见表 2。研究区土壤中本底PAHs的各环组分含量从大到小依次为:4环、5环、6环、3环、2环, 占本底PAHs总量分别为2.0%、11.5%、20.8%、31.6%、34.1%。
紫花苜蓿种子购于中国农业科学院植物保护研究所。取饱满的紫花苜蓿种子放于500 mL三角瓶中, 加入10%的双氧水溶液中消毒5 min, 再用无菌水反复冲洗。将灭菌后的滤纸放入保温盒中, 加入适量无菌水, 使滤纸保持湿润状态。将表面消毒后的种子均匀铺在湿润的滤纸上, 再盖上一层灭菌后的纱布, 盖好保温盖, 放于28 ℃恒温培养箱中, 催芽2~3 d后用于后期的盆栽试验及田间试验。根瘤菌(Rhizobium petrolearium)菌株SL-1[15]由本实验室筛选自石油污染土壤, 对菲、芴等PAHs组分具有较强的降解能力。
1.3 药品与试剂 1.3.1 培养基TSA合成培养基:大豆木瓜蛋白酶消化物5.0 g, 酪蛋白胰酶消化物15.0 g, NaCl 5.0 g, 琼脂15.0 g, 蒸馏水1 000 mL, pH7.3。
普通培养基(LB):酵母提取物5.0 g, 胰蛋白胨10.0 g, NaCl 10.0 g, 琼脂20.0 g, 蒸馏水1 000 mL, pH7.2。
松本哲良培养液:试剂1, KH2PO4 2.2 g, KCl 15.5 g, MgSO4 25 g, 溶于500 mL蒸馏水; 试剂2, CaCl2 21.5 g溶于500 mL蒸馏水; 试剂3, 柠檬酸铁3 g溶于500 mL蒸馏水; 试剂4, NaNO3 3 g, MnSO4 0.1 g, ZnSO4 0.025 g, CuSO4 0.025 g, H3BO3 0.025 g, Na2MoO4 0.005 g, 溶于500 mL蒸馏水。4种试剂等体积混合后稀释200倍使用。
1.3.2 主要试剂16种PAHs标准溶液均购于中国国家标准物质研究中心; 培养基所用化学药品, 二氯甲烷、正己烷、丙酮、甲醇、环己烷等有机溶剂均为分析纯, 正己烷、层析硅胶为色谱纯, 购于美国Tedia公司。
1.4 试验设计 1.4.1 盆栽试验试验设置4个处理:1) 不种苜蓿, 不接根瘤菌(CK); 2) 不种苜蓿, 接根瘤菌(菌); 3) 种植苜蓿, 不接根瘤菌(苜蓿); 4) 种植苜蓿, 接根瘤菌(苜蓿+菌), 每个处理设3个重复。将采集的污染土样和灭菌的蛭石按体积比为1 : 1混合, 依次装入盆钵中, 每盆约150 g, 接菌处理的土壤加入5 mL SL-1菌悬液。将菌株SL-1接至TSB中培养至对数生长期后期, 离心弃上清液, 菌体用生理盐水洗涤2次后, 加入生理盐水制成菌含量约为1.0×1010 CFU的菌悬液。将催芽后的种子放入SL-1菌悬液中浸泡30 min, 取出晾干后依次均匀播种于盆钵土壤中, 每个盆钵播入10粒种子。盆栽放于光照培养箱中培养, 每天浇水1次, 半个月浇1次松本哲良营养液。处理后20和60 d定期取样, 测定其中PAHs含量。植物取出后洗出根系保存, 测量其各项生理指标。
1.4.2 田间试验试验设置4个处理:1) 不种苜蓿, 不接根瘤菌(CK); 2) 不种苜蓿, 接根瘤菌(菌); 3) 种植苜蓿, 不接根瘤菌(苜蓿); 4) 种植苜蓿, 接根瘤菌(苜蓿+菌), 每个处理设3个重复。将菌悬液与无菌蛭石混匀, 使菌剂中SL-1含量为1.0×1010 CFU·g-1。将研究区划分为12个小区, 小区面积为12 m2(6 m×2 m), 并采用随机抽签的方式分布各个处理。上述4个处理区, CK处理区既不接种根瘤菌SL-1, 也不种植苜蓿。菌处理区, 制备的上述菌剂按照每小区300 g的量拌入土壤中。苜蓿处理区, 按每平方米1 000粒种子的播种量播种。以上各处理区定期除杂草以确保无其他植物生长。分别于处理60和90 d以五点采样法进行采样。植株及根际土的采集:用采样铲挖出带根植物(深度约20 cm), 抖落根部松散的土壤, 然后将剩余的土随植株放入采样袋中带回实验室, 而采集空白及只接根瘤菌对照土壤时, 随机选取五点, 现场混合后带回实验室。
1.5 样品处理分析 1.5.1 植株生理指标的测定采集的苜蓿植株样品先用蒸馏水充分淋洗表面的泥土, 再用滤纸吸干植物表面的水分, 单独测量每株苜蓿的株高。测量结束后将植株放入烘箱中烘至恒质量, 测其整体干质量。
1.5.2 土壤中多环芳烃的检测土壤中多环芳烃的检测参照EPA 3550C标准[16]。将待分析土样经晾干研磨后过筛(60目), 称取适量样品于50 mL具塞玻璃离心管中, 加入30 mL二氯甲烷/正己烷(体积比1 : 1) 混合溶剂, 置于超声波清洗器中振荡提取1 h。提取结束后, 保留上清液, 再次加入30 mL二氯甲烷/正己烷混合溶剂, 超声振荡30 min, 收集上清液再重复提取1次。将收集到的上清液在旋转蒸发器中浓缩至1~2 mL, 然后加入8~10 mL正己烷, 继续浓缩至3 mL左右, 以达到溶剂替换的目的。
将上述浓缩液加入硅胶/氧化铝/无水硫酸钠层析柱(最下层12 cm为硅胶, 中层6 cm为中性氧化铝, 最顶部为1 cm无水硫酸钠)进行分级净化, 然后加入15 mL正己烷冲洗层析柱, 洗脱出烷烃组分弃去, 再加入70 mL二氯甲烷/正己烷混合液(体积比3 : 7) 洗脱出烷烃和芳烃(多环芳烃和有机氯), 然后将上述洗脱液在旋转蒸发仪上浓缩到1 mL以下, 利用色谱级正己烷定容至1 mL, 装入棕色样品瓶中送到国土资源部保定矿产资源监督检测中心进行检测分析(利用GC-MS分析16种PAHs)。
1.6 数据统计分析图表均由Excel 2007制作完成, 使用SPSS 18.0软件进行差异显著性分析。
2 结果与分析 2.1 接种根瘤菌SL-1对紫花苜蓿生长的影响测定了盆栽和田间试验中接菌和不接菌处理的紫花苜蓿的株高和干质量。由图 1可知:苜蓿受土壤中高浓度多环芳烃的胁迫, 生长受到严重抑制, 处理20和60 d时接入根瘤菌SL-1的苜蓿株高分别是未接菌苜蓿株高的2.0和2.6倍, 接菌的苜蓿干质量比未接菌的处理高1.8和2.3倍。以上结果说明在高浓度PAHs胁迫土壤中接种根瘤菌SL-1能显著促进苜蓿生长。

|
图 1 不同处理盆栽试验土壤中苜蓿的株高(A)和干质量(B)
Figure 1 Plant height(A)and dry weight(B)of alfalfa in soil contaminated with PAHs
1)“苜蓿”代表种植苜蓿而不接种根瘤菌的处理; “苜蓿+菌”代表种植苜蓿并接种根瘤菌的处理。“Alfalfa”:Planting alfalfa without inoculation of Rhizobium; “Alfalfa+strain”:Planting of alfalfa and inoculation of Rhizobium. 2) 不同小写字母表示处理间差异显著(P < 0.05)。Different lowercase letters indicate significant difference at 0.05 level. The same as follows. |
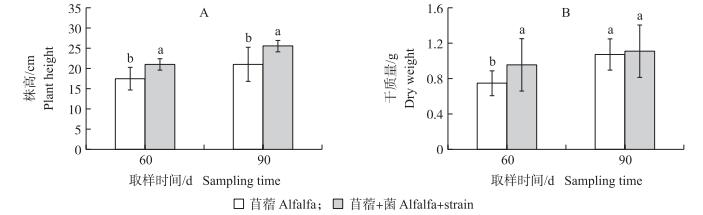
田间试验条件下, 种植60 d后, 接种根瘤菌的苜蓿株高和干质量分别比不接种苜蓿高20%和23%(图 2-A), 说明接种根瘤菌对高浓度PAHs胁迫下的苜蓿生长有明显的促进作用。种植90 d后, 2个处理中植株的各生理指标差异不明显, 可能的原因是田间试验的土壤PAHs浓度没有盆钵试验的高, 而且经过90 d降解修复后土壤PAHs浓度进一步降低, 其浓度不足以对苜蓿生长产生抑制作用。
|
图 2 不同处理田间试验土壤中苜蓿的株高(A)和干质量(B) Figure 2 Plant height(A)and dry weight(B)of alfalfa in soil contaminated with PAHs |
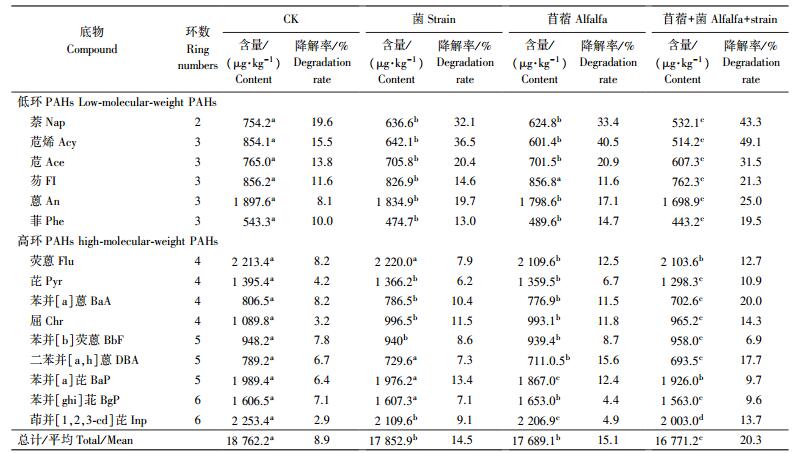
盆栽种植20 d后, 取不同处理土壤进行检测, PAHs的含量变化如表 3所示。由表 3可知:高环、低环PAHs均非常稳定, 难于自然降解, CK与原始PAHs含量相比下降很少(均值仅0.6%)。单接菌、单种苜蓿和种植苜蓿并接菌处理土壤的PAHs平均降解率分别为5.9%、4.2%和11.5%。各处理土壤PAHs的去除率从大到小依次为苜蓿+菌处理、菌处理、苜蓿处理、CK, 菌剂与植物联合修复处理的PAHs总含量明显低于只接入菌剂和只种植苜蓿的处理, 可见在土壤中高浓度PAHs胁迫下微生物与植物联合修复效果最好。盆栽种植苜蓿+菌处理联合修复60 d后, 不接种不种苜蓿的对照(CK), 单接菌不种苜蓿(菌)、单种苜蓿不接菌(苜蓿)以及种植苜蓿并接菌4个处理的PAHs总降解率分别为8.9%、14.5%、15.1%和20.3%(表 4)。各处理土壤PAHs的去除率从大到小依次为苜蓿+菌处理、苜蓿处理、菌处理、CK, 微生物与植物联合降解PAHs效果最好。

|
|
从PAHs不同环组分的降解规律来看, 盆栽种植60 d后, 苜蓿+菌处理对2环PAHs降解率为43.3%;3环PAHs降解率为19.5%~49.1%, 均值为29.3%;4环PAHs降解率为10.9%~20.0%, 均值为14.5%;5环PAHs降解率为6.9%~17.7%, 均值为6.3%;6环PAHs降解率为9.6%~13.7%, 均值为11.0%。其中降解率最高和最低的组分分别为苊烯(49.1%)和苯并[a]芘(2.2%)。可见在高浓度PAHs时低环多环芳烃的降解效果较好, 对于4环以上的PAHs降解效率不高, 且不同处理差异不明显。
2.2.2 田间试验修复效果从表 5可知:田间试验60 d后, 相对于CK, 各处理土壤中PAHs的含量都有不同程度的下降。单接菌不种苜蓿(菌)、单种苜蓿不接菌(苜蓿)以及种植苜蓿并接菌3个处理的PAHs总的降解率分别为7.6%、3.7%和16.8%。降解效果从大到小的处理依次为苜蓿+菌处理、菌处理、苜蓿处理、CK。可见种植苜蓿并接菌联合处理PAHs的去除效果最好。

|
从PAHs不同环组分的降解规律来看, 苜蓿+菌处理联合修复60 d, 4个处理土壤中不同环数PAHs的降解率存在差异:2环PAHs降解率为28.7%;3环PAHs降解率为8.3%~39.1%, 均值为24.7%;4环PAHs降解率为8.3%~19.5%, 均值为15.1%;5环PAHs降解率为6.5%~17.1%, 均值为10.7%;6环PAHs降解率为5.3%~7.6%, 均值为6.5%。可见随着苯环数的增加, PAHs的平均降解率逐渐降低, 低环PAHs的降解效果要高于高环PAHs。
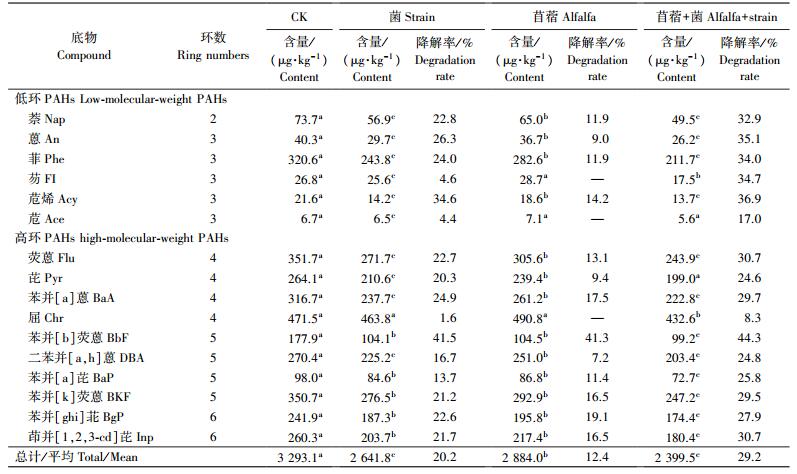
种植90 d后, 各处理土壤中PAHs含量及去除率如表 6所示。相对于CK, 单接种菌、单接种苜蓿和同时接种苜蓿与菌处理对PAHs的平均降解率分别为20.2%、12.4%和29.2%。可见土壤PAHs去除率从大到小的处理依次为苜蓿+菌处理、菌处理、苜蓿处理、CK, 苜蓿+菌联合降解效果最佳。比较各时期的空白对照组及本底PAHs含量, 发现随着修复时间的延长, 土壤中PAHs含量反而逐渐增加, 苊烯增加率最大, 为57.3%。各组分PAHs含量平均增加率为18.5%。PAHs含量增加可能是由于雨水或大气沉降致使附近工厂排放到大气中的PAHs降落回归于农田土壤中。从表 5和表 6可以看出:与CK相比, 各处理土壤中PAHs的去除率较60 d后均明显上升, 尤其是种植苜蓿并接菌处理中PAHs的降解效果最为明显。
|
各处理土壤中不同环数PAHs的降解率:2环PAHs降解率为32.9%;3环PAHs降解率为17.0%~36.9%, 均值为31.6%;4环PAHs降解率为8.3%~30.7%, 均值为27.4%;5环PAHs降解率为24.8%~44.3%, 均值为26.6%;6环PAHs降解率为27.9%~30.7%, 均值为30.1%。不同于60 d后的修复效果, 该阶段高环PAHs的降解率相比于低环PAHs有了较大提升, 甚至部分高环PAHs的降解率要高于低环PAHs, 如苯并[k]荧蒽(44.3%)。
3 讨论土壤是诸多污染物最主要的环境归宿, 近年来, 越来越多的农田土壤环境受到PAHs的严重污染[3]。2012年的调查[17]显示我国表层土壤PAHs的总含量中位值为580 μg·kg-1。长江三角洲地区和珠江三角洲主要类型土壤中16种PAHs总量分别高达3 881和3 077 μg·kg-1。本研究所选试验土壤中PAHs总含量为20 429.01 μg·kg-1, 远高于上述农田土壤, 其中具有强致癌性的4~6环PAHs组分占到68%以上, 属于PAHs严重污染的土壤。因此控制土壤中特别是耕作层土壤中的PAHs是消减其进入食物链的重要途径, 也是控制整个自然环境中PAHs的重要环节。
关于微生物降解PAHs的降解机制和降解途径的研究较多, 主要以外侧苯环加羟基开始并最终开环降解, 但微生物降解PAHs的实际应用仍需进一步深入研究[18]。植物-微生物联合修复污染土壤被认为是最具潜力的生物修复技术之一, 因其高效、安全、环境友好、低成本等优点而获得广泛认可[19-20]。苜蓿为世界上种植最为广泛的豆科植物之一。苜蓿作为绿肥能够增加土壤的有机质和总氮含量, 改善和提高土壤肥力, 对水稻具有增产作用[21]。苜蓿还对有机污染物具有很大的修复潜力, 可应用于包括PAHs在内的多种有机物污染土壤的修复[22-23]。根瘤菌是最常见的土著微生物之一, 在土壤中生存能力强, 同时又可以与豆科植物如苜蓿共生固氮, 促进豆科植物生长。根瘤菌还可降解多氯联苯、PAHs或芳香杂环化合物等[24-25]。本实验室筛选到的菌株R.petrolearium SL-1能够有效地与紫花苜蓿共生结瘤, 明显促进紫花苜蓿生长; 同时R.petrolearium SL-1还能高效降解不同组分的PAHs。因此, 本研究选用菌株SL-1与豆科植物紫花苜蓿联合修复实地污染土壤中的PAHs。
在较低浓度人为添加的PAHs污染土壤的植物修复试验过程中, 同时添加污染物的高效降解菌或植物促生菌等, 能提高植物对污染物的修复效率[11, 26]。姚伦芳等[14]利用木霉-紫花苜蓿联合修复中等浓度PAHs(9 634 μg·kg-1)污染土壤, 发现土壤中接种木霉菌不仅能促进紫花苜蓿的生长, 还能与紫花苜蓿共同作用去除土壤中PAHs污染。本研究测定了实地PAHs污染土壤条件下盆栽试验中微生物-植物联合降解效果及规律。在盆栽试验修复过程中, 种植苜蓿的2个处理中植株的各生理指标分析结果表明:苜蓿+菌处理的株高和干质量均要高于仅仅种植苜蓿的处理, 说明在较高浓度的PAHs胁迫下菌株SL-1对苜蓿也具有较为明显的促生作用。降解60 d后, 苜蓿+菌处理对PAHs去除率达到17.9%, 而PAHs不同组分间的降解效果从大到小依次为3环、2环、4环、6环、5环。因此, 在实地污染的PAHs胁迫下, 菌株联合苜蓿仍能够有效地联合降解各组分污染物。
近年来, 关于微生物-植物联合降解修复PAHs土壤的试验多数局限于盆栽试验[13, 23, 27], 鉴于此, 本研究进行了田间修复试验。经过60和90 d修复后, 苜蓿+菌处理中PAHs的去除率均明显大于只种植苜蓿或只接菌的处理, 土壤中低环PAHs的降解率明显高于高环PAHs, 从大到小依次为2环、3环、4环、5环、6环。可见大田试验修复过程中, 植物与微生物优先联合降解低环PAHs, 而高环PAHs降解缓慢。刘魏魏等[28]研究结果也表明, 植物-微生物联合修复PAHs污染土壤时发现随着PAHs苯环数的增加, 其平均降解率逐渐降低。本研究发现随着修复时间的延长, 90 d后土壤中低环PAHs和高环PAHs的降解率无明显差异, 从低环到高环PAHs(2~6环)的降解率分别为32.9%、31.6%、27.4%、26.6%和30.1%。这可能是由于随着土壤中PAHs含量的降低, 植物须根创造出有利于高环PAHs降解细菌的生态位, 进而加速了高环PAHs的降解; 也可能是因为土壤中存在部分老化的PAHs, 或部分PAHs分布在微生物很难接触的土壤微孔中, 致使其很难被生物利用, 进而阻碍了生物对各环PAHs的进一步降解。此外, 由于试验时间(90 d)限制, PAHs各组分的降解量仍较小(均小于40%)。本研究后续试验将尝试延长修复时间以及添加生物炭或其他外源营养物等方法提高PAHs各组分的降解率。
| [1] | Kim K H, Jahan S A, Kabir E, et al. A review of airborne polycyclic aromatic hydrocarbons(PAHs)and their human health effects[J]. Environment International, 2013, 60: 71–80. DOI: 10.1016/j.envint.2013.07.019 |
| [2] | Wise S A, Sander L C, Schantz M M. Analytical methods for determination of polycyclic aromatic hydrocarbons(PAHs):a historical perspective on the 16 US EPA priority pollutant PAHs[J]. Polycyclic Aromatic Compounds, 2015, 35(2/3/4): 187–247. |
| [3] |
邓绍坡, 吴运金, 龙涛, 等. 我国表层土壤多环芳烃(PAHs)污染状况及来源浅析[J].
生态与农村环境学报, 2015, 31(6): 866–875.
Deng S B, Wu Y J, Long T, et al. PAHs contamination in the surface soil of china and its sources[J]. Journal of Ecology and Rural Environment, 2015, 31(6): 866–875. DOI: 10.11934/j.issn.1673-4831.2015.06.011(in Chinese with English abstract) |
| [4] |
姜永海, 韦尚正, 席北斗, 等. PAHs在我国土壤中的污染现状及其研究进展[J].
生态环境学报, 2009, 18(3): 1176–1181.
Jiang Y H, Wei S Z, Xi B D, et al. Polycyclic aromatic hydrocarbons(PAHs)pollution in soils in China:recent advances and future prospects[J]. Ecology and Environmental Sciences, 2009, 18(3): 1176–1181. (in Chinese with English abstract) |
| [5] |
丁克强, 骆永明. 多环芳烃污染土壤的生物修复[J].
土壤, 2001, 33(4): 169–178.
Ding K Q, Luo Y M. Bioremediation of polycyclic aromatic hydrocarbons in soil[J]. Soils, 2001, 33(4): 169–178. (in Chinese with English abstract) |
| [6] | Samanta S K, Singh O V, Jain R K. Polycyclic aromatic hydrocarbons:environmental pollution and bioremediation[J]. Trends in Biotechnology, 2002, 20(6): 243–248. DOI: 10.1016/S0167-7799(02)01943-1 |
| [7] | Bamforth S M, Singleton I. Bioremediation of polycyclic aromatic hydrocarbons:current knowledge and future directions[J]. Journal of Chemical Technology and Biotechnology, 2005, 80(7): 723–736. DOI: 10.1002/(ISSN)1097-4660 |
| [8] | Wu Y, Teng Y, Li Z, et al. Potential role of polycyclic aromatic hydrocarbons(PAHs)oxidation by fungal laccase in the remediation of an aged contaminated soil[J]. Soil Biology and Biochemistry, 2008, 40(3): 789–796. DOI: 10.1016/j.soilbio.2007.10.013 |
| [9] | Haritash A, Kaushik C. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):a review[J]. Journal of Hazardous Materials, 2009, 169(1): 1–15. |
| [10] | Kuiper I, Lagendijk E L, Bloemberg G V, et al. Rhizoremediation:a beneficial plant-microbe interaction[J]. Molecular Plant-Microbe Interactions, 2004, 17(1): 6–15. DOI: 10.1094/MPMI.2004.17.1.6 |
| [11] |
林爱军, 李晓亮, 王凤花, 等. 土壤多环芳烃污染的植物根际降解研究[J].
中国农学通报, 2011, 27(32): 266–269.
Lin A J, Li X L, Wang F H, et al. Biodegradation of polycyclic promatic pydrocarbons(PAHs)in the rhizosphere soil[J]. Chinese Agricultural Science Bulletin, 2011, 27(32): 266–269. (in Chinese with English abstract) |
| [12] | Zafra G, Cortés-Espinosa D V. Biodegradation of polycyclic aromatic hydrocarbons by Trichoderma species:a mini review[J]. Environmental Science and Pollution Research, 2015, 22(24): 19426–19433. DOI: 10.1007/s11356-015-5602-4 |
| [13] |
沈源源, 滕应, 骆永明, 等. 几种豆科和禾本科植物对多环芳烃复合污染土壤的修复[J].
土壤, 2011, 43(2): 253–257.
Shen Y Y, Teng Y, Luo Y M, et al. Remediation efficiency of several legumes and grasses in PAH-contaminated soils[J]. Soils, 2011, 43(2): 253–257. (in Chinese with English abstract) |
| [14] |
姚伦芳, 滕应, 刘方, 等. 多环芳烃污染土壤的微生物-紫花苜蓿联合修复效应[J].
生态环境学报, 2014, 23(5): 890–896.
Yao L F, Teng Y, Liu F, et al. Influence of Trichoderma reesei and Rhizobium meliloti on phytoremediation of PAH-contaminated soil by alfalfa[J]. Ecology and Environmental Sciences, 2014, 23(5): 890–896. (in Chinese with English abstract) |
| [15] | Zhang X, Li B, Wang H, et al. Rhizobium petrolearium sp.nov., isolated from oil-contaminated soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(8): 1871–1876. |
| [16] | Acevedo F, Pizzul L, del Pilar Castillo M, et al. Degradation of polycyclic aromatic hydrocarbons by the Chilean white-rot fungus Anthracophyllum discolor[J]. Journal of Hazardous Materials, 2011, 185: 212–219. DOI: 10.1016/j.jhazmat.2010.09.020 |
| [17] |
曹云者, 柳晓娟, 谢云峰, 等. 我国主要地区表层土壤中多环芳烃组成及含量特征分析[J].
环境科学学报, 2012, 32(1): 197–203.
Cao Y Z, Liu X J, Xie Y F, et al. Patterns of PAHs concentrations and components in surface soils of main areas in China[J]. Acta Scientiae Circumstantiae, 2012, 32(1): 197–203. (in Chinese with English abstract) |
| [18] | Peng R H, Xiong A S, Xue Y, et al. Microbial biodegradation of polyaromatic hydrocarbons[J]. FEMS Microbiology Reviews, 2008, 32(6): 927–955. DOI: 10.1111/j.1574-6976.2008.00127.x |
| [19] | Weyens N, van der Lelie D, Taghavi S, et al. Phytoremediation:plant-endophyte partnerships take the challenge[J]. Current Opinion in Biotechnology, 2009, 20(2): 248–254. DOI: 10.1016/j.copbio.2009.02.012 |
| [20] |
周妍, 滕应, 姚伦芳, 等. 植物-微生物联合对土壤不同粒径组分中PAHs的修复作用[J].
土壤, 2015, 47(4): 711–718.
Zhou Y, Teng Y, Yao L F, et al. Combined effect of plant and microorganism on degradation of PAHs in different particle size fractions[J]. Soils, 2015, 47(4): 711–718. (in Chinese with English abstract) |
| [21] |
赵鲁, 史冬燕, 高小叶, 等. 紫花苜蓿绿肥对水稻产量和土壤肥力的影响[J].
草业科学, 2012, 29(7): 1142–1147.
Zhao L, Shi D Y, Gao X Y, et al. Effectd of alfalfa green manure on rice yield and soil fertility[J]. Pratacultural Science,, 2012, 29(7): 1142–1147. (in Chinese with English abstract) |
| [22] | Parrish Z D, White J C, Isleyen M, et al. Accumulation of weathered polycyclic aromatic hydrocarbons(PAHs)by plant and earthworm species[J]. Chemosphere, 2006, 64(4): 609–618. DOI: 10.1016/j.chemosphere.2005.11.003 |
| [23] |
范淑秀, 李培军, 何娜, 等. 多环芳烃污染土壤的植物修复研究进展[J].
农业环境科学学报, 2007, 26(6): 2007–2013.
Fan S X, Li P J, He N, et al. Research of phytoremediation on contaminated soil with polycyclic aromatic hydrocarbons(PAHs)[J]. Journal of Agro-Environment Science, 2007, 26(6): 2007–2013. (in Chinese with English abstract) |
| [24] | Tejeda-Agredano M, Gallego S, Vila J, et al. Influence of the sunflower rhizosphere on the biodegradation of PAHs in soil[J]. Soil Biology and Biochemistry, 2013, 57: 830–840. DOI: 10.1016/j.soilbio.2012.08.008 |
| [25] | Wang X, Teng Y, Luo Y, et al. Biodegradation of 3, 3', 4, 4'-tetrachlorobiphenyl by Sinorhizobium meliloti NM[J]. Bioresource Technology, 2016, 201: 261–268. DOI: 10.1016/j.biortech.2015.11.056 |
| [26] |
滕应, 李秀芬, 潘澄, 等. 土壤及场地持久性有机污染的生物修复技术发展及应用[J].
环境监测管理与技术, 2011, 23(3): 23.
Teng Y, Li X F, Pan C, et al. Technology development and applications of bioremediation for persistent organic pollutants contaminated soil and sites[J]. The Administration and Technique of Environmental Monitoring, 2011, 23(3): 23. (in Chinese with English abstract) |
| [27] | Teng Y, Li X, Chen T, et al. Isolation of the PCB-degrading bacteria Mesorhizobium sp.ZY1 and its combined remediation with Astragalus sinicus L. for contaminated soil[J]. International Journal of Phytoremediation, 2016, 18(2): 141–149. DOI: 10.1080/15226514.2015.1073667 |
| [28] |
刘魏魏, 尹睿, 林先贵, 等. 生物表面活性剂-微生物强化紫花苜蓿修复多环芳烃污染土壤[J].
环境科学, 2010, 31(4): 1079–1084.
Liu W W, Yin R, Lin X G, et al. Interaction of biosurfactant-microorganism to enhance phytoremediation of aged polycyclic aromatic hydrocarbons(PAHs)contaminated soils with alfalfa(Medicago sativa L.)[J]. Environmental Science, 2010, 31(4): 1079–1084. (in Chinese with English abstract) |