文章信息
- 程瑞, 张虎平, 程寅胜, 王英珍, 刘兴, 王国明, 张绍铃
- CHENG Rui, ZHANG Huping, CHENG Yinsheng, WANG Yingzhen, LIU Xing, WANG Guoming, ZHANG Shaoling
- 蔷薇科果树TMT基因家族生物信息学分析
- Bioinformatics analysis of tonoplast monosaccharide transporter(TMT)gene family in fruit trees of Rosaceae
- 南京农业大学学报, 2017, 40(4): 601-610
- Journal of Nanjing Agricultural University, 2017, 40(4): 601-610.
- http://dx.doi.org/10.7685/jnau.201612028
-
文章历史
- 收稿日期: 2016-12-16
糖是构成果实风味物质的主要成分, 其含量高低直接影响着果实的品质。糖在果实细胞中主要积累于液泡内, 其积累能力受液泡膜上的糖转运蛋白高度调控[1-2]。液泡膜单糖转运蛋白(TMT)是定位于液泡膜的糖转运蛋白, 负责糖在胞质和液泡之间的转运[2]。对拟南芥AtTMT1、AtTMT2的敲除能明显降低葡萄糖和果糖在液泡中的积累[3-4]; 葡萄VvTMT1在果实中有较高的表达, 并在果实发育过程中与葡萄糖和果糖含量明显相关[5]; 苹果MdTMT1、MdTMT2对果糖和蔗糖有较高的底物亲和性, 主要负责果实成熟期糖在液泡中的积累[6]。
蔷薇科果树种类繁多, 分布地区广, 在经济果树中占有极重要的地位。近年来随着测序技术的发展, 蔷薇科果树中苹果(Malus domestica)[7]、草莓(Fragaria×vesca)[8]、梅(Prunus mume)[9]、桃(Prunus persica)[10]、白梨(Pyrus bretschneideri)[11]、西洋梨(Pyrus communis)[12]和黑树莓(Rubus occidentalis)[13]等相继完成全基因组测序, 这为在全基因组水平上研究其重要功能基因提供了基础数据。本研究基于已公布的蔷薇科果树全基因组数据, 筛选出苹果、草莓、梅、桃、白梨、西洋梨和黑树莓等物种的TMT基因, 通过生物信息学分析以及定量分析研究白梨PbTMTs在各器官组织和果实不同发育阶段表达情况, 了解它们的基本特性和进化关系, 为探索蔷薇科果树TMT基因的功能及液泡糖的积累机制提供理论基础。
1 材料与方法 1.1 材料供试梨品种为‘鸭梨’, 采自南京农业大学江浦试验站梨种质资源圃。试验于2015至2016年进行, 采集梨的根、茎、幼叶、成熟叶、花、果实和种子作为待测样品。为检测果实发育过程中基因的表达, 于盛花期后10 d开始, 每隔20 d取果实样品1次, 直至果实成熟(盛花期后170 d), 共9次。样品采后立即用液氮速冻, 并保存于-80 ℃冰箱备用。
1.2 蔷薇科果树TMT基因的筛选与鉴定苹果、桃、草莓基因序列信息从Phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html)中获得, 西洋梨和黑树莓基因序列信息从蔷薇科基因组数据库(GDR)(http://www.rosaceae.org/)中获得, 梅基因序列信息从梅基因组数据库(http://prunusmumegenome.bjfu.edu.cn/index.jsp)中获得, 白梨基因序列信息从梨基因组数据库(http://peargenome.njau.edu.cn/)中获得。从拟南芥基因组数据库(http://www.arabidopsis.org/index.jsp)中获得拟南芥TMT基因序列, 分别以AtTMT1 (At1g20840)、AtTMT2 (At4g35300)、AtTMT3 (At3g51490) 基因编码的蛋白序列为模板在拟南芥及蔷薇科7个果树物种基因组数据库中进行BLASTp, 获得同源序列, 并将获得的拟南芥同源序列分别与各物种同源序列用MEGA 6.0软件[14]构建系统进化树, 与拟南芥TMT家族基因聚为一类的为候选基因。通过Pfam数据库(http://pfam.xfam.org/)分析所有候选基因保守结构域, 移除与TMT家族基因保守结构域不一致的序列, 并在NCBI保守结构数据库CCD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)中进一步验证保守结构域, 确定目的基因。
1.3 蔷薇科果树TMT基因生物信息学分析染色体信息从各基因组数据库中获得, 染色体定位图利用MapDraw软件完成。基因内含子/外显子利用GSDS2.0(http://gsds.cbi.pku.edu.cn/)分析[15]。跨膜结构利用在线工具TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析, 跨膜模型利用TMRPRES2d软件构建。蛋白的基本理化性质由在线工具ExPASy(http://web.expasy.org/protparam/)预测。亚细胞定位利用MBC(http://cello.life.nctu.edu.tw/)预测[16]。蛋白序列Motif利用MEME数据库(http://meme-suite.org/)分析[17]。启动子元件利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析[18]。同源基因从PGDD(http://chibba.agtec.uga.edu/duplication/)数据库获得[19], Ka/Ks利用KaKs_Calculator计算[20]。系统进化树利用MEGA 6.0软件采用NJ方法构建, Bootstrap值设置为1 000[14]。
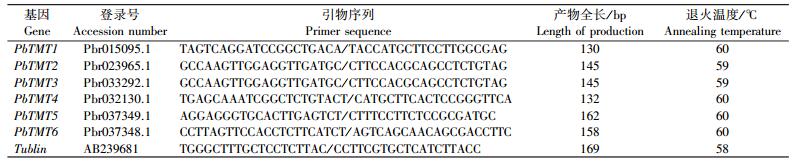
1.4 白梨PbTMTs基因定量表达分析采用多糖多酚植物RNA提取试剂盒(成都福际生物技术有限公司)提取RNA, 采用反转录试剂盒TransScript® One-Step RT-PCR SuperMix(北京全式金生物技术有限公司)进行反转录, 合成的cDNA用于实时荧光定量PCR(RT-qPCR)分析PbTMTs基因的表达情况。定量PCR仪为罗氏lightCycler 480Ⅱ, 反应试剂为SYBR Premix Ex TaqTM(TaKaRa)。以Tublin(登录号:AB239681) 为内参基因[21], 不同样品得到的数据经内参基因均一化处理后, 通过2-ΔΔCT法计算出待测基因相对表达量[22]。实时荧光定量PCR分析引物见表 1。
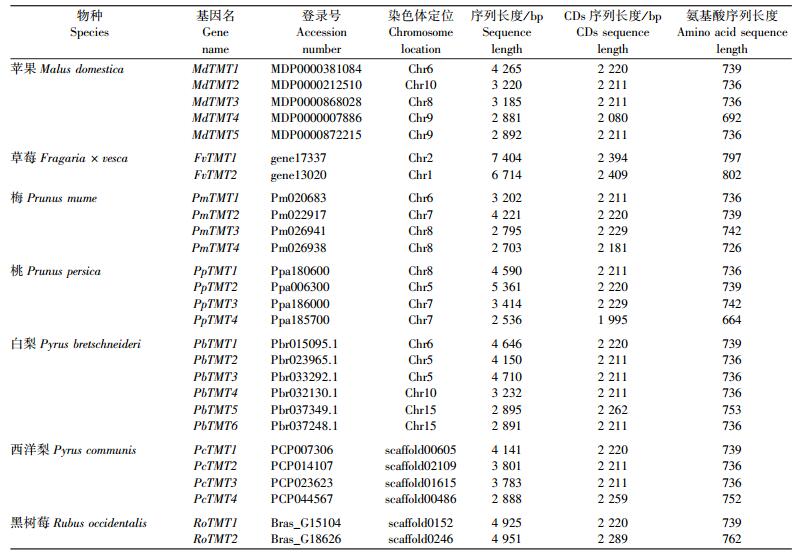
以AtTMT1、AtTMT2和AtTMT3基因编码的蛋白序列为模板分别在拟南芥基因组数据库和各蔷薇科果树基因组数据库中进行BLASTp, 获得同源基因序列:拟南芥32个、苹果83个、草莓72个、梅57个、桃56个、白梨95个、西洋梨83个、黑树莓38个。聚类分析中与拟南芥TMT基因聚为一类的候选基因:苹果9个、草莓3个、梅5个、桃4个、白梨7个、西洋梨6个、黑树莓3个。通过Pfam数据库和CDD数据库对所有候选基因保守结构分析发现, 苹果中MDP0000281884、MDP0000166125、MDP0000134813, 梅中Pm026939, 白梨中Pbr011741.1和西洋梨中PCP017782缺少TMT基因家族保守结构域, 草莓中gene31477、西洋梨中PCP008760、黑树莓中Bras_G01311保守结构域多出一个Str结构, 苹果中MDP0000286805存在TIR和NB-AR结构, 将这些与TMT基因家族保守结构不相符的基因移除。最后获得7个蔷薇科果树物种TMT基因27个:苹果5个、草莓2个、梅4个、桃4个、白梨6个、西洋梨4个、黑树莓2个; 并对鉴定出的TMT基因进行命名(表 2)。
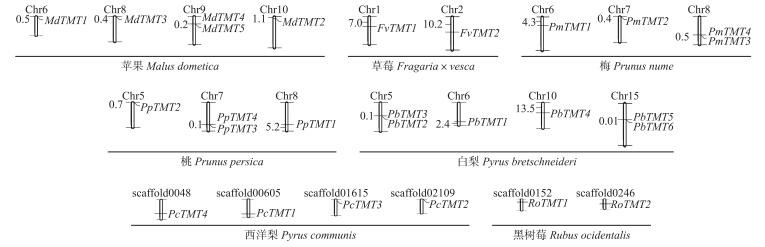
根据各物种基因组信息, 得到筛选出的27个TMT基因在染色体上的分布情况。由图 1可见:苹果Chr6、Chr8、Chr10上各分布1个TMT基因, Chr9上分布2个TMT基因; 草莓Chr1、Chr2上各分布1个TMT基因; 梅Chr6、Chr7上各分布1个TMT基因, Chr8上分布2个TMT基因; 桃Chr5、Chr8上各分布1个TMT基因, Chr7上分布2个TMT基因; 白梨Chr6、Chr10上各分布1个TMT基因, Chr5和Chr9上各分布2个TMT基因; 西洋梨TMT基因分别分布在scaffold00486、scaffold00605、scaffold01615、scaffold02109上; 黑树莓TMT基因分别分布在scaffold0152、scaffold0246上。各物种TMT基因分别随机分布在2~4条染色体上。其中, 苹果、梅、桃、白梨中存在2个TMT基因分布在同一条染色体上情况。
|
图 1 蔷薇科果树TMT基因染色体定位分布图 Figure 1 Chromosomal location of TMT genes in fruit tree of Rosaceae |
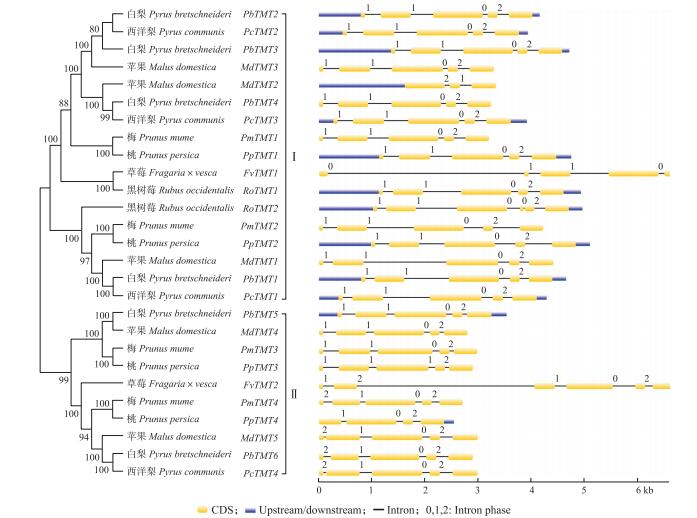
TMT基因一级结构高度相似, CDs序列长2 200 pb左右。其中, 桃PpTMT4 (2 536 bp)基因序列最短, 草莓FvTMT1 (7 404 bp)序列最长。所有TMT家族基因均含有内含子, 且物种之间含有的内含子数差异较小, 除草莓FvTMT2和黑树莓RoTMT2包含5个内含子外, 蔷薇科果树TMT基因均包含4个内含子(图 2)。这种内含子/外显子结构保守现象, 很可能是在进化过程中基因功能保守的体现。
|
图 2 蔷薇科果树TMT基因系统进化树及基因结构图 Figure 2 Phylogenetic relationship of TMT genes and the exon/intron structure of TMT genes in fruit tree of Rosaceae 左侧:TMT基因无根进化树, 由MEGA 6.0软件采用NJ方法构建; 右侧:TMT基因外显子/内含子结构示意图 Left panel:an unrooted phylogenetic tree constructed using MEGA 6.0 by the NJ method. Right panel:exon/intron structure of TMT gene |
TMT基因序列具有高度保守性, 通过DNAMAN 7.0软件比对分析, 所有被筛选出的TMT基因序列一致性达67%。在系统进化树中, TMT基因主要聚为两组:组Ⅰ和组Ⅱ。组Ⅰ中包含PbTMT2、PcTMT2、PbTMT3、MdTMT3、MdTMT2、PbTMT4、PcTMT3、PmTMT1、PpTMT1、FvTMT1、RoTMT1、RoTMT2、PmTMT2、PpTMT2、MdTMT1、PbTMT1、PcTMT1; 组Ⅱ中包含PbTMT5、MdTMT4、PmTMT3、PpTMT3、FvTMT2、PmTMT4、PpTMT4、MdTMT5、PbTMT6、PcTMT4。
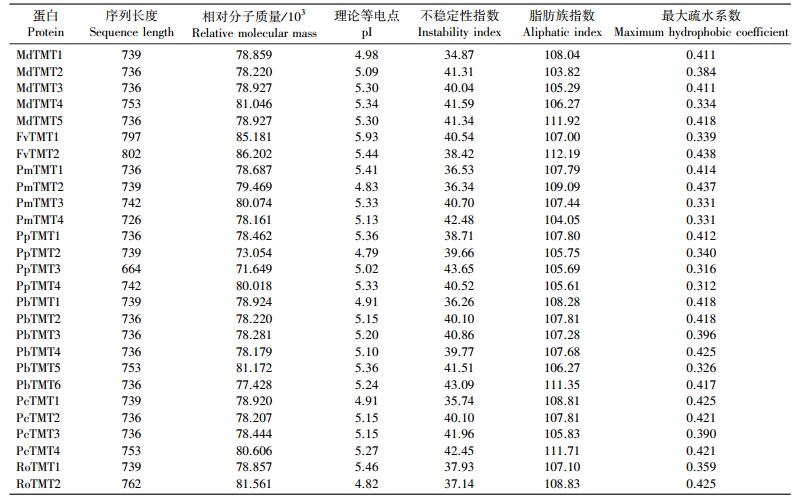
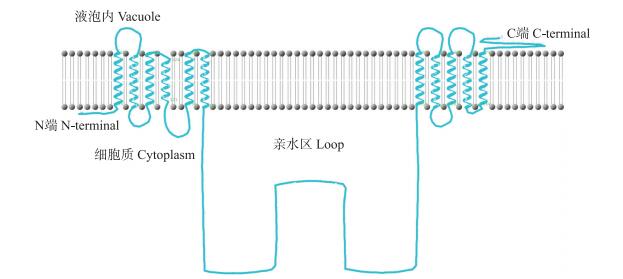
2.4 蔷薇科果树TMT基因家族蛋白序列特性由表 3可见:TMT基因的氨基酸序列长度为700 bp左右; 各物种TMT基因家族蛋白平均相对分子质量为(75.796~85.692)×103; 理论等电点(pI)为4.79~5.93, 显酸性; 不稳定性指数为34.87~43.65;脂肪族指数为101.71~112.19;最大疏水系数为0.312~0.438, 为疏水性蛋白; 亚细胞定位预测均定位在液泡膜上。对TMT基因家族蛋白序列进行跨膜结构分析发现, TMT基因存在11个α螺旋构成的高疏水性跨膜结构域, 中间面向细胞质部分有1个大细胞质环, 该环将蛋白分为各含6个、5个跨膜结构域的2个半区(图 3)。
|
图 3 蔷薇科果树TMT序列结构模型 Figure 3 Model of sequence structure of TMT in fruit tree of Rosaceae |
对TMT基因家族蛋白序列进行motif分析发现, 蔷薇科果树TMT基因motif与拟南芥的高度一致, 其中motif 1、2、3、4、6、7是TMT基因家族中比较重要且保守的结构(图 4), 蔷薇科果树TMT基因中均包含这6个motif, 进一步说明TMT基因在进化过程中的相对保守性。

|
图 4 TMT基因编码的蛋白motif分析 Figure 4 The motif analysis of TMT proteins A:拟南芥TMT基因; B:蔷薇科果树TMT基因; C:TMT基因关键motif A:TMT genes of Arabidopsis thaliana; B:TMT genes in fruit tree of Rosaceae; C:The key motif of TMT genes |
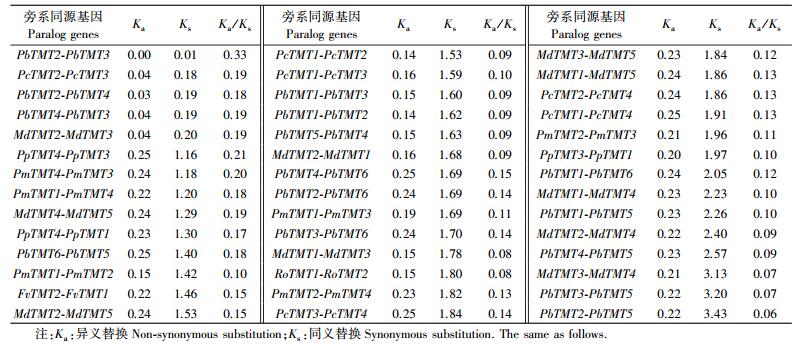
Ks和Ka/Ks的比值揭示了进化时期和驱动力。Ks被广泛用于推算全基因组的进化时期或复制事件的时期。蔷薇科果树物种TMT同源基因Ks值如表 4所示, 蔷薇科果树物种TMT家族同源基因的Ks值为0.01~3.43。进一步推测苹果中MdTMT2-MdTMT3、白梨中PbTMT2-PbTMT4、PbTMT2-PbTMT3、PbTMT4-PbTMT3, 西洋梨PcTMT2-PcTMT3等同源基因对可能由近代全基因组复制引起(Ks≈0.2)。而且蔷薇科果树物种中很多同源基因对具有同样的Ks值(Ks≈1.16~2.00), 表明这些同源基因对可能是由远古时期同样的三倍体加倍复制过程(γ)引起的。另外, PmTMT2-PmTMT4、PcTMT3-PcTMT4、MdTMT3-MdTMT5、MdTMT1-MdTMT5、PcTMT2-PcTMT4、PcTMT1-PcTMT4、PmTMT2-PmTMT3、PpTMT3-PpTMT1、PbTMT1-PbTMT6、MdTMT1-MdTMT4、PbTMT1-PbTMT5、MdTMT2-MdTMT4、PbTMT4-PbTMT5、MdTMT3-MdTMT4、PbTMT3-PbTMT5、PbTMT2-PbTMT5具有很高的Ks值(Ks≈1.81~3.44), 说明它们可能起源于一个更古老的重复事件; 而这些同源基因对中均存在1个基因(PmTMT4、PcTMT4、MdTMT5、PmTMT3、PpTMT3、PbTMT6、MdTMT4、PbTMT5)分布在系统进化树组Ⅱ中(图 2)。
|
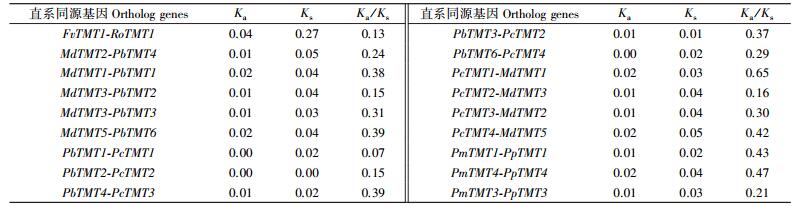
从植物基因与基因组复制数据库(PGDD)获得蔷薇科果树TMT基因家族直系同源基因18对, 对其进行Ka/Ks分析发现, 其Ka/Ks比值都小于1, 说明蔷薇科果树TMT基因在进化过程中主要受纯化选择作用(表 5)。
|
基因的启动子元件通过基因上游2 000 bp序列进行分析, TMT基因家族除存在大量基本启动子元件CAAT-box和TATA-box外, 还存在参与光响应顺时调控元件, 例如:ACE、ATCT-motif、Box 4、G-Box、GAG-motif、I-box、Sp1、TCCC-motif、chs-CMA1a、GT1-motif、MNF1等, 以及响应昼夜顺时调控元件circadian和参与胚乳发育调控元件Skn-1_motif。还含有多个与胁迫响应相关的顺式作用元件, 包括MeJA响应元件CGTCA-motif, 光响应MYB结合位点MBS, 热力响应元件HSE, 脱落酸响应元件ABRE, 乙烯反应元件ERE, 水杨酸响应元件TCA-element, 赤霉素应答顺时调控元件GARE-motif, 真菌诱导响应元件Box-W1, 抗病响应元件W-box及激发子和病原菌响应元件box S等。这些结果表明:TMT基因不仅受光调控, 参与胚乳的发育, 还可能通过这些顺式作用元件参与了植物对胁迫信号传导途径的应答, 在植物响应胁迫过程中发挥作用。
2.7 白梨PbTMTs基因表达分析由图 5-A可见:白梨6个PbTMT基因中, PbTMT4在成熟果中表达量最高, PbTMT5在种子中不表达。在白梨8个组织中, PbTMT1表达量在成熟叶中最高, PbTMT2和PbTMT3在成熟叶中表达量高于其他组织; PbTMT5在花中表达量最高; PbTMT6表达量在成熟叶中最高。根和成熟果中PbTMT4表达量最高; 茎和花中PbTMT5表达量最高; 幼叶、成熟叶、幼果和种子中PbTMT6表达量最高。
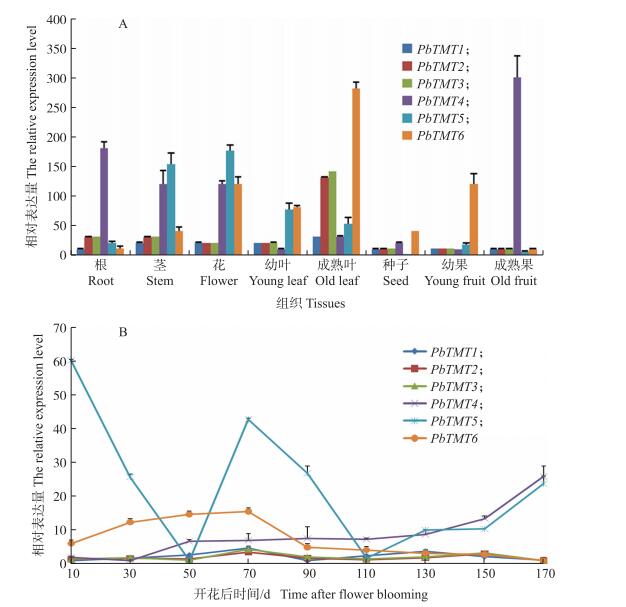
|
图 5 白梨不同组织(A)及果实发育过程(B)中PbTMT基因的相对表达量 Figure 5 The relative expression level of PbTMT among different tissues(A)and during fruit development(B)of Pyrus bretschneideri |
由图 5-B可见:在白梨果实发育过程, PbTMT1表达量在幼果期(花后70 d之前)不断上升, 到果实膨大期(花后70 d)达到最高后急剧下降, 而后随着果实发育又缓慢上升到果实成熟前期(花后130 d)达第2个表达高峰, 随后开始下降至果实成熟(花后170 d)。PbTMT2、PbTMT3与PbTMT1表达量相似, 在果实膨大期和果实成熟前期有2个峰值。PbTMT4表达量随着果实发育不断增大, 至果实膨大期急剧增加, 果实成熟期达最大值。PbTMT5在幼果期、果实膨大期、果实成熟期表达量较高, 但其他时期表达量都较低。PbTMT6的表达量在幼果期不断增高, 至果实膨大期达到最大值, 而后开始慢慢降低, 至果实成熟达到最小值。
3 讨论与结论 3.1 TMT基因家族基本特性TMT是典型的膜结合蛋白, 具有高度保守的序列, 属于高疏水性蛋白, 广泛存在于植物组织和细胞中, 是易化扩散载体超家族(major facilitator superfamily, MFS)下的糖转运家族成员[5]。本研究共鉴定出7个蔷薇科果树物种TMT基因27个, 其特性与已报道的拟南芥[2]、苹果[6]、葡萄[5]等TMT基因高度相似, 均定位于液泡膜上, 且都存在糖转运保守结构域和11个α螺旋构成的高疏水性跨膜结构域, 同属于MFS家族[23], 氨基酸长度为700左右, 具有TMT家族蛋白关键motif。TMT基因启动子元件中不仅包含光响应元件, 还包含了与胚乳发育、抗逆有关的响应元件, 所以TMT家族基因不仅与果实糖分积累有关, 可能还参与了胚胎发育, 以及通过这些顺式作用元件参与了植物对胁迫信号传导途径的应答, 在植物响应胁迫过程中发挥作用。这与Wormit等[2]对拟南芥TMT基因的研究结果一致。
3.2 蔷薇科果树TMT基因进化关系本研究中, 蔷薇科果树中白梨、苹果、西洋梨、梅、桃TMT基因家族成员较多(4~6个), 草莓和黑树莓TMT家族成员较少(2个), 只有苹果、梅、桃、白梨存在2个TMT基因分布在同一条染色的情况, 同一条染色体上的同源基因对可能是由近代基因串联复制造成的(Ks≈0.1)。基于Ks的研究, 梨和苹果进化过程中都出现过2次全基因组重复事件:三倍体加倍(γ)(Ks≈1.5~1.8) 和近代全基因组复制(Ks≈0.15~0.3)[7, 11]。有研究表明, 双子叶植物都经历了三倍体加倍过程(γ)[8-9, 24-25]。TMT基因家族可能起源于更远古的复制事件(Ks≈1.81~3.44), 经历过多次全基因组复制事件; 苹果、梨等TMT家族的成员数量多于草莓和黑树莓, 可能是其近代全基因组复制及基因串联复制事件共同作用的结果。对蔷薇科果树直系同源TMT基因对分析发现, 其Ka/Ks的比值均小于1, 所以在进化过程中TMT基因家族主要受纯化选择作用。这可能与人类长期对糖含量优质品种的驯化和培育有关。
3.3 TMT基因的表达与糖分积累的关系本研究表达分析表明, 白梨中PbTMTs在各组织中表达特异性明显。在果实发育过程中, PbTMT1、PbTMT2和PbTMT3表达模式相似, 表达量在果实膨大期(花后70 d)和果实成熟前期(花后130 d)出现2个高峰; 这2个时期是果实糖分积累的关键时期, 所以PbTMT1、PbTMT2和PbTMT3可能对白梨的糖分积累起重要功能作用。PbTMT4表达量随果实发育不断上升, 至果实膨大期急剧增加, 果实成熟期达最大值, 其表达模式跟梨中糖分积累模式高度吻合[26], 所以PbTMT4可能是白梨果实发育过程中参与糖分积累的关键基因之一。马新立等[6]研究表明, 苹果MdTMT1和MdTMT2在果实中高度表达, 且与果实糖的积累极显著正相关, MdTMT3的表达与苹果果实糖的积累呈负相关; Wormit等[2]研究表明, 拟南芥AtTMT1和AtTMT2表达丰度较高, 尤其在花粉中表达最高, 它们是液泡膜上负责糖转运的关键基因, 主要负责葡萄糖在液泡中的积累。这些有明显功能作用的基因都聚集在系统进化树组Ⅰ中, 由此我们推测系统进化树组Ⅰ中的TMT基因可能是进化过程中经纯化选择作用得到的液泡膜上负责糖转运的关键蛋白基因, 对果实糖分积累起重要功能作用。
| [1] | Yamaki S, Ino M. Alteration of cellular compartmentation and membrane permeability to sugars in immature and mature apple fruit[J]. Journal of the American Society for Horticultural Science, 1992, 117(6): 951–954. |
| [2] | Wormit A, Trentmann O, Feifer I, et al. Molecular identification and physiological characterization of a novel monosaccharide transporter from Arabidopsis involved in vacuolar sugar transport[J]. The Plant Cell, 2006, 18(12): 3476–3490. DOI: 10.1105/tpc.106.047290 |
| [3] | Wingenter K, Schulz A, Wormit A, et al. Increased activity of the vacuolar monosaccharide transporter TMT1 alters cellular sugar partitioning, sugar signaling, and seed yield in Arabidopsis[J]. Plant Physiology, 2010, 154(2): 665–677. DOI: 10.1104/pp.110.162040 |
| [4] | Schulz A, Beyhl D, Marten I, et al. Proton-driven sucrose symport and antiport are provided by the vacuolar transporters SUC4 and TMT1/2[J]. The Plant Journal, 2011, 68(10): 129–136. |
| [5] | Zeng L, Wang Z, Vainstein A, et al. Cloning, localization, and expression analysis of a new tonoplast monosaccharide transporter from Vitis vinifera L[J]. Journal of Plant Growth Regulation, 2011, 30: 199–212. DOI: 10.1007/s00344-010-9185-5 |
| [6] |
马新立, 秦源, 魏晓钰, 等. 苹果糖转运蛋白TMT基因的表达及其与糖积累的关系[J].
园艺学报, 2014, 41(7): 1317–1325.
Ma X L, Qin Y, Wei X Y, et al. Sequence and expression analysis of apple tonoplast monosaccharide transporter TMT genes and their relationship with sugar accumulation in fruit[J]. Acta Horticulturae Sinica, 2014, 41(7): 1317–1325. (in Chinese with English abstract) |
| [7] | Velasco R, Zharkikh A, Affourtit J, et al. The genome of the domesticated apple(Malus domestica Borkh)[J]. Nature Genetics, 2010, 42(6): 833–839. |
| [8] | Shulaev V, Sargent D J, Crowhurst R N, et al. The genome of woodland strawberry(Fragaria vesca)[J]. Nature Genetics, 2010, 43(2): 109–116. |
| [9] | Zhang Q X, Chen W B, Sun L D, et al. The genome of Prunus mume[J]. Nat Commun, 2012, 3: 1318. DOI: 10.1038/ncomms2290 |
| [10] | Verde I, Abbott A G, Scalabrin S, et al. The high-quality draft genome of peach(Prunus persica)identifies unique patterns of genetic diversity, domestication and genome evolution[J]. Nature Genetics, 2013, 45(5): 487–493. DOI: 10.1038/ng.2586 |
| [11] | Wu J, Wang Z, Shi Z, et al. The genome of the pear(Pyrus bretschneideri Rehd)[J]. Genome Res, 2013, 23(6): 396–408. |
| [12] | Chagne D, Crowhurst R N, Pindo M, et al. The draft genome sequence of european pear(Pyrus communis L.'Bartlett')[J]. PLoS ONE, 2014, 9: e92644. DOI: 10.1371/journal.pone.0092644 |
| [13] | van Buren R, Bryant D, Bushakra J M, et al. The genome of black raspberry(Rubus occidentalis)[J]. The Plant Journal, 2016, 87(6): 535–547. DOI: 10.1111/tpj.2016.87.issue-6 |
| [14] | Tamura K, Stecher G, Peterson D, et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(6): 2725–2729. |
| [15] | Hu B, Jin J P, Guo A Y, et al. GSDS 2.0:an upgraded gene feature visualization server[J]. Bioinformatics, 2015, 31(2): 1296–1297. |
| [16] | Yu C S, Lin C J, Hwang J K. Predicting subcellular localization of proteins for Gram-negative bacteria by support vector machines based on n-peptide compositions[J]. Protein Sci, 2004, 13(6): 1402–1406. |
| [17] | Bailey T L, Williams N, Misleh C, et al. MEME:discovering and analyzing DNA and protein sequence motifs[J]. Nucleic Acids Research, 2006, 34(2): W369–W373. |
| [18] | Magali L, Patrice D, Gert T, et al. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325–327. DOI: 10.1093/nar/30.1.325 |
| [19] | Lee T H, Tang H, Wang X, et al. PGDD:a database of gene and genome duplication in plants[J]. Nucleic Acids Research, 2012, 41: D1152–D1158. |
| [20] | Zhang Z, Li J, Zhao X Q, et al. KaKs_Calculator:calculating Ka and Ks through model selection and model averaging[J]. Geno Prot Bioinfo, 2006, 4(4): 259–263. DOI: 10.1016/S1672-0229(07)60007-2 |
| [21] | Yamada K, Kojima T, Bantog N, et al. Cloning of two isoforms of soluble acid invertase of Japanese pear and their expression during fruit development[J]. Journal of Plant Physiology, 2007, 164(1): 746–755. |
| [22] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2007, 25(5): 402–408. |
| [23] | Marger M D, Saier M H. A major superfamily of transmembrane facilitators that catalyse uniport, symport and antiport[J]. Trends Biochem Sci, 1993, 18: 13–20. DOI: 10.1016/0968-0004(93)90081-W |
| [24] | Fawcett J A, Maere S, van de P Y. Plants with double genomes might have had a better chance to survive the Cretaceous-Tertiary extinction event[J]. Proc Natl Acad Sci USA, 2009, 106(14): 5737–5742. DOI: 10.1073/pnas.0900906106 |
| [25] | Jaillon O, Aury J M, Noel B, et al. The grapevine genome sequence suggests ancestral hexaploidization in major angiosperm phyla[J]. Nature, 2007, 449(7161): 463–467. DOI: 10.1038/nature06148 |
| [26] |
伍涛. 丰水、鸭梨果实发育过程中糖积累特性及其与果实大小关系研究[D]. 南京: 南京农业大学, 2011.
Wu T. The characteristics of sugar accumulation and its relationship with fruit size during the fruit development in'Fengshui'and'Yali'pear[D]. Nanjing:Nanjing Agricultural University, 2011(in Chinese with English abstract). |