文章信息
- 田璐, 吴嘉琪, 李昕悦, 杨润强, 顾振新
- TIAN Lu, WU Jiaqi, LI Xinyue, YANG Runqiang, GU Zhenxin
- NaCl与CaCl2处理对西兰花芽苗硫苷和异硫氰酸盐含量的影响
- Effect of NaCl and CaCl2 treatment on glucosinolate and isothiocyanates content in broccoli sprouts
- 南京农业大学学报, 2017, 40(2): 352-358
- Journal of Nanjing Agricultural University, 2017, 40(2): 352-358.
- http://dx.doi.org/10.7685/jnau.201610002
-
文章历史
- 收稿日期: 2016-10-05
2. 上海大学悉尼工商学院, 上海 201800
2. SHU-UTS SILC Business School, Shanghai University, Shanghai 201800, China
西兰花 (Brassica oleracea L.var.italica) 系十字花科芸薹属一年生蔬菜, 富含维生素、抗坏血酸、多酚、花色苷、硫代葡萄糖苷 (GLs, 简称硫苷) 等对人体有益的物质[1], 其中硫苷含量高于其他植物性食品[2]。据报道, 芸薹属芽苗中生物活性物质含量显著高于其成熟的营养体[3], 西兰花芽苗中硫苷含量约为其花球的20倍[4]。当完整组织遭受损伤后, 硫苷因与黑芥子酶 (MYR) 接触而水解, 产生的异硫氰酸盐 (ITCs) 可预防多种癌症的发生[5]。但是, 随着芽苗的生长, GLs不断被利用, ITCs形成量持续减少。因此, 如何在芽苗菜中富集GLs和ITCs已成为研究的热点之一。
调控十字花科芸薹属芽苗菜的培育条件可提高其中的GLs等功能成分的含量, 从而定向富集ITCs。研究表明, 喷施NaCl能提高西兰花花球中GLs含量[6-7], 但随着NaCl喷施浓度的提高, 西兰花种子的发芽及其芽苗生长均受到抑制, 导致芽长变短[8]。Ca2+作为植物生长过程中必需的矿质元素, 能维持植物细胞的结构和功能[9], 调节植物光合作用及气孔运动[10], 也能增强植物对环境胁迫的耐受性[11]。郭强晖[12]研究表明, 在西兰花芽苗生长过程中喷施CaCl2可以缓解外源ZnSO4导致的胁迫, 促进芽苗正常生长, 并且不影响ZnSO4作为硫源来富集GLs和ITCs。CaCl2也能缓解NaCl胁迫对黄瓜幼苗叶片光合作用的伤害, 提高植株耐盐性[13]。但是, CaCl2是否能够缓解NaCl对西兰花芽苗的胁迫作用, 并促进GLs的合成与ITCs的形成, 该方面的研究尚未见研究报道。
本研究比较了外源NaCl和CaCl2处理后西兰花芽苗中MYR活性和GLs与ITCs含量变化, 优化了NaCl与CaCl2处理西兰花芽苗富集GLs和ITCs浓度组合, 旨在为增强西兰花芽苗菜的功能品质提供技术支撑。
1 材料与方法 1.1 材料供试材料为西兰花 (Brassica oleracea L.var.italica) 品种‘优秀/YX’, 种子购于山东禾之元种业有限公司, -20 ℃保存, 待用。
西兰花种子先用30 ℃蒸馏水浸泡4 h后, 均匀撒入铺有蛭石的发芽机中, 然后置于30 ℃恒温培养箱中, 光照16 h/黑暗8 h, 用蒸馏水催芽1 d后, 每隔12 h分别用不同浓度的NaCl或CaCl2或联合处理喷施1次, 每次喷施10 mL; 第8天收集芽苗, 准确记录株数, 清洗后用吸水纸吸干水分, 用液氮速冻后, 置于-20 ℃保存, 待测。
1.2 试验方法 1.2.1 单因素试验以GLs含量、ITCs生成量和MYR活性为考察指标, 对NaCl及CaCl2浓度进行单因素试验。NaCl浓度范围为0~200 mmol·L-1, CaCl2浓度范围为0~15 mmol·L-1。
1.2.2 响应面试验在单因素试验的基础上, 选择水平为120、160、200 mmol·L-1的NaCl和5、10、15 mmol·L-1的CaCl2, 以GLs含量和ITCs生成量为响应值, 优化其最优浓度组合。因素水平表见表 1。
| 因素Factor | 水平Level | ||
| -1 | 0 | 1 | |
| X1(mmol·L-1):NaCl | 120 | 160 | 200 |
| X2(mmol·L-1):CaCl2 | 5 | 10 | 15 |
参考Font等[14]的方法并稍作修改。取10株芽苗, 用75%沸甲醇研磨匀浆后, 80 ℃恒温水浴中浸提, 10 000 r·min-1离心10 min, 收集上清液。取2 mL上清液流经DEAE SephadexTM A-25离子交换柱, 排干提取液, 分2次加入2 mL 0.02 mol·L-1醋酸钠, 排干后加入400 μL硫酸酯酶 (酶活性单位4 U·mL-1), 于30 ℃下反应16 h。用4 mL去离子水洗脱, 洗脱液用0.45 μm滤膜过滤, 进行HPLC分析。HPLC分析条件:色谱柱为Eclipse XDB-C18 Column (5 μm, 4.6 mm×150 mm; Agilent Technologies Co. Ltd., USA), 流动相为超纯水和20%乙腈, 0、1、21、26 min内乙腈浓度线性梯度为0%、0%、100%、0%。检测波长为226 nm, 流速为1 mL·min-1, 柱温30 ℃, 进样量20 μL。以烯丙基GLs作为内标。根据Brown等[15]报道的校正因子进行计算。
1.2.4 ITCs含量测定参考Chung等[16]的方法稍作修改。取10株芽苗, 用蒸馏水研磨匀浆后于37 ℃孵育3 h; 10 000 r·min-1离心15 min, 取上清液250 μL与1, 2-苯二硫醇的异丙醇溶液于65 ℃水浴反应2 h, 反应液经0.45 μm滤膜过滤后用于HPLC分析。HPLC分析条件:色谱柱为Eclipse XDB-C18 Column, 流动相为超纯水和甲醇 (体积比为30:70), 检测波长为365 nm, 流速为1 mL·min-1, 柱温30 ℃, 进样量20 μL。用异硫氰酸苯酯 (PITC) 作标准曲线, 根据标准曲线计算出样品中ITCs的生成量。
1.2.5 MYR活性测定根据Kim等[17]的方法并稍作修改。取10株芽苗, 用3 mL 0.1 mol·L-1磷酸盐缓冲液 (pH6.5) 冰浴研磨, 在4 ℃下10 000 r·min-1离心15 min, 上清液即为粗酶液。取粗酶液0.5 mL与0.5 mL的0.1 mol·L-1烯丙基硫苷混合, 于37 ℃水浴反应15 min后沸水灭酶5 min, 以不加烯丙基硫苷为空白, 直接沸水灭酶5 min, 用葡萄糖试剂盒测定葡萄糖的含量。以每株西兰花每分钟被MYR转化生成1 nmol葡萄糖为1个酶活性单位, 酶活性单位为U·min-1。
1.3 数据统计与分析试验设3次生物学重复, 各指标测定设3次重复, 结果以x±SD表示。试验数据采用SAS 9.0软件进行方差分析, 在0.05水平上进行显著性检验。
2 结果与分析 2.1 NaCl和CaCl2处理对西兰花芽苗中GLs和ITCs含量及MYR活性的影响 2.1.1 GLs含量由表 2可知:160 mmol·L-1 NaCl和10 mmol·L-1 CaCl2单独处理西兰花芽苗后, 4-甲基亚磺酰基丁基硫苷 (GRA) 含量最高, 分别占总GLs的80%和77%, 而对照中GRA仅占67%;单独喷施NaCl的处理中, 总GLs含量显著增加 (P < 0.05), 并随着NaCl浓度的升高呈先升后降的趋势, GRA的变化趋势与之一致。喷施5、10和15 mmol·L-1的CaCl2后, 总GLs的含量分别为每10株含4.25、4.33和3.92 μmol (表 2)。NaCl与10 mmol·L-1的CaCl2共同处理能显著增加GLs含量, 总GLs含量是同浓度NaCl单独处理时的1.01~1.18倍, 并在160 mmol·L-1时达到最大值, 每10株含5.78 μmol; CaCl2与160 mmol·L-1 NaCl共同处理比单独CaCl2处理总GLs含量显著增加, 分别达到每10株含4.94、5.73和4.59 μmol (表 3)。
| 处理 Treatment |
浓度/(mmol·L-1) Concentration |
硫苷含量/μmol GLs contents per 10 sprouts | 总硫苷 Total GLs |
|||||||
| 脂肪族Aliphatic series | 吲哚族Indole series | |||||||||
| GRA | GNA | GER | 4HGB | GB | 4MGB | NGB | ||||
| CK | 0 | 2.32±0.15d | 0.07±0.01c | 0.12±0.00bcd | 0.68±0.12a | 0.03±0.01c | 0.11±0.01ab | 0.11±0.03a | 3.46±0.30d | |
| NaCl | 40 | 3.23±0.18bc | 0.11±0.02bc | 0.09±0.02cd | 0.38±0.02c | 0.05±0.01bc | 0.10±0.01ab | 0.07±0.01a | 4.02±0.12c | |
| 80 | 3.35±0.02abc | 0.10±0.01bc | 0.19±0.01b | 0.52±0.03bc | 0.05±0.00bc | 0.07±0.01b | 0.09±0.01a | 4.37±0.02abc | ||
| 120 | 3.37±0.05abc | 0.18±0.04a | 0.18±0.01b | 0.42±0.04bc | 0.07±0.01ab | 0.14±0.02ab | 0.09±0.01a | 4.45±0.05abc | ||
| 160 | 3.71±0.19a | 0.17±0.03a | 0.28±0.04a | 0.46±0.02bc | 0.06±0.01abc | 0.10±0.02ab | 0.11±0.00a | 4.89±0.16a | ||
| 200 | 3.37±0.02abc | 0.17±0.02a | 0.27±0.08a | 0.45±0.01bc | 0.06±0.02abc | 0.08±0.01b | 0.08±0.02a | 4.47±0.13abc | ||
| CaCl2 | 5 | 3.16±0.18bc | 0.15±0.02ab | 0.16±0.01bc | 0.42±0.04bc | 0.09±0.02a | 0.16±0.04a | 0.11±0.01a | 4.25±0.18bc | |
| 10 | 3.31±0.14bc | 0.14±0.01ab | 0.10±0.01cd | 0.48±0.02bc | 0.07±0.01ab | 0.13±0.01ab | 0.10±0.03a | 4.33±0.19bc | ||
| 15 | 3.01±0.22c | 0.10±0.02bc | 0.06±0.01d | 0.53±0.02b | 0.05±0.01bc | 0.07±0.07b | 0.09±0.03a | 3.92±0.36cd | ||
| 注:1) GLs:硫苷Glucosinolate; GRA:4-甲基亚磺酰基丁基硫苷 (萝卜硫苷) Glucoraphanin; GNA:3-丁烯基硫苷Gluconapin; GER:4-甲硫基丁基硫苷Glucoerucin; 4HGB:4-羟基吲哚基-3-甲基硫苷4-hydroxyglucobrassicin; GB:3-吲哚基甲基硫苷Glucobrassicin; 4MGB:4-甲氧基吲哚基-3-甲基硫苷4-methoxyglucobrassicin; NGB:1-甲氧基吲哚基-3-甲基硫苷Neoglucobrassicin。 2) 不同小写字母表示在0.05水平上差异显著。Different letters are significantly different at 0.05 level. The same as below. |
||||||||||
| 处理Treatment | GLs含量/μmol GLs contents per 10 sprouts | 总硫苷 Total GLs |
||||||||
| c(NaCl)/ (mmol·L-1) |
c(CaCl2)/ (mmol·L-1) |
脂肪族Aliphatic series | 吲哚族Indole series | |||||||
| GRA | GNA | GER | 4HGB | GB | 4MGB | NGB | ||||
| 40 | 10 | 3.36±0.28b | 0.12±0.01b | 0.09±0.01c | 0.39±0.05bcd | 0.07±0.00a | 0.10±0.01a | 0.04±0.01c | 4.16±0.36c | |
| 80 | 10 | 3.61±0.41b | 0.08±0.00b | 0.10±0.03c | 0.48±0.03b | 0.08±0.01a | 0.08±0.01a | 0.05±0.02bc | 4.48±0.39bc | |
| 120 | 10 | 3.54±0.44b | 0.18±0.05b | 0.34±0.15ab | 0.41±0.05bc | 0.08±0.02a | 0.11±0.01a | 0.06±0.01bc | 4.72±0.15bc | |
| 160 | 10 | 4.46±0.31a | 0.19±0.03b | 0.50±0.03a | 0.34±0.05cde | 0.08±0.02a | 0.11±0.00a | 0.11±0.03a | 5.78±0.36a | |
| 200 | 10 | 3.41±0.03b | 0.12±0.01b | 0.41±0.01ab | 0.30±0.00de | 0.07±0.00a | 0.08±0.01a | 0.10±0.02ab | 4.49±0.02bc | |
| 160 | 5 | 3.90±0.22ab | 0.11±0.01b | 0.35±0.12ab | 0.33±0.05cde | 0.07±0.02a | 0.10±0.01a | 0.09±0.01ab | 4.94±0.40b | |
| 160 | 10 | 4.04±0.28ab | 0.46±0.13a | 0.31±0.02b | 0.71±0.02a | 0.06±0.01a | 0.11±0.01a | 0.05±0.00bc | 5.73±0.15a | |
| 160 | 15 | 3.71±0.02b | 0.10±0.00b | 0.28±0.03b | 0.27±0.00e | 0.06±0.00a | 0.10±0.04a | 0.07±0.03abc | 4.59±0.12bc | |
由图 1可见:单独喷施NaCl时, 随着NaCl浓度的升高, 西兰花芽苗中ITCs含量呈先升后降的趋势, 在160 mmol·L-1时达到最大值; 在喷施NaCl的同时喷施10 mmol·L-1的CaCl2, 能在一定程度上增加芽苗中ITCs含量, 达到每10株含1.38~3.52 μmol (图 1-A); 而NaCl对MYR活性无显著影响 (图 1-C)。喷施CaCl2后西兰花芽苗中ITCs含量比对照高2.82~3.36倍; 同时喷施CaCl2和160 mmol·L-1的NaCl能显著增加西兰花芽苗中ITCs含量, 每10株含量达到3.04~3.58 μmol, 相较于同浓度的CaCl2处理, ITCs含量每10株分别增加1.13~2.44 μmol (图 1-B); 喷施CaCl2对西兰花芽苗中MYR活性无显著影响 (图 1-D)。
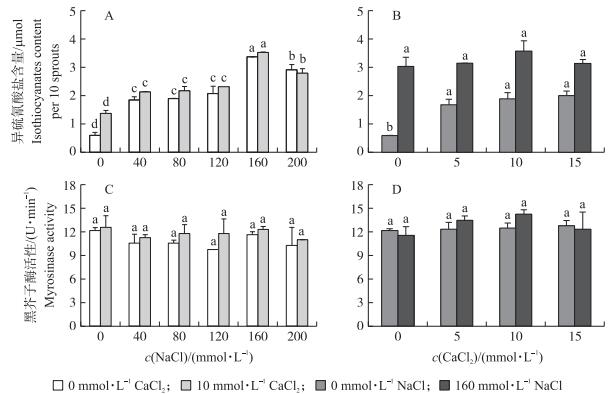
|
图 1 不同浓度NaCl和CaCl2对西兰花芽苗异硫氰酸盐 (ITCs) 含量和黑芥子酶 (MYR) 活性的影响 Figure 1 Effects of different NaCl or CaCl2 concentrations on isothiocyanates (ITCs) content and myrosinase (MYR) activity in broccoli sprouts |
在单因素试验的基础上, 采用响应面法优化西兰花芽苗GLs水解与富集ITCs的发芽条件, Miscellaneous试验设计组合及数据结果见表 4。
| 编号Code | X1:NaCl/(mmol·L-1) | X2:CaCl2/(mmol·L-1) | Y1:GLs/μmol | Y2:ITCs/μmol |
| 1 | 0 | 0 | 5.593±0.076 | 3.323±0.015 |
| 2 | 0 | -1 | 4.372±0.267 | 2.061±0.028 |
| 3 | 1 | 1 | 4.605±0.141 | 2.524±0.080 |
| 4 | -1 | 1 | 3.281±0.121 | 0.765±0.023 |
| 5 | 1 | 0 | 4.625±0.124 | 3.235±0.438 |
| 6 | 0 | 1 | 5.424±0.009 | 2.619±0.255 |
| 7 | 0 | 0 | 5.610±0.209 | 3.338±0.583 |
| 8 | 0 | 0 | 5.820±0.221 | 3.761±0.187 |
| 9 | 0 | 0 | 5.515±0.289 | 3.000±0.031 |
| 10 | -1 | 0 | 4.055±0.276 | 1.045±0.050 |
| 11 | 1 | -1 | 4.729±0.094 | 2.505±0.006 |
| 12 | -1 | -1 | 3.329±0.189 | 0.648±0.007 |
利用Design Expert 8.0软件对表 4数据进行二次多元回归拟合, 得到GLs含量 (Y1) 对编码自变量NaCl浓度 (X1) 和CaCl2浓度 (X2) 的二次多项回归方程:
Y1=-16.904+0.235X1+0.481X2-9.500×10-5X1X2-6.895×10-4X12-0.022X22。
ITCs生成量 (Y2) 对编码自变量NaCl浓度 (X1) 和CaCl2浓度 (X2) 的二次多项回归方程:
Y2=-19.674+0.220X1+0.661X2-1.225×10-4X1X2-6.078×10-4X12-0.031X22。
统计分析结果 (表 5、表 6) 表明, 所建GLs模型的决定系数R2为0.906 9, ITCs模型的决定系数R2为0.953 4, 显示试验模型与真实值之间有较好的拟合度。模型的F值分别为11.68和25.44, P值小于0.01, 表明模型是极显著的; 模型的精密度分别是9.214和12.995, 表明模型精密度良好。以上数据都证明试验模型有效。NaCl浓度对GLs和ITCs的含量具有极显著影响 (P < 0.01), 而CaCl2浓度对GLs和ITCs的含量无显著影响。根据P值大小可知, NaCl浓度对ITCs含量的影响大于其对GLs含量的影响。
| 变异来源Source | 平方和Sum of squares | 自由度DF | 均方Mean square | F值F-value | P值P-value | 显著性Significance |
| 模型Model | 7.69 | 5 | 1.54 | 11.68 | 0.005 | ** |
| X1-NaCl | 1.81 | 1 | 1.81 | 13.75 | 0.010 | ** |
| X2-CaCl2 | 0.13 | 1 | 0.13 | 0.98 | 0.360 | |
| X1X2 | 0.00 | 1 | 0.00 | 0.01 | 0.920 | |
| X12 | 3.25 | 1 | 3.25 | 24.67 | 0.003 | ** |
| X22 | 0.79 | 1 | 0.79 | 6.03 | 0.050 | * |
| 残差Residual | 0.79 | 6 | 0.13 | |||
| 失拟项Lack of fit | 0.74 | 3 | 0.25 | 14.47 | 0.027 | * |
| 误差Pure error | 0.05 | 3 | 0.02 | |||
| 总变异Cor total | 8.47 | 11 | ||||
| R2=0.906 9 | Radj2=0.829 2 | CV=7.64% | ||||
| Note:*P < 0.05, ** P < 0.01. The same as follows. | ||||||
| 变异来源Source | 平方和Sum of squares | 自由度DF | 均方Mean square | F值F-value | P值P-value | 显著性Significance |
| 模型Model | 11.83 | 5 | 2.37 | 24.55 | 0.001 | ** |
| X1-NaCl | 5.62 | 1 | 5.62 | 58.29 | 0.000 | ** |
| X2-CaCl2 | 0.08 | 1 | 0.08 | 0.83 | 0.397 | |
| X1X2 | 0.00 | 1 | 0.00 | 0.02 | 0.880 | |
| X12 | 2.52 | 1 | 2.52 | 26.17 | 0.002 | ** |
| X22 | 1.59 | 1 | 1.59 | 16.51 | 0.007 | ** |
| 残差Residual | 0.58 | 6 | 0.10 | |||
| 失拟项Lack of fit | 0.29 | 3 | 0.10 | 0.98 | 0.507 | |
| 误差Pure error | 0.29 | 3 | 0.10 | |||
| 总变异Cor total | 12.41 | 11 | ||||
| R2=0.953 4 | Radj2=0.914 6 | CV=12.93% |
由图 2-A可见:当NaCl浓度一定时, GLs含量随CaCl2浓度的增加呈先升高后降低的趋势; 当CaCl2浓度不变时, 随着NaCl浓度升高, GLs含量先升高后降低。NaCl和NaCl的二次项对GLs含量都有极显著的影响 (P < 0.01), CaCl2的二次项对GLs含量有显著影响 (P < 0.05), 而NaCl和CaCl2的交互作用差异不显著 (表 5)。
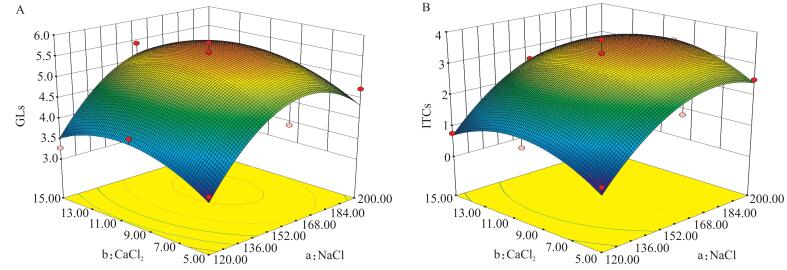
|
图 2 NaCl和CaCl2的交互作用对GLs和ITCs含量的影响 Figure 2 The interaction between NaCl and CaCl2 on GLs and ITCs contents |
由图 2-B可知:ITCs的含量随NaCl浓度和CaCl2浓度的变化趋势与GLs的变化趋势一致。NaCl和NaCl的二次项以及CaCl2的二次项对ITCs含量都有极显著的影响, 而CaCl2以及NaCl和CaCl2的交互作用对ITCs含量的影响均不显著 (表 6)。
2.3 验证性试验结果采用优化的西兰花芽苗发芽条件进行验证试验后得出, 当NaCl浓度为174.09 mmol·L-1、CaCl2浓度为10.48 mmol·L-1时, GLs和ITCs含量最大, 分别为每10株含5.57和3.54 μmol。表 7显示:2个组合GLs和ITCs的实测值与预测值均无显著差异, 证明模型精确有效。
| 试验 Experiment |
c(NaCl)/ (mmol·L-1) |
c(CaCl2)/ (mmol·L-1) |
GLs含量/μmol GLs content per 10 sprouts | ITCs含量/μmol ITCs content per 10 sprouts | |||
| 实测值Measured value | 预测值Predicted value | 实测值Measured value | 预测值Predicted value | ||||
| 最优组合Optimum | 174.09 | 10.48 | 5.57±0.18 | 5.56 | 3.54±0.46 | 3.50 | |
| 随机组合Stochastic | 120.00 | 10.00 | 4.08±0.23 | 3.86 | 1.25±0.12 | 1.34 | |
本试验结果表明, NaCl抑制西兰花芽苗的生长, 但能提高GLs含量并促进ITCs生成。添加CaCl2能缓解NaCl造成的盐胁迫, 且有利于ITCs的生成, 但NaCl和CaCl2均对MYR活性无显著影响。据报道, MYR活性易受环境的影响, 光刺激[18]和茉莉酸甲酯处理[17]均能改变MYR活性。但在本试验中, 无论是NaCl、CaCl2单独处理, 还是两者共同处理, MYR活性均无显著变化, 这可能与芽苗生长的阶段有关。在Guo等[19]研究中, NaCl处理3 d的西兰花芽苗中MYR活性与对照无显著差异, 而苗龄为5 d的芽苗用80和100 mmol·L-1的NaCl处理后其MYR活性显著高于对照, 到第7天其活性反而低于对照; Yuan等[20]对萝卜苗的研究中也出现类似的结果。
本研究中, 喷施NaCl时, ITCs的含量显著高于对照, 这与之前的报道一致[8, 19-20], 表明NaCl对西兰花芽苗的次生物质代谢有显著影响。在盐胁迫下, 植物的生理生化特征受到影响, 促使GLs的含量增多, 以适应在低水势下的渗透调节[21]。ITCs含量不仅与GLs含量和MYR活性相关, 还受到水解条件[22]以及上皮硫特异硫蛋白 (ESP) 活性[23]的影响, ESP会改变硫苷水解产物的组成, 使原本水解为异硫氰酸盐的硫苷朝着腈类物质方向水解。另外, Liang等[24]发现在西兰花种子水解过程中添加Ca2+能提高水解液中MYR活性。所以, 本试验中NaCl和CaCl2也可能通过降低ESP蛋白的活性, 同时植物体内积累的Na+和Ca2+被释放后也可能提高水解液中MYR活性, 从而使ITCs含量在硫苷水解过程中显著增加。
在种子发芽基质中添加外源Ca2+可有效缓解盐胁迫, 提高种子的发芽率, 并促进芽苗生长[25-26]。然而, 由于胁迫来源、植物种类和基因型差异, 不同植物对外源Ca2+的需求量不同。Yang等[27]研究发现, 西兰花芽苗在发芽过程中喷施CaCl2可以缓解ZnSO4造成的胁迫, 单独施用可提高GLs和ITCs的含量, 但联合ZnSO4处理对GLs和ITCs的含量以及MYR活性的影响却与本研究结果存在一定的差异, 可能是由于西兰花品种、芽苗培养条件以及采收时间不同所致。本研究中, CaCl2对NaCl胁迫的缓解作用存在浓度效应, 当CaCl2浓度为10 mmol·L-1时, 西兰花芽苗中ITCs和GLs含量均最高, 虽然5或15 mmol·L-1的CaCl2能提高ITCs和GLs的含量, 但提高的幅度不及10 mmol·L-1的处理。本研究与Marcar[25]的研究结果相似, 5 meq·L-1 Ca2+最利于缓解NaCl对瑞士黑麦芽苗的胁迫, 而1或10 meq·L-1 Ca2+对黑麦芽苗的发芽率和根长的缓解作用都不及5 meq·L-1的处理。
综上, NaCl处理对西兰花芽苗的生长表现出一定的浓度效应, 低浓度的NaCl处理促进芽苗的生长, 而喷施适宜浓度的NaCl, 特别是浓度为160 mmol·L-1时, 显著提高了芽苗中ITCs和GLs含量, NaCl与10 mmol·L-1 CaCl2共同处理能进一步增加ITCs和GLs的含量。174.09 mmol·L-1的NaCl和10.48 mmol·L-1的CaCl2联合处理可用于西兰花芽苗菜的生产中。
| [1] | Jeffery E H, Brown A F, Kurilich A C, et al. Variation in content of bioactive compounds in broccoli[J]. Journal of Food Composition and Analysis, 2003, 16(3): 323–330. DOI: 10.1016/S0889-1575(03)00045-0 |
| [2] | Pérez-Balibrea S, Moreno D A, García-Viguera C. Genotypic effects on the phytochemical quality of seeds and sprouts from commercial broccoli cultivars[J]. Food Chemistry, 2011, 125(2): 348–354. DOI: 10.1016/j.foodchem.2010.09.004 |
| [3] | Barillari J, Cervellati R, Costa S, et al. Antioxidant and choleretic properties of Raphanus sativus L.sprout (Kaiware Daikon) extract[J]. Journal of Agricultural and Food Chemistry, 2006, 54(26): 9773–9778. DOI: 10.1021/jf061838u |
| [4] | Guo R, Yuan G, Wang Q. Effect of sucrose and mannitol on the accumulation of health-promoting compounds and the activity of metabolic enzymes in broccoli sprouts[J]. Scientia Horticulturae, 2011, 128(3): 159–165. DOI: 10.1016/j.scienta.2011.01.014 |
| [5] | Higdon J V, Delage B, Williams D E, et al. Cruciferous vegetables and human cancer risk:epidemiologic evidence and mechanistic basis[J]. Pharmacological Research, 2007, 55(3): 224–236. DOI: 10.1016/j.phrs.2007.01.009 |
| [6] | Lópezberenguer C, Moreno D A, Carvajal M, et al. Growing hardier hardier crops for better health:salinity tolerance and the nutritional value of broccoli[J]. Journal of Agricultural and Food Chemistry, 2009, 57(2): 572–578. DOI: 10.1021/jf802994p |
| [7] | López-Berenguer C, Martínez-Ballesta M C, García-Viguera C, et al. Leaf water balance mediated by aquaporins under salt stress and associated glucosinolate synthesis in broccoli[J]. Plant Science, 2008, 174(3): 321–328. DOI: 10.1016/j.plantsci.2007.11.012 |
| [8] | Guo L, Yang R, Wang Z, et al. Effect of NaCl stress on health-promoting compounds and antioxidant activity in the sprouts of three broccoli cultivars[J]. International Journal of Food Sciences and Nutrition, 2014, 65(4): 476–481. DOI: 10.3109/09637486.2013.860583 |
| [9] | Chandra S, Stennis M, Low P S. Measurement of Ca2+ fluxes during elicitation of the oxidative burst in aequorin-transformed tobacco cells[J]. Journal of Biological Chemistry, 1997, 272(272): 28274–28280. |
| [10] |
宗会, 胡文玉. 钙信使系统在苹果果肉圆片衰老中的作用[J].
植物生理学报, 2000, 36(4): 305–307.
Zong H, Hu W Y. The role of calcium messenger system in senescence of apple fruit discs[J]. Plant Physiology Journal, 2000, 36(4): 305–307. (in Chinese) |
| [11] | Askari H, Edqvist J, Hajheidari M, et al. Effects of salinity levels on proteome of Suaeda aegyptiaca leaves[J]. Proteomics, 2006, 6(8): 2542–2554. DOI: 10.1002/(ISSN)1615-9861 |
| [12] |
郭强晖. 西兰花芽苗异硫氰酸酯富集与调控技术研究[D]. 南京: 南京农业大学, 2014: 45-61.
Guo Q H. Study on isothiocyanates accumulation and regulation techniques in germinated broccoli[D]. Nanjing:Nanjing Agricultural University, 2014:45-61(in Chinese with English abstract). |
| [13] |
严蓓, 孙锦, 束胜, 等. 外源钙对NaCl胁迫下黄瓜幼苗叶片光合特性及碳水化合物代谢的影响[J].
南京农业大学学报, 2004, 37(1): 31–36.
Yan B, Sun J, Shu S, et al. Effects of exogenous calcium on photosynthetic characteristics and carbohydrate metabolism in leaves of cucumber (Cucumis sativus L.) seedlings under NaCl stress[J]. Journal of Nanjing Agricultural University, 2004, 37(1): 31–36. DOI: 10.7685/j.issn.1000-2030.2014.01.006 (in Chinese) |
| [14] | Font R, Río-Celestino M D, Cartea E, et al. Quantification of glucosinolates in leaves of leaf rape (Brassica napus ssp.pabularia) by near-infrared spectroscopy[J]. Phytochemistry, 2005, 66(2): 175–185. DOI: 10.1016/j.phytochem.2004.11.011 |
| [15] | Brown P D, Tokuhisa J G, Reichelt M, et al. Variation of glucosinolate accumulation among different organs and developmental stages of Arabidopsis thaliana[J]. Phytochemistry, 2003, 62(3): 471–481. DOI: 10.1016/S0031-9422(02)00549-6 |
| [16] | Chung F L, Jiao D, Getahun S M, et al. A urinary biomarker for uptake of dietary isothiocyanates in humans[J]. Cancer Epidemiology Biomarkers and Prevention, 1998, 7(2): 103–108. |
| [17] | Kim H J, Chen F, Wang X, et al. Effect of methyl jasmonate on phenolics, isothiocyanate, and metabolic enzymes in radish sprout (Raphanus sativus L.)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(19): 7263–7269. DOI: 10.1021/jf060568c |
| [18] | Yamada K, Hasegawa T, Minami E, et al. Induction of myrosinase gene expression and myrosinase activity in radish hypocotyls by phototropic stimulation[J]. Journal of Plant Physiology, 2003, 160(3): 255–259. DOI: 10.1078/0176-1617-00950 |
| [19] | Guo R F, Yuan G F, Wang Q M. Effect of NaCl treatments on glucosinolate metabolism in broccoli sprouts[J]. Journal of Zhejiang University Science B, 2013, 14(2): 124–131. DOI: 10.1631/jzus.B1200096 |
| [20] | Yuan G, Wang X, Guo R, et al. Effect of salt stress on phenolic compounds, glucosinolates, myrosinase and antioxidant activity in radish sprouts[J]. Food Chemistry, 2010, 121(4): 1014–1019. DOI: 10.1016/j.foodchem.2010.01.040 |
| [21] | Qasim M, Ashraf M, Ashraf M Y, et al. Salt-induced changes in two canola cultivars differing in salt tolerance[J]. Biologia Plantarum, 2003, 46(46): 629–632. |
| [22] | Guo Q, Guo L, Wang Z, et al. Response surface optimization and identification of isothiocyanates produced from broccoli sprouts[J]. Food Chemistry, 2013, 141(3): 1580–1586. DOI: 10.1016/j.foodchem.2013.04.026 |
| [23] | Williams D J, Critchley C, Pun S, et al. Epithiospecifier protein activity in broccoli:the link between terminal alkenyl glucosinolates and sulphoraphane nitrile[J]. Phytochemistry, 2008, 69(16): 2765–2773. DOI: 10.1016/j.phytochem.2008.09.018 |
| [24] | Liang H, Yuan Q, Xiao Q. Effects of metal ions on myrosinase activity and the formation of sulforaphane in broccoli seed[J]. Journal of Molecular Catalysis B:Enzymatic, 2006, 43: 19–22. DOI: 10.1016/j.molcatb.2006.03.008 |
| [25] | Marcar N E. Effect of calcium on the salinity tolerance of Wimmera ryegrass (Lolium rigidum Gaud., cv.Wimmera) during germination[J]. Plant and Soil, 1986, 93(1): 129–132. DOI: 10.1007/BF02377152 |
| [26] | Al-Harbi A R. Growth and nutrient composition of tomato and cucumber as affected by sodium chloride salinity and supplemental calcium[J]. Journal of Plant Nutrition, 1995, 18(7): 1403–1416. DOI: 10.1080/01904169509364990 |
| [27] | Yang R, Guo L, Zhou Y, et al. Calcium mitigates the stress caused by ZnSO4 as a sulphur fertilizer and enhances the sulforaphane formation of broccoli sprouts[J]. RSC Advances, 2015, 5(17): 12563–12570. DOI: 10.1039/C4RA11371C |




