文章信息
- 丁易飞, 申长卫, 王洁, 谢昶琰, 彭莉润, 金昕, 董彩霞, 徐阳春
- DING Yifei, SHEN Changwei, WANG Jie, Xie Changyan, PENG Lirun, JIN Xin, DONG Caixia, XU Yangchun
- 不同施氮水平对棚架栽培‘寿新水’梨生长及山梨醇代谢的影响
- Effects of different supply of N levels on tree growth and sorbitol metabolism in leaf and fruit of trellis trained 'Kotobuki shinsui' pear
- 南京农业大学学报, 2017, 40(2): 242-250
- Journal of Nanjing Agricultural University, 2017, 40(2): 242-250.
- http://dx.doi.org/10.7685/jnau.201604055
-
文章历史
- 收稿日期: 2016-04-27
氮是蛋白质、核酸、叶绿素、激素和多种酶等含氮有机物的重要组成成分, 是果树必需矿质元素中的核心元素, 在植物生命活动中占有首要地位, 又称生命元素[1]。研究表明增施氮肥可促进苹果叶片蔗糖和可溶性糖的合成与积累[2], 而过量施氮会降低氮肥利用率和果实中可溶性糖含量, 影响产量和品质[3]。梨树棚架式栽培是采用人工支架将梨树枝条绑缚在支架网的一种新式栽培模式, 具有树体光照与通风条件好, 管理方便, 能提高单果质量, 提高果实可溶性固形物含量, 果实品质均匀等优点[4], 但是棚架式梨树中央干去除后, 中间部位会抽生大量的徒长枝, 消耗大量的树体营养[5]; 而1年生枝条氮素含量显著高于多年生枝条[6], 棚架式栽培下较高的冬季疏枝量将移走大量养分。因此, 研究棚架式栽培梨树的田间氮肥施用具有重要意义。
可溶性糖是果实的重要组成成分, 也是衡量其品质的重要指标。梨属于蔷薇科果树, 相比蔗糖, 山梨醇是其光合产物、运输形态及优势积累的主要碳水化合物[7]。在山梨醇代谢过程中, 6-磷酸山梨醇脱氢酶 (S6PDH) 是山梨醇合成的关键酶, 依赖NAD的山梨醇脱氢酶 (NAD-SDH) 和依赖NADP的山梨醇脱氢酶 (NADP-SDH) 分别起着分解山梨醇生成果糖和葡萄糖的作用, 但NADP-SDH在叶片和果实中的活性都比较低[8]。本研究以棚架式栽培的‘寿新水’梨树为材料, 研究不同施氮水平对树体生长和叶片果实山梨醇含量的影响, 以及山梨醇合成与分解关键酶S6PDH和NAD-SDH活性及基因相对表达量对氮素的响应, 从而为棚架式梨树氮肥的科学施用提供理论依据。
1 材料与方法 1.1 试验设计试验于2014—2015年在江苏省南京市高淳区花山果园内对同一批梨树体进行。以12年生砂梨品种‘寿新水’为试材, 梨园栽培方式为棚架式栽培, 株行距3 m×5 m, 2014年单株负载量水平为80~100, 2015年为50~70。供试梨园土壤基本养分性状:碱解氮69.37 mg·kg-1, 速效磷43.18 mg·kg-1, 速效钾146.33 mg·kg-1, 有机质17.07 g·kg-1。选择树势均匀一致的梨树, 3株为1个重复, 重复3次, 处理间设置隔离树, 随机区组排列。以不施氮 (N0) 为对照, 设置4个施氮水平:165、330、660和990 kg·hm-2, 分别标记为N1、N2、N3和N4。磷肥 (P2O5) 为528 kg·hm-2, 钾肥 (K2O) 为990 kg·hm-2。尿素 (46% N) 分4次施用 (秋肥、基肥、萌芽肥和膨大肥各施入比例为20%、40%、20%和20%), 过磷酸钙 (12% P2O5) 作基肥一次性施用, 硫酸钾 (45% K2O) 分3次施用 (基肥、萌芽肥和膨大期各施入比例为40%、20%和40%)。施肥方式:环状穴施 (在距树干中心1.5~2 m处, 环状挖6个穴, 直径为30 cm, 深度为30 cm)。
1.2 样品采集及处理于盛花期后30 d (幼果期)、65 d (第1次膨大期)、100 d (第2次膨大期) 和120 d (成熟期) 时采集梨叶片和果实, 每个处理分别从树体外围的东、南、西、北4个方位, 距地面1.5~2 m处, 共采集24片新稍叶片 (从枝条底部往上数第4~5叶)、24片结果枝成熟叶片和24个果实。新稍叶片样品带回实验室用超纯水清洗干净, 烘干至恒质量后用于测定氮含量。2015年采集的结果枝成熟叶片样品去除叶脉并剪碎, 果实样品削皮去核, 在果实对称部位取部分样品测定可溶性固形物, 之后都采用四分法对角取样分为2份。将样品混匀后立即用液氮速冻, 一份存于-70 ℃冰箱, 用于叶片和果实总RNA的提取和相关基因表达的测定; 另一份存于-20 ℃冰箱, 用于叶片中相关酶活性及叶片和果实中山梨醇含量的测定, 成熟期果实样品用于可溶性糖含量的测定。
1.3 测定方法 1.3.1 果实产量和品质的测定树体干周用卷尺测定; 百叶质量和单果质量用分析天平测定, 于膨大期统计单株挂果量, 单株产量为成熟期单果质量乘以挂果量; 用日本ATAGO公司生产的PAL-1型电子折光仪测定可溶性固形物; 采用蒽酮比色法[9]测定果实可溶性糖含量; 采用酸碱滴定法测定果实可滴定酸含量, 并根据测定结果计算糖酸比。测定时每个样品3次重复。
1.3.2 叶片和果实中山梨醇含量测定采用高效液相色谱方法 (HPLC) 检测梨叶片和果实中山梨醇含量[10]。分别称取1 g叶片和2 g果样, 加入20 mL超纯水研磨, 转移至离心管中, 于4 ℃、12 000 g离心15 min, 取上清液, 用0.45 mm微孔滤膜 (Sep Pak; Waters, Milford, MA) 过滤后上机, 重复3次。高效液相色谱 (1200;Agilent, Santa Clara, CA) 条件为:CapCell Pak NH2(4.6 mm×250 mm, 5 μm) 色谱柱 (Shiseido, Tokyo, Japan), 柱温50 ℃, 流动相为乙腈和水 (体积比为80:20) 的溶液, 流速为1.0 mL·min-1, 蒸发光散射检测器 (Alltech 3300 ELSD; Grace, Deerfield, IL), 漂移管温度为80 ℃, N2流速为2.0 mL·min-1, 进样量为5 μL。以山梨醇 (Sigma公司) 标准样品作为内参。
1.3.3 叶片中山梨醇代谢关键酶活性的测定酶的提取:NAD-SDH酶液的提取参考Ito等[11]的方法, 并加以改进, 所有操作均在4 ℃下进行。称取1 g鲜叶片, 冰浴下研磨, 加10 mL 200 mmol·L-1磷酸钾提取缓冲液 (含20 mmol·L-1 β-疏基乙醇, 10 mmol·L-1抗坏血酸钠, 10% PVPP, 0.1% Triton-X100, pH7.0), 匀浆3 min, 12 000 g离心20 min, 取上清液进行透析过夜, 透析缓冲液为20 mmol·L-1磷酸钾缓冲液 (含20 mmol·L-1 β-疏基乙醇, pH7.0), 透析后的酶提取液用于酶的测定。S6PDH酶的提取在0~4 ℃条件下进行。取1 g叶片加入1 g PVPP在冰浴下研磨, 加入50 mmol·L-1 Hepes-NaOH提取缓冲液 (10 mmol·L-1 MgCl2、2.5 mmol·L-1 DTT、1 mmol·L-1 EDTA、5%甘油和1% Tween-20, pH7.5), 然后在12 000 g下离心30 min, 上清液可用于酶的测定。
酶的测定:NAD-SDH酶的测定方法参照文献[11], 在1 mL反应体系中, 含30 mmol·L-1 Tris-HCl缓冲液 (pH9.5)、275 mmol·L-1山梨醇、1 mmol·L-1 NAD、250 μL酶提取液。S6PDH酶的测定参照Loescher等[12]的方法, 反应体系1 mL, 包括100 mmol·L-1 Tris-HCL缓冲液 (pH9.0)、20 mmol·L-1 G-6-P、0.1 mmol·L-1 NADPH、250 μL酶液。
2种酶活性测定均在A340波长下比色, 对照反应为失活的酶液。测定时, 加入反应底物后立即用紫外分光光度计测定吸光度, 记录5 min, 重复3次, 并以每分钟吸光度变化0.01为1个酶活单位。酶活性单位为U·min-1·g-1。
1.3.4 山梨醇代谢关键酶基因qRT-PCR分析叶片和果实总RNA的提取采用改良的CTAB法[13]。在NCBI上搜索到已经报道的砂梨的S6PDH(KC506733.1) 和NAD-SDH3(KC506732.1) 基因[14]的核苷酸序列, 设计qRT-PCR特异引物。引物序列如下:S6PDHSP:5′-CAACAAACCTGGGAGGGCATG-3′; S6PDHAP:5′-GAGGGGTGTGAGCTGTGGGAA-3′。SDH3SP:5′-ATTTCGGATTCATCGAGAGGACAGGT-3′; SDH3AP:5′-TGTGGTGCATGCCGAGATCTAATACA-3′。ACTIN(JN684184.1) 作为内参基因[15]。引物序列如下:ACTINSP:5′-CCATCCAGGCTGTTCTCTC-3′; ACTINAP:5′-GCAAGGTCCAGACGAAGG-3′。根据SYBR Green Real-Time Master Mix (TaKaRa) 公司提供的试剂盒进行操作, 每个样品3次重复。qRT-PCR的反应总体积为20 μL。具体为:SYBR® Premix Ex TaqTM(2×)10 μL, 正、反引物各0.4 μL, DNA模板2 μL, 参比荧光0.4 μL, ddH2O 6.8 μL。PCR反应程序为:94 ℃ 4 min; 94 ℃ 5 s, 60 ℃ 30 s, 共40个循环。采用2-ΔΔCT法分析基因表达相对变化。
1.4 数据分析所得结果为各处理平均值, 多重比较和相关性分析采用SPSS 16.0软件, 其中多重比较采用Duncan′s法, 图表绘制采用Origin 8.5软件。
2 结果与分析 2.1 施氮对‘寿新水’梨生长及果实产量的影响从图 1可知:两年间施氮处理对树体影响的变化趋势基本一致, 与2014年各处理相比, 2015年树体的干周、百叶质量和单果质量都明显增加, 产量有所下降。梨树干周随施氮量增加而逐渐增加, 与对照相比, N2、N3和N4处理树体干周增加比例较高 (图 1-A), 成熟期百叶质量增加显著 (图 1-B)。相比N0处理, 2014和2015年N2处理梨树百叶质量分别显著提高了16.3%和26.5%;N3和N4处理间百叶质量差异不明显。单果质量和产量均随施氮量增加呈先增加后降低的趋势 (图 1-C)。2014年, N3处理下单株产量最高, 比对照显著提高了38.38%。2015年由于座果期梨树遭受冰雹影响, 整体产量下降 (图 1-D)。两年间N2、N3和N4处理单株产量无显著差异。
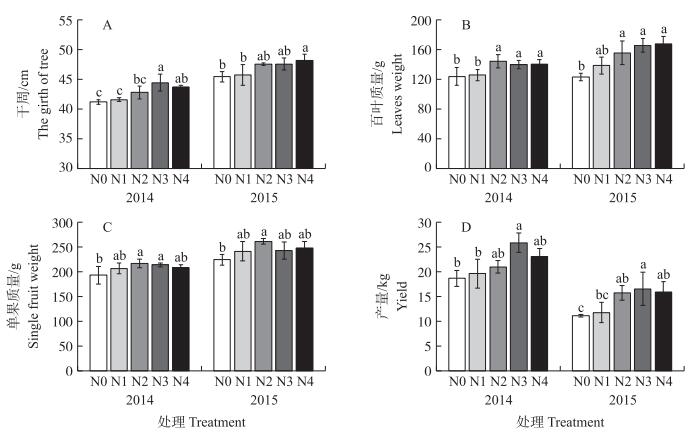
|
图 1 施氮对‘寿新水’梨生长及果实产量的影响 Figure 1 Effects of the N application rates on plant growth and yield of'Kotobuki shinsui'pear 1) N0:0 kg·hm-2 N; N1:165 kg·hm-2 N; N2:330 kg·hm-2 N; N3:660 kg·hm-2 N; N4:990 kg·hm-2 N。2) 不同小写字母表示同一时期不同处理间在0.05水平差异显著。Different small letters mean significant difference in different treatments at 0.05 level in the same period. The same as follows. |
由图 2可知:从幼果期至膨大期叶片氮含量呈下降趋势, 且2个时期施氮处理相比不施氮处理增加了叶片氮的含量。随着施氮量的增加, 叶片氮含量增加, 与N0处理相比, 在N3处理下2014和2015年幼果期叶片氮含量分别显著增加了8.6%和25.7%, 膨大期分别显著增加了5.7%和13.6%。2014年膨大期N2处理下叶片氮含量比N0处理提高了4.9%, 但差异不显著, 而2015年显著高出13.2%。
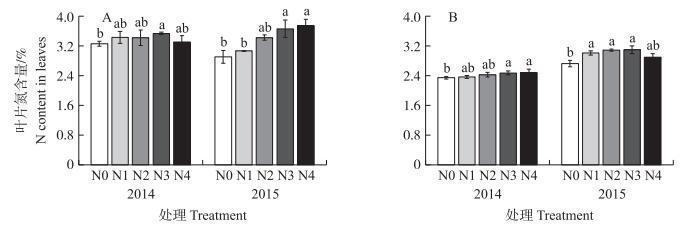
|
图 2 施氮对梨幼果期 (A) 和膨大期 (B) 叶片氮含量的影响 Figure 2 Effects of N application rates on the N content in pear leafat the young fruit stage (A) and expanding stage (B) |
如表 1所示:连续2年施氮处理下梨果实的可溶性固形物含量无显著性差异, 可溶性固形物含量随施氮量增加呈先增加后降低的趋势, 且最大值均在N2处理。2015年N2处理较N0处理梨果实可溶性糖含量显著提高了12.1%, 施氮量继续增加可溶性糖含量呈下降的趋势。两年间在N0和N1处理下果实可滴定酸含量都较高, 但N2、N3和N4处理果实可滴定酸含量显著下降。而N2处理下糖酸比最高, 施氮量继续增加, 糖酸比有下降的趋势。与N0处理比, 2014和2015年N2处理梨果实糖酸比分别显著增加了15.9%和23.8%。2015年N4处理糖酸比比N2处理显著降低了10.9%。
| 处理 Treatment |
可溶性固形物含量/% Soluble solid content |
可溶性糖含量/% Soluble sugar content |
可滴定酸含量/% Titratable acidity content |
糖酸比 Ratio of sugar to acid |
|||||||
| 2014 | 2015 | 2014 | 2015 | 2014 | 2015 | 2014 | 2015 | ||||
| N0 | 12.17±0.18a | 11.66±0.13a | 9.01±0.24a | 8.86±0.34b | 0.15±0.01a | 0.14±0.01a | 62.9±1.9b | 63.0±3.8b | |||
| N1 | 12.18±0.11a | 11.43±0.55a | 8.61±0.25a | 9.07±0.51b | 0.15±0.01a | 0.14±0.01a | 56.9±2.2b | 63.0±6.4b | |||
| N2 | 12.55±0.47a | 11.79±0.38a | 9.11±0.55a | 9.93±0.90a | 0.13±0.01b | 0.13±0.01b | 72.9±5.7a | 78.0±3.7a | |||
| N3 | 12.43±0.30a | 11.74±0.24a | 8.44±0.69a | 8.78±0.37b | 0.12±0.01b | 0.13±0.01b | 72.5±6.4a | 65.5±5.2b | |||
| N4 | 12.14±0.18a | 11.73±0.27a | 8.73±0.10a | 8.62±0.42b | 0.12±0.01b | 0.12±0.01b | 70.8±2.3a | 69.5±3.6b | |||
| 注:同列数据后不同小写字母表示不同处理间在0.05水平差异显著。 Note:Different small letters in the same column mean significant differences in different treatments at 0.05 level. | |||||||||||
从图 3-A中可以看出:各处理梨叶片山梨醇含量随果实发育呈逐渐降低的趋势。膨大期N2处理梨叶片中山梨醇含量呈增加的趋势, 而过量施氮导致叶片山梨醇含量降低。幼果期处理间叶片山梨醇含量无显著差异, 膨大Ⅰ期N2处理叶片山梨醇含量显著高于其他处理, 比不施氮处理提高了14.1%。膨大Ⅱ期与膨大Ⅰ期山梨醇含量变化趋势基本一致。

|
图 3 施氮对不同时期梨叶片 (A) 和果实 (B) 中山梨醇含量的影响 Figure 3 Effects of N application rates on the sorbitol concentration in pear leaf (A) and fruit (B) at different stages |
从幼果期到成熟期, 果实中山梨醇含量先逐渐上升, 膨大Ⅱ期达到峰值, 成熟期时含量有所下降。幼果期、膨大Ⅰ期和膨大Ⅱ期N2处理果实山梨醇含量最高, 相比N0处理分别显著提高了42.7%、42.4%和90.9%, 施氮量继续增加, 果实中山梨醇含量呈下降趋势。成熟期施氮处理对山梨醇含量的影响差异不显著 (图 3-B)。
2.5 施氮对梨叶片山梨醇关键酶活性的影响6-磷酸山梨醇脱氢酶 (S6PDH) 活性随叶片的生长呈逐渐下降的趋势 (图 4-A), 膨大Ⅱ期时N2处理活性最高, 较N0处理活性增加了3.2倍。由图 4-B可知:各处理间NAD-SDH活性变化趋势基本一致。幼果期叶片中NAD-SDH活性最低, 随着果实生长发育的变化其活性逐渐提高。除成熟期外的其他时期, N2处理的NAD-SDH活性最高。幼果期和膨大Ⅰ期N2处理NAD-SDH活性是N0处理的3.4和1.8倍, 是N4处理的4.0和4.4倍。
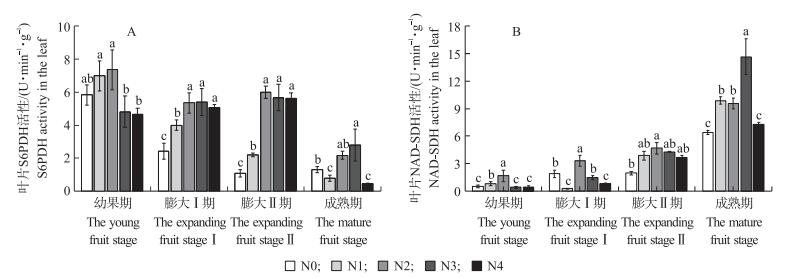
|
图 4 施氮对不同时期梨叶片6-磷酸山梨醇脱氢酶 (S6PDH)(A) 和依赖NAD的山梨醇脱氢酶 (NAD-SDH)(B) 活性的影响 Figure 4 Effects of the N application rates on the activity of sorbitol-6-phosphate dehydrogenase (S6PDH)(A) and NAD-dependent sorbitol dehydrogenase (NAD-SDH)(B) in pear leaf at different stages |
由图 5-A可知:不同时期叶片中S6PDH基因的表达都随施氮量的增加先增加后下降。除膨大Ⅱ期外, 其他时期在N2处理下S6PDH基因相对表达量最高, 而N4处理显著抑制了S6PDH基因的表达。相比N0处理, 成熟期叶片在N2处理下S6PDH基因的相对表达量显著提高了4.8倍, 而N4处理S6PDH基因的相对表达量显著提高了2.8倍。这说明N2处理上调了叶片中S6PDH的表达, 进而提高叶片中S6PDH酶活性, 促进叶片中山梨醇的合成。整个生育期叶片中NAD-SDH3相对表达量较低 (图 5-B), 膨大期N2处理SDH3相对表达量显著高于其他处理, 比N0处理分别提高了172%和49%。除幼果期外, 与N2处理比, 膨大Ⅰ期、膨大Ⅱ期、成熟期N4处理显著抑制了NAD-SDH3的表达, 相对表达量分别降低了22.6%、43.0%和22.3%。
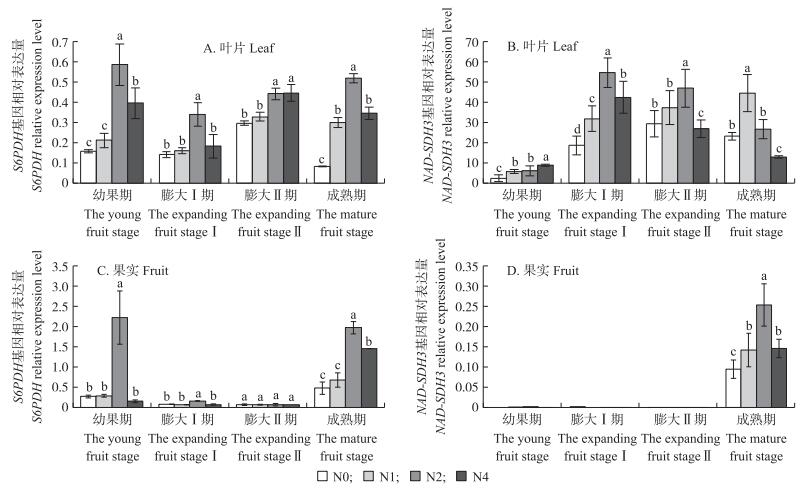
|
图 5 施氮对不同时期梨叶片、果实中S6PDH和NAD-SDH3基因相对表达量的影响 Figure 5 Effects of the N application rates on S6PDH and NAD-SDH3 relative expression levelin pear leaf and fruit at different stages |
在整个发育过程中, 果实中S6PDH的表达在幼果期和成熟期表达丰度较高, 而膨大期表达丰度较低 (图 5-C)。在幼果期, N2处理相比N0处理S6PDH的表达上调了77倍。膨大期施氮对S6PDH的相对表达量影响差异不显著。到成熟期, 随着施氮量的增加, 果实中S6PDH基因的相对表达量先增加后降低, 除膨大Ⅱ期外, 各施氮处理下S6PDH基因的相对表达量均高于N0处理, 且N2处理下相对表达量最高, 说明施氮促进了果实中S6PDH基因的表达, 过量施氮可能抑制其表达。NAD-SDH3基因在梨果实成熟期前几乎检测不到, 而在成熟期该基因大量表达 (图 5-D)。成熟期果实中N2处理NAD-SDH3基因的相对表达量最高, 显著高于其他处理, 比N0处理提高了167%, 而N4处理显著抑制了NAD-SDH3表达, 较N2处理降低了42.5%。
3 讨论连续两年试验表明, 年际间施氮处理对树体影响的变化趋势是基本一致的, 即施氮量越高, 越有利于促进树体的营养生长, 但只有适宜的施氮量才能获得较高的产量和品质。2015年由于在座果期遭到恶劣气候影响, 产量整体下降。与对照相比, 2014年N3处理可以显著增加单株产量而2015年N2处理时增产显著, 这可能与肥料的年度间积累和树体氮贮藏营养的积累有关[16]。氮素营养状况的好坏, 直接影响植物光合作用速率和生长发育, 并最终影响产量与品质[17]。研究发现, 氮施用量在450 kg·hm-2能提高红富士苹果叶片光合速率, 促进光合作用, 有助于产量的形成, 氮素过量使果实着色面积、可溶性固形物显著下降[18]。因此可通过调控梨树氮素的营养状况, 最小化产量和品质之间的负相关关系。本研究发现N2处理下, 成熟期果实的可溶性糖含量最高, 高氮处理下反而品质降低, 这与彭福田[19]在苹果和陈磊等[20]在丰水梨上的试验结论一致。随着施氮量的增加, 叶片氮含量也增加, 而叶片和果实的山梨醇含量先增加后降低。果实中山梨醇含量的变化与可溶性糖含量的变化趋势基本一致。这表明, 适量施氮能提高果实可溶性糖含量, 过量施氮后可溶性糖含量有所下降。这可能是过量施氮后导致氮代谢旺盛, 消耗了更多的碳骨架和还原力, 降低了植物同化速率, 影响光合产物输出, 最终使果实中糖含量降低[21]。
果实品质的形成在很大程度上取决于果实中可溶性糖含量, 而山梨醇是梨叶片中优势积累的碳水化合物, 通过韧皮部运输进入果实。有证据表明苹果在光照条件下山梨醇占新固定的碳水化合物80%之多[22], 山梨醇中约有60%~90%的碳来自叶片。叶片中碳水化合物浓度和含量的变化与梨树源库间生长中心的转移有关[23], 前期叶片是营养生长的中心, 碳代谢过程中碳水化合物的合成和积累都主要发生在叶片中, 而在果实的膨大期, 大量碳水化合物向果实中转运和积累。研究表明, 适量施氮能提高叶片中6-磷酸山梨醇脱氢酶的活性, 在膨大Ⅱ期N2处理与N0处理相比提高了S6PDH的活性, 促进了梨叶片中山梨醇的大量合成。合成的山梨醇一部分用于叶片自身代谢, 另一部分转运到果实[22]。这可能是膨大Ⅱ期梨果中N2处理山梨醇含量显著高于N0处理含量的原因之一。幼果期N2处理NAD-SDH活性最高, 此时叶片自身形态建成不完善[24], 较高的NAD-SDH活性能促进山梨醇的分解, 形成的单糖用于自身代谢和形态建成, 加速叶片的成熟。
实际上, 环境条件的改变产生的影响, 常常是通过调控相关基因的表达来实现的。叶片中山梨醇代谢关键酶S6PDH基因在整个生育期中都在N2处理下相对表达量最高, 且膨大期N2处理叶片中山梨醇含量也最高, 说明S6PDH的表达有助于山梨醇的合成[25]。膨大期N2处理叶片中NAD-SDH3的相对表达量显著高于其他处理, 与叶片中NAD-SDH活性趋势一致, 而成熟期时N1处理NAD-SDH3相对表达量最高, N3处理下酶活性最高, 这种不一致可能是因为成熟期NAD-SDH的活性受其他酶或NAD-SDH的同工酶调控[26]。果实中NAD-SDH3前期相对表达量低后期急剧表达, 这与Kim等[27]的研究结果一致, 这说明果实中山梨醇在果实发育前期可能主要用于合成和储存, 成熟期大量分解积累果糖。在成熟期N2处理NAD-SDH3相对表达量最高, 进而促进了山梨醇向果糖的分解, 有利于果实的品质形成。
对我国梨园施肥现状调查中发现, 目前梨树上的施肥仍处于“盲目施肥”“经验施肥”状态, 较多梨园单株施氮量在1 kg以上[28]。本研究结果表明, N2处理有利于协调叶片和果实中的山梨醇代谢, 显著提高了成熟期S6PDH和NAD-SDH3基因的表达, 提高成熟期果实糖含量, 果实品质表现较好, 建议棚架式栽培梨果的纯氮施用量为330 kg·hm-2。
| [1] |
顾曼如, 张若杼, 束怀瑞, 等. 苹果氮素营养研究初报——植株中氮素营养的年周期变化特性[J].
园艺学报, 1981, 8(4): 21–28.
Gu M R, Zhang R Z, Shu H R, et al. A study on the nitrogen nutrition of apple tree:the variation of nitrogen nutrition within the plant in a year's cycle[J]. Acta Horticulturae Sinica, 1981, 8(4): 21–28. (in Chinese) |
| [2] |
刘长虹, 韩明玉, 张立新. 初夏施肥对渭北旱塬红富士苹果生长、产量及品质的影响[J].
干旱地区农业研究, 2008, 26(1): 62–66.
Liu C H, Han M Y, Zhang L X. The effects of fertilizer application at early summer on growth, yield and quality of Fuji apple in Weibei Highland[J]. Agricultural Research in the Arid Areas, 2008, 26(1): 62–66. (in Chinese) |
| [3] |
彭福田, 姜远茂, 顾曼如, 等. 不同负荷水平下氮素对苹果果实生长发育的影响[J].
中国农业科学, 2002, 35(6): 690–694.
Peng F T, Jiang Y M, Gu M R, et al. Effect of nitrogen on apple fruit development in different load[J]. Scientia Agricultura Sinica, 2002, 35(6): 690–694. (in Chinese) |
| [4] |
魏树伟, 李喆, 刘斌, 等. 不同树形丰水梨的生长和果实品质调查[J].
落叶果树, 2012, 44(5): 15–17.
Wei S W, Li Z, Liu B, et al. Investigation on the growth and fruit quality of pear trees with different tree forms[J]. Deciduous Fruits, 2012, 44(5): 15–17. (in Chinese) |
| [5] |
张绍铃, 伍涛. 我国棚架梨生产现状与栽培技术探讨[J].
中国南方果树, 2010, 39(5): 82–84.
Zhang S L, Wu T. The discussion of China's trellis trained pear current situation and cultivation techniques[J]. South China Fruits, 2010, 39(5): 82–84. (in Chinese) |
| [6] |
张乃文, 董彩霞, 徐阳春. 梨树修剪枝和果实从树体移走的养分研究[J].
南京农业大学学报, 2013, 36(4): 37–42.
Zhang N W, Dong C X, Xu Y C. Nutrient amounts removed by the pruning branches and the fruit harvest from the pear tree[J]. Journal of Nanjing Agricultural University, 2013, 36(4): 37–42. DOI: 10.7685/j.issn.1000-2030.2013.04.007 (in Chinese) |
| [7] | Grant C R, Rees T A. Sorbitol metabolism by apple seedlings[J]. Phytochemistry, 1981, 20(7): 1505–1511. DOI: 10.1016/S0031-9422(00)98521-2 |
| [8] |
梁东, 马锋旺, 管清美, 等. 蔷薇科植物中山梨醇代谢酶的研究进展[J].
西北植物学报, 2004, 24(7): 1362–1366.
Liang D, Ma F W, Guan Q M, et al. Advances in the research of enzymes related to sorbitol metabol ism in plants of rosaceae[J]. Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(7): 1362–1366. (in Chinese) |
| [9] |
李合生.
植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2003.
Li H S. Experimental Principle and Technology on Plant Physiology and Biochemistry[M]. Beijing: Higher Education Press, 2003. (in Chinese) |
| [10] |
宋晓晖, 谢凯, 李艳丽, 等. HPLC-ELSD法测定梨果实中不同种类可溶性糖含量[J].
南京农业大学学报, 2012, 35(2): 87–91.
Song X H, Xie K, Li Y L, et al. Determination of contents and components of water-soluble sugar in pear fruit by HPLC-ELSD[J]. Journal of Nanjing Agricultural University, 2012, 35(2): 87–91. DOI: 10.7685/j.issn.1000-2030.2012.02.015 (in Chinese) |
| [11] | Ito A, Hayama H, Kashimura Y. Partial cloning and expression analysis of genes encoding NAD+-dependent sorbitol dehydrogenase in pear bud during flower bud formation[J]. Scientia Horticulturae, 2005, 103(4): 413–420. DOI: 10.1016/j.scienta.2004.07.006 |
| [12] | Loescher W H, Marlow G C, Kennedy R A. Sorbitol metabolism and sink-source interconversions in developing apple leaves[J]. Plant Physiology, 1982, 70(2): 335–339. DOI: 10.1104/pp.70.2.335 |
| [13] | Gasic K, Hernandez A, Korban S S. RNA extraction from different apple tissues rich in polyphenols and polysaccharides for cDNA library construction[J]. Plant Molecular Biology Reporter, 2004, 22(4): 437–438. DOI: 10.1007/BF02772687 |
| [14] | Liu D, Ni J, Wu R, et al. High temperature alters sorbitol metabolism in Pyrus pyrifolia leaves and fruit flesh during late stages of fruit enlargement[J]. Journal of the American Society for Horticultural Science, 2013, 138(6): 443–451. |
| [15] | Yu B, Zhang D, Huang C, et al. Isolation of anthocyanin biosynthetic genes in red Chinese sand pear (Pyrus pyrifolia Nakai) and their expression as affected by organ/tissue, cultivar, bagging and fruit side[J]. Scientia Horticulturae, 2012, 136(2): 29–37. |
| [16] |
张彦昌, 赵德英. 果树氮素贮藏营养研究进展[J].
山西农业科学, 2009, 37(1): 88–91.
Zhang Y C, Zhao D Y. Advanced research on nitrogen storage in fruit trees[J]. Journal of Shanxi Agricultural Sciences, 2009, 37(1): 88–91. (in Chinese) |
| [17] |
李晶. 供氮水平等对中间砧苹果碳氮营养利用、分配特性影响的研究[D]. 泰安: 山东农业大学, 2013.
Li J. Effects of different nitrogen levels on carbon and nitrogen nutrition utilization and allocation on interstock apple tree[D]. Tai'an:Shandong Agricultural University, 2013(in Chinese with English abstract). |
| [18] |
冯焕德, 李丙智, 张林森, 等. 不同施氮量对红富士苹果品质、光合作用和叶片元素含量的影响[J].
西北农业学报, 2008, 17(1): 229–232.
Feng H D, Li B Z, Zhang L S, et al. Influences of different rates of nitrogen on fruit quality, photosynthesis and element contents in leaves of red Fuji apples[J]. Acta Agriculture Boreali-Occidentalis Sinica, 2008, 17(1): 229–232. (in Chinese) |
| [19] |
彭福田. 氮素对苹果果实发育与产量、品质的调控[D]. 泰安: 山东农业大学, 2001.
Peng F T. Regulation of nitrogen to apple fruit development, yield and quality[D]. Tai'an:Shandong Agricultural University, 2001(in Chinese with English abstract). |
| [20] |
陈磊, 伍涛, 张绍铃, 等. 丰水梨不同施氮量对果实品质形成及叶片生理特性的影响[J].
果树学报, 2010, 27(6): 871–876.
Chen L, Wu T, Zhang S L, et al. Effects of nitrogen fertilizer on fruit quality and leaf physiological metabolism of Hosui pear[J]. Journal of Fruit Science, 2010, 27(6): 871–876. (in Chinese) |
| [21] |
曹翠玲, 李生秀, 苗芳. 氮素对植物某些生理生化过程影响的研究进展[J].
西北农业大学学报, 1999, 27(4): 96–101.
Cao C L, Li S X, Miao F. The research situation about effects of nitrogen on certain physiological and biochemical process in plants[J]. Acta Universitatis Agriculturalis Boreali-Occidentalis, 1999, 27(4): 96–101. (in Chinese) |
| [22] | Yamaki S. Metabolism and accumulation of sugars translocated to fruit and their regulation[J]. Journal of the Japanese Society for Horticultural Science, 2010, 79(1): 1–15. DOI: 10.2503/jjshs1.79.1 |
| [23] | Loescher W H. Physiology and metabolism of sugar alcohols in higher plants[J]. Physiologia Plantarum, 1987, 70(3): 553–557. DOI: 10.1111/ppl.1987.70.issue-3 |
| [24] |
许让伟. 砂梨果实和叶片中糖积累及代谢相关酶活性变化研究[D]. 武汉: 华中农业大学, 2009.
Xu R W. Studies on changes of sugar accumulation and related enzymes activities in sand pear fruits and leaves[D]. Wuhan:Huazhong Agricultural University, 2009(in Chinese with English abstract). |
| [25] | Tao R, Uratsu S L, Dandekar A M. Sorbitol synthesis in transgenic tobacco with apple cDNA encoding NADP-dependent sorbitol-6-phosphate dehydrogenase[J]. Plant Cell Physiol, 1995, 36(3): 525–532. DOI: 10.1093/oxfordjournals.pcp.a078789 |
| [26] | Yamaguchi H. Changes in the amounts of NAD+-dependent sorbitol dehydrogenase and its involvement in the development of apple fruit[J]. American Society for Horticultural Science, 1996, 121(5): 848–852. |
| [27] | Kim H Y, Ahn J C, Choi J H, et al. Expression and cloning of the full-length cDNA for sorbitol-6-phosphate dehydrogenase and NAD-dependent sorbitol dehydrogenase from pear (Pyrus pyrifolia N.)[J]. Scientia Horticulturae, 2007, 112(4): 406–412. DOI: 10.1016/j.scienta.2007.01.015 |
| [28] |
董彩霞, 姜海波, 赵静文, 等. 我国主要梨园施肥现状分析[J].
土壤, 2012, 44(5): 754–761.
Dong C X, Jiang H B, Zhao J W, et al. Current fertilization in pear orchards in China[J]. Soils, 2012, 44(5): 754–761. (in Chinese) |




