文章信息
- 纪红军, 胡进, 肖成, 牛亚茹, 徐银学
- JI Hongjun, HU Jin, XIAO Cheng, NIU Yaru, XU Yinxue
- 下调DKK2表达对小鼠子宫内膜基质细胞增殖和凋亡的影响
- Effects of DKK2 down-regulation on the proliferation and apoptosis of mouse endometrial stromal cells
- 南京农业大学学报, 2017, 40(1): 138-144
- Journal of Nanjing Agricultural University(Social Science), 2017, 40(1): 138-144.
- http://dx.doi.org/10.7685/jnau.201512012
-
文章历史
- 收稿日期: 2015-12-10
哺乳动物Dickkopf基因(DKK)能编码一类细胞外信号分子,控制着胚胎发育和调节组织内稳态[1-2]。DKK由4名成员组成,DKK 1~DKK4 ,它们分泌的蛋白对Wnt/β-catenin信号通路有拮抗作用[2-5]。经典Wnt/β-catenin信号通路的基本过程是:在辅助受体LRP5/LRP6(LDL receptor related protein5/6) 协同作用下,分泌性frizzled相关蛋白(SFRPs)竞争性地同Wnt配体蛋白结合,切断β-catenin的降解途径从而使β-catenin在细胞质中稳定的积累。转移到细胞核的β-catenin与核内转录因子TCF/LEF结合,激活下游靶基因cyclin D 1 、c-myc等,从而调节细胞的增殖、凋亡和分化[6]。
DKK2是一种分泌蛋白,通常被认为是与FZD(Frizzled)的辅助受体LRP5/LRP6结合直接抑制Wnt信号,通过下游靶基因影响细胞的增殖、凋亡和分化[7-9]。RNA干扰是目前广泛使用的基因阻断技术,它通过把与目的基因mRNA序列同源的双链RNA分子导入细胞达到基因沉默,具有高度的特异性。我们的前期研究发现玉米赤霉烯酮在引起细胞凋亡的同时会导致DKK 2 表达量显著下降,DKK 2 的表达下降是否影响细胞的增殖和凋亡,目前还不清楚。因此,我们采用RNA干扰小鼠子宫内膜基质细胞DKK 2 基因,研究其对小鼠子宫内膜基质细胞增殖和凋亡的影响。
1 材料与方法 1.1 试验材料 1.1.1 试验动物3~4周龄雌性昆明小白鼠,购自南京青龙山实验动物中心。
1.1.2 主要仪器CO2培养箱,全波长酶标仪(Thermo,America),荧光倒置显微镜(Leica,Germany),流式细胞仪(BD FACSCautoTM),实时荧光定量PCR仪(ABI7400 System,America),超净工作台(上海博讯实业有限公司医疗设备厂),LAS-4000凝胶成像系统(FUJIFILM,日本)。
1.1.3 主要试剂Ⅰ型胶原酶,2.5 g ·L-1胰酶,孕马血清促性腺激素(PMSG)、LipofectamineTM 2000(Invitrogen),DMEM/F12(1:1) (Hyclone),胎牛血清(Gibco),Caspase3检测试剂盒、CCK8检测试剂盒(上海碧云天生物有限公司),Annexin-V FITC/PI细胞凋亡检测试剂盒(南京诺维赞生物技术有限公司),DKK2抗体(R&D Systems),siRNA(上海吉玛生物有限公司)。
1.2 试验方法 1.2.1 原代小鼠子宫内膜基质细胞的制备与纯化采用颈部脱臼处死小鼠,迅速无菌取出子宫,放入培养皿中去除子宫周围脂肪组织,然后用PBS冲洗去除血渍,随后在另一培养皿中沿子宫长轴剖开,切成3~5 mm片段。用预冷(4 ℃)PBS冲洗完之后放入15 mL离心管中,加入4 mL预冷(4 ℃)2.5 g ·L-1的胰酶。4 ℃消化1 h,室温消化1 h,消化时每隔5 min振荡1次。用含10%胎牛血清的培养基终止胰酶消化,轻轻吹打3 min,再静置1 min,随后加入4 mL PBS,反复吹打后去除子宫内膜上皮细胞。加入5 g ·L-1 Ⅰ型胶原酶37 ℃消化1 h,结束后立即用含10%胎牛血清的PBS稀释,清洗2次后反复吹打组织直至上清液出现浑浊,500 r·min-1离心5 min,然后将上清液转入另一干净的15 mL离心管中,1 000 r·min-1离心5 min后取沉淀,最后以1×106 mL-1的细胞浓度接种于6孔板。放置在37 ℃、5% CO2饱和湿度条件下培养2 h后移除未贴壁的杂细胞。
1.2.2 siRNA的设计合成根据siRNA设计原则合成针对小鼠DKK 2 基因的3条干扰序列和1条Scrambled阴性对照,另外购买1条FAM荧光标记通用阴性对照(上海吉玛生物有限公司)。siRNA1序列(正义/反义链):5′-GGGCCAAACUCAACUCCAUTT-3′/5′-AUGGAGUUGAGUUUGGCCCTT-3′;siRNA2序列:5′-GCAAUAAUGGAAUCUGCAUTT-3′/5′-AUGCAGAUUCCAUUAUUGCTT-3′;siRNA3序列:5′-GGACAUGAAGGAGACCCAUTT-3′/5′-AUGGGUCUCCUUCAUGUCCTT-3′。Scrambled阴性对照与选中的siRNA序列有相同的组成,但是和mRNA没有明显的同源性,FAM荧光标记的阴性对照与哺乳动物基因无同源性。
1.2.3 细胞转染原代小鼠子宫内膜基质细胞用含10%胎牛血清的DMEM/F12(1:1) 培养基置于37 ℃、5% CO2饱和湿度条件下培养,待细胞密度达到70%~90%时开始转染。转染前移除原来的培养基并用不含胎牛血清和抗生素的DMEM/F12(1:1) 培养基清洗2次细胞,然后加入1.5 mL不含胎牛血清和抗生素的DMEM/F12(1:1) 培养基。试验分为3组:空白对照组(不加转染试剂和siRNA)、阴性对照组(加转染试剂和阴性对照siRNA)、siRNA干扰组(加转染试剂和siRNA1、siRNA2、siRNA3) ,每组设置3个平行孔。转染操作按照LipofectamineTM 2000说明书进行。转染6 h后,更换为含10%胎牛血清的DMEM/F12(1:1) 培养基继续培养。
1.2.4 RT-qPCR法检测转染siRNA后DKK 2 mRNA的表达转染后24 h收集细胞,按照Trizol试剂(Invitrogen)说明书提取总RNA,然后根据RT试剂盒(诺维赞)说明反转录合成cDNA。实时定量PCR(qPCR)反应条件完全参照诺维赞qPCR(High ROX Premixed)试剂盒进行。引物从PrimerBank网站筛选(表 1)。以GAPDH作为对照,通过CT值进行数据分析,筛选出抑制效率最高的1条siRNA用于后续试验。
1.2.5 RT-qPCR法检测凋亡相关基因mRNA的表达用筛选抑制效率最高的1条siRNA转染原代小鼠子宫内膜基质细胞后24 h收集细胞,按照Trizol试剂说明书提取总RNA,然后根据RT试剂盒反转录合成cDNA。qPCR反应条件完全参照诺维赞qPCR试剂盒进行。引物从PrimerBank网站筛选(表 1)。以GAPDH作为对照,通过CT值进行数据分析,检测抑制DKK 2 基因后一些与凋亡相关基因(mRNA)表达水平的变化。
| 基因名称Gene name | 引物对序列(5′→3′)Sequences of primer pairs |
| DKK2 | CTGATGCGGGTCAAGGATTCA/CTCCCCTCCTAGAGAGGACTT |
| GAPDH | AGGTCGGTGTGAACGGATTTG/TGTAGACCATGTAGTTGAGGTCA |
| Bax | TGAAGACAGGGGCCTTTTTG/AATTCGCCGGAGACACTCG |
| Bcl-2 | ACGTGGACCTCATGGAGTG/TGTGTATAGCAATCCCAGGCA |
| Caspase3 | ACAGCACCTGGTTACTATTC/CAGTTCTTTCGTGAGCAT |
用96孔板处理细胞,每孔加入100 μL细胞悬液,每组设6个平行孔。在细胞培养箱培养24 h后,按上述转染方法转染siRNA,6 h后换含8%胎牛血清的正常培养基培养,分别在转染0、12、24、48和72 h后每孔加入10 μL的CCK8溶液。空白组为加入等量培养液和CCK8溶液,但未加入细胞。将96孔板放在培养箱中孵育90 min,用酶标仪在450 nm处测各组吸光值(A450)。
1.2.7 Caspase3活性分析6孔板接种细胞,转染siRNA 24 h后,吸取细胞培养液,备用。用胰酶消化贴壁细胞,并收集至备用的细胞培养液中。600 g、4 ℃离心5 min收集细胞,吸除上清液,PBS洗涤2次。每孔加入200 μL裂解液,重悬细胞,冰浴裂解15 min。4 ℃、12 000 g离心20 min,取上清液转移至经过预冷的EP管中,Bradford法测定蛋白浓度。按照Caspase3活性测定试剂盒测定Caspase3的活性。酶标仪测定样品吸光值(A405)。样品中Caspase3催化βNA产生的吸光值=样品A405值-空白对照A405值。
1.2.8 流式细胞术分析细胞凋亡率用Annexin-V FITC/PI双染法检测细胞凋亡。6孔板处理细胞,每孔接种1×106个细胞,每组设置3个平行孔。转染48 h后胰酶消化收集各组细胞,PBS缓冲液洗涤2次,1 000 r·min-1离心5 min。加入100 μL 1×Binding Buffer重悬细胞,分别加入5 μL Annexin V-FITC和5 μL PI转染液,轻轻混匀。避光、室温反应10 min,然后加入400 μL 1×Binding Buffer,混匀,样品在1 h内用流式细胞仪检测。
1.3 数据分析所有数据采用SPSS 20.0统计学软件进行处理,数据用平均数±标准差(x±SD)表示,2组数据之间比较采用t测验。
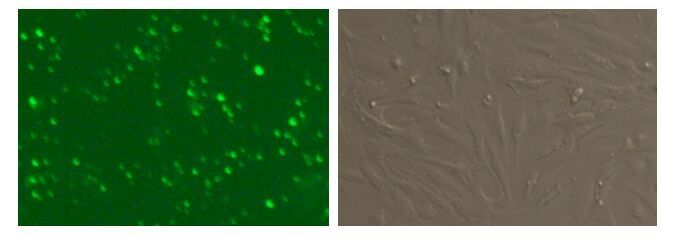
2 结果与分析 2.1 转染阴性对照FAM-siRNA观察转染效率用FAM荧光标记的siRNA作为阴性对照转染小鼠子宫内膜基质细胞6 h后,在荧光倒置显微镜下观察。明场下记录视野细胞数,同一视野在蓝光下观察被转染细胞呈圆形、绿色,记录细胞数(图 1)。
|
图 1 FAM-siRNA转染小鼠子宫内膜基质细胞6 h后的观察(×200) Figure 1 Expression of FAM after FAM-siRNA being transfected into mice endometrial stromal cell at 6 h A:FAM荧光标记FAM-fluorescence light;B:普通光线Common light |
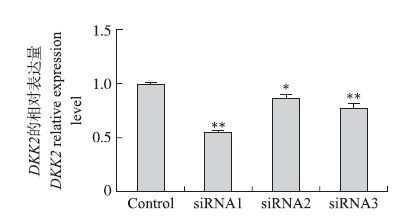
用siRNA转染原代小鼠子宫内膜基质细胞24 h后,以管家基因GAPDH为对照,对DKK 2 基因进行定量分析。结果显示:处理组与对照组相比,转染的siRNA能引起DKK 2 基因mRNA表达量下调,处理组siRNA1、siRNA2、siRNA3对DKK 2 基因的抑制率分别为45.2%(P<0.01) 、13.2%(P<0.05) 、23.2%(P<0.01) (图 2)。其中siRNA1抑制效果最明显,用于后续试验。
|
图 2 siRNA转染小鼠子宫内膜基质细胞24 h后对DKK 2 基因mRNA相对表达量的影响 Figure 2 The effects of siRNA transfection on relative expression level of DKK 2 mRNA in mice endometrial stromal cells at 24 h *P<0.05,* *P<0.01. The same as follows. |
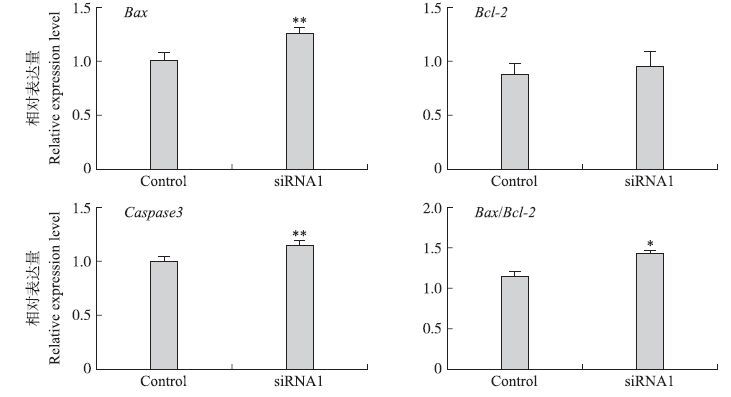
用siRNA1转染原代小鼠子宫内膜基质细胞24 h,分别收集各组细胞并提取总RNA,然后根据诺维赞反转录试剂盒反转成cDNA,RT-qPCR检测Caspase 3、Bcl-2 、Bax mRNA的表达水平。结果(图 3)显示:处理组与对照组相比,转染siRNA1的细胞Caspase 3 和Bax mRNA表达量均极显著上调(P<0.01) ;Bcl- 2 mRNA表达量与对照组相比没有明显变化(P>0.05) ;处理组与对照组相比Bax/Bcl- 2 的相对表达量显著上调(P<0.05) 。
|
图 3 siRNA1转染小鼠子宫内膜基质细胞对凋亡相关基因表达的影响 Figure 3 The effects of siRNA1 transfection on apoptosis related gene expression in mice endometrial stromal cells |
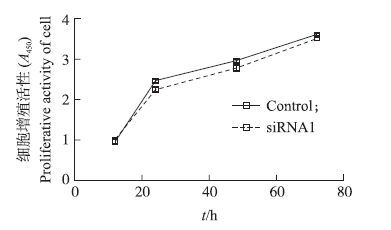
为了研究干扰DKK 2 基因后是否对细胞增殖产生影响,我们用CCK8试剂盒检测转染siRNA1后细胞的增殖活性。结果显示:与对照组相比,用siRNA1转染基质细胞24和48 h后细胞增殖活性受到显著抑制(P<0.05) ,72 h时已无明显差异(P>0.05) 。根据CKK8处理基质细胞后检测的吸光值绘制细胞生长曲线(图 4),由生长曲线可知转染siRNA1后细胞生长速度较对照组明显下降。表明干扰DKK 2 基因表达可明显抑制小鼠子宫内膜基质细胞的增殖活性。
|
图 4 CCK8检测siRNA1对小鼠子宫内膜基质细胞增殖的影响 Figure 4 The effect of siRNA1 on the proliferation of mice endometrial stromal cells by CCK8 |
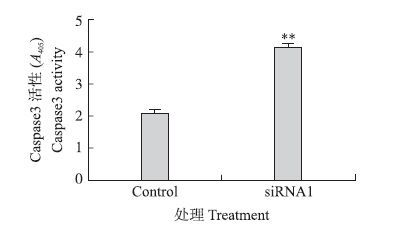
为了进一步验证干扰DKK 2 基因后细胞Caspase3活性变化,我们用Caspase3活性试剂盒检测转染的细胞,发现用siRNA1转染原代小鼠子宫内膜基质细胞24 h后,与阴性对照相比,转染siRNA1能极显著上调Caspase3活性(P<0.01) (图 5)。
|
图 5 转染siRNA1后Caspase3活性分析 Figure 5 The effect of siRNA1 transfection on the Caspase3 activity of mice endometrial stromal cells |
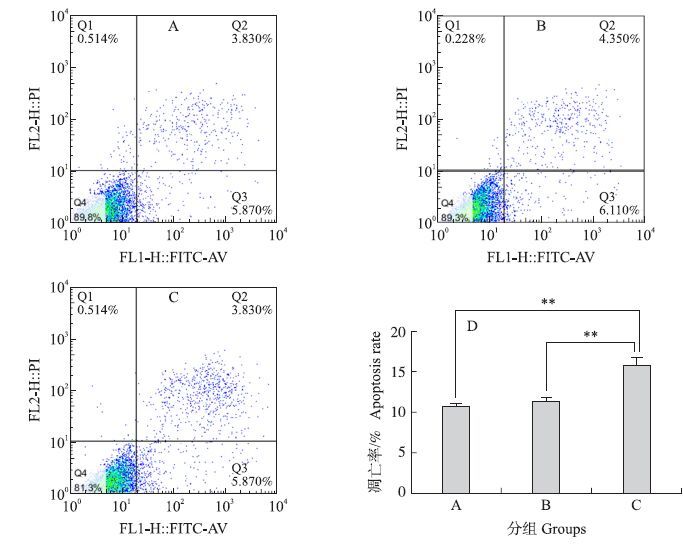
为了进一步验证转染siRNA1对细胞凋亡的影响,siRNA1转染原代小鼠子宫内膜基因细胞24 h后收集各组细胞,用流式细胞仪Annexin-V FITC/PI双染法检测细胞凋亡率。结果发现:转染siRNA1组细胞凋亡率为18.5%(图 6),空白对照组和阴性对照组细胞凋亡率分别为9.7%和10.5%。转染siRNA1的细胞比空白和阴性对照组凋亡率均极显著增加(P<0.01) ,而空白组与阴性对照组间没有明显变化(P>0.05) 。
|
图 6 流式细胞仪检测转染siRNA1后的细胞凋亡 Figure 6 The effect of siRNA1 on apoptosis of mice endometrial stromal cells by FCM A:空白对照组Blank control;B:阴性对照组Negative control;C:siRNA1 |
Wnt信号通路是生物体内一条极其保守的信号转导通路,参与调节胚胎的种植和发育,对细胞的增殖、分化和凋亡也有重要作用[10]。DKK蛋白是一种分泌型糖蛋白,被认为是Wnt信号通路的抑制剂,对胚胎的种植和骨生长有重要作用,其中DKK2在介导子宫内膜容受性方面发挥着极其重要作用[11-12]。RNA干扰(RNA interference,RNAi)是目前广泛使用的基因阻断技术,它通过把与目的基因mRNA序列同源的双链RNA分子导入细胞达到沉默特定基因。RNAi具有稳定性好、特异性强、作用持久等优点,是近年来发展起来的转录后基因阻断技术,已广泛应用于基因功能的研究。
在本试验中,以小鼠子宫内膜基质细胞中DKK2蛋白为研究对象,通过RNAi的方法敲减DKK2的表达。我们前期研究发现:用玉米赤霉烯酮处理过的小鼠子宫内膜基质细胞,其凋亡率明显增加,DKK 2 mRNA表达量明显下调。由此推断,阻断DKK2信号转导可能会影响细胞的增殖和凋亡。本试验采用前期筛选的siRNA沉默DKK 2 基因,用CCK8检测小鼠子宫内膜基质细胞增殖的变化,发现24和48 h siRNA1处理组增殖活力受到抑制,细胞生长速度明显变慢。而72 h时处理组与对照组无明显差异,可能与siRNA为瞬时沉默靶基因,持续时间短有关。
我们用siRNA1沉默DKK 2 基因24 h后,流式细胞仪检测发现,细胞凋亡率明显升高,表明siRNA1沉默DKK 2 后可以诱导小鼠子宫内膜基质细胞凋亡。通过RT-qPCR检测发现与细胞凋亡相关的一些基因Caspase 3 、Bax mRNA水平明显上调,Bcl- 2 mRNA无明显变化,而Bax/Bcl- 2 值明显上调。Jung等[13]研究发现,在NSCLC H460细胞系中敲除DKK 3基因,p53、p21 和Bax明显上调,细胞增殖受到抑制,凋亡率明显增加。而Hirata等[14]研究发现在RCC细胞系中过表达DKK 2 基因导致与细胞凋亡相关的一些基因表达发生改变,其中Bax基因表达略微上调,Bcl- 2基因表达明显下调,但是Caspase3基因表达则无明显变化。在本研究中我们发现干扰DKK2后Caspase3 的表达量明显升高。细胞凋亡的一个主要途径是依赖Caspase的途径[15],在这个途径中Caspase3是引起细胞凋亡的最下游分子,是细胞凋亡信号转导途径中关键的效应分子[16]。为了进一步测定细胞凋亡活性,我们检测了细胞中Caspase3的活性,结果发现干扰DKK 2 后,细胞中Caspase3活性明显增强。Caspase3活性的升高不仅说明细胞凋亡的发生,而且还表明细胞凋亡的发生与Caspase途径有关。另外,Bcl-2/Bax通路也参与细胞凋亡,它们的相对水平决定着细胞的命运[17-19],其中Bcl-2是一种抗凋亡蛋白,与细胞凋亡密切相关[20]。本试验中我们还发现,干扰DKK 2后,Bax/Bcl-2值也明显上调,其中Bax明显上调,具有抗凋亡作用的Bcl-2 则没有明显变化。Sakinah等[21]研究认为Bax/Bcl- 2 值是调控细胞凋亡的关键,Bax和Bcl-2通过形成同源或异源二聚体来调节细胞。Bcl-2家族蛋白是在细胞凋亡过程中起重要作用的一类蛋白,细胞内Bax含量升高能拮抗Bcl-2的抗凋亡作用,Bax与Bcl-2形成的同源二聚体增多从而诱导细胞凋亡;当Bax与Bcl-2形成异源二聚体时,Bcl-2抗凋亡作用增强从而抑制细胞凋亡,细胞的凋亡是由Bcl-2和Bax两种因子平衡的结果[22]。Bax蛋白作为线粒体膜上离子通道的组成成分,它能够使细胞色素C穿过线粒体膜激活Caspase9,进一步激活Caspase3诱导细胞凋亡[23-26]。但DKK 2基因沉默通过何种途径影响Bax、Bcl-2和Caspase3 表达的具体机制仍不清楚。
综上所述,采用RNA干扰技术,将针对DKK 2 基因的siRNA转入原代小鼠子宫内膜基质细胞不仅能够抑制小鼠子宫内膜细胞的增殖,而且还能通过上调Caspase 3 和Bax的表达促进细胞凋亡。
| [1] | Glinka A, Wu W, Delius H, et al. Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction[J]. Nature, 1998,391(6665): 357–362. DOI: 10.1038/34848 |
| [2] | Krupnik V E, Sharp J D, Jiang C, et al. Functional and structural diversity of the human Dickkopf gene family[J]. Gene, 1999,238(2): 301–313. DOI: 10.1016/S0378-1119(99)00365-0 |
| [3] | He X, Semenov M, Tamai K, et al. LDL receptor-related proteins 5 and 6 in Wnt/β-catenin signaling:arrows point the way[J]. Development, 2004,131(8): 1663–1677. DOI: 10.1242/dev.01117 |
| [4] | Mao B, Niehrs C. Kremen modulates Dickkopf2 activity during Wnt/LRP6 signaling[J]. Gene, 2003,302(1): 179–183. |
| [5] | Lee E J, Jo M, Rho S B, et al. Dkk3,downregulated in cervical cancer,functions as a negative regulator of β-catenin[J]. International Journal of Cancer, 2009,124(2): 287–297. DOI: 10.1002/ijc.v124:2 |
| [6] | Sun Z, Li S, Cao C, et al. shRNA targeting SFRP2 promotes the apoptosis of hypertrophic scar fibroblast[J]. Molecular and Cellular Biochemistry, 2011,352(1/2): 25–33. |
| [7] | Niehrs C. Function and biological roles of the Dickkopf family of Wnt modulators[J]. Oncogene, 2006,25(57): 7469–7481. DOI: 10.1038/sj.onc.1210054 |
| [8] | Kuphal S, Lodermeyer S, Bataille F, et al. Expression of Dickkopf genes is strongly reduced in malignant melanoma[J]. Oncogene, 2006,25(36): 5027–5036. DOI: 10.1038/sj.onc.1209508 |
| [9] | Hoang B H, Kubo T, Healey J H, et al. Dickkopf 3 inhibits invasion and motility of Saos-2 osteosarcoma cells by modulating the Wnt-β-catenin pathway[J]. Cancer Research, 2004,64(8): 2734–2739. DOI: 10.1158/0008-5472.CAN-03-1952 |
| [10] | Kawano Y, Kypta R. Secreted antagonists of the Wnt signalling pathway[J]. Journal of Cell Science, 2003,116(13): 2627–2634. DOI: 10.1242/jcs.00623 |
| [11] | Chen L, Wang K, Shao Y, et al. Structural insight into the mechanisms of Wnt signaling antagonism by Dkk[J]. Journal of Biological Chemistry, 2008,283(34): 23364–23370. DOI: 10.1074/jbc.M802375200 |
| [12] | Zhang Y, Peng S, Kuang H, et al. Expression and regulation of Dickkopf 2 during periimplantation in mice[J]. Journal of Reproduction and Development, 2009,55(1): 17–22. DOI: 10.1262/jrd.20043 |
| [13] | Jung I L, Kang H J, Kim K C, et al. Knockdown of the Dickkopf 3 gene induces apoptosis in a lung adenocarcinoma[J]. International Journal of Molecular Medicine, 2010,26(1): 33–38. |
| [14] | Hirata H, Hinoda Y, Nakajima K, et al. Wnt antagonist gene DKK2 is epigenetically silenced and inhibits renal cancer progression through apoptotic and cell cycle pathways[J]. Clinical Cancer Research, 2009,15(18): 5678–5687. DOI: 10.1158/1078-0432.CCR-09-0558 |
| [15] | Tait S W G, Green D R. Caspase-independent cell death:leaving the set without the final cut[J]. Oncogene, 2008,27(50): 6452–6461. DOI: 10.1038/onc.2008.311 |
| [16] | LeBlanc A C. Natural cellular inhibitors of caspases[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2003,27(2): 215–229. DOI: 10.1016/S0278-5846(03)00017-4 |
| [17] | Butt A J, Firth S M, King M A, et al. Insulin-like growth factor-binding protein-3 modulates expression of Bax and Bcl-2 and potentiates p53-independent radiation-induced apoptosis in human breast cancer cells[J]. Journal of Biological Chemistry, 2000,275(50): 39174–39181. DOI: 10.1074/jbc.M908888199 |
| [18] | Parker J E, Mufti G J, Rasool F, et al. The role of apoptosis,proliferation,and the Bcl-2-related proteins in the myelodysplastic syndromes and acute myeloid leukemia secondary to MDS[J]. Blood, 2000,96(12): 3932–3938. |
| [19] | Yang B, Johnson T S, Thomas G L, et al. Expression of apoptosis-related genes and proteins in experimental chronic renal scarring[J]. Journal of the American Society of Nephrology, 2001,12(2): 275–288. |
| [20] | Zinkel S, Gross A, Yang E. BCL2 family in DNA damage and cell cycle control[J]. Cell Death and Differentiation, 2006,13(8): 1351–1359. DOI: 10.1038/sj.cdd.4401987 |
| [21] | Sakinah S A, Handayani S T, Hawariah L P. Zerumbone induced apoptosis in liver cancer cells via modulation of Bax/Bcl-2 ratio[J]. Cancer Cell International, 2007,7(4): 1–11. |
| [22] | Huang Q, Bu S, Yu Y, et al. Diazoxide prevents diabetes through inhibiting pancreatic β-cells from apoptosis via Bcl-2/Bax rate and p38-β mitogen-activated protein kinase[J]. Endocrinology, 2007,148(1): 81–91. DOI: 10.1210/en.2006-0738 |
| [23] | Schon E A, Manfredi G. Neuronal degeneration and mitochondrial dysfunction[J]. Journal of Clinical Investigation, 2003,111(3): 303. DOI: 10.1172/JCI200317741 |
| [24] | Eskes R, Desagher S, Antonsson B, et al. Bid induces the oligomerization and insertion of Bax into the outer mitochondrial membrane[J]. Molecular and Cellular Biology, 2000,20(3): 929–935. DOI: 10.1128/MCB.20.3.929-935.2000 |
| [25] | 李宁, 李树峰, 严云勤. 体外培养小鼠精原干细胞的研究[J]. 畜牧与兽医, 2016, 48(7): 71–75. Li N, Li S F, Yan Y Q. A study on culturing mouse spermatogonial stem cells in vitro[J]. Animal Husbandry and Veterinary Medicine, 2016,48(7): 71–75. (in Chinese) |
| [27] | Wei M C, Lindsten T, Mootha V K, et al. tBID,a membrane-targeted death ligand,oligomerizes BAK to release cytochrome c[J]. Genes and Development, 2000,14(16): 2060–2071. |




