文章信息
- 姚倩倩, 顾向阳
- YAO Qianqian, GU Xiangyang
- 中度嗜盐菌Halomonas sp.W2的分离和鉴定及其高产四氢嘧啶特性研究
- Isolation,identification and the high ectoine-producing characteristics of a moderately halophilic bacterium Halomonas sp.W2
- 南京农业大学学报, 2017, 40(1): 109-115
- Journal of Nanjing Agricultural University(Social Science), 2017, 40(1): 109-115.
- http://dx.doi.org/10.7685/jnau.201604003
-
文章历史
- 收稿日期: 2016-04-01
四氢嘧啶类物质(包括四氢嘧啶和羟基四氢嘧啶)是中度嗜盐菌胞内合成的最常见的相容性溶质,其主要的生理功能是平衡细胞内外渗透压,抵御高盐浓度引起的渗透压胁迫,其突出的优点是能与细胞内体系相容而不影响其他生物大分子的功能[1-2]。近年来的体外试验研究发现四氢嘧啶有许多商业用途,比如用作保护剂为处于外界高温、冷冻、射线、干燥等逆境条件的蛋白质、核酸、细胞膜,甚至完整细胞提供保护作用;它可以缓解紫外线照射引起的皮肤损害,提高皮肤的再生能力和延缓皮肤的老化;此外它对阿尔兹海默氏症、帕金森病等神经性疾病均有一定的疗效[3-4]。可以预计四氢嘧啶在酶制剂、生物医药及护肤品等行业将具有广泛的应用前景。
四氢嘧啶的分子结构含有1个手性碳原子,其化学合成十分困难,目前只有依赖中度嗜盐菌进行商业化生产。四氢嘧啶的制备方法可分为发酵后提取和细菌泌乳两类,其中细菌泌乳法是Sauer等[5]提出的新工艺,它利用某些中度嗜盐菌在高渗透压条件下合成四氢嘧啶、低渗透压下可释放至胞外的功能,由于发酵培养的菌体可以反复使用,产物可多次回收,四氢嘧啶的合成量得到大幅提高,因而具有巨大的应用潜力[6-9]。目前国际上报道的适合于细菌泌乳工艺的菌株主要有Halomonas elongata、Brevibacterium sp. JCM 6894、Halomonas bolivinsis等,单位质量细胞中四氢嘧啶的合成量达0.1~0.2 g·g-1 ,国内分离的优良菌株尚不多见[10-11],也未见商业化生产的报道,因此本研究旨在分离筛选中度嗜盐菌,分析相容性溶质的主要成分,筛选以四氢嘧啶为主要相容性溶质的中度嗜盐菌,为四氢嘧啶的生物合成积累菌种资源。
1 材料与方法 1.1 培养基及试验菌种的分离乙酸培养基:CH3COOH 2 g·L-1,NaCl 100 g·L-1,(NH4)2SO4 0.5 g·L-1,MgSO4·7H2O 0.25 g·L-1,K2HPO4 0.25 g·L-1,pH7.0。保存培养基:蛋白胨10 g·L-1,酵母粉5 g·L-1,NaCl 100 g·L-1,琼脂20 g·L-1,pH7.0。
试验菌株分离自江苏省连云港市某盐池土样,方法如下:在250 mL三角瓶中加入100 mL乙酸培养基和3 g盐池土样,置于35 ℃、160 r·min-1摇床培养,定期取样测定培养液中乙酸的质量浓度,待乙酸完全降解后,将所得富集液进行梯度稀释并涂布于乙酸培养基平板,35 ℃培养3 d,从平板上挑取单菌落划线纯化后,得到2株嗜盐菌W1和W2,在低渗冲击(NaCl质量浓度为30 g·L-1)的预备试验中发现菌株W2表现出较好的分泌功能(61.2%),菌株W1的分泌率较低(28.5%),因此选择W2菌株进行进一步研究。
1.2 分离菌株的形态学特征及生理生化特性的测定将分离菌株涂布于固体平板,体视显微镜下观察其菌落形态,细胞形态采用扫描电镜观察并照相。革兰氏染色、鞭毛染色及各种生理生化特性的测定参照文献[12]进行。
1.3 分离菌种的16S rDNA序列鉴定从乙酸培养基平板上挑取少量幼嫩菌体直接进行16S rDNA序列扩增,用于PCR扩增的正向引物为5′-AGAGTTTGATCCTGGCTCA-3′,反向引物为5′-GGTTACCTTGTTACGACTT-3′[13]。扩增体系为:双蒸水(灭菌)34 μL,10×PCR Buffer 5 μL,MgCl2(25 mmol·L-1)3 μL,dNTPs(2.5 mmol·L-1)5 μL,引物(25 pmol·μL-1)各1 μL,Taq DNA 聚合酶(2.5 U·μL-1)1 μL。扩增程序:94 ℃ 2 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 20 min。扩增产物送南京金斯瑞生物技术有限公司测序,测定所得序列递交到GenBank,通过EzTaxon网站与细菌模式菌株的16S rRNA 基因序列进行比对,采用MEGA 5.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.4 分离菌株耐盐生长的特性及相容性溶质分析试验在500 mL摇瓶中进行,各三角瓶均含有180 mL乙酸培养基和20 mL种子液,8个摇瓶中NaCl盐分的终浓度分别为0、25、50、75、100、125、150和200 g·L-1,所有摇瓶均置于35 ℃、160 r·min-1摇床,培养36 h后从各摇瓶中先后吸取1 mL菌液离心沉淀菌体,用等体积的0.5 mol·L-1 NaOH溶液溶解后采用Folin酚试剂法[14]测定菌体蛋白的质量浓度,并换算成菌体质量(菌体质量/菌体蛋白比值为1.93,由预备试验测定),剩余菌液用于各种相容性溶质的提取与测定:四氢嘧啶类相容性溶质的提取、HPLC测定及质谱鉴定按照文献[6]进行;甜菜碱的提取与测定按照文献[15]进行;游离氨基酸的提取及HPLC分析按照文献[16]进行。
1.5 渗透压冲击下相容性溶质的释放与合成试验在6个盛有180 mL乙酸培养基的500 mL三角瓶中接入20 mL事先活化好的W2种子液,置于35 ℃、160 r·min-1摇床培养36 h得到新鲜的W2菌液,从每个三角瓶中各取1 mL菌液,8 000 r·min-1离心沉淀菌体,用于四氢嘧啶的提取与定量分析;各瓶剩余菌液于6 000 r·min-1离心10 min沉淀菌体,倾去上清液,加入等体积的低渗冲击液(NaCl质量浓度分别为0、10、20、30、40和50 g·L-1),将沉淀菌体重新悬浮后再转移至500 mL三角瓶,置于35 ℃、160 r·min-1摇床进行低渗冲击,在低渗冲击过程中,定期吸取1 mL菌液,于8 000 r·min-1离心4 min,取上清液用于四氢嘧啶的测定。按下列公式计算四氢嘧啶的释放率(release rate,RR):RR=ρe/(ρe+ρi)×100%[7]。式中:ρe和ρi分别表示低渗冲击后胞外和胞内四氢嘧啶的质量浓度(mg·L-1)。
将上述低渗冲击1 h的菌液,于6 000 r·min-1离心10 min沉淀菌体,倾去上清液,加入等体积的乙酸培养基(NaCl质量浓度为100 g·L-1),将菌体重新悬浮后再转移至500 mL三角瓶,置于35 ℃、160 r·min-1摇床培养,每3 h取样1次,每次取样1 mL,离心沉淀菌体用于四氢嘧啶的提取与测定。
2 结果与分析 2.1 菌株W2的形态学特征采用含100 g ·L-1 NaCl的乙酸培养基从盐池土中成功富集分离到1株中度嗜盐菌W2,该菌株在乙酸培养基上形成乳白色圆形菌落,菌落平坦,表面光滑、湿润,易挑起。菌株W2为革兰氏阴性的短杆状细胞,大小(1.21~1.65) μm×(1.03~1.19) μm,不产芽孢,无鞭毛。在扫描电镜下可见细胞呈聚集生长状态,细胞之间有胞外聚合物粘连,这可以解释菌株W2的液体培养物经静置过夜后其菌体可沉降至瓶底,且其上部悬浮液较清澈的现象(图 1)。

|
图 1 菌株W2的细胞形态 Figure 1 Cellular morphology of strain W2 |
菌株W2对淀粉水解试验、明胶液化试验、酯酶试验、蛋白酶试验、吲哚试验、产硫化氢试验的结果均呈阴性,过氧化氢酶试验、乙酰甲基甲醇试验、苯丙氨酸脱氢酶试验和石蕊牛乳试验结果均呈阳性。菌株W2可利用乙酸、葡萄糖、果糖、蔗糖、半乳糖、麦芽糖为唯一碳源生长,但不能利用淀粉、乳糖、木糖、核糖、鼠李糖、阿拉伯糖、纤维二糖为唯一碳源生长。菌株W2可以以硝酸盐或亚硝酸盐为电子受体通过无氧呼吸获得能量进行生长,说明W2为兼性好氧细菌。
将新鲜的W2菌体直接加入PCR扩增体系,以细菌16S rDNA通用引物进行PCR扩增并进行测序,得到1 405 bp的片段,将测序结果提交至GenBank(登录号为KU983515) ,与GenBank中其他菌株的16S rDNA进行相似性比较,并采用邻接法构建系统发育树(图 2)。结果显示:W2菌株与Halomonas属中各种的相似度在93.27%~99.93%之间,与Halomonas ventosae Al12T的相似性最高,为99.93%。结合W2的生理生化特征和16S rDNA序列同源性比对结果,将菌株W2鉴定为盐单胞菌属的1个种,并命名为Halomonas sp.W2。

|
图 2 菌株W2基于16S rRNA基因序列同源性构建的系统发育树 Figure 2 Phylogenetic tree of strain W2 based on the 16S rRNA gene sequences |
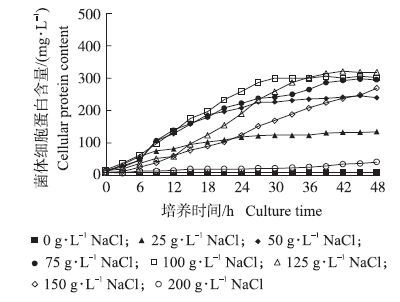
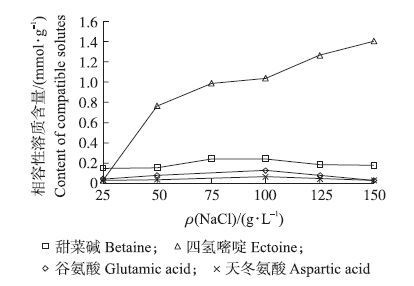
菌株W2可以适应25~200 g·L-1的NaCl质量浓度并以乙酸为唯一碳源生长(图 3),最适生长的NaCl质量浓度为100 g·L-1,高于或低于该浓度W2的生长速率逐渐下降。在NaCl质量浓度为100 g·L-1的乙酸培养基中,W2的生长速率最高,对数期代时为4.6 h。化学分析结果显示,菌株W2的细胞内存在甜菜碱、四氢嘧啶及谷氨酸、天冬氨酸等4种相容性溶质,未发现羟基四氢嘧啶(图 4和图 5)。
|
图 3 菌株W2在不同盐浓度培养基中的生长情况 Figure 3 Growth of strain W2 in acetate medium with different salinity |
|
图 4 盐浓度对菌株W2胞内相容性溶质合成的影响 Figure 4 Effect of salinity on the accumulation of intracellular compatible solutes in W2 cells |
|
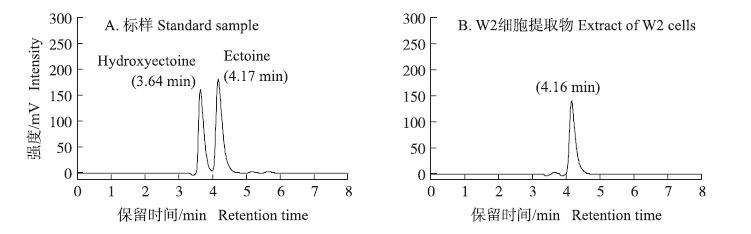
图 5 W2细胞提取物中四氢嘧啶类相容性溶质的HPLC图谱 Figure 5 HPLC spectra of compatible solutes in the extract of W2 cells |
将菌株W2的相容性溶质提取液进行高效液相色谱检测,HPLC图谱中出现1个峰且其出峰时间与自Sigma公司购买的四氢嘧啶标准品相同(图 5),质谱分析显示该物质质谱图及分子质量与四氢嘧啶标准品完全一致(图 6),上述结果证明菌株W2细胞提取液中的相容性物质确为四氢嘧啶。从图 4可以看出,在菌株W2可以耐受的盐浓度范围内(25~150 g·L-1),W2菌体中甜菜碱的含量较低(0.15~0.24 mmol·g-1),且其含量与培养基中的盐浓度之间无明显的相关性。而四氢嘧啶的含量与培养基中盐浓度之间则有明显的相关性,虽然当NaCl质量浓度为25 g·L-1时其含量极低(0.025 mmol·g-1),但当培养基中NaCl质量浓度提高至50~150 g·L-1时其含量迅速上升至0.76~1.40 mmol·g-1,大大高于相同盐浓度下W2菌体中甜菜碱的含量,这说明四氢嘧啶对保障该菌株在高盐浓度下的生长代谢起着关键作用。相比而言,在W2菌体中只发现谷氨酸和天冬氨酸2种游离氨基酸,但其含量均低于0.1 mmol·g-1且与培养基中盐浓度无明显相关性。从上述耐盐的浓度范围和相容性溶质来看,菌株W2是一株以四氢嘧啶为主要相容性溶质的中度嗜盐菌。

|
图 6 四氢嘧啶标样及W2细胞提取物中四氢嘧啶类相容性溶质的质谱图 Figure 6 MS spectrograms for standard ectoine and compatible solutes in the extract of W2 cells |
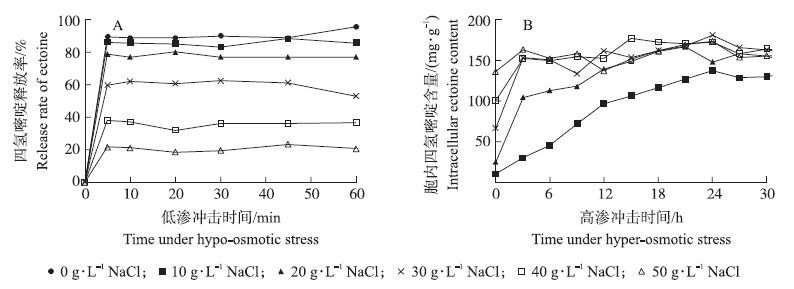
为了研究细菌泌乳法制备四氢嘧啶的可行性,首先以最适生长的高渗培养基(NaCl质量浓度为100 g·L-1)中培养的菌体为材料,研究了低渗盐溶液对菌株W2胞内四氢嘧啶释放率的影响。从图 7-A可以看出:在低渗溶液中菌株W2胞内四氢嘧啶的释放极快,经短短5 min的低渗冲击即可达到最大的释放率,延长冲击时间释放率不再有明显变化;四氢嘧啶的释放率与NaCl质量浓度呈明显负相关关系,当冲击液中盐溶液由0逐步提高至50 g·L-1时,四氢嘧啶的释放率由90.3%大幅下降至20.8%。应当指出的是,在无盐蒸馏水的冲击下虽然四氢嘧啶的释放率最高,但冲击后菌液由浑浊变为澄清,显微镜镜检结果显示菌株W2在蒸馏水中存在细胞裂解现象,因此蒸馏水不适合在细菌泌乳工艺中应用。
|
图 7 渗透压冲击下W2细胞中四氢嘧啶的释放与重新合成 Figure 7 Release and re-synthesis of ectoine in W2 cells under hypo/hyper-osmotic stress |
在盐质量浓度为10~50 g·L-1的低渗溶液中菌株W2未发生明显的细胞裂解现象,因此我们将低渗盐溶液冲击1 h后的W2菌液离心收集之后转移至高盐培养基中进一步考察其在高渗冲击下重新合成四氢嘧啶的能力。结果(图 7-B)显示:经NaCl质量浓度为30~50 g·L-1盐溶液冲击的W2菌体在高渗培养基中能够迅速合成四氢嘧啶以抵御外界的渗透压力,其胞内四氢嘧啶含量恢复至最高水平(161 mg·g-1)仅需3 h,而较低盐浓度下低渗冲击的W2菌体转移至高渗培养基中后其四氢嘧啶的合成速率明显减慢,合成量也有所下降。例如经NaCl质量浓度为20和10 g·L-1盐溶液冲击的W2菌体在后续高渗培养阶段胞内四氢嘧啶的最高合成量分别为157和134 mg·g-1,而恢复至最高合成量所需的时间分别延长至21和24 h,可见盐质量浓度为10~20 g·L-1的低渗冲击对W2菌体的代谢活性已经产生不利影响。综合起来看,低渗冲击的最适盐质量浓度为30 g·L-1,此时胞内四氢嘧啶的释放率可达61.2%,适合于细菌泌乳工艺的要求。在本试验中菌体质量浓度为574 mg·L-1的条件下,经30 g·L-1 NaCl溶液低渗冲击后释放至培养基中的四氢嘧啶产量可达56.6 mg·L-1。
3 结论与讨论本文报道的Halomonas sp.W2菌株可以耐受25~200 g·L-1的NaCl生长,最适生长所需的盐质量浓度为100 g·L-1,根据嗜盐菌耐盐范围的划分[1],该菌属于典型的中度嗜盐菌。为了查明W2的耐盐机制,本研究提取并分析了W2胞内的相容性溶质,发现不同盐浓度下培养的W2菌体细胞内均存在甜菜碱、四氢嘧啶、谷氨酸和天冬氨酸等相容性溶质,未发现其他相容性溶质的存在。前三者作为相容性溶质已有大量文献[1-2]报道,而天冬氨酸作为相容性溶质尚未见文献报道。盐浓度对相容性溶质的相对含量有明显影响,在较低的盐质量浓度下(25 g·L-1)各相容性溶质的比例依次为甜菜碱(60.8%)、四氢嘧啶(10.5%)、谷氨酸(16.4%)和天冬氨酸(12.3%),在较高盐质量浓度的条件下(50~100 g·L-1),各相容性溶质的比例依次为四氢嘧啶(70.8%~85.9%)、甜菜碱(10.7%~16.1%)、谷氨酸(1.6%~8.8%)和天冬氨酸(1.8%~4.2%),说明在不同渗透压条件下菌株W2耐盐生长的机制是不同的:在较低盐条件下主要靠甜菜碱来维持细胞内外的渗透压平衡,而在高盐条件下主要依赖四氢嘧啶来抵御高渗透压的冲击。
在最适生长的盐浓度下,菌株W2胞内的相容性溶质中四氢嘧啶摩尔比例达70.8%,单位质量细胞中四氢嘧啶的合成量达161 mg·g-1,同Sauer等[5]报道的Halomonas elongata的产率(155 mg·g-1)十分接近,是一株较高产的产四氢嘧啶菌株。该菌株在低渗透压冲击条件下其胞内的四氢嘧啶能迅速释放出来,而转入高渗透压培养基中后又能快速重新合成,具备了进行细菌泌乳工艺菌株的要求。值得一提的是,本研究分离的W2菌株能够以乙酸等有机酸为碳源生长,在培养过程中可保持中性至微碱性的pH环境,不会出现pH下降的弊病,有利于保持菌体生长及四氢嘧啶合成产量的稳定,因此在四氢嘧啶的生物合成领域具有更好的应用潜力。
| [1] | Horikoshi K, Antranikian G, Bull A T, et al. Halophilic Bacteria[M]. Boca Raton: CRC Press, 2011 : 255 -308. |
| [2] | Satyanarayana T, Johri B N, Prakash A. Microorganisms in Environmental Management[M]. Dordrecht: Springer, 2012 : 1 -34. |
| [3] | 郑昕, 马虹, 闫喜文, 等. Halomonas venusta DSM4743渗透压冲击下四氢嘧啶合成与释放[J]. 微生物学通报, 2010, 37(7): 1090–1096. Zheng X, Ma H, Yan X W, et al. Ectoine synthesis and release under osmotic shock in Halomonas venusta DSM4743[J]. Microbiology, 2010,37(7): 1090–1096. (in Chinese) |
| [4] | Pastor J M, Salvador M, Argandona M, et al. Ectoines in cell stress protection:uses and biotechnological production[J]. Biotechnology Advances, 2010,28: 782–801. DOI: 10.1016/j.biotechadv.2010.06.005 |
| [5] | Sauer T, Galinski E A. Bacterial milking:a novel bioprocess for production of compatible solutes[J]. Biotechnology and Bioengineering, 1998,57(3): 306–313. DOI: 10.1002/(ISSN)1097-0290 |
| [6] | Wei Y H, Yuan F W, Chen W C, et al. Production and characterization of ectoine by Marinococcus sp. ECT1 isolated from a high-salinity environment[J]. Journal of Bioscience and Bioengineering, 2011,111(3): 336–342. DOI: 10.1016/j.jbiosc.2010.11.009 |
| [7] | Nagata S, Wang Y, Oshima A, et al. Efficient cyclic system to yield ectoine using Brevibacterium sp. JCM 6894 subjected to osmotic downshock[J]. Biotechnology and Bioengineering, 2007,99(4): 941–948. |
| [8] | Van-Thuoc D, Guzmán H, Quillaguamán J, et al. High productivity of ectoines by Halomonas boliveinsis using a combined two-step fed-batch culture and milking process[J]. Journal of Biotechnology, 2010,147: 46–51. DOI: 10.1016/j.jbiotec.2010.03.003 |
| [9] | Fallet C, Rohe P, Franco-Lara E. Process optimization of the integrated synthesis and secretion of ectoine and hydroxyectoine under hyper/hypo-osmotic stress[J]. Biotechnology and Bioengineering, 2010,107(1): 402–407. |
| [10] | 何健, 汪婷, 孙纪全, 等. 以四氢嘧啶为主要相容性溶质的中度嗜盐菌I15的分离和特性研究[J]. 微生物学报, 2005, 45(6): 900–904. He J, Wang T, Sun J Q, et al. Isolation and characteristics of a moderately halophilic bacterium accumulated ectoine as main compatible solute[J]. Acta Microbiologica Sinica, 2005,45(6): 900–904. (in Chinese) |
| [11] | 朱德瑞, 龙启福, 沈国平, 等. 青海湖樊氏盐单胞菌QHL5四氢嘧啶合成影响因素分析[J]. 环境化学, 2015, 34(1): 111–116. Zhu D R, Long Q F, Shen G P, et al. Accumulation and influential factors of ectoine synthesis in Halomonas ventosae QHL5 isolated from Qinghai Lake[J]. Environmental Chemistry, 2015,34(1): 111–116. (in Chinese) |
| [12] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001 : 364 -398. Dong X Z, Cai M Y. Manual for Systematic Identification of Common Bacteria[M]. Beijing: Science Press, 2001 : 364 -398. (in Chinese) |
| [13] | Julia R M, Takuichi S, Andrew J W. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA[J]. Appl Environ Microbiol, 1998,64(2): 795–799. |
| [14] | Walker J M. The Protein Protocols Handbook[M]. 3rd ed. New York: Humana Press, 2009 . |
| [15] | Grieve C M, Grattan S R. Rapid assay for determination of water soluble quaternary ammonium compounds[J]. Plant and Soil, 1983,70: 303–307. DOI: 10.1007/BF02374789 |
| [16] | Tempest D W, Meers J L, Brown C M. Influence of environment on the content and composition of microbial free amino acid pools[J]. Journal of General Microbiology, 1970,64: 171–185. DOI: 10.1099/00221287-64-2-171 |




