文章信息
- 刘世拓, 肖栋, 许玉超, 侯喜林, 徐玮玮, 韩克, 董慧杰, 胡春梅
- LIU Shituo, XIAO Dong, XU Yuchao, HOU Xilin, XU Weiwei, HAN Ke, DONG Huijie, HU Chunmei
- 不结球白菜过氧化还原蛋白基因Brc2-Cys Prx的克隆和表达分析
- Clone and expression analysis of Brc2-Cys Prx gene from non-heading Chinese cabbage
- 南京农业大学学报, 2017, 40(1): 40-47
- Journal of Nanjing Agricultural University (Social Science), 2017, 40(1): 40-47.
- http://dx.doi.org/10.7685/jnau.201603040
-
文章历史
- 收稿日期: 2016-03-18
过氧化还原蛋白(Prxs)是一类过氧化物酶家族,能够有效清除植物体内的活性氧。在生物体内普遍存在且不依赖于其他过氧化物酶而独立起作用[1]。Prxs蛋白可在作用于烷基氢过氧化物和过氧化亚硝酸的基础上对H2O2进行分解,且其经常与硫氧还蛋白和亲环素类蛋白联系在一起发挥作用[1-2]。
根据Cys残基数目和位置的不同,Prxs可分为5种亚型:1-Cys Prxs、2-Cys Prxs、Prx、PrxQ和Grx。2-Cys Prxs在5种亚型中保守程度最高。 2-Cys Prx 基因编码双半胱氨酸型硫氧还蛋白过氧化物酶。2-Cys Prx蛋白存在保守基序,例如Cysp附近的F基序(FFYPLDFTFVCPTEI)和CysR附近的基序(EVCP)以及在真核生物中发现的GGLG、YF基序,这些基序均参与脂质氧化过敏反应[3]和氧化信号的感知[4]。 2-Cys Prx 的表达依赖于氧化还原信号、脱落酸和蛋白激酶级联反应[1]。在胞藻中,2-Cys Prx蛋白是清除H2O2和烷基氢过氧化物的唯一蛋白酶[5]。 2-Cys Prx 基因作为Prxs家族成员之一,参与到抗氧化防御系统反应中。当植物处于胁迫条件时,2-Cys Prx蛋白能够有效地清除植物体内多余的活性氧,从而减轻其对植物细胞的氧化伤害,提高植物对胁迫环境的抗性。
不结球白菜(Brassica rapa ssp. chinensis)是我国主要绿叶蔬菜[6]。其生长过程中常遭受霜霉病菌[Peronospora parasitica(Pers.)Fr.]的侵染,致使产量下降和品质变劣[7]。研究证实霜霉病的初次侵染源来自病叶内的卵孢子和带病种子[8],且霜霉病可引起不结球白菜幼苗和成株叶片枯黄、枯死,在适宜环境条件下,可重复侵染,引起病害流行,导致产量大幅度下降[9]。生产者为了减轻病害,长期施用农药,这不仅污染环境,破坏生态平衡,也严重威胁人们的身体健康。土地资源不合理的开发、农药化肥过量使用以及工业生产污染问题,导致土壤环境变得愈加恶劣,对植物的正常生长造成不利影响。因此,本文利用生物信息学方法对不结球白菜叶片Brc 2 -Cys Prx基因进行信息学分析,采用qRT-PCR技术对该基因在霜霉病菌侵染及NaCl、CdCl2、PEG6000和ABA等非生物胁迫处理条件下的表达模式进行研究,为揭示霜霉病的抗病机制和选育抗性品种提供理论依据。
1 材料与方法 1.1 材料试验材料为南京农业大学园艺学院白菜课题组提供的不结球白菜霜霉病抗病自交系‘苏州青’和霜霉病感病自交系‘矮脚黄’。不结球白菜种子经1 g · L-1 HgCl2灭菌后播种于装有灭菌基质的穴盘中,在人工气候室25 ℃、光周期12 h/12 h条件下培养,待长至4叶期时进行处理。
RNA提取试剂盒、反转录试剂盒、RACE试剂盒、SYBR GreenⅠ和DNA Marker等均购自大连TaKaRa公司,引物由南京金斯瑞生物公司合成。
1.2 方法 1.2.1 霜霉菌菌株获得及侵染方法接种液制备参照程永安等[10]的方法。霜霉孢子悬浮液均匀喷洒在叶片上,对照组同时喷等量的无菌水。接种后在湿度为90%、20 ℃黑暗条件下保湿24 h后正常管理。于接种后0、24、48和72 h取植株叶片各0.1 g,保存于-70 ℃备用。每个处理3次重复。
1.2.2 非生物胁迫分别用0.2 mol · L-1 NaCl、150 μmol · L-1 CdCl2、200 g · L-1 PEG6000和100 μmol · L-1ABA对‘苏州青’进行胁迫处理。于处理后0、12、24和48 h取植株叶片各0.1 g,保存于-70 ℃备用。每个处理3次重复。
1.2.3 叶片中总RNA提取及cDNA合成采用RNA simple Total RNA Kit试剂盒提取不结球白菜样品总RNA;用Prime Script RT reagent Kit将RNA反转录成cDNA。
1.2.4 不结球白菜Brc 2-Cys Prx 基因全长cDNA获得以霜霉病菌侵染的不结球白菜叶片总RNA为材料,参照反转录试剂盒说明(BD SMARTTMRACE Amplification Kit User Manual)进行反转录合成第1链cDNA。 参照毛毅辉等[11]的方法克隆得到Brc 2 -Cys Prx基因全长cDNA序列,RACE克隆用到的引物序列见表 1。
| 引物名称 Primer name | 引物序列 Primer sequence(5′→3′) |
| Prx-P1-F/R | AGGGAATAGCACTGAGAGGACTT/AAAAGCCCTCTCAGTG CTATTCC |
| Prx-P2-F/R | AGTCAATGAAACCCGACCCAA/CAAGGTGGGAGAACACACTATCA |
| UPM short | CTAATACGACTCACTATAGGGC |
| UPM long | CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT |
采用OFR FINDER程序查找Brc 2 -Cys Prx基因的开放阅读框。利用Brc 2 -Cys Prx基因开放阅读框翻译的氨基酸序列在NCBI的BLASTp(http://www.ncbi.nlm.nih.gov/blast/)进行序列的同源性比对,比对结果用DNAMAN 6.0进行多序列同源性比对结果显示。Signal P软件用于蛋白信号肽预测。利用BioXM 2.6软件预测Brc2-Cys Prx蛋白的氨基酸残基数、相对分子质量和等电点。通过MEGA 6.0的Clustal W算法对开放阅读框编码的氨基酸序列进行多重比对后,构建系统进化树并生成报告图形。利用在线软件SOPMA预测Brc2-Cys Prx蛋白的二级结构,利用NCBI-Conserved Domain Search 进行蛋白保守域预测。
1.2.6 不结球白菜Brc 2 -Cys Prx基因在不同处理条件下的实时定量表达分析使用RNA提取试剂盒(TaKaRa)提取各器官材料总RNA,取1 μg RNA反转录(gDNA Eraser,TaRaKa)成cDNA,根据Brc 2 -Cys Prx基因编码区序列,利用Beacon Designer v 7.9软件进行qRT-PCR引物设计,正向引物序列为TACCCTTTGGACTTCACTTT,反向引物序列为ACTGAGACACCTAACACTTC。以引物序列为CTCAGTCCAAAAGAGGTATTCT/GTAGAATGTGTGATGCCAGATC(F/R)的actin基因作为内参。总体积20 μL:MgCl2(25 mmol · L-1)2 μL,dNTP(2.5 mmol · L-1)2 μL,10×PCR Buffer 2 μL,rTaq酶0.2 μL,引物PRX-RT-F和PRX-RT-R各1 μL,cDNA模板1 μL。反应程序为:95 ℃ 4 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃1 min,25个循环;72 ℃ 10 min。3次重复。
2 结果与分析 2.1 不结球白菜Brc2-Cys Prx 基因的分子结构对Brc 2 -Cys Prx 3′-RACE 及5′-RACE产物(图 1)测序得知:Brc 2 -Cys Prx基因全长999 bp,开放阅读框长度为810 bp,编码270个氨基酸,其中包括42个酸性氨基酸和28个碱性氨基酸。根据Brc 2 -Cys Prx基因编码的氨基酸序列预测其相对分子质量为28.15×103,理论等电点为5.87,属于酸性蛋白。Signal P分析结果显示,该基因不存在信号肽序列。
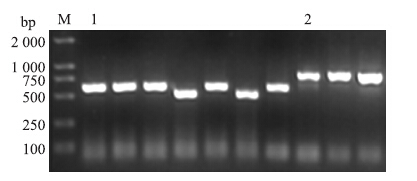
|
图 1 RACE扩增的Brc 2-Cys Prx 基因 Figure 1 Result of RACE amplification of Brc 2-Cys Prx gene M.Marker;1.Brc 2 -Cys Prx基因5′-RACE产物 PCR product of 5′-RACE;2.Brc 2 -Cys Prx基因3′-RACE产物 PCR product of 3′-RACE |
从GenBank中检索与不结球白菜Brc2-Cys Prx蛋白相似性较高的物种氨基酸序列,通过序列比对,结果(图 2-A)显示,该蛋白与大白菜、甘蓝型油菜、野甘蓝、拟南芥和亚麻芥等植物同源性较高,其中与大白菜的相似性最高,达到99%。为进一步了解13种植物Brc2-Cys Prx蛋白之间的相似程度,对其氨基酸组成和理化性质进行了分析(表 2)。各物种氨基酸残基数为215~270,蛋白质相对分子质量为(24.02~29.32)×103,理论等电点(pI)为4.82~8.04,酸性氨基酸数为42~48,碱性氨基酸数为26~33,pI值除亚麻芥和可可树大于7.0外,其余均小于7.0,为酸性氨基酸。

|
图 2 不结球白菜Brc2-Cys Prx蛋白的同源序列多重比对(A)及结构域预测(B) Figure 2 Homology alignment of Brc2-Cys Prx protein from non-heading Chinese cabbage compared with other plants(A)and it′s domain prediction(B) |
| 植物 Species | 氨基酸残基数 No.of amino acids | 相对分子质量/103 Relative molecular mass | 理论等电点 Theoretical pI | 碱性氨基酸数量 No.of asic amino acid | 酸性氨基酸数量 No.of acidic amino acid | 登录号 GenBank accession No. |
| 不结球白菜B.rapa ssp.chinensis | 270 | 28.15 | 5.87 | 28 | 42 | AB495004.1 |
| 大白菜B.rapa ssp.pekinensis | 269 | 29.32 | 5.15 | 28 | 44 | XP_009122235.1 |
| 甘蓝型油菜B.napus | 266 | 29.07 | 5.15 | 28 | 44 | XP_013715675.1 |
| 野甘蓝B.oleracea var.oleracea | 262 | 28.77 | 6.52 | 31 | 43 | XP_013628146.1 |
| 拟南芥A.thaliana | 215 | 24.02 | 4.82 | 26 | 45 | AAM62760.1 |
| 亚麻芥C.sativa | 267 | 29.21 | 7.50 | 32 | 43 | XP_010497542.1 |
| 玉山筷子芥A.lyratasub sp.lyrata | 266 | 29.05 | 6.52 | 31 | 44 | XP_002882740.1 |
| 醉蝶花T.hassleriana | 235 | 26.04 | 5.39 | 28 | 45 | XP_010534394.1 |
| 可可树T.cacao | 266 | 29.28 | 8.04 | 33 | 44 | XP_007027930.1 |
| 玉米Z.mays | 255 | 27.63 | 5.88 | 30 | 44 | NP_001137046.1 |
| 小果野蕉M.acuminata | 254 | 28.01 | 6.79 | 30 | 45 | XP_009404913.1 |
| 大豆G.max | 257 | 28.17 | 6.02 | 29 | 46 | XP_003535806.1 |
| 林烟草N.sylvestris | 234 | 26.21 | 5.88 | 29 | 48 | XP_009766233.1 |
用NCBI软件分析Brc2-Cys Prx蛋白二级结构中保守的结构域,结果(图 2-B)显示,该蛋白含有1个PRX-Typ2cys结构域,属于Thioredoxin-like superfamily超家族。用SOPMA在线软件对不结球白菜Brc2-Cys Prx蛋白的二级结构进行预测,结果显示该蛋白含39%的α-螺旋、17%的β-折叠以及34%的无规则卷曲,α-螺旋和无规则卷曲是该蛋白多肽链上的主要元件(图 3)。
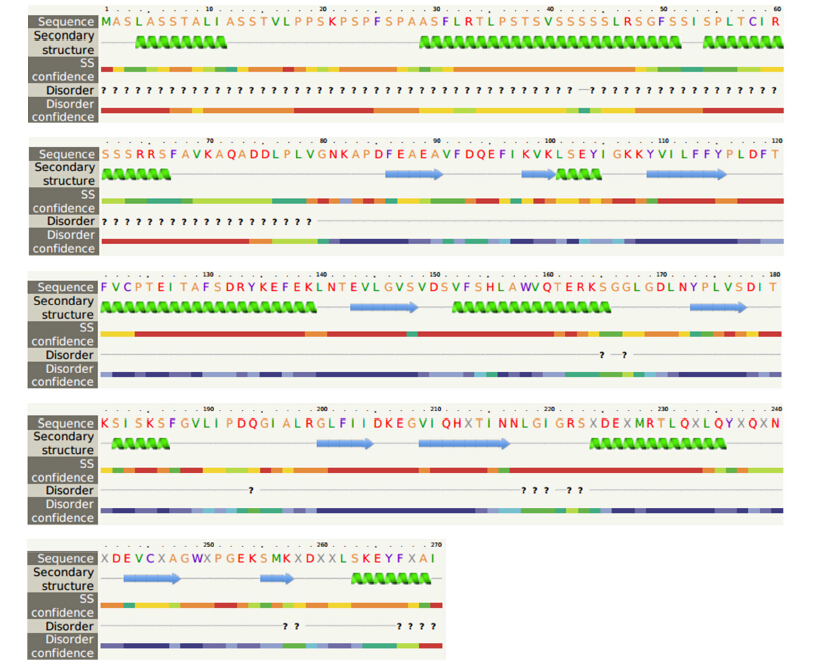
|
图 3 不结球白菜Brc2-Cys Prx蛋白的二级结构预测 Figure 3 Prediction of the two-dimension structure of Brc2-Cys Prx protein from non-heading Chinese cabbage |
为进一步分析Brc2-Cys Prx蛋白在不同物种之间的进化关系,使用 MEGA 5.0 经序列比对后,构建不结球白菜与12种植物的分子进化树。由图 4可见:不结球白菜Brc2-Cys Prx蛋白与大白菜、甘蓝型油菜首先聚为一支,表明其在进化关系上最近。不结球白菜、大白菜、甘蓝型油菜均为芸薹属植物,它们的2-Cys Prx蛋白位于同一个分支。由此发现十字花科植物的2-Cys Prx蛋白与同属植物的进化关系最近,呈现种属特性。

|
图 4 不结球白菜及同源物种2-Cys Prx氨基酸序列的系统进化树 Figure 4 Phylogenetic tree of amino acid sequence of 2-Cys Prx from non-heading Chinese cabbage and homologous species 分支上的数字表示Bootstrap 验证中基于1 000次重复该节点可信度的比例。 The number for each interior branch indicate the reliability percent of bootstrap values based on1 000 replications. |
利用荧光定量PCR技术分析了霜霉菌侵染后Brc 2 -Cys Prx基因在叶片中的表达模式,结果(图 5)发现,侵染‘苏州青’初期,Brc 2 -Cys Prx基因在24 h时下调表达,48 h时其表达量突然上升并且后期稳定在较高水平。侵染‘矮脚黄’期间,Brc 2 -Cys Prx基因的表达量要低于‘苏州青’且上调表达迟钝,呈现逐渐上调趋势。在48 h时,‘苏州青’中Brc 2 -Cys Prx基因的表达量约是‘矮脚黄’中的1.92倍(图 5)。
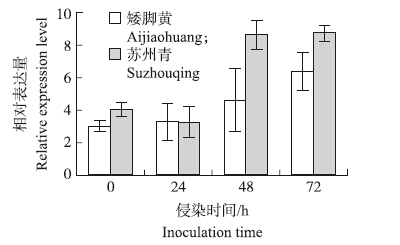
|
图 5 不结球白菜在霜霉菌侵染条件下叶中 Brc 2-Cys Prx 基因的相对表达量 Figure 5 The relative expression level of Brc 2-Cys Prx gene in leaf of non-heading Chinese cabbage infected by downy mildew |
由图 6可见:0.2 mol · L-1 NaCl抑制Brc 2 -Cys Prx基因的表达。200 g · L-1 PEG6000抑制Brc 2 -Cys Prx基因的表达,在12 h达到最低值。与200 g · L-1 PEG6000处理相反,150 μmol · L-1 CdCl2诱导了Brc 2 -Cys Prx基因的表达,在24 h达到最大值。100 μmol · L-1 ABA先是诱导Brc 2 -Cys Prx基因瞬时表达,处理12 h后又抑制该基因的表达。
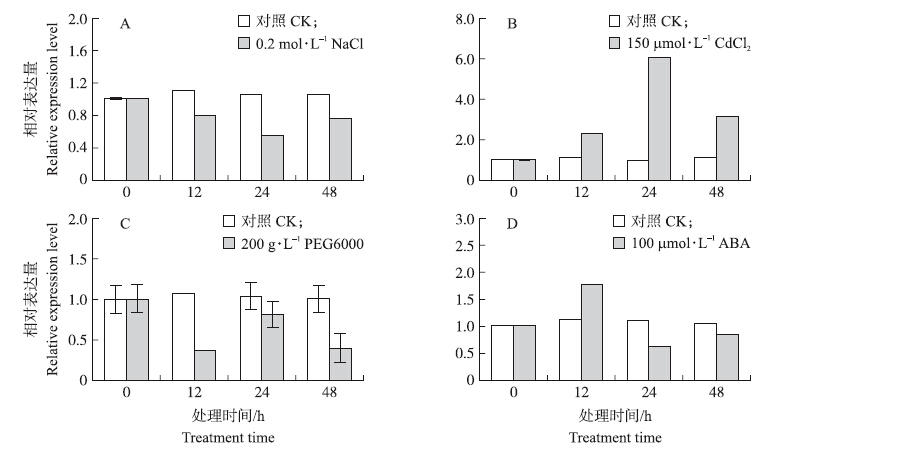
|
图 6 不结球白菜在非生物胁迫条件下Brc 2-Cys Prx 基因的相对表达量 Figure 6 The relative expression level of Brc 2-Cys Prx gene from non-heading Chinese cabbage under abiotic stresses |
N末端保守的半胱氨酸残基能够与H2O2发生氧化反应,生成Cys-SOH,Cys-SOH再与相邻的亚单位上的Cys-SH结合形成分子内的二硫化物。这种二硫化物能被硫氧还蛋白(Trx)还原,同时,H2O2则被Prxs还原为H2O,烷化为乙醇而清除出细胞[12-14],从而起到解毒的作用。本研究中,霜霉菌侵染植株后,抗病自交系‘苏州青’叶片中Brc 2 -Cys Prx基因的表达量及上调表达速度均大于感病自交系‘矮脚黄’,结合Brc2-Cys Prx具有清除H2O2的作用,可推断抗病自交系中清除H2O2的量要大于感病自交系中的。多余H2O2的清除有效缓解了细胞的氧化伤害,减少了叶片病斑的发生。推测Brc2-Cys Prx蛋白与硫氧还蛋白互作以及其高表达促进了Brc2-Cys Prx蛋白的合成,从而能提高植株清除H2O2,减少其对植株的伤害,是抗病自交系‘苏州青’具有高抗性的原因之一。
本研究中,NaCl和PEG6000抑制了Brc 2 -Cys Prx基因的表达,结合胡国霞[15]的研究结果,推测可能是植株叶片内H2O2的过度积累而使其失活或植株叶片内发生了光失活的原因。本研究中,ABA处理后,12 h时表达上调,随后表达受抑制。推测是霜霉病菌侵染后期,植株叶片内H2O2的过度积累而使过氧化还原蛋白失活,且ABA是 2 -Cys Prx基因表达的抑制因子[16],胁迫后期抑制了其表达的原因。0.2 mol · L-1 NaCl、200 g · L-1 PEG6000和100 μmol · L-1 ABA抑制Brc 2 -Cys Prx基因的表达将导致植株体内的过氧化水平增加,加剧细胞的氧化伤害,因此,胁迫后,植株对病害抵抗力减弱,叶片病斑数增加,这可能是抗性品种出现明显病害症状的重要原因。
重金属能够严重干扰细胞氧化还原反应的代谢平衡,破坏Brc2-Cys Prx蛋白的工作环境。研究表明,5、10和15 mg · L-1镉处理草莓幼苗6 d后,根尖超氧化物歧化酶、过氧化物酶以及过氧化氢酶活性下降[17]。而本研究中,CdCl2促进了Brc 2 -Cys Prx基因的表达,且在24 h达到最大值。这一结果也与上述3种非生物胁迫所得结果不同。本试验中,CdCl2并没有抑制Brc 2 -Cys Prx基因而是促进其表达,CdCl2胁迫有效地引起了植物抗氧化防御系统的反应以及其胁迫,而没有严重干扰细胞氧化还原反应的平衡。肖清铁等[18]的研究表明,与对照(镉敏感水稻IR24)相比,不同浓度镉胁迫下,抗镉水稻PI312777叶片中谷胱甘肽还原酶上调表达,而镉敏感水稻IR24叶片中谷胱甘肽还原酶蛋白的表达无显著差异,可知不同试验材料在相同浓度镉胁迫条件下,其抗氧化酶具有不同的表达模式。推测CdCl2促进Brc 2 -Cys Prx基因的表达可能是CdCl2的试验设计浓度还未达到不结球白菜忍耐临界值或试验材料差异的原因。总之,不结球白菜Brc 2 -Cys Prx基因针对不同的非生物胁迫因子具有不同的应答模式,探究其所涉及的信号途径对今后的不结球白菜育种及生产应用具有重要意义。
| [1] | Dietz K J, Jacob S, Oelze M L, et al. The function of peroxiredoxins in plant organelle redox metabolism[J]. Journal of Experimental Botany, 2006,57(8): 1697–1709. DOI: 10.1093/jxb/erj160 |
| [2] | Sigrun R, Sheng Q, Kyaw A, et al. In-depth proteome analysis of Arabidopsis leaf peroxisomes combined with in vivo subcellular targeting verification indicates novel metabolic and regulatory functions of peroxisomes[J]. Plant Physiology, 2009,150(150): 125–143. |
| [3] | Wood Z A, Poole L B, Karplus P A. Peroxiredoxin evolution and the regulation of hydrogen peroxide signaling[J]. Science, 2003,300(5619): 650–653. DOI: 10.1126/science.1080405 |
| [4] | Klotz L O, Schroeder P, Sies H. Peroxynitrite signaling:receptor tyrosine kinases and activation of stress-responsive pathways[J]. Free Radical Biology and Medicine, 2002,33(6): 737–743. DOI: 10.1016/S0891-5849(02)00892-4 |
| [5] | Yamamoto H, Miyake C, Dietz K J, et al. Thioredoxin peroxidase in the Cyanobacterium Synechocystis sp. PCC 6803[J]. Febs Letters, 1999,447(2/3): 269–273. |
| [6] | 黄菲艺, 唐君, 侯喜林, 等. 不结球白菜响应ABA和低温基因WRKY18的克隆及表达分析[J]. 南京农业大学学报, 2015, 38(2): 189–196. Huang F Y, Tang J, Hou X L, et al. Cloning and expression analysis of WRKY18 gene in non-heading Chinese cabbage under ABA and low temperature treatments[J]. Journal of Nanjing Agricultural University, 2015,38(2): 189–196. DOI: 10.7685/j.issn.1000-2030.2015.02.003 (in Chinese) |
| [7] | 刘克钧, 朱月林, 侯喜林, 等. 不结球白菜抗病育种的研究Ⅳ.不结球白菜抗芜菁花叶病、霜霉病及黑斑病的多抗性鉴定及筛选[J]. 南京农业大学学报, 1997, 20(3): 31–35. Liu K J, Zhu Y L, Hou X L, et al. Studies on breeding for disease resistance in non-heading Chinese cabbage Ⅳ. Identification and screening for multiple resistance to turnip mosaic virosis, downy mildew and black spot in non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 1997,20(3): 31–35. DOI: 10.7685/j.issn.1000-2030.1997.03.006 (in Chinese) |
| [8] | 姚健民, 傅淑云. 白菜霜霉病侵染规律的研究[J]. 沈阳农学院学报, 1985, 16(1): 17–24. Yao J M, Fu S Y. Study on the infection pattern of downy mildew of Chinese cabbage[J]. Journal of Shenyang Agricultural College, 1985,16(1): 17–24. (in Chinese) |
| [9] | 申姗娜, 侯喜林. 不结球白菜感染霜霉病菌后防御物质及酶的变化[J]. 南京农业大学学报, 2009, 32(1): 23–26. Shen S N, Hou X L. Changes of protective substances and enzymes in non-heading Chinese cabbage after infection by downy mildew[J]. Journal of Nanjing Agricultural University, 2009,32(1): 23–26. DOI: 10.7685/j.issn.1000-2030.2009.01.005 (in Chinese) |
| [10] | 程永安, 柯桂兰. 影响大白菜霜霉病抗性鉴定的因素[J]. 西北农业学报, 1995, 4(4): 69–72. Cheng Y A, Ke G L. Factors affecting resistance to downy mildew of Chinese cabbage[J]. Acta Agriculturae Boreali-occidentalis Sinica, 1995,4(4): 69–72. (in Chinese) |
| [11] | 毛毅辉, 李会勇, 王天宇, 等. 玉米液泡ATP酶亚基A基因的克隆及表达分析[J]. 作物学报, 2008, 34(1): 31–36. Mao Y H, Li H Y, Wang T Y, et al. Cloning and expression analysis of a vacuolar ATPase subunit A gene in maize[J]. Acta Agronomica Sinica, 2008,34(1): 31–36. (in Chinese) |
| [12] | Dietz K J. Peroxiredoxins in plants and cyanobacteria[J]. Antioxidants and Redox Signaling, 2011,15(4): 1129–1159. DOI: 10.1089/ars.2010.3657 |
| [13] | Goyer A, Haslekås C, Miginiac-Maslow M. Isolation and characterization of a thioredoxin-dependent peroxidase from Chlamydomonas reinhardtii[J]. European Journal of Biochemistry, 1992,269(1): 272–282. |
| [14] | Kitajima S. Hydrogen peroxide-mediated inactivation of two chloroplastic peroxidases, ascorbate peroxidase and 2-Cys peroxiredoxin and dagger[J]. Photochemistry and Photobiology, 2008,84(6): 1404–1409. DOI: 10.1111/php.2008.84.issue-6 |
| [15] | 胡国霞. PEG预处理对水分胁迫下水稻抗氧化系统的影响[D]. 沈阳:沈阳师范大学,2011. Hu G X. Effects of PEG pretreatment on antioxidant system and ROS of rice under water stress[D]. Shenyang:Shenyang Normal University,2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10166-1011084273.htm |
| [16] | Baier M, Stroher E, Dietz K J. The acceptor availability at photosystem I and ABA control nuclear expression of 2-Cys peroxiredoxin-A in Arabidopsis thaliana[J]. Plant Cell Physiology, 2004,45(8): 997–1006. DOI: 10.1093/pcp/pch114 |
| [17] | 李慧, 丛郁, 王宏伟, 等. 镉对草莓幼苗根尖氧化系统和基因组DNA损伤的影响[J]. 园艺学报, 2010, 37(5): 721–730. Li H, Cong Y, Wang H W, et al. Effects of cadmium stress on oxygen enzyme system and genome DNA polymorphism in the root tips of strawberry plants[J]. Acta Horticulturae Sinica, 2010,37(5): 721–730. (in Chinese) |
| [18] | 肖清铁, 戎红, 周丽英, 等. 水稻叶片对镉胁迫响应的蛋白质差异表达[J]. 应用生态学报, 2011, 22(4): 1013–1019. Xiao Q T, Rong H, Zhou L Y, et al. Differential expression of proteins in Oryza sativa leaves in response to cadmium stress[J]. Chinese Journal of Applied Ecology, 2011,22(4): 1013–1019. (in Chinese) |




