文章信息
- 李双洁, 卢宇, 张金秋, 苗晋锋, 侯继波
- LI Shuangjie, LU Yu, ZHANG Jinqiu, MIAO Jinfeng, HOU Jibo
- VP4和VP5蛋白在鸡传染性法氏囊病毒感染Vero细胞中的作用
- The effect of VP4 and VP5 protein of IBDV on the infection of Vero cells
- 南京农业大学学报, 2016, 39(6): 1030-1036
- Journal of Nanjing Agricultural University, 2016, 39(6): 1030-1036.
- http://dx.doi.org/10.7685/jnau.201601039
-
文章历史
- 收稿日期: 2016-01-20
2. 江苏省农业科学院 国家兽用生物制品工程技术研究中心, 江苏 南京 210014
2. National Research Center of Veterinary Biologicals Engineering and Technology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
鸡传染性法氏囊病是由鸡传染性法氏囊病毒(IBDV)引起的鸡的急性、高度接触性和免疫抑制性传染病, 每年会给养鸡业造成巨大的损失。IBDV属于双股RNA病毒科双股RNA病毒属, 其基因组分别为A和B 2个片段。A片段长约3.2 kb, 包括2个部分重合的开放阅读框(ORF)[1], 第1个较大的阅读框编码相对分子质量约为110×103的前体融合蛋白(NH2-VPX-VP4-VP3-COOH), 加工成熟后被有蛋白水解活性的VP4分裂成3个成熟的多肽, 即VP2前体(pVP2, 48×103)、VP3(32×103)及VP4(28×103)[2-3]。VP4蛋白具有蛋白水解酶的活性, 其催化活性位点主要在69-Lys和652-Ser[4-5], 作用是对前体融合蛋白NH2-pVP2-VP4-VP3-COOH进行加工, 形成pVP2、VP3和VP4, 然后进一步将pVP2加工成VP2[2, 6]。第2个较小的阅读框编码相对分子质量约为17×103的非结构蛋白VP5。VP5能够与宿主PI3K和电压依赖性离子通道2的p85α亚基蛋白相互作用, 并在病毒子代颗粒的释放和在体内的传播与致病方面起到重要作用[7-10]。B片段的核苷酸长约2 800 bp, 只含1个ORF, 编码结构蛋白VP1(约90×103)[11-12]。
抗病毒天然免疫是机体抵抗病毒感染的第一道防线, 受几种天然免疫识别受体介导, 主要包括Toll样受体(Toll-like receptors, TLRs)、RIG-Ⅰ样受体(RIG-Ⅰlike receptors, RLRs)、NOD样受体(NOD-like recepter, NLRs)。研究表明, TLR3、RIG-Ⅰ在dsRNA病毒的感染中发挥重要的作用[13-14]。病原及其代谢产物激活这些天然免疫受体后, 通过干扰素调节因子3(interferon regulatory factor 3, IRF3)、干扰素调节因子7(IRF7)和NF-κB (nuclear factor κB)等核转录因子促进干扰素及促炎症因子的表达, 而这些蛋白因子是病原和宿主互作过程中的重要媒介。如干扰素的产生能够诱导干扰素刺激基因(IFN-stimulated genes, ISGs)、双链RNA依赖性蛋白激酶(double-stranded RNA-dependent protein kinase, PKR)、2′-5′-寡腺甙酸合成酶(2′-5′-oligoadenylate synthetase, OAS)和Mx (myxovirus resistance)蛋白等抗病毒因子的产生; 而适度的炎症反应也是机体防御反应的重要组成部分。
在对同属双RNA病毒科双RNA病毒属的传染性胰坏死病毒(IPNV)的研究中发现, VP4和VP5蛋白能够明显抑制抗病毒因子Mx基因的表达从而抑制机体的先天性免疫应答[15], 因此推测IBDV的VP4和VP5蛋白能通过抑制机体Ⅰ型IFN的产生发挥免疫抑制作用。为此, 我们先前克隆了IBDV所有的结构蛋白和非结构蛋白基因, 转染Vero细胞后, 用IFN-β-Luc报告质粒检测, 发现IBDV的结构蛋白VP4和非结构蛋白VP5能够显著降低IFN-β启动子的活性, 从而明显降低IFN的产生, 而VP1、VP2和VP3没有此作用(数据尚未发表)。研究说明Ⅰ型干扰素信号通路在机体抵抗IBDV感染中发挥重要的作用。众所周知, 机体的防御反应是多种信号途径共同调配的结果, VP4和VP5蛋白对宿主的非Ⅰ型干扰素产生途径是否也有重要的影响, 是本试验将要探讨的问题。
1 材料与方法 1.1 材料与试剂 1.1.1 试验材料IBDV病毒CV03株(笔者2011年分离鉴定), 强毒; 真核表达载体pCI-neo购于Promega; pMD19-T和感受态细胞DH5α购于TaKaRa公司; Vero细胞(美国组织培养库)。
1.1.2 主要试剂RNA提取试剂(9108Q), ExTaq DNA聚合酶(DR001A), dNTP Mixture (D4030A), T4 DNA连接酶(D2011A), DNA marker, 内切酶NotⅠ(1166A)、NheⅠ(1241A)、EcoRⅠ(1040A), 反转录试剂盒(AK3901)均购于TaKaRa公司; 胶回收试剂盒(D2500-02)购于Omega公司; 质粒小量提取试剂盒(AP-MN-P-250G)购于AXYGEN公司; 酵母提取物、蛋白胨购于OXOID公司; 氨苄青霉素购于上海生工生物工程公司; X-treme GENE HP DNA转染试剂(06366546001)、荧光定量PCR酶(04913914001)购于Roche公司; 细胞总蛋白提取试剂RIPA裂解液(强)(P0013B)、BCA蛋白浓度测定试剂盒(P0011)购于碧云天公司; PMSF (321D0315)购于Solarbio公司。鼠抗Flag标签IgG (05-0078)和鼠抗β-actin IgG (05-0079)购于ABMAX公司; 羊抗鼠IgG酶标二抗(A90-116p)和鼠抗Flag标签并有FITC标记的单克隆抗体(F4049)购于Sigma-Aldrich; TLR3(315002)和RIG-Ⅰ(sc-48932)单克隆抗体分别购于Biolegend和SANTA CRUZ; IRF3(11904)、P-IRF3(4947)购于Cell Signalling; IRF7(LS-C110268)和鼠抗GAPDH单抗(TA-08)分别购于LifeSpan BioSciences和ZSGB-BIO; 羊抗兔IgG-HRP (sc-2004)、羊抗鼠IgG-HRP (sc-2005)、驴抗羊IgG-HRP (sc-2020)均购于SANTA CRUZ。本试验所用引物如表 1所示。
| 引物名称 Names |
限制性内切酶 Restriction enzyme |
引物对序列(5′→3′) Primer pairs sequences |
| VP4-F/R | NheⅠ/NotⅠ | ACAGCTAGCATGGATTACAAGGACGATGACGATAAGAGGAGGATAGCTGTGCCG/ ATAGCGGCCGCGCGGCCGCGCGTGGATTGTGAGGGA |
| VP5-F/R | NheⅠ/NotⅠ | ACAGCTAGCATGGATTACAAGGACGATGACGATAAGCTATCATTGATGGTTAGT/ ATAGCGGCCGCAACATCTGTCAGTTCACT |
| IL-1β-F/R | TTACTACAGTGGCAACGAG/ATGAAGGGAATCAAGGTG | |
| IL-6-F/R | TCGGTCCAGTTGCCTTCT/GCCTCTTTGCTGCTTTCA | |
| Mx-F/R | GTTATGGGCAAATGGACT/TATCGCTGACAGTTGGGT | |
| PKR-F/R | CACCTACATTTGACCCTC/CTCTGCCTTCTTGCTATT | |
| OAS-F/R | TACGCCCTGGAGCTGTTG/AAGGCTTCATTGCTGTTTGC | |
| IFN-α-F/R | ATTTGATGCTCCTGGTAC/AGTGCGGAATTTGTCTAG | |
| IFN-β-F/R | CAAGTGTCTCCTCCAAAT/CAGGGATGTCAAAGTTCA | |
| TNF-α-F/R | GAATCCCGAGTGACAAGCC/TGTGGGTGAGGAGCATAAAG | |
| p65-F/R | AAGCCTACAAGGTCTTCTTT/GTTATCTCGCACTTTCAGC | |
| GAPDH-F/R | CAAGGCTGTGGGCAAGGT/GGTGGAAGAGTGGGTGTCG |
根据RNA提取试剂RNAiol Plus使用说明, 提取病毒总RNA, 再用反转录酶进行目的片段第1链cDNA的合成; 根据IBDV CV03的基因序列, 运用Primer Premier 5.0分别设计扩增VP4、VP5基因带Flag标签的引物(如表 1)并由北京华大基因合成。以所获得的CV03-cDNA为模板扩增VP4、VP5基因片段, 将PCR产物进行琼脂糖凝胶电泳, 切下CV03-VP4和CV03-VP5目的条带, 进行胶回收目的片段, 然后参照pMD19-T载体使用说明书将各目的基因片段的PCR纯化回收产物与pMD19-T载体连接, 连接产物转化DH5α感受态细胞, 过夜培养, 进行测序鉴定; 测序正确后提取连接T载体转化DH5α感受态细胞摇菌后的重组质粒, 对重组质粒的目的基因和空载体真核表达载体进行NheⅠ和NotⅠ两个位点的双酶切, 然后将目的基因与真核表达载体pCI-neo进行连接, 将连接产物pCI-neo-VP4和pCI-neo-VP5转化DH5α感受态细胞; 提取重组的真核表达质粒进行酶切鉴定, 将鉴定正确的质粒命名为pCI-VP4和pCI-VP5。将构建的带Flag标签的pCI-VP4和pCI-VP5按照Roche转染试剂说明书转染Vero细胞, 用间接免疫荧光试验检测其表达能力。
1.2.2 真核表达载体转染Vero细胞后对Vero细胞表面受体及其下游转录因子的影响Vero细胞常规培养至对数生长期, 以每孔1×106个接种6孔培养板, 待细胞达到80%融合, 将构建的真核表达质粒按照Roche转染试剂说明书转染Vero细胞, 24 h后用IBDV CV03株按感染复数(multiplicity of infection, MOI)为1感染Vero细胞, 感染后24 h提取细胞总蛋白, Western-blot法检测TLR3、RIG-Ⅰ受体及其下游转录因子的表达情况。
1.2.3 真核表达载体转染Vero细胞后对炎性细胞因子、抗病毒因子基因表达的影响将Vero细胞常规培养至对数生长期, 以每孔1×106个接种6孔培养板, 待细胞达到80%融合时, 将构建的真核表达质粒转染Vero细胞, 24 h后用IBDV CV03株按MOI为1感染Vero细胞, 24 h后提取细胞总RNA, RT-qPCR法检测炎症因子及抗病毒因子mRNA的表达情况。
2 结果与分析 2.1 CV03病毒VP4、VP5基因的扩增以cDNA为模板, 以材料中所示的引物扩增CV03病毒蛋白带Flag标签的基因, 目的基因VP4和VP5的大小分别为881和508 bp, 扩增条带符合预期结果(图 1)。

|
图 1 带Flag标签的CV03病毒VP4、VP5基因的扩增 Figure 1 PCR products of viral VP4 and VP5 genes of CV03 M:DNA marker (DL 2000);1:CV03-VP4; 2: CV03-VP5 |
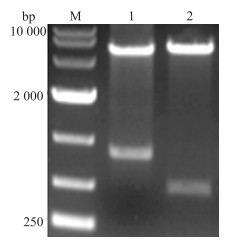
构建的CV03株病毒蛋白基因带Flag标签的真核表达载体pCI-VP4和pCI-VP5用NheⅠ和NotⅠ双酶切, 目的片段与预期的大小一致(图 2)。
|
图 2 IBDV CV03毒株VP4和VP5基因真核表达载体的酶切鉴定 Figure 2 Identification of plasimid by digestion M:DNA marker (DL 10000);1:CV 03-VP4; 2: CV03-VP5 |
将构建的带Flag标签的病毒基因真核表达载体转染Vero细胞后, 各表达载体在相应的位置均出现了特异性蛋白条带(图 3), 证实构建的各表达载体均能在Vero细胞中较好地表达。

|
图 3 IBDV CV03毒株VP4和VP5蛋白真核表达载体Western-blot鉴定 Figure 3 Analysis of recombinant plasimid by Western-blot 1:pCI-VP4表达产物(32.3×103); 2:pCI-VP5表达产物(18.6×103) |
将构建的带Flag标签的病毒蛋白基因的真核表达载体转染Vero细胞后, 用间接免疫荧光(IFA)试验检测其表达能力。如图 4所示, 各表达载体在荧光显微镜下均有数量不等的细胞出现荧光, 而空载体对照没有荧光出现, 证实了构建的真核表达载体均能在Vero细胞中较好地表达。

|
图 4 IBDV VP4、VP5蛋白真核表达载体的IFA鉴定(×400) Figure 4 Identification for the protein expression by IFA A:用pCI-VP4转染Vero细胞; B:用pCI-VP5转染Vero细胞; C:用pCI-neo转染Vero细胞。 A:Vero cells were transfected by pCI-VP4; B:Vero cells were transfected by pCI-VP5; C:Vero cells were transfected by pCI-neo. |
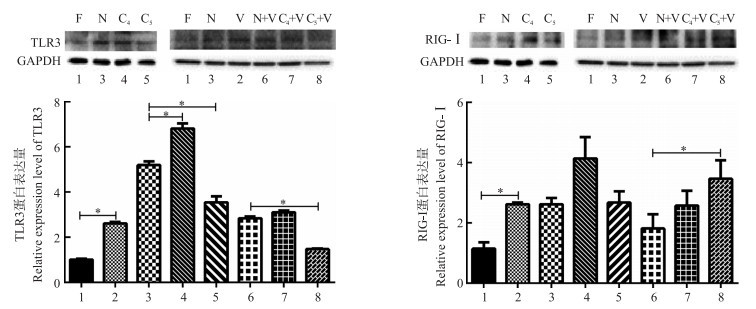
将IBDV CV03病毒VP4、VP5蛋白的真核表达质粒转染Vero细胞后, 用IBDV CV03毒株感染Vero细胞(设对照), 并用Western-blot方法检测Vero细胞中TLR3和RIG-Ⅰ受体的表达。结果(图 5)显示:病毒感染能够刺激TLR3、RIG-Ⅰ受体的表达(P < 0.05);IBDV CV03病毒VP4蛋白在Vero细胞中的表达能够显著刺激TLR3受体的表达(P < 0.05);过表达的VP4蛋白在IBDV CV03病毒感染后在一定程度上能够提高TLR3、RIG-Ⅰ蛋白含量, 但差异不显著; VP5能够显著降低TLR3受体的表达(P < 0.05), 对RIG-Ⅰ的表达有一定抑制作用; VP5的过表达在IBDV CV03病毒感染后显著抑制了TLR3的表达, 却明显刺激了RIG-Ⅰ的表达(P < 0.05)。
|
图 5 IBDV CV03病毒VP4、VP5蛋白真核表达质粒转染Vero细胞后对TLR3和RIG-Ⅰ受体的影响(n=3, *P < 0.05) Figure 5 The effects on TLR3 and RIG-Ⅰreceptors after the expression of IBDV CV03 VP4 and VP5 protein in Vero cells 1:空白对照(F); 2:空白对照细胞培养24 h后用IBDV CV03病毒感染(V); 3:空载体转染对照(N); 4:IBDV VP4蛋白基因真核表达质粒转染Vero细胞(C4); 5:IBDV VP5蛋白基因真核表达质粒转染Vero细胞(C5); 6:空载体转染Vero细胞24 h后用IBDV CV03病毒感染(N+V); 7:IBDV VP4蛋白基因真核表达质粒转染Vero细胞24 h后用IBDV CV03病毒感染Vero细胞(C4+V); 8:IBDV VP5蛋白基因真核表达质粒转染Vero细胞24 h后用IBDV CV03病毒感染Vero细胞(C5+V)。 1:Blank (F); 2:Blank cells were infected with IBDV CV03 after 24 h post in transfection (V); 3:Empty vector (N); 4:Eukaryotic expression plasmid of IBDV VP4 gene was transfected into Vero cells (C4); 5:Eukaryotic expression plasmid of IBDV VP5 gene was transfected into Vero cells (C5); 6:Vero cell were infected with IBDV CV03 after empty vector was transfected 24 h (N+V); 7:Vero cell were infected with IBDV CV03 after VP4 gene was transfected 24 h (C4+V); 8:Vero cell were infected with IBDV CV03 after VP5 gene was transfected 24 h (C5+V).The same as follows. |
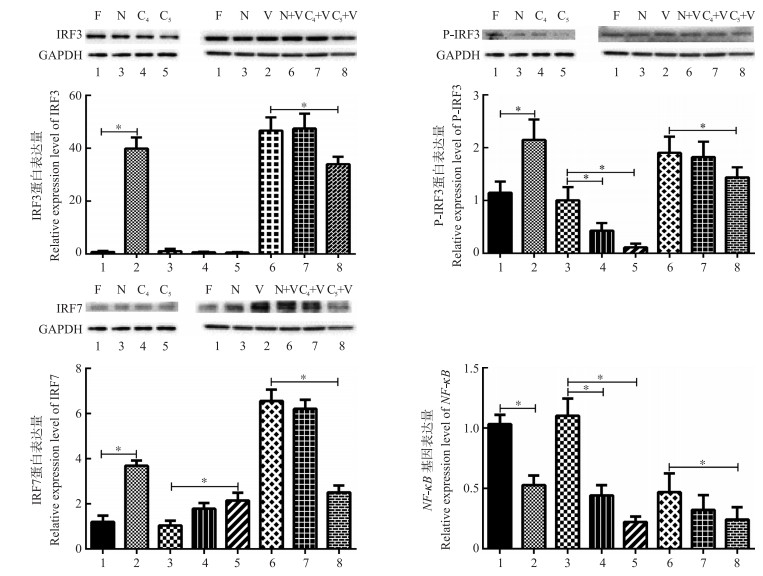
将IBDV CV03病毒VP4、VP5蛋白的真核表达质粒转染Vero细胞后, 用IBDV CV03毒株刺激, 然后用Western-blot方法检测Vero细胞中转录因子IRF3、IRF7的表达及IRF7的磷酸化水平变化, 并用RT-qPCR方法检测核转录因子NF-κB mRNA的表达。结果(图 6)显示:病毒感染能够刺激转录因子IRF3、IRF7的表达及IRF3的磷酸化水平, 但抑制了核转录因子NF-κB mRNA的表达; IBDV CV03病毒VP4蛋白在Vero细胞中的表达能够显著抑制IRF3的磷酸化及NF-κB的表达, 但对IRF7的表达有一定的刺激作用; VP5蛋白也显著抑制了IRF3的磷酸化及NF-κB的表达, 对IRF7有显著刺激作用; 过表达VP5在IBDV CV03病毒感染后显著抑制了IRF3的表达及其磷酸化水平, 也显著抑制了IRF7和NF-κB的表达。
|
图 6 IBDV CV03病毒VP4、VP5蛋白真核表达质粒在Vero细胞中表达后对细胞转录因子的影响(n=3, *P < 0.05) Figure 6 The effects on transcription factors after the expression of IBDV CV03 VP4 and VP5 protein in Vero cells |
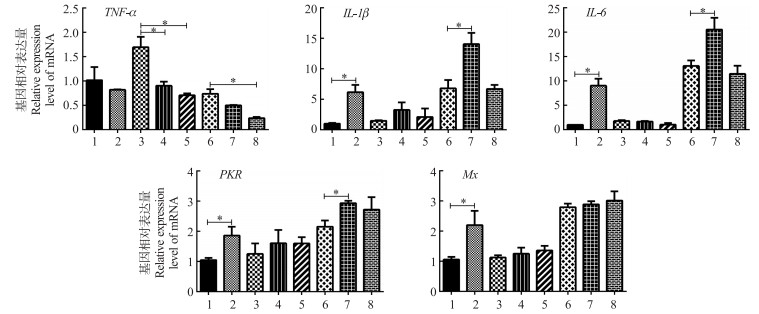
将IBDV CV03病毒VP4、VP5蛋白的真核表达质粒转染Vero细胞后, 用IBDV CV03毒株感染Vero细胞, 用RT-qPCR方法检测Vero细胞中细胞炎症因子及抗病毒因子基因的表达。结果(图 7)显示:病毒感染能够显著刺激炎症因子IL-1β、IL-6基因及抗病毒因子PKR、Mx基因的表达, 但对TNF-α的表达有一定的抑制作用; VP4的表达对TNF-α的表达有显著抑制作用, 但却在一定程度上刺激了炎症因子IL-1β、IL-6基因及抗病毒因子PKR、Mx基因的表达, 过表达VP4在IBDV CV03病毒感染后能够显著刺激炎症因子IL-1β、IL-6及抗病毒因子PKR基因的表达, 对TNF-α和Mx基因作用不明显; VP5的表达及过表达后用IBDV CV03病毒刺激能显著抑制TNF-α mRNA的表达, 上述处理对炎症因子IL-1β、IL-6及抗病毒因子PKR、Mx基因的表达无显著性影响。由于Vero细胞是干扰素缺陷型细胞[16-17], 本研究未检测到Ⅰ型IFN-α、IFN-β的表达, 对于另外一种重要的抗病毒蛋白OAS, 也未检出到相关mRNA的表达。
|
图 7 IBDV CV03病毒VP4、VP5蛋白真核表达质粒在Vero细胞中表达后对炎性细胞因子及抗病毒因子基因表达的影响(n=3, *P < 0.05) Figure 7 The effects on proinflammatory cytokines and antiviral factors after the expression of IBDV CV03 VP4 and VP5 protein in Vero cells |
VP4、VP5是IBDV成熟过程中重要的蛋白。研究已证明两者能够显著降低IFN-β启动子活性, 从而明显降低IFN的产生, 而VP1、VP2和VP3没有此作用。虽然, Ⅰ型干扰素的产生是机体细胞抵抗病毒感染的第一道防线, 调控Ⅰ型干扰素的产生及其相关信号通路的活性在宿主抗病毒感染过程中有重要的作用[18], 但是必须承认的是, 机体的防御反应是多种信号途径共同调配的结果。为探讨VP4、VP5蛋白在IBDV感染过程中对非干扰素通路的调节作用, 本试验首先构建了IBDV CV03病毒VP4、VP5蛋白基因的真核表达载体, 然后将其同Ⅰ型干扰素缺陷型细胞(Vero细胞)[16]共孵育, 观察VP4、VP5蛋白及其过表达后病毒刺激对相关天然免疫因子的影响。研究结果显示:在本试验所选用的Vero细胞上(Vero细胞有各种品系, 不同细胞形态及特性很不相同), 除未检测到Ⅰ型IFN, IFN-α、IFN-β的表达及抗病毒蛋白OAS的表达外, TLR3及RIG-Ⅰ介导的信号通路上的其他因子(包括受体、接头蛋白及效应分子)均有表达, 且VP4、VP5蛋白对这些因子的表达有不同程度的影响。说明该Vero细胞保留了除产生IFN-α、IFN-β和OAS外的基本宿主防御反应, 是研究IBDV感染过程中非干扰素通路的良好模式细胞。
机体抗病毒状态的建立首先通过模式识别受体识别病原相关分子模式, 然后动员多种转录因子参与调控。已有报道, TLR3、RIG-Ⅰ在dsRNA病毒感染中发挥重要作用[13-14]。TLR3、RIG-Ⅰ均为胞内受体; TLR3除识别dsRNA外还识别人工合成的聚肌胞苷酸Poly (I:C), 然后通过MyD88非依赖的信号通路引起细胞防御反应(接头蛋白包括TRIF、TRAFs、TBK1及IRF3等)[19]; RIG-Ⅰ是一种RNA解旋酶, 和配体结合后主要通过MAVS等将信号传递给下游的TRAF3、TBK1激酶和IKKi复合体, 进一步引起IRF3磷酸化后和IRF7结合形成IRF3/7复合体, 该复合体可转移至细胞核内, 诱导相关基因的表达[14, 20]。本研究结果显示, IBDV CV03病毒感染能够刺激TLR3、RIG-Ⅰ受体的表达; 过表达VP4蛋白在IBDV CV03病毒感染后在一定程度上能够提高TLR3、RIG-Ⅰ蛋白含量; VP5过表达在IBDV CV03病毒感染后显著抑制了TLR3的表达, 却明显刺激了RIG-Ⅰ的表达。说明非结构蛋白VP5在IBDV与宿主的互作中(对宿主的防御能力影响方面)可能发挥重要作用。这与先前的报道相符:VP5蛋白在IBDV成熟释放过程中发挥重要作用[10]。
病原及其代谢产物激活相关免疫通路后通过核转录因子调控一些基因(干扰素、促炎症因子及各种抗感染蛋白)的表达来影响机体的防御能力。本试验的检测结果表明:IBDV CV03病毒感染能够刺激转录因子IRF3、IRF7的表达及IRF3的磷酸化水平, 但抑制了NF-κB的表达; 过表达VP5在IBDV CV03病毒感染后显著抑制了IRF3的表达及其磷酸化水平, 也显著抑制了IRF7和NF-κB的表达; 而过表达VP4无此作用。研究结果说明VP5对TLR3、RIG-Ⅰ等介导的天然免疫通路有一定的抑制作用。进一步检测下游的效应因子, 发现NF-κB抑制后TNF-α的表达显著降低, 推测VP5蛋白在IBDV CV03病毒Vero细胞的互作过程中主要通过非干扰素通路发挥作用, 但不排除其他信号通路的影响, 表现在其刺激了炎症因子IL-1β、IL-6和抗病毒基因PKR、Mx的表达(虽然IFN-α、IFN-β表达缺失), 但具体机制还需要进一步探讨。
本研究结果发现, VP5蛋白对相关信号通路有一定的抑制作用, 这种抑制作用和核转录因子及TNF-α的抑制密切相关。另一方面, VP4和VP5蛋白在Vero细胞中的过表达对IBDV的感染和复制的影响目前还不清楚, 有待进一步的探讨。
| [1] | Spies U, Müller H, Becht H. Nucleotide sequence of infectious bursal disease virus genome segment A delineates two major open reading frames[J]. Nucleic Acids Research, 1989,17(19): 7982. DOI: 10.1093/nar/17.19.7982 |
| [2] | Birghan C, Mundt E, Gorbalenya A E. A non-canonical Lon proteinase lacking the ATPase domain employs the Ser-Lys catalytic dyad to exercise broad control over the life cycle of a double-stranded RNA virus[J]. The EMBO Journal, 2000,19(1): 114–123. DOI: 10.1093/emboj/19.1.114 |
| [3] | Sánchez A B, Rodriguez J F. Proteolytic processing in infectious bursal disease virus:identification of the polyprotein cleavage sites by site-directed mutagenesis[J]. Virology, 1999,262(1): 190–199. DOI: 10.1006/viro.1999.9910 |
| [4] | 赵慧, 邓永强, 陈水平, 等. 日本脑炎病毒非结构蛋白NS5对IFN-α介导的信号转导通路的抑制作用[J]. 解放军医学杂志, 2008, 33(7): 811–815. Zhao H, Deng Y Q, Chen S P, et al. Blocking of alpha interferon-induced signaling transduction pathway by Japanese encephalitis virus NS5[J]. Med J Chin PLA, 2008,33(7): 811–815. (in Chinese) |
| [5] | 赵慧.重要蚊媒黄病毒在IFN-α介导的信号转导通路中的作用机制研究[D].北京:中国人民解放军军事医学科学院, 2008. Zhao H. The mechanism on the effect of alpha interferon-induced signaling transduction pathway by important mosquito-borne Flaviviruses[D]. Beijing:Academy of Military Medical Science, 2008(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-90106-2008117430.htm |
| [6] | Granzow H, Birghan C, Mettenleiter T C, et al. A second form of infectious bursal disease virus-associated tubule contains VP4[J]. Journal of Virology, 1997,71(11): 8879–8885. |
| [7] | Lombardo E, Maraver A, Espinosa I, et al. VP5, the nonstructural polypeptide of infectious bursal disease virus, accumulates within the host plasma membrane and induces cell lysis[J]. Virology, 2000,277(2): 345–357. DOI: 10.1006/viro.2000.0595 |
| [8] | Wei L, Hou L, Zhu S, et al. Infectious bursal disease virus activates the phosphatidylinositol 3-kinase (PI3K)/Akt signaling pathway by interaction of VP5 protein with the p85α subunit of PI3K[J]. Virology, 2011,417(1): 211–220. DOI: 10.1016/j.virol.2011.03.003 |
| [9] | Li Z, Wang Y, Xue Y, et al. Critical role for voltage-dependent anion channel 2 in infectious bursal disease virus-induced apoptosis in host cells via interaction with VP5[J]. Journal of Virology, 2012,86(3): 1328–1338. DOI: 10.1128/JVI.06104-11 |
| [10] | Wu Y, Hong L, Ye J, et al. The VP5 protein of infectious bursal disease virus promotes virion release from infected cells and is not involved in cell death[J]. Archives of Virology, 2009,154(12): 1873–1882. DOI: 10.1007/s00705-009-0524-4 |
| [11] | Kibenge F S, Dhillon A S, Russell R G. Biochemistry and immunology of infectious bursal disease virus[J]. J Gen Virol, 1988,69(Pt 8): 1757–1775. |
| [12] | Mundt E, Müller H. Complete nucleotide sequences of 5'-and 3'-noncoding regions of both genome segments of different strains of infectious bursal disease virus[J]. Virology, 1995,209(1): 10–18. DOI: 10.1006/viro.1995.1226 |
| [13] | Doyle S E, O'Connell R, Vaidya S A, et al. Toll-like receptor 3 mediates a more potent antiviral response than Toll-like receptor 4[J]. The Journal of Immunology, 2003,170(7): 3565–3571. DOI: 10.4049/jimmunol.170.7.3565 |
| [14] | Yoneyama M, Kikuchi M, Natsukawa T, et al. The RNA helicase RIG-Ⅰhas an essential function in double-stranded RNA-induced innate antiviral responses[J]. Nature Immunology, 2004,5(7): 730–737. DOI: 10.1038/ni1087 |
| [15] | Skjesol A, Aamo T, Hegseth M N, et al. The interplay between infectious pancreatic necrosis virus (IPNV) and the IFN system:IFN signaling is inhibited by IPNV infection[J]. Virus Research, 2009,143(1): 53–60. DOI: 10.1016/j.virusres.2009.03.004 |
| [16] | Emeny J M, Morgan M J. Regulation of the interferon system:evidence that Vero cells have a genetic defect in interferon production[J]. J Gen Virol, 1979,43(1): 247–252. DOI: 10.1099/0022-1317-43-1-247 |
| [17] | Chew T, Noyce R, Collins S E, et al. Characterization of the interferon regulatory factor 3-mediated antiviral response in a cell line deficient for IFN production[J]. Mol Immunol, 2009,46(3): 393–399. DOI: 10.1016/j.molimm.2008.10.010 |
| [18] | Kyogoku C, Tsuchiya N. A compass that points to lupus:genetic studies on typeⅠinterferon pathway[J]. Genes and Immunity, 2007,8(6): 445–455. DOI: 10.1038/sj.gene.6364409 |
| [19] | Lee C C, Avalos A M, Ploegh H L. Accessory molecules for Toll-like receptors and their function[J]. Nature Reviews Immunology, 2012,12(3): 168–179. |
| [20] | Chen H, Jiang Z. The essential adaptors of innate immune signaling[J]. Protein and Cell, 2013,4(1): 27–39. DOI: 10.1007/s13238-012-2063-0 |




